Краткий курс лекций для студентов Iкурса Направление подготовки
| Вид материала | Курс лекций |
- Методические указания: краткий курс лекций для студентов заочной формы обучения Санкт-Петербург, 1540.61kb.
- В. Б. Аксенов Краткий курс лекций, 1098.72kb.
- Краткий курс лекций по философии учебно-методическое пособие для студентов всех специальностей, 2261.57kb.
- Краткий курс лекций, 182.24kb.
- Краткий курс лекций учебной дисциплины «Методика преподавания начального курса математики», 631.78kb.
- Краткий курс лекций, 505.9kb.
- Краткий конспект лекций Кемерово 2002 удк: 744 (075), 1231.26kb.
- Н. В. Рудаков Краткий курс лекций, 1552.23kb.
- Основы автоматического управления, 520.52kb.
- Краткий курс лекций по медицинской паразитологии Часть Клещи, 643.33kb.
Министерство сельского хозяйства Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Саратовский государственный аграрный университет
имени Н. И. Вавилова»
Химия
краткий курс лекций
для студентов I курса
Направление подготовки
250100.62 Лесное дело
Профиль подготовки
Лесное хозяйство
Саратов 2011
УДК 54
ББК 24
П92
Рецензенты:
Заведующая кафедрой «Общая и неорганическая химия», доктор химических наук, профессор ГОУ ВПО «СГУ им. Чернышевского».
^ С.П. Муштакова
Заведующий кафедрой «Химия и основы экологии», кандидат химических наук, профессор ФГОУ ВПО «Саратовский ГАУ»
А. А. Кольцов
| П92 | Химия: краткий курс лекций для студентов I курса специальности (направления подготовки) 250100.62 «Лесное дело» / Сост.: Н.М. Пчелинцева, Т.В. Холкина, Ю.В. Самохина // ФГОУ ВПО «Саратовский ГАУ». – Саратов, 2011. – 80 с. Краткий курс лекций по дисциплине «Химия» составлен в соответствие с рабочей программой дисциплины и предназначен для студентов направления подготовки 250100.62 «Лесное дело». Краткий курс лекций содержит теоретический материал по основным вопросам общей, неорганический и органической химии, рассмотрены вопросы идентификации химических веществ. Направлен на формирование у студентов знаний об основных закономерностях химических явлений, на применение этих знаний для понимания процессов, происходящих в природе, для решения экологических проблем. УДК 54 ББК 24 |
© Пчелинцева Н.М., Холкина Т.В., Самохина Ю.В., 2011
© ФГОУ ВПО «Саратовский ГАУ», 2011
Введение.
Химия — одна из важнейших естественнонаучных дисциплин. Химия изучает вещества, их строение, свойства и превращения, происходящие в результате химических реакций, а также фундаментальные законы, которым эти превращения подчиняются. Современная химия – настолько обширная область естествознания, что многие ее разделы представляют собой самостоятельные, хотя и связанные между собой научные дисциплины.
Краткий курс лекций по дисциплине «Химия» предназначен для студентов по направлению подготовки 250100.62 «Лесное дело». Он раскрывает основные законы общей химии, на которых базируются химические дисциплины, включает в себя введение в неорганическую химию, знакомит с основными классами органических соединений, предполагает освоение теоретических основ методов анализа. Курс нацелен на формирование ключевых компетенций, необходимых для эффективного решения профессиональных задач и организации профессиональной деятельности на основе глубокого понимания законов функционирования экосистем.
Лекция 1
^ ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1.1. Скорость химической рекции
Химической кинетикой называется раздел химии, изучающий скорость и механизмы химических реакций.
Под скоростью химической реакции понимают изменение концентрации вещества в единицу времени. При этом безразлично, о каком веществе идет речь – о вступающем в реакцию или о продукте реакции.
Если за промежуток времени от t1 до t2 концентрация вещества изменилась от значения С1 до С2, то выражение скорости реакции:
V = ±
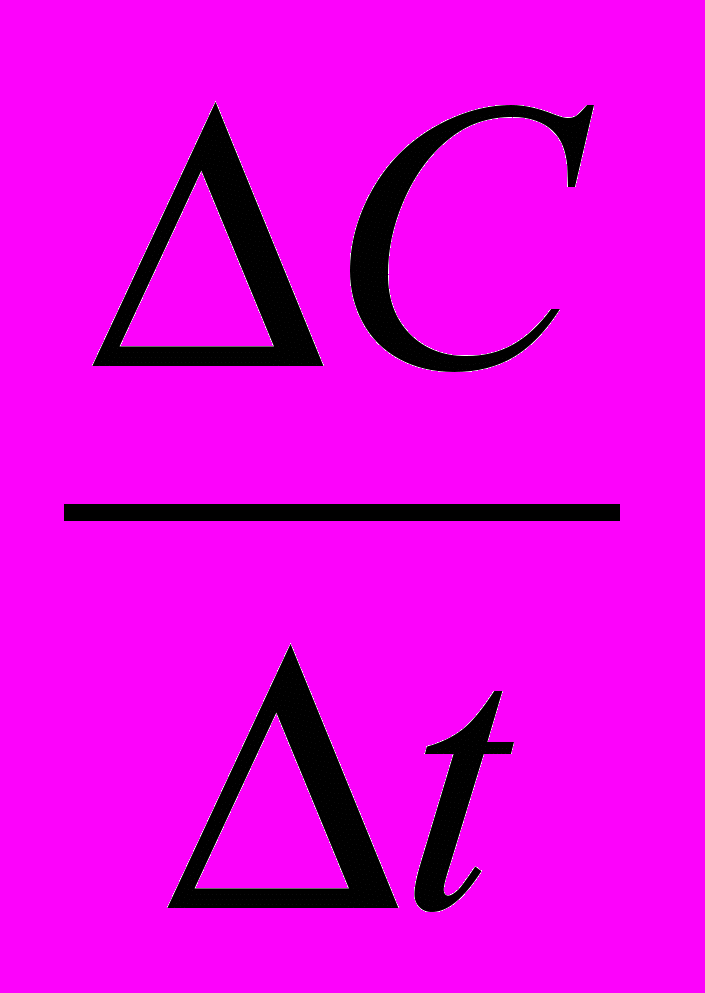 = ±
= ± 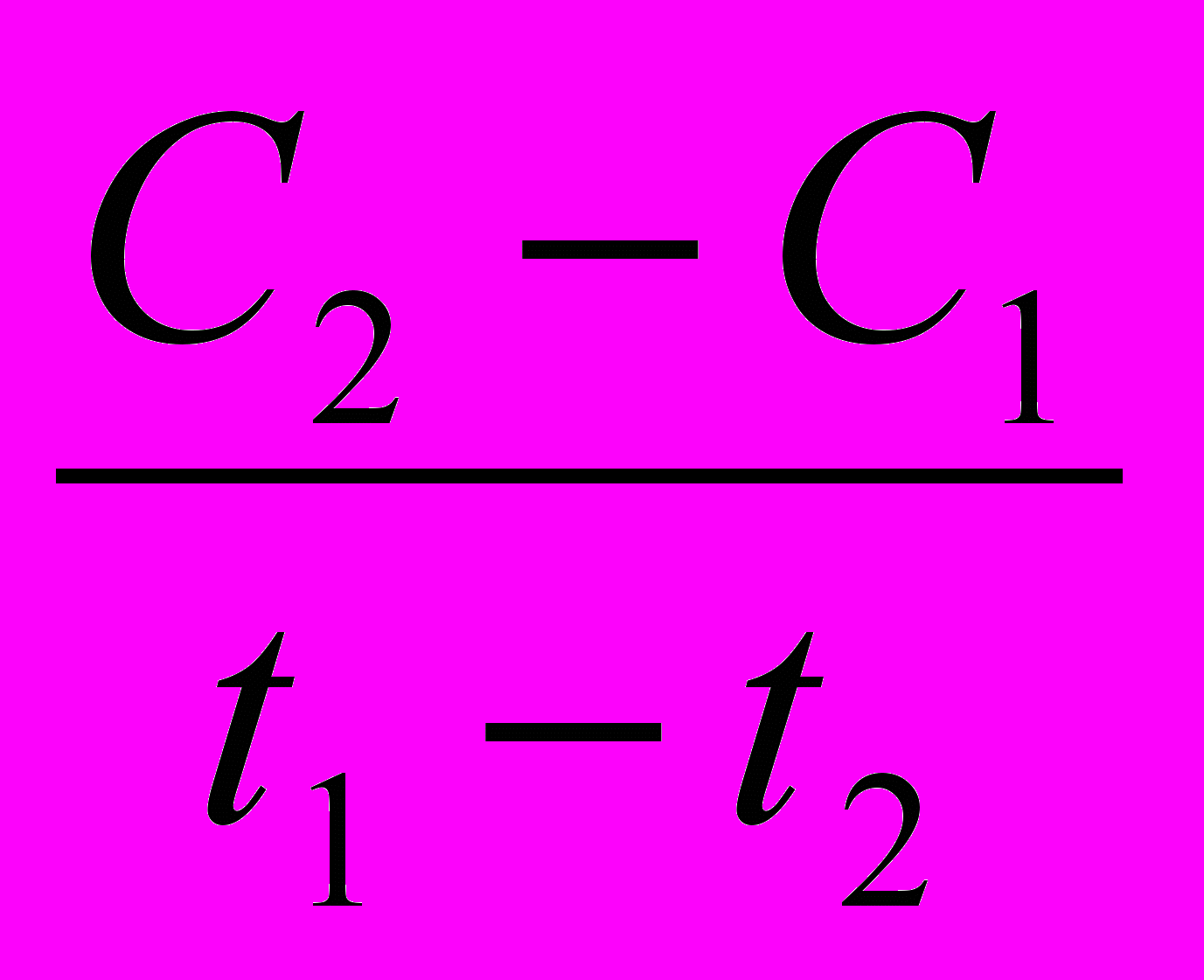 , моль/л∙с
, моль/л∙сПри этом знак «+» в формуле относится к изменению концентрации вещества, образующегося в результате реакции (С2>С1, ΔС>0), а знак «–» относится к изменению концентрации вещества, вступающего в реакцию (С1>С2, ΔС<0).
^ 1.2. Факторы, влияющие на скорость химической реакции
Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, давления – для газов, площади поверхности соприкосновения (степени измельчения) – для твердых веществ, присутствия катализатора.
Влияние природы реагирующих веществ. Различные вещества обладают различной реакционной способностью. Например, калий (щелочной металл) бурно реагирует с водой с выделением водорода, тогда как золото с водой практически не взаимодействует.
Реакционная способность веществ определяется в большой степени характером химических связей и строением молекул реагентов.
^ 1.3. Влияние концентрации реагирующих веществ на скорость реакции.
Закон действия масс
Необходимым условием химического взаимодействия является столкновение частиц друг с другом. Чем больше столкновений, тем быстрее протекает реакция. С увеличением концентрации (числа частиц в единице объема) столкновения происходят чаще и, следовательно, скорость реакции возрастает.
Зависимость скорости реакции от концентрации реагирующих веществ характеризуется законом действия масс (К.Гульдберг, П.Вааге, 1867 г.):
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Для реакции, протекающей по уравнению аА + вВ → сС скорость реакции определяется выражением:
V = k [A]а ∙ [B]b,
где k – константа скорости реакции, зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации.
Применительно к конкретным реакциям выражение закона действия масс будет иметь вид (табл. 1):
^ Таблица 1 – Примеры выражения закона действия для различных реакций
| Уравнение реакции | Выражение закона действия масс |
| N2 + 3H2 → 2NH3 | V = k[N2] ∙ [H2]3 |
| C + O2 → CO2 | V = k[O2] (скорость реакции не зависит от концентрации твердого вещества) |
^ 1.4. Влияние температуры на скорость реакции. Правило Вант-Гоффа.
Теория активации
Зависимость скорости реакции от температуры приблизительно оценивается правилом Вант-Гоффа:
При повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза.
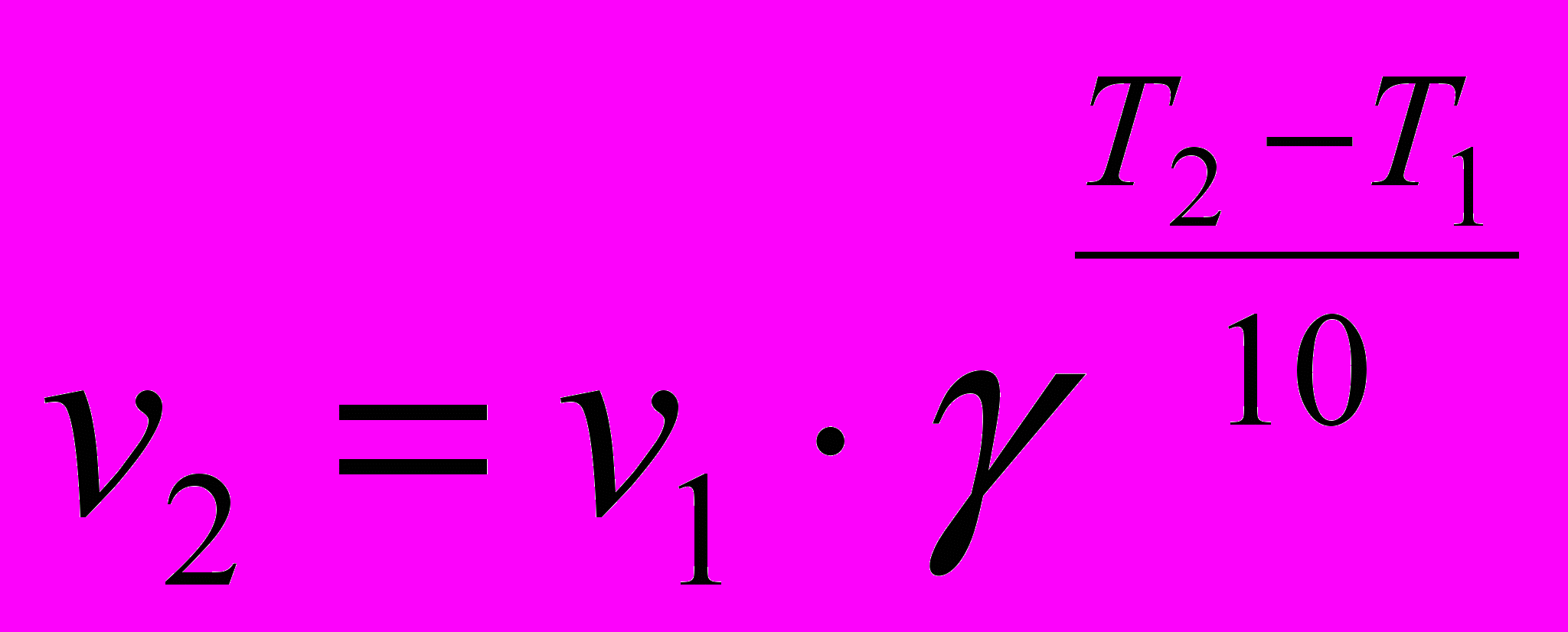 ,
, где γ – температурный коэффициент скорости реакции, равен 2–4.
Увеличение скорости реакции при повышении температуры объясняет теория активации (С. Аррениус). Согласно этой теории, при столкновении реагируют не все молекулы, а лишь активные – те, которые обладают достаточной энергией, избыточной по сравнению со средней энергией молекул при данной температуре – энергией активации. Итак, энергия активации Еа (размерность – кДж/моль) – это избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение привело к химическому превращению. Другими словами, каждая реакция характеризуется определенным энергетическим барьером. С ростом температуры число активных молекул возрастает, что приводит к увеличению скорости реакции.
Уравнение Аррениуса:
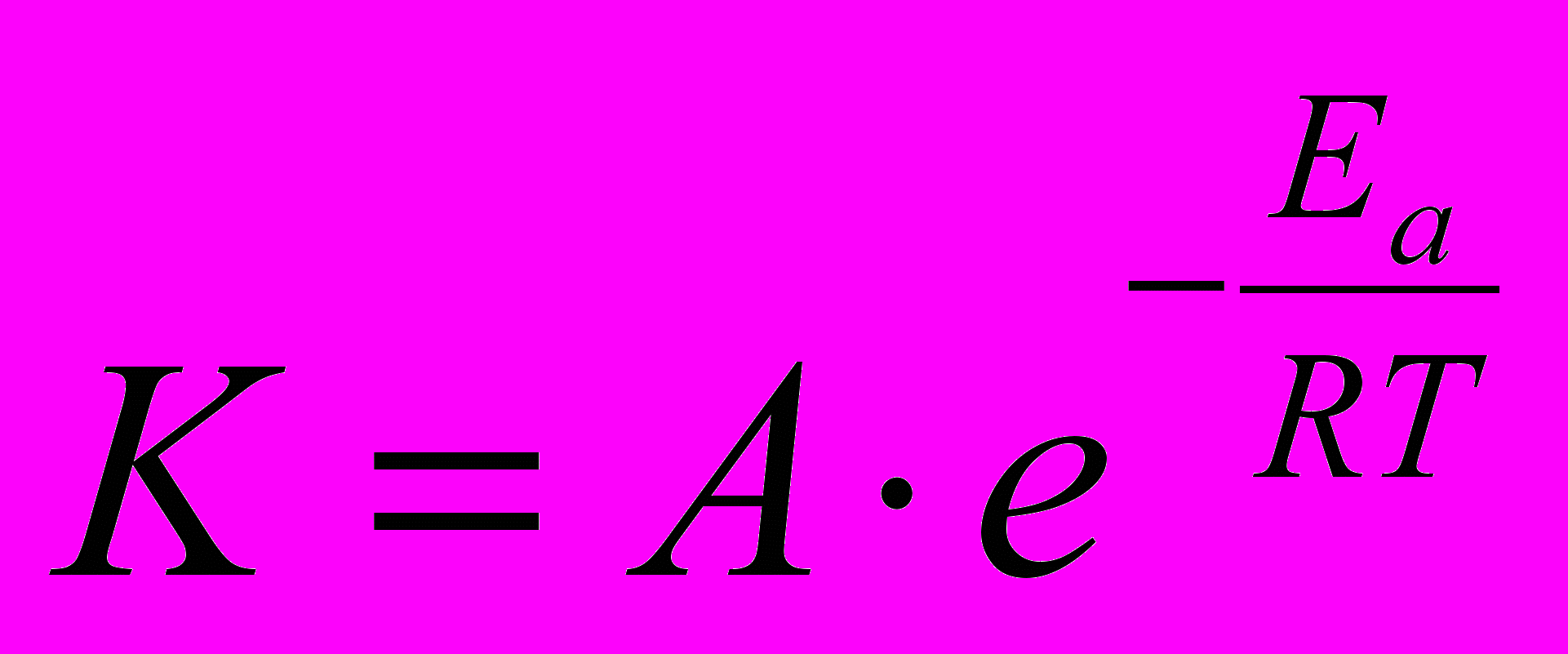
где А – предэкспоненциальный множитель, связан с частотой столкновений частиц и их ориентацией при столкновениях.
Как следует из уравнения Аррениуса, скорость реакции тем больше, чем меньше энергия активации и выше температура.
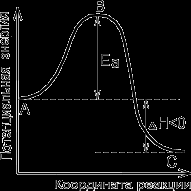
Рисунок 1. Энергетическая диаграмма химической реакции:
А – реагенты, В – активированный комплекс
(переходное состояние), С – продукты.
Реакция протекает через стадию образования неустойчивого промежуточного соединения – активированного комплекса. Именно для его образования необходима энергия активации. Этот комплекс неустойчив, он существует очень короткое время, в результате его распада образуются продукты реакции. В простейшем случае активированный комплекс можно представить как конфигурацию атомов, в которой ослаблены старые химические связи и образуются новые.
^ 1.5. Катализ. Катализаторы
Катализ – явление изменения скорости реакции под действием веществ – катализаторов. Различают положительный катализ (увеличение скорости реакции) и отрицательный катализ (замедление реакции под действием веществ – ингибиторов). Сам катализатор при реакции не расходуется, но изменяет ее скорость.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества находятся в одном агрегатном состоянии. В случае гетерогенного катализа – в разных агрегатных состояниях.
Примеры каталитических реакций:
Синтез аммиака: N2 + 3H2 → 2NH3; (катализатор – железо).
Получение серной кислоты контактным способом: SO2 + O2 → SO3; (катализатор – V2O5).
Ферменты – вещества белковой природы, катализаторы биохимических реакций в клетках живых организмов.
Действие катализатора объясняется снижением энергии активации реакции. Катализатор вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, причем для этого требуется более низкая энергия активации и реакция протекает быстро.
Реакция А + В = АВ без катализатора протекает медленно.
В присутствии катализатора реакция происходит в две быстро протекающие стадии:
А + К = АК;
АК + В = АВ + К.
^ 1.6. Химическое равновесие, условия его смещения. Принцип Ле Шателье
Обратимые реакции – протекающие не до конца, они протекают одновременно в двух противоположных направления.
Например: N2 + 3H2 2NH3
Эта реакция может протекать в двух направлениях – образования аммиака и его разложения.
Обратимая реакция заканчивается установлением химического равновесия – это состояние системы реагирующих веществ, когда скорости прямой и обратной реакции равны:
V→ = V←
Состояние равновесия в обратимой системе характеризуется константой равновесия.
Рассмотрим обратимую реакцию aA + bB cC + dD.
Скорость прямой реакции, протекающей слева направо, согласно закону действия масс имеет выражение Vпр = k[A]a ∙ [B]b. Скорость обратной реакции, протекающей справа налево, имеет вид Vобр = k[C]c ∙ [D]d. При равенстве скоростей прямой и обратной реакции: k[A]a ∙ [B]b = k[C]c ∙ [D]d. В результате получаем выражение константы равновесия:
Kp =
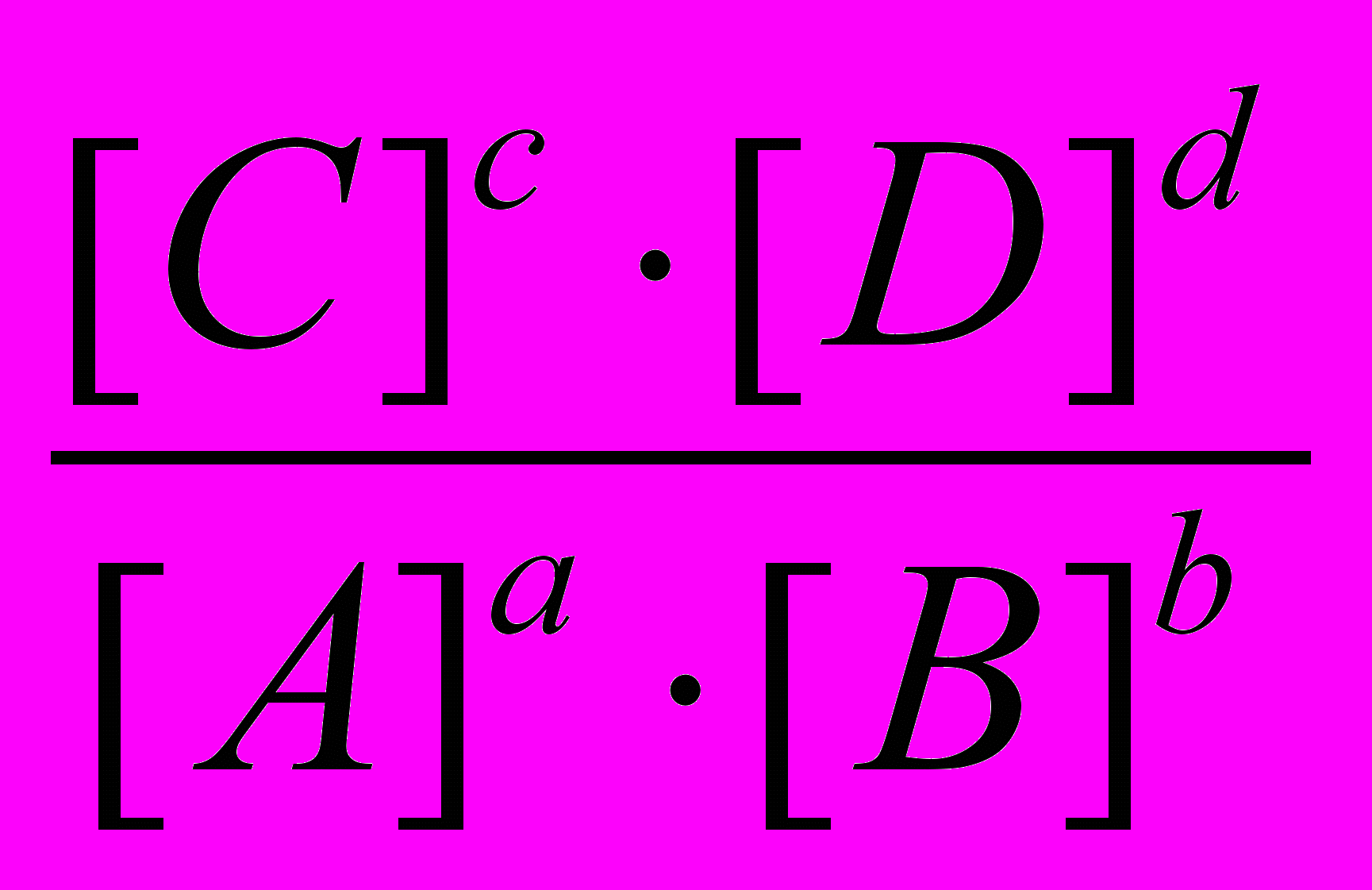
Константа равновесия обратимой реакции есть отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, возведенных степень их стехиометрических коэффициентов.
Уравнение константы равновесия показывает, что концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из них приведет к изменению концентраций всех остальных. В итоге установятся новые концентрации, но соотношение между ними отвечает константе равновесия.
Принцип смещения равновесия – принцип Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия оказать какое-либо воздействие (изменить концентрацию, температуру или давлении), то равновесие сместится в направлении, где это оказанное воздействие уменьшится.
При увеличении концентрации одного из веществ равновесие сместится в сторону расхода этого вещества.
При увеличении температуры равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
При увеличении давления равновесие сместится в сторону уменьшения объемов.
^
Вопросы для самоконтроля
1) Понятие скорости химической реакции. Какие факторы оказывают влияние на скорость химической реакции?
2) Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действия масс. Задача: Как изменится скорость реакции 2NO + O2 → 2NO2, если повысить концентрацию NO в 2 раза?
3) Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Задача: Температурный коэффициент некоторой реакции равен 2. Во сколько раз увеличится скорость реакции при повышении температуры от 10 до 50 ºС?
^4) Катализаторы и их роль в изменении скорости химической реакции.
5) Химическое равновесие. Константа химического равновесия. Задача: Равновесие в системе H2 + J2 2HJ установилось при концентрациях: [H2] = 0,025 моль/л, [J2] = 0,005 моль/л, [HJ] = 0,09 моль/л. Вычислите константу равновесия.
^6) Смещение химического равновесия, принцип Ле-Шателье. Определите направление смещения равновесия в системе:
СО(г.) + О2 (г.) 2СО2 (г.) + 566 кДж
а) при повышении температуры; б) при повышении давления; в) при увеличении концентрации СО; г) при увеличении концентрации СО2?
^СПИСОК ЛИТЕРАТУРЫ
Основная
1. Глинка, Н.А. Общая химия / Н.А. Глинка.– М. : Интеграл-пресс, 2002. – 728 с.
2. Князев, Д.А., Смарыгин, С.Н. Неорганическая химия / Д.А. Князев, С.Н. Смарыгин. – М. : Дрофа, 2004. – 529 с.
3. Рязанова, Г.Е., Самохина, Ю.В. Практикум по общей и неорганической химии: учебное пособие / Г.Е. Рязанова, Ю.В. Самохина; ФГОУ ВПО «Саратовский ГАУ». – Саратов, 2007. – 192 с.
Дополнительная
1. Егоров, В.В. Теоретические основы неорганической химии. Краткий курс для студентов сельскохозяйственных вузов : учебник / В. В. Егоров. – Краснодар : Лань, 2005. – 192 с.
2. Клинский, Г.Д., Скопинцев, В.Д. Неорганическая химия для биологов: учебное пособие для студ. с.-х. вузов / Г.Д. Клинский, В.Д. Скопинцев. – М. : Изд-во МСХА, 2001. – 384 с.
^3. Журналы: «Химия и жизнь», «Агрохимия», «Агрохимический вестник», «Экологический вестник России».
Лекция 2
Энергетика химических процессов
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
^
1. Артеменко, А.И. Органическая химия / А.И. Артеменко. – М. : Высшая школа, 2005. – 605 с.
2. Гандберг, И.И. Органическая химия / И.И. Гандберг. – М. : Дрофа, 2002. – 672 с.
^3. Глинка, Н.А. Общая химия: учебное пособие / Н.А. Глинка. – М. : Интеграл-пресс, 2002. – 728 с.
4. Егоров, В.В. Теоретические основы неорганической химии. Краткий курс для студентов сельскохозяйственных вузов : учебник / В. В. Егоров. – Краснодар : Лань, 2005. – 192 с.
5. Золотов, Ю.А., Вершинин, В.И. История и методология аналитической химии / Ю.А. Золотов, В.И. Вершинин. – М. : Издательский центр «Академия», 2007. – 464 с.
6. Князев, Д.А., Смарыгин, С.Н. Неорганическая химия / Д.А. Князев, С.Н. Смарыгин. – М. : Дрофа, 2004. – 529 с.
^
7. Основы органической химии / С.Э. Зурабян [и др.]. – М. : Дрофа, 2006. – 560 с.
8. Основы аналитической химии в 2-х книгах: Учебник для вузов/ Ю.А.Золотов, [и др.] – М. : Высшая школа, 1999. – 351 с.
^9. Угай, Я.У. Неорганическая химия / Я.У. Угай. – М. : Высшая школа, 2002. – 463 с.

Содержание
Введение…………………………………………………………………………………..3
Лекция 1. Химическая кинетика. Химическое равновесие……………………..4
1.1. Скорость химической реакции………………………………………………….4
1.2. Факторы, влияющие на скорость химической реакции……………………….4
1.3. Влияние концентрации реагирующих веществ на скорость реакции.
Закон действия масс………………………………………………………………….5
1.4. Влияние температуры на скорость реакции. Правило Вант-Гоффа.
Теория активации…………………………………………………………………….6
1.5. Катализ. Катализаторы…………………………………………………………..6
1.6. Химическое равновесие, условия его смещения. Принцип Ле Шателье……..7
Вопросы для самоконтроля…………………………………………………………..8
Список литературы………………………...…………………………………………8
Лекция 2. Энергетика химических процессов ………………………………….....9
……...
………
Библиографический список………………………………………………………...10
С

 одержание………………………………………………………………………...…11
одержание………………………………………………………………………...…11