Болезни эндокринной системы болезни островкового аппарата поджелудочной железы
| Вид материала | Документы |
- Программа №16 санаторно-курортной помощи больным с болезнями печени, желчного пузыря,, 40.25kb.
- Реферат на тему: Болезни поджелудочной железы, 322.36kb.
- Рак поджелудочной железы общие сведения об анатомии поджелудочной железы и ее функциях, 675.42kb.
- Задачи занятия: Иметь представление: о методах обследования слюнных желез, поджелудочной, 42.7kb.
- Программа «Здоровье путь к успеху» Срок реализации 3 года, 172.09kb.
- Задачи по оказанию доврачебной помощи при неотложных состояниях 43 акушерство, 1884.21kb.
- Стандарт медицинской помощи больным с другими уточненными нарушениями поджелудочной, 403.8kb.
- Санаторий «Предгорье Кавказа» находится в одном из самых живописнейших мест Краснодарского, 47.52kb.
- А. В. Борота 2011 г. Тематический план, 49.19kb.
- Темы дня молочные железы и гинекологические болезни • Пластическая хирургия молочных, 514.96kb.
Больные сахарным диабетом в 4 раза чаще, чем в популяции, болеют инфекционно-воспалительными заболеваниями мочевыводящих путей (циститами, пиелонефритами). Обычно это относится к женщинам старше 50 лет и мужчинам с доброкачественной гиперплазией предстательной железы. Этому способствуют также
автономные нейропатии и нейропатия мочевого пузыря, вызывающие нарушения тонуса мочевыводящих путей.
При сахарном диабете могут наблюдаться следующие клинические формы инфекционно-воспалительного поражения мочевыводящих путей:
• бессимптомная мочевая инфекция (составляет 90% всех инфекций мочевой системы); выявляется исключительно бактериологическими методами. Основные критерии — бактериурия более 100,000 микробных тел в 1 мл мочи и лейкоцитурия, превышающая 10,000 в 1 мм3 (Rostu, 1995). При отсутствии лейкоцитурии диагноз устанавливается на основании посева двух последовательных образцов мочи; отсутствие роста микроорганизмов в посеве мочи при высокой лейкоцитурии требует повторного, более тщательного исследования мочи;
• латентно протекающий пиелонефрит;
• острый пиелонефрит, который может осложниться папиллярным некрозом; характерны высокая температура тела, сильные боли в пояснице, озноб, гематурия, острая почечная недостаточность, бактериальный шок, обнаружение в моче обрывков почечной ткани;
• острое нагноение почки (карбункул, абсцесс, апостематоз), проявляющееся высокой температурой тела с ознобами, болями в поясничной области, значительной пиурией;
• тяжелый геморрагический и даже некротически-геморрагический цистит.
Инфекция мочевыводящих путей часто приводит к декомпенсации сахарного диабета, развитию кетоацидоза и даже гиперкетонемической комы.
При всякой беспричинной декомпенсации сахарного диабета, а также при появлении лихорадки «неясного генеза» следует исключить воспаление мочевыводящих путей, а у мужчин, кроме того, простатит.
Rostu (1995) приводит следующие показания к микроскопическому исследованию, посеву мочи и определению чувствительности к антибиотикам у больных сахарным диабетом:
• систематически один-два раза в год;
• неожиданное ухудшение гликемического контроля;
• наличие кетонурии;
• появление или усиление микроальбуминурии;
• наличие минимальных признаков инфекции;
• часто у женщин, больных сахарным диабетом, в возрасте старше 50 лет.
Диабетическая нефропатия изложена далее.
^ Диабетические ангиопатии
Диабетическая ангиопатия — генерализованное поражение сосудов при сахарном диабете, распространяющееся как на мелкие сосуды (микроангиопатия), так и на артерии крупного и среднего калибра (макроангиопатия). Это поздние осложнения сахарного диабета, развивающиеся через несколько лет (в среднем 10—15) после манифестащии заболевания.
^ Диабетическая макроангиопатия — поражение артерий крупного и среднего калибра у больных сахарным диабетом в виде атеросклероза и реже — кальцифицирующего склероза Менкеберга или диффузного фиброза интимы.
^ Диабетическая микроангиопатия — специфическое для сахарного диабета распространенное поражение мелких сосудов (капилляров, прекапилляров, артериол, венул). Она характеризуется следующими гистологическими особенностями:
• утолщением базальной мембраны капилляров, что связано с избыточным синтезом коллагена IV типа, протеогликанов, фибронектина и ламинина (Stemberg, 1985);
• пролиферацией эндотелия;
• отложением в стенку сосуда PAS-положительных веществ (гликогена, гликопротеинов, гликозаминогликанов);
• гиалинозом стенок артериол с последующим их запустеванием;
• микротромбами в микроциркуляторном русле в связи с повышенной агрегацией тромбоцитов;
• развитием микроаневризм.
Поражение базальной мембраны является важнейшим патоморфологическим проявлением диабетической микроангиопатии. В состав базальной мембраны входят белки коллагена IV и V типов, протеогликаны: гепарансульфат, дерматансульфат, хондроитинсульфат; ламинин; энтактин; фибронектин.
Коллаген IV типа является основным структурным компонентом базальной мембраны, он обусловливает ее стабильность и селективную проницаемость. Ламинин прилежит к эндотелию, имеет отрицательный заряд (за счет сиаловых кислот), обусловливающий проницаемость базальной мембраны. Ламинин обеспечивает также адгезивную функцию эндотелиальных клеток и участвует в образовании подоцитов базальной мембраны. Фибронектин располагается в базальной мембране в том же слое, что и ламинин, имеет отрицательный заряд, что обусловливает селективную проницаемость.
Энтактин участвует в процессах адгезии клеток. Протеогликаны, большая часть которых представлена гепарансульфатом, обусловливают барьерную функцию базальной мембраны и задерживают фильтрацию плазменных белков.
При сахарном диабете нарушается функциональное состояние названных компонентов базальной мембраны, что резко увеличивает ее проницаемость. Именно этот факт является важнейшим патофизиологическим проявлением диабетической микроангиопатии.
Диабетические ангиопатии классифицируются в зависимости от локализации и клинических проявлений.
Классификация ангиопатий при сахарном диабете
(А. С. Ефимов, 1989; М. И. Балаболкин, 1994)
1. Макроангиопатия:
1.1. Атеросклероз аорты и коронарных артерий (ИБС, инфаркт миокарда).
1.2. Атеросклероз церебральных артерий (острое нарушение мозгового кровообращения, атеросклеротическая энцефалопатия).
1.3. Атеросклероз периферических артерий, в том числе нижних конечностей.
2. Микроангаопатия:
2.1. Ретинопатия.
2.2. Нефропатия.
2.3. Микроангиопатия нижних конечностей.
3. Универсальная ангиопагия — сочетание макро- и микроангаопатии.
Диабетическая микроангиопатия
Основным морфологическим проявлением диабетической макроангиопатии является атеросклероз артерий крупного и среднего калибра. Механизмы его развития аналогичны таковым у лиц, не имеющих сахарного диабета (см. гл. «Атеросклероз»). Особенностью следует считать гликозилирование (неферментативное соединение с глюкозой) липопротеинов низкой плотности. Они не распознаются соответствующими нормальными рецепторами и период их полужизни в плазме крови возрастает.
В результате создаются более благоггриятные условия для их проникновения в стенку сосуда. Наряду с этим происходит гликозилирование липопротеинов высокой плотности, что приводит к уменьшению транспорта холестерина из пораженных участков артерии. Большое значение имеет также активация перекисного окисления липидов, что ведет к модифицированию ЛПНП, изменению их структуры и физико-химических свойств. Такие ЛПНП захватываются макрофагами и другими иммунокомпетентными клетками как «чужеродные», что включает аутоиммунные механизмы поражения артерий. Кроме того, сами продукты перекисного окисления липидов оказывают повреждающее влияние на артериальную стенку и активируют агрегацию тромбоцитов, способствуя тромбообразованию.
Клиническая симптоматика атеросклероза аорты, коронарных и церебральных артерий та же, что у больных, не имеющих сахарного диабета. Особенности ИБС при сахарном диабете изложены выше. Частота сосудистых поражений мозга у больных сахарным диабетом в 2 раза выше, чем в общей популяции.
Клиническая картина
Симптомы диабетической макроангиопатии нижних конечностей:
• зябкость ног, слабость в ногах при ходьбе, длительном стоянии;
• синдром перемежающейся хромоты — боли в области икроножных мышц, появляющиеся или усиливающиеся при ходьбе и уменьшающиеся в покое, что заставляет больного прерывать ходьбу и останавливаться;
• по мере прогрессирования поражения артерий боли становятся постоянными;
• трофические изменения и сухость кожи голеней и стоп, похолодание стоп; темные сухие ногти, часто пораженные грибковой инфекцией, болезненные глубокие трещины кожи на пятках;
• мраморность кожи стоп и голеней;
• атрофия мышц голеней;
• выпадение волос на голенях;
• цианоз пальцев;
• ослабление или отсутствие пульса на a. tibialis post. a. dorsalis pedis;
• крайняя степень нарушения кровообращения в стопах — развитие гангрены, обычно локализующейся в области пальцев. Вначале появляется темное пятно, а далее развивается сухой некроз кожи. Гангрена может вызвать самоампутацию пальца. Нередко образуются пузырьки с серозным или геморрагическим содержимым, изъязвление кожи с распространением язвенно-некротического процесса и последующим осложнением бактериальной инфекцией (влажная гангрена), что является показанием к ампутации. Гангрена может вовлекать также тыльную и пяточную области стопы.
Особенности атеросклеротического поражения артерий ног при сахарном диабете (Verhaeghe, 1956)
• место основного повреждения обычно располагается более дистально, чем у больных, не имеющих сахарного диабета;
• поражение более диффузное, более тяжелое и манифестирует в более молодом возрасте, чем при отсутствии диабета;
• гангрена на диабетической стопе характеризуется частым инфицированием, плохой демаркацией, «пятнистым» распространением;
• изредка у больных сахарным диабетом определяется пульс на артериях стопы даже при критической ишемии, так как она может быть обусловлена преимущественно выраженным нарушением микроциркуляции (т. е. обычно имеется сочетание макро- и микроангиопатии стопы);
• гангрена может манифестировать без предшествующей перемежающейся хромоты.
^ Инструментальная диагностика диабетический макроангиопатии ног изложена в разделе «Диабетическая стопа».
Периферическая макроангиопатия нижних конечностей часто является причиной смерти больных сахарным диабетом, так как ее финалом являются гангрена и сепсис. Частота поражения периферических артерий у больных сахарным диабетом в 5 раз выше, чем в общей популяции (Nattras1996).
При длительном течении сахарного диабета часто развивается кальцифицирующий склероз Менкеберга и диффузный фиброз. Эти поражения чаще развиваются в сосудах газа и нижних конечностей.
Диабетическая микроангиопатия
Микроангиопатия играет ведущую роль в нарушении функции всех органов и систем, особенно почек и глаз, при сахарном диабете. Диабетические микроангиопатия при тщательном обследовании выявляются у 45-90% больных, причем чаще и раньше при ИЗСД по сравнению с ИНСД.
Основные патогенетические факторы
1. Генетическая предрасположенность. Не исключается существование генетической предрасположенности к развитию диабетической микроангиопатии в виде передачи дефекта базальной мембраны сосудов. Возможно, что существует генетическая гетерогенность микроангиопатий у больных ИЗСД и ИНСД. Не исключено, что за наследование сахарного диабета и микроангиопатий ответственны разные гены. Имеются наблюдения, что у ближайших родственников больных сахарным диабетом микрососудистые поражения в биоптатах кожи определяются еще без нарушений показателей углеводного обмена.
2. ^ Наличие гипергликемии.
Гипергликемия способствует повышению проницаемости сосудистой стенки и выходу белков плазмы в экстравазальное пространство. Накопление белков приводит к нарушению состояния мезангиального матрикса в сосудах, что способствует их дальнейшей окклюзии.
3. ^ Активация инсулиннезависимого сорбитолового шунта метаболизма глюкозы.
Гипергликемия приводит к увеличению обмена глюкозы по сорбитоловому пути с образованием большого количества сорбитола. Процесс превращения глюкозы во фруктозу через сорбитол активируется двумя ферментами — альдозредуктазой и сорбитолдегидрогеназой.
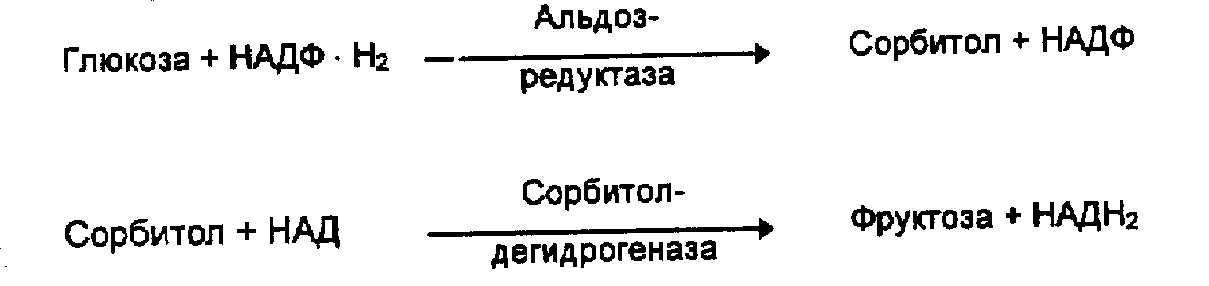
У больных сахарным диабетом возрастает активность альдозредуктазы и снижается — сорбитолдегидрогеназы, в результате большое количество сорбитола накапливается в хрусталике, нервных волокнах, сосудах, что оказывает на них повреждающее влияние. Механизм повреждающего действия избытка сорбитола заключается в следующем:
избыток сорбитола сорбитоловая гиперосмолярность стенок сосуда накопление воды и ионов натрия с одновременной потерей ионов калия отек сосудистой стенки и ее повреждение гипоксия тканей.
4. ^ Гликозилирование белков.
Гипергликемия способствует развитию гликозилирования белков (присоединение глюкозы к аминокислоте лизину), в том число гемоглобина. Продукты реакции гликозилирования белков необратимо связываются с белками: сосудистой стенки (в том числе коллагеном и др.), что изменяет их свойства и повышает проницаемость сосудов. Продукты гликозилирования белков взаимодействуют с рецепторами гладких мышц сосудистой стенки и фибробластов и приводят к пролиферации гладкомышечных и мезангиальных клеток, увеличению матрикса.
Гликозилирование гемоглобина способствует развитию гипоксии тканей, в том числе сосудистой стенки, что способствует ее повреждению.
5. ^ Аутоимунные реакции в сосудистой стенке.
Гликозилированные белки (коллаген, альбумин и др.) в связи с изменением своей структуры становятся аутоантигенами, вследствие повышения проницаемости сосудистой стенки накапливаются в ней и взаимодействуют с иммунокомпетентными клетками, что вызывает развитие аутоиммунных реакций. Взаимодействие аутоантигенов с рецепторами макрофагов приводит к синтезу цитокинов (фактора некроза опухоли, интерлейкина-1) и способствует пролиферации клеток эндотелия и матрикса сосудистой стенки. Развиваются также и аутоиммунные реакции на липопротеины очень низкой плотности, измененные под влиянием активизации перекисного окисления липидов. Образуются иммунные комплексы (пре-ЛП+инсулин+антитела), проникающие в интиму путем эндоцитоза (А. С. Ефимов, 1989) и повреждающие ее.
6. ^ Активизация перекисного окисления липидов. При сахарном диабете активируется перекисное окисление липидов, при этом образуются высокотоксичные гидроперекиси и свободные радикалы, которые повреждают сосудистую стенку, мембрану эритроцитов, модифицируют атерогенные липопротеины, придавая им аутоантигенные свойства, а также способствуют повышению агрегации тромбоцитов.
7. ^ Дисфункция эндотелия и повышение агрегации тромбоцитов.
В норме эндотелий обладает тромборезистентностью, а также способностью восстанавливать поврежденную сосудистую стенку. Тромборезистентность эндотелия обусловлена секрецией простагландина PgI2 (простациклина), который угнетает агрегацию тромбоцитов и оказывает сосудорасширяющее действие; регуляцией фибринолитической системы (синтез тканевого активатора плазминогена и его ингибитора); продукцией антитромбина III (наряду с печенью); участием в регуляции протеин C-протеин-S-тромбомодулиновой системы (с ингибированием тромбина). Эндотелий вырабатывает также эндотелиальный вазодилатирующий фактор — азота оксид (NO), который обладает также и антиагрегантным действием. Наряду с этим в эндотелии синтезируется мощный сосудосуживающий и проагрегантный фактор — эндотелин.
При сахарном диабете под влиянием гипергликемии, свободных радикалов, гидроперекисей: эндотелий повреждается и приобретает тромбогенные свойства. Нарушается продукция простациклина, активатора плазминогена, азота оксида. Одновременно увеличивается продукция тромбоксана и эндотелина, которые повышают агрегацию тромбоцитов и вызывают вазоспастические реакции. Тромбоциты больных сахарным диабетом выделяют также в большом количестве тромбоцитарный фактор роста, способствующий развитию микроангиопатий (Guillauseau, 1983). Вследствие вышеуказанной дисфункции эндотелия и повышенной агрегации тромбоцитов усугубляются сосудистые поражения и развивается микротромбирование в системе микроциркуляции.
8. ^ Активация глюкуронатного пути метаболизма глюкозы. При сахарном диабете в связи с ограничением синтеза гликогена активируется глюкуронатный путь метаболизма глюкозы. Это приходит к усиленному образованию гликозаминов с измененной структурой, которые откладываются в стенку сосуда.
9. ^ Снижение активности пентозного цикла метаболизма глюкозы. Уменьшение интенсивности пентозного цикла метаболизма глюкозы приводит к снижению синтеза рибозо-5-фосфата, нарушению синтеза белка и способствует развитию дистрофических изменений в стенке сосуда.
10. ^ Гиперпродукцчя контринсулярных гормонов. В патогенезе диабетических микроангиопатий принимают участие и гормоны, обладающие контринсулярным действием. Обычно наблюдается повышение содержания в крови глюкокортикоидов, катехоламинов, соматотропина, глюкагона, соматостатина, что способствует усугублению метаболических нарушений, дистрофических изменений в стенке сосуда, отложению в ней гликозаминогликанов, повышению агрегации тромбоцитов, дальнейшей активации перекисного окисления липидов.
11. ^ Повышение активности системы ренин-ангиотензин-альдостерон.
У больных сахарным диабетом установлено повышение активности системы ренин-ангиотензин-алвдостерон, особенно при тяжелой форме заболевания и развитии ангиопатий (А. Е. Ефимов, 1989).
Стойкое повышение активности этой системы усиливает спазм сосудов, вызывает отек сосудистой стенки и способствует прогрессированию ангиопатий. Активация системы ренинангиотензин II-альдостерон обусловлена полиурией, потерей натрия, уменьшением объема циркулирующей крови и количества внеклеточной жидкости. Параллельно активируются хининовая и протеолитическая системы, что усугубляет проницаемость сосудов и способствует прогрессированию ангиопатий.
Диабетическая нефроангиопатия (нефропатия)
Диабетическая нефропатия является ведущей причиной высокой инвалидизации и смертности больных сахарным диабетом. Частота развития ее колеблется от 40 до 50% у больных ИЗСД и от 15 до 30% у больных ИНСД (М. Б. Анциферов и соавт., 1995). По данным мировой статистики только 50% больных с диабетической нефропатией доживают до 50 лет. Остальные погибают преимущественно от терминальной почечной недостаточности в возрасте 20-45 лет.
Морфологической: основой диабетической нефропатии является нефроантиосклероз почечных клубочков. Он бывает двух видов — узелковый и диффузный.
Чаще наблюдается диффузный гломерулосклероз с достаточно равномерным утолщением базальной мембраны клубочков всей почки, изменения прогрессируют медленно и довольно поздно приводят к развитию ХПН.
Узелковый гломерулосклероз описан Киммельстилом и Уилсоном. Он развивается достаточно рано после появления симптомов диабета и прогрессирует быстро. Эта форма нефропатии характеризуется развитием гломерулокапиллярных микроаневризм по периферии или в центре клубочков. В последующем эти микроаневризмы трансформируются в гиалиновые узелки, происходит запустевание сосудов, обтюрация их просвета. Узелковый гломерулосклероз специфичен для сахарного диабета.
Как при диффузном, так и при узелковом гломерулосклерозе наряду с поражением клубочковых капилляров, утолщением их базальной мембраны наблюдается поражение артериол, утолщение их интимы, обусловленное накоплением мукополисахаридов.
Основные факторы патогенеза и прогрессирования
А. Метаболические нарушения
І. Нарушения углеводного обмена
• гипергликемия оказывает повреждающее действие (глюкозотоксичность) на капилляры почек и эндотелий;
• гипергликемия нарушает экспрессию генов, ответственных за синтез протеогликанов в сосудах клубочков;
• гликозилирование белков мезангия и базальной мембраны капилляров нарушает синтез их основных компонентов, а также вызывает утолщение базальной мембраны, нарушение ее структуры;
• накопление сорбитола в капиллярах клубочков и других сосудах почек вызывает нарушение структуры базальной мембраны.
ІІ. Нарушения липидного обмена:
• гиперлипидемия оказывает повреждающее действие на эндотелий капилляров клубочков;
• отложение липидов в мезангии приводит к избыточному образованию экстрацеллюлярного матрикса и гломерулосклерозу;
• липиды связываются с гликозаминогликанами базальной мембраны и нарушают ее функцию.
В. Гемодинамические нарушения:
• развивается внутриклубочковая гипертензия в связи с расширением приносящей и сужением выносящей артериолы, а также в связи с развитием системной артериальной гипертензии; внутриклубочковая гипертензия способствует потере отрицательного заряда базальной мембраны и повышает ее проницаемость;
• увеличивается (на начальной стадии заболевания) скорость клубочковой фильтрации, снижается функциональный почечный резерв, однако по мере прогрессирования нефропатии и системной артериальной гипертензии клубочковая фильтрация снижается.
С. Дисфункция эндотелия и нарушения гемостаза:
• снижается продукция эндотелием антитромбина ІІІ, азота оксида, простациклина и повышается — тромбоксана и эндотелина, что вызывает спазмирование сосудов почек и резко повышает агрегацию тромбоцитов;
• снижается фибринолитическая активность, что способствует микротромбированию в микроциркуляторном русле.
В. Иммунологические нарушения:
• в базальной мембране канальцев, капилляров клубочков, в капсуле клубочков выявляются альбумин, IgG, IgM, С3-компонент комплемента, антитела к поврежденным компонентам базальной мембраны (антигенам), иммунные комплексы. Иммунологические нарушения вызывают дальнейшее повреждение капилляров клубочков.
Е. Нарушение структуры базальной мембраны капилляров клубочков:
• в базальной мембране снижается содержание протеогликана, гепарансульфата, что приводит к утрате зарядоселективных свойств и повышенной проницаемости базальной мембраны для белка;
• установлена генетическая предрасположенность к нарушению синтеза гепарансульфата при диабетической нефропатии;
• наблюдается гиперпродукция эндотелием факторов
роста, что приводит к избыточному синтезу коллагена,
гликопротеинов и утолщению базальной мембраны
капилляров.
Клинические и лабораторные проявления
1. Субъективные проявления диабетической нефропатии в начальных стадиях отсутствуют. Они характерны только для клинически выраженной стадии и характеризуются головными болями, снижением зрения (при наличии артериальной гипертензии), жалобами на отечность лица, общую слабость, снижение аппетита, диспептические явления (при развитии ХПН). Коварство этого осложнения сахарного диабета состоит в том, что оно развивается постепенно и долгое время остается незамеченным, так как на начальных стадиях не вызывает у больных ощущения дискомфорта (А. В. Воронцов, М. В. Шестакова, 1996).
2. Диабетическая нефропатия в клинически выраженных стадиях проявляется:
• нарастающей протеинурией;
• артериальной гипертензией;
• нефротическим синдромом (примерно у 30% больных);
• прогрессирующим снижением клубочковой фильтрации и развитием клиники хронической почечной недостаточности (см. раздел «Болезни почек»).
^ 3. Наиболее ранним признаком развития диабетической нефропатии является микроальбуминурия. Микроальбуминурия — это экскреция альбумина с мочой, превышающая нормальные значения, но не достигающая степени протеинурии. В норме за сутки с мочой выделяется не более 30 мг альбумина. При развитии протеинурии экскреция альбумина с мочой за сутки превышает 300 мг. Диапазон микроальбуминурии составляет от 30 до 300 мг/сутки. Появление у больного сахарным диабетом постоянной микроальбуминурии указывает на то, что в течение ближайших 5-7 лет сформируется клинически выраженная стадия диабетической нефропатии. Классификация альбуминурии представлена в табл. 41 (цит.; М. Б. Анциферов и соавт., 1995).
^ Табл. 41. Классификация альбуминурии

Для экспресс-диагностики микроальбуминурии применяют тест-полоски для мочи «:Micral-Test» («Boehringer Ingelheim», Германия), абсорбирующие таблетки «Micro-Bumintest» («Bayer», Германия) и др. Однако они имеют относительно низкую специфичность. Более точными методами являются радиоиммунный анализ (РИА), турбодиметрические и иммунные методы.
Если при однократном анализе мочи неоднократно выявляется альбуминурия более 20 мг/л, а в моче, собранной за сутки содержание альбумина более 30 мг, и это величина подтверждается в анализах мочи, повторенных через 6 и 12 недель, необходимо выставлять диагноз начинающейся диабетической нефропатии. Однако следует учитывать, что экскреция альбумина с мочой может увеличиваться после физических нагрузок, при инфекции мочевыводящих путей и застойной сердечной недостаточности. Согласно Mogensen (1984), Jarret (1984), Schmith (1988), Nelson (1988), Mattock (1992) наличие микроальбуминурии (экскреция альбумина с мочой больше 30 мг за сутки) имеет
при ИНСД прогностическое значение, т. к. ассоциируется с повышенным риском смерти преимущественно от сердечно-сосудистых заболеваний.
С прогрессированием диабетической нефропатии протеинурия усиливается и становится устойчивой (средняя длительность диабета до возникновения явной протеинурии составляет около 17 лет) (Somers, 1995). Терминальная стадия почечной недостаточности в среднем развивается через 7 лет после начала протеинурии. Если устойчивая протеинурия не развивается в течение 25-30 лет, то, как считает Somers, развитие и прогрессирование диабетической нефропатии маловероятно.
4. ^ Повышение скорости клубочковой фильтрации (гиперфильтрация) является одним из наиболее ранних последствий влияния гипергликемии на функцию почек при ИЗСД и ИНСД. Гиперфильтрация способствует дальнейшему повреждению почек. Гиперфильтрацией обозначается повышение скорости клубочковой фильтрации более 140 мл/мин х 1.73 м2 (более 150 мл/мин). С увеличением длительности заболевания СКФ прогрессивно снижается пропорционально увеличению протеинурии и выраженности артериальной гипертензии. По данным Mogensen у больных сахарным диабетом с нормальной СКФ с началом протеинурии клубочковая фильтрация снижается со скоростью 11 мл/мин/год.
Уровень креатинина в крови начинает повышаться через год после появления протеинурии, когда СКФ снижена на 50-75%. В большинстве случаев СКФ определяют, используя пробу Реберга-Тареева, основанную на исследовании клиренса эндогенного креатинина. Наиболее точным методом определения СКФ является радиоизотопное исследование почечной функции с использованием 51Cr-EDTA. Наряду с повышением СКФ ранними маркерами диабетической нефропатии являются также гиперперфузия почек (повышение почечного кровотока) и внутриклубочковая гипертензия (т. е. повышение давления в капиллярах почечных клубочков), которые в клинических условиях изучить пока невозможно.
5. ^ Артериальная гипертензия характерна для клинически выраженной диабетической нефропатии. Больные сахарным диабетом с АД 140/90 мм рт. ст. (определенным после 2 визитов к врачу) нуждаются в гипотензивном лечении. Гипотензивная терапия может отсрочить наступление летального исхода после начала нефропатии на 10 лет. Ингибиторы АПФ задерживают развитие нефропатии или предотвращают нефропатию даже у больных сахарным диабетом с нормальным артериальным давлением и устойчивой микроальбуминурией.
6. ^ Радиоизотопная ренография обнаруживает снижение секреторно-экскреторной функции обеих почек, но не является методом ранней и специфичной диагностики диабетической нефропатии. При УЗИ почек выявляется диффузный характер поражения и прогрессирующее уменьшение их размеров. УЗИ позволяет также предположить наличие сопутствующего хронического пиелонефрита на основании деформации чашечно-лоханочной системы.
Клинические и лабораторные проявления диабетической нефропатии на поздних стадиях
Поздние стадии диабетической нефропатии характеризуются следующей симптоматикой:
• протеинурия постоянная (как правило, при неизмененном осадке мочи);
• снижение скорости клубочковой фильтрации; с момента появления постоянной протеинурии темп снижения СКФ составляет 2 мл/мин/мес, что приводит к развитию терминальной ХПН через 5-7 лет после выявления протеинурии;
• нарастание азотемии (прогрессирующее повышение содержания в крови креатинина и мочевины);
^ Табл. 42. Классификация диабетической нефропатии (Mogensen) (Стадии развитии диабетической нефропатии)

Примечания: СКФ — скорость клубочковой фильтрации; ПК — почечный кровоток.
• усугубление и стабилизация артериальной гипертензии;
• развитие нефротического синдрома (у 30% больных), характеризующегося массивной протеинурией (более 3.5 г/сут); гипоальбуминемией, гиперхолестеринемией, отечностью, вплоть до анасарки.
Современная классификация стадий развития диабетической нефропатии предложена Mogensen и представлена в табл. 42.
Первые 3 стадии диабетической нефропатии не диагностируются при рутинном обследовании, эти стадии являются обратимыми при правильном и своевременном лечении. Появление протеинурии, определяемой уже обычными лабораторными методами, указывает на глубокое и необратимое поражение почек. В табл. 43 представлена дифференциальная диагностика диабетической нефропатии и хронического пиелонефрита.
Состояние углеводного обмена при диабетической нефропатии
При клинически выраженных стадиях диабетической нефропатии, особенно при развитии нефротического синдрома и ХПН, возможно уменьшение глюкозурии (в связи со снижением фильтрационной способности почек для глюкозы и увеличением ее ре-абсорбции в канальцах); спонтанное снижение уровня гликемии и потребности в инсулине (в связи со снижением активности инсулиназы почек и уменьшением разрушения инсулина в почках, уменьшением образования антител к инсулину).
Скрининг
Основная цель скрининга — своевременное выявление факторов риска развития диабетической нефропатии, почечной недостаточности, сердечно-сосудистых заболеваний и смерти.
Somers (1995) называет следующие факторы риска развития диабетической нефропатии:
• семейный анамнез сердечно-сосудистых заболеваний;
• семейный анамнез артериальной гипертензии;
• микроальбуминурия;
• значительная длительность диабета (после пубертата);
• артериальная гипертензия;
• повышенный уровень проренина в плазме?;
• снижение уровня аскорбиновой кислоты в плазме?;
Анциферовым М. Б. и соавт. предложена следующая программа скрининга и мониторинга (1995):
^ Табл. 43. Дифференциальный диагноз диабетической нефропатии и хронического пиелонефрита у больных сахарным
Диабетом


1. При отсутствии протеинурии необходимо исследовать наличие микроальбуминурии:
• у больных ИЗСД не реже 1 раза в год спустя 5 лет от начала заболевания (при дебюте сахарного диабета после пубертата);
• не реже 1 раза в год с момента установления диагноза сахарного диабета в возрасте до 12 лет;
• у больных ИНСД не реже 1 раза в год с момента установления диагноза.
2. При наличии протеинурии необходимо не реже 1 раза в 4-6 мес. исследовать:
• скорость нарастания протеинурии (в суточной моче);
• скорость снижения клубочковой фильтрации (по клиренсу креатинина);
• скорость нарастания артериальной гипертензии;
• содержание в крови креатинина, мочевины, холестерина.
Диабетическая ретинопатия
Диабетическая ретинопатия является основной причиной слепоты у больных сахарным диабетом. Слепота наступает у больных сахарным диабетом в 25 раз чаще, чем в общей популяции (ВОЗ, 1997). Риск развития диабетической регинопатии зависит от длительности декомпенсации углеводного обмена и типа сахарного диабета. Через 20 лет от начала заболевания 98% больных ИЗСД имеют диабетическую ретинопатию (Klein и соавт., 1984). Около 30% больных ИНСД имеют регинопатию при установлении диагноза заболевания (Stratton и соавт., 1995). Факторами риска развития диабетической ретинопатии являются:
• длительность сахарного диабета;
• частая декомпенсация диабета;
• стойкая гиперлипопротеинемия;
• диабетическая нефропатия;
• автономная вегетативная нейропатия;
• артериальная гипертензия.
Клинические проявления
Субъективно диабетическая ретинопатия проявляется мельканием перед глазами мушек, пятен, ощущением тумана, нечеткостью предметов, прогрессирующим снижением остроты зрения. Объективные проявления диабетической ретинопатии зависят от ее стадии. В настоящее время в большинстве стран используется классификация диабетической ретинопатии, предложенная Kohner и Porta (1990). Согласно этой классификации различают следующие три стадии диабетической ретинопатии.
Непролиферативная ретинопатия
Характерными признаками этой стадии являются наличие в сетчатке микроаневризм, кровоизлияний, отека, твердых экссудатов. Ранним признаком диабетической ретинопатии часто являются капиллярные микроаневризмы. Кровоизлияния имеют вид небольших точек или пятен округлой формы темного цвета, они располагаются в центральной зоне глазного дна или по ходу крупных вен в глубоких слоях сетчатки. Кровоизлияния не влияют на остроту зрения. «Твердые» и «мягкие» экссудаты располагаются преимущественно в центральной части глазного дна. «Твердые» экссудаты обусловлены экссудацией плазмы через стенку калилляров и выглядят как желтовато-белые очаги с четкими границами. Появление «твердых» экссудатов в макулярной зоне может снижать остроту зрения. «Мягкие» («ватные») очаги обусловлены нарушением тока аксоплазмы вследствие локальной ишемии сетчатки и выглядят в виде очагов серо-белого цвета с нечеткими границами. Появление «ватных» очагов указывает на нарушение микроциркуляции в сетчатке. В центральной (макулярной) области или по ходу крупных сосудов выявляется отек сетчатки. Он не виден при обычной офтальмоскопии, его можно заподозрить, если острота зрения снижается более чем на 2 линии по таблице Снеллена.
Препролиферативная ретинопатия
Для этой стадии характерны изменения вен сетчатки (четкообразность, извитость, петли, удвоение, колебания калибра сосудов), большое количество «твердых» и «мягких» («ватных») исссудатов, ретинальных геморрагий.
Пролиферативная ретинопатия
Эта стадия характеризуется появлением новых сосудов в области диска зрительного нерва и в других отделах сетчатки, частыми и обширными кровоизлияниями в сетчатку, что приводит к ее отслойке, интенсивным образованием соединительной ткани.
При диабетосклеротической ретинопатии наряду с признаками диабетической ретинопатии наблюдаются склероз артерий сетчатки, симптом «серебряной проволоки», штрихообразные кровоизлияния в сетчатку.
При диабето-гипертоиической ретинопатии помимо признаков диабетической ретинопатии наблюдаются изменения, свойственные артериальной гипертензии: сужение артерий, усиление рефлекса на них, симптом перекреста вен и артерий (симптом Салюса), артериолярные кровоизлияния.
При диабето-почечной ретинопатии развивается перикапиллярный отек сетчатки, видны фигура «звезд») в макулярной области, разбросанные «ватные» очаги.
Кроме ретинопатии при сахарном диабете наблюдаются также и другие виды патологии органов зрения — рубеоз радужки (новообразование сосудов радужки, что может привести к развитию вторичной, рубеозной глаукомы), помутнение хрусталика (катаракта) вследствие накопления в нем сорбитола и воды, конъюнктивит, при резких колебаниях гликемии нарушается рефракция и аккомодация, появляется дальнозоркость или близорукость.
Для исследования органов зрения и диагностики ретинопатии применяются следующие методы:
• наружный осмотр глазного яблока;
• определение остроты зрения;
• исследование полей зрения (на периметре Гольдмана);
• исследование роговицы, радужной оболочки, угла передней камеры глаза (с помощью щелевой лампы);
• тонометрия (тонометром Маклакова);
• биомикроскопия хрусталика и стекловидного тела с помощью щелевой лампы;
• ультразвуковое исследование при наличии значительных помутнений в стекловидном теле и хрусталике, затрудняющих офтальмоскопию;
• электрофизиологические методы исследования для определения функционального состояния зрительного нерва и сетчатки;
• исследование глазного дна.
Для исследования глазного дна применяются:
• метод офтальмоскопии при расширенных зрачках;
• фотографирование глазного дна с помощью стандартной или немидриатическои камеры;
• флюоресцентная ангиография сетчатки.
Скрининг диабетической ретинопатии
«Золотым стандартом» для диагностики диабетической ретинопатии является использование стереоскопического цветного фотографирования глазного дна, флуоресцентной ангиографии и исследование глаза с помощью щелевой лампы. Однако эти методы пока не везде доступны и наиболее распространенным методом скрининга является прямая офтальмоскопия.
Задачей скрининга является выявление больных с повышенной степенью риска развития диабетической ретинопатии, которые нуждаются в дальнейшем тщательном наблюдении.
Анциферов М. Б. и соавт. (1995) выделяют следующие этапы скрининга:
• сбор и анализ данных анамнеза, клинического и лабораторного обследования;
• верификация начальных сроков проявления нарушений зрения;
• исследование внутриглазного давления;
• определение остроты зрения с коррекцией;
• расширение зрачка;
• исследование хрусталика;
• исследование глазного дна.
Офтальмологические осмотры больных сахарным диабетом проводятся со следующей частотой:
• первое обследование проводится через 1.5-2 года с момента установления диагноза сахарного диабета;
• при отсутствии диабетической ретинопатии — не реже 1 раза в 1 -2 года, а при наличии диабетической ретинопатии — не реже 1 раза в год, при необходимости — чаще;
• при сочетании диабетической ретинопатии с беременностью, артериальной гипертензией, ХПН частота офтальмологических осмотров индивидуальная, при внезапном снижении остроты зрения осмотр офтальмологом производится немедленно.
Микроангиопатия нижних конечностей
Можно различать три стадии микроангиопатии нижних конечностей.
^ Первая стадия (доклиническая). В этой стадии отсутствуют субъективные клинические и объективные симптомы. Распознать ее можно с помощью изучения микроциркуляции в стопах радиоизотопным методом (возможны нарушения), определением скорости кровотока в тканях стопы (ускорение), гистохимическим исследованием биоптатов кожи и мышц голени, тепловизионным исследованием (мозаичность рисунка тепловизиограммы).
^ Вторая стадия (начальных клинический проявлений). Больные жалуются на боли в области стоп и утомляемость при ходьбе. При осмотре выявляются «мраморность» кожи стоп, снижение кожной температуры. Тепловизионное исследование обнаруживает снижение интенсивности излучения в области стоп. Скорость кровотока в области стоп замедлена, микроциркуляция значительно снижена. Пульсация на крупных артериях стопы не изменена.
^ Третья стадия (выраженных клинических проявлений). Больные жалуются на зябкость, выраженную слабость в ногах, боли преимущественно в покое. При осмотре — гипотрофия мышц голени и стопы, цианоз пальцев, неравномерная пятнистая окраска кожи голени, выраженный гиперкератоз, сухость кожи, большие трофические изменения ногтей. В дальнейшем развивается трофическая язва голени или стоп, или гангрена («сухая» или «влажная»). При этом пульсация на крупных артериях стопы сохраняется. Однако, часто имеется сочетание макро- и микроангиопатии, поэтому пульсация может исчезать. При тепловизионном исследовании выявляется синдром «ампутации» стопы.
^ Диабетическая нейропатия
Диабетическая нейропатия является одним из наиболее частых осложнений сахарного диабета. М. И. Балаболкин (1989) указывает, что после более или менее длительного существования сахарного диабета нарушение функции периферических нервов выявляется почти у 100% больных.
Основные патогенетические факторы
1. Активизация полиолового (сорбитолового) пути метаболизма глюкозы и накопления сорбитола и фруктозы в нервных волокнах, что ведет к их набуханию, отеку и демиелинизации.
2. Дефицит -миоинозитола и Nа+-К+-АТФ-азы в нервных волокнах способствует ухудшению их функционального состояния.
3. Ферментативное и неферментативное гликозилирование белков нервных волокон.
4. Нарушение обмена липидов в нервных волокнах (снижение синтеза цереброзидов, уменьшение активности уксусной тиокиназы, активация перекисного окисления липидов) способствует демиелинизации нервных волокон.
5. Эндоневральная микроангиопатия (пролиферация эндотелия, утолщение базальной мембраны, уплотнение мелких сосудов) способствует ухудшению кровоснабжения нервов (замедление капиллярного кровотока, «гипоксия аксонов»).
6. Атеросклероз эпиневральных артерий и ухудшение кровоснабжения нервов.
7. Развитие аутоиммунных реакций в нервных волокнах (обнаружены антитела к фосфолипидам нервных клеток, фактору роста нервных волокон).
Классификация
(В. М. Прихожан, 1981)
А. Центральная нейропатия.
1. Острые нервно-психические нарушения при гипогликемических, кетоацидотических, гиперосмолярных и лактацидотических состояниях, острые нарушения мозгового кровообращения.
2. Неврозоподобные и пснхопатоподобные состояния.
3. Энцефалопатия.
4. Миелопатия.
В. Периферическая нейропатия.
1. Полинейропатия черепномозговых нервов.
2. Полинейропатия спинномозговых нервов:
• дистальная полинейропатия;
• нейромиалгия (при декомпенсации сахарного диабета);
• проксимальная амиотрофия;
3. Автономная висцеральная нейропатия:
• нейропатия органов кровообращения;
• нейропатия органов пищеварения;
• нейропатия органов дыхания;
• нейропатия половых и мочевыводящих органов;
• нейропатия периферических эндокринных желез.
