Российская академия медицинских наук нии нормальной физиологии им. П. К. Анохина
| Вид материала | Автореферат диссертации |
- Психосоциальная проблема, направленная на восстановление физического и психосоциального, 348.21kb.
- Донозологический контроль соматического здоровья населения 03. 00. 13- физиология, 836.84kb.
- Сергиев Владимир Петрович Член-корреспондент рамн, доктор медицинских наук, профессор, 829.91kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Acta Neurobiologia Experimentalis», «Biological Theory», а также членом диссертационных, 19.24kb.
- Составители: В. В. Зинчук, 610.47kb.
- Основание Петербургской академии наук, 49.85kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Академия медицинских наук СССР научный совет по физиологии человека, 4592.08kb.
- Цель настоящей программы состоит в изучении строения здорового организма и жизнедеятельности, 472.25kb.
Таблица 6. Влияние азида натрия и пептида HLDF6 на динамику АСР и поведение замирания при аппликации на червь мозжечка за 5 дней до обучения.
| Группы животных | Амплитуда первой АСР | Индекс восстанов-ления АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Физ. р-р (суммарно) n=21 | 14,9± 2,5 | 0,5± 0,47 | 0,43± 0,25 | 0,35± 0,17# | 62,6± 15,6 | 100,8± 10,2* |
| Физ. р-р (b>0) n=7 | 17,0± 3,5 | -4,0 ±2,2 | 1,77± 0,46 | 0,44± 0,11 | 95,2± 8,4 | 123,5± 9,8* |
| Физ. р-р (b=0) n=7 | 14,3 ±5,9 | -0,7± 2,6 | 0,38± 0,16 | 0,39 ± 0,23 | 34,6 ±10,1 | 77,4± 11,0* |
| Физ. р-р (b<0) n=7 | 12,4± 3,4 | 5,0 ±2,8 | -1,6± 0,44 | -1,03± 0,48 | 54,0 ±10,4 | 85,6± 9,2 |
| NaN3 (суммарно) n=22 | 14,6± 2,2 | -5,3 ±2,3# | 0,07 ±0,24 | 0,41± 0,21 | 49,0± 10,4 | 65,8± 11,6 |
| NaN3 (b>0) n=3 | 27,3± 2,3 | -5,3 ±3,7 | 2,4± 0,37 | 0,36± 0,34 | 86,2± 12,4 | 73,5± 19,6 |
| NaN3 (b=0) n=11 | 11,7± 1,8 | -9,7 ±3,9# | 0,36± 0,34 | 0,55 ±0,26 | 42,9± 8,6 | 64,2± 11,2 |
| NaN3 (b<0) n=8 | 11,2± 3,2 | 1,0 ±1,8 | -1,2± 0,23 | 0,28± 0,35 | 62,2± 9,9 | 64,0± 9,0 |
| NaN3+HLDF6 (суммарно) n=24 | 15,1± 3,7 | 3,05 ±3,22 | 0,13±0,34 | 0,6± 0,29 | 59,9± 8,0 | 92,0± 9,7 * |
| NaN3+НLDF6 (b>0) n=4 | 24,0 ±4,9 | 2,0 ±3,1 | 2,48± 1,0 | 1,25± 0,34 | 58,0 ±6,2 | 79,0± 7,2* |
| NaN3+HLDF6 (b=0) n=12 | 11,4± 3,6 | -1,5 ±3,3 | 0,45± 3,1 | 0,64± 0,37 | 72,6± 6,6 | 93,2± 8,2* |
| NaN3+HLDF6(b<0) n=8 | 11,0 ±2,5 | 6,8 ±1,5# | -2,36± 1,0 | 0,42± 0,25 | 62,5 ±6,1 | 94,0 ±10,2* |
*- p<0,05 - отличия от исходного уровня. p<0,05 – отличия от контроля, # p<0,05 отличия от нулевого значения
клеток Пуркинье, характерной для гипоксических поражений. В контроле число таких клеток составило 21±6%, что соответствует литературным данным и, возможно, связано с глутаматной токсичностью (Pae EK, et al., 2005). После введения NaN3 количество поврежденных клеток Пуркинье возрастало до 63±3%, тогда как аппликация HLDF6 через 5 мин после азида натрия достоверно снижала его до 42±4% (p<0,05).
Обнаружено, что время замирания в сеансе адаптации в группе, получавшей NaN3, было достоверно выше, чем в контроле (98,4±10,2 с по сравнению с 65,2±8,1с p<0,05) и снижалось до 61,4±9,6 с при воздействии HLDF6. Введение NaN3 вызывало нарушение кратковременного угашения АСР (табл.6), ассоциированное с уменьшением количества крыс, демонстрирующих привыкание (b1>0) и увеличением числа животных без выраженной динамики реакции (b1=0), , а также подавление долговременного угашения АСР по показателю спонтанного восстановления (преимущественно в подгруппе с b1=0) и нарушение формирования условного замирания.
Введение пептида HLDF6 не влияло на показатели динамики АСР в день обучения, однако восстанавливало долговременное угашение АСР и формирование поведения замирания, нарушенные азидом натрия (табл.6).
Эффекты белка S100b в дозе, вызывающей апоптоз. Глиальный белок S100b, секретируемый астроцитами в межклеточное пространство, в зависимости от концентрации, оказывает протекторное или проапоптотическое действие на нервные клетки (Rothermundt al., 2003). Аппликация S100b на червь мозжечка крыс за 4 часа до начала обучения в дозе, которая, согласно литературным данным, вызывает апоптоз (500 нг/3мкл), приводила к подавлению кратковременного привыкания (табл.7). На индекс спонтанного восстановления существенного влияния введение S100b не оказывало, однако у всех крыс было нарушено долговременное привыкание, оцениваемое по коэффициенту b2, а также формирование условного обстановочного замирания.
Полученные результаты свидетельствуют, что с функциями мозжечка связан контроль безусловной реакции замирания при высоком уровне оборонительной мотивации, направленный на предотвращение избыточного проявления пассивно-оборонительного поведения, и обеспечивающий адекватный уровень ориентировочно-исследовательской активности. Так, аппликация ТТХ и NaN3 на червь мозжечка приводила к возрастанию времени замирания животных при первом помещении в экспериментальную камеру. Кроме того, обнаружено, что подавление активности червя мозжечка нарушает формирование условного обстановочного замирания. Документированные нами факты также указывают на участие червя мозжечка в обеспечении кратковременного привыкания и кратковременной сенситизации АСР.
Таблица 7. Влияние белка S100b в дозе 500 нг на динамику АСР и поведение замирания при аппликации на червь мозжечка крыс за 4 часа до обучения.
| Группы животных | Амплитуда первой АСР | Индекс восстановле- ния АСР | Коэффициент регрессии b1 исходно | Коэффициент регрессии b2 через 24 часа | Время замирания исходно | Время замирания через 24 часа |
| Контроль (суммарно) n=20 | 16,4 ± 2,9 | 2,1± 1,9 | 0,29± 0,17 | 0,56 ± 0,22 | 52,8± 4,4 | 78,4± 6,6* |
| Контроль (b>0) n=7 | 18,4± 2,9 | -2,0 ±2,3 | 1,03± 0,47 | 0,52± 0,23 | 77,0± 10,4 | 102,8± 9,2* |
| Контроль (b=0) n=8 | 16,0 ±3,6 | 3,38± 2,7 | 0,31± 0,51 | 0,57± 0,37 | 35,8± 8,2 | 64,8± 5,9* |
| Контроль (b<0) n=5 | 13,2 ±3,9 | 5,1 ± 3,2 | -1,58± 0,62 | -0,57± 0,29 | 43,6± 7,4 | 91,2 ±6,0* |
| S100b (суммарно) n=21 | 11,2 ±2,7 | 2,2 ± 1,4 | -0,39± 0,35 | 0,23± 0,16 | 64,0± 7,8 | 63,8± 5,6 |
| S100b (b>0) n=0 | - | - | - | - | - | - |
| S100b n=15 (b=0) | 10,1± 3,02 | 2,3 ±2,0 | -0,18 ± 0,49 | 0,2 ±0,34 | 69,4±9,6 | 64,2± 8,6 |
| S100b n=6 (b<0) | 12,0± 3,14 | 2,0 ±1,8 | -2,00± 0,44 | 0,26± 0,27 | 87,6± 5,5 | 72,2± 9,8 |
* p<0,05 - отличия от исходного уровня, p<0,05 – отличия от контроля
# p<0,05 отличия от нулевого значения
При анализе данных о влиянии нарушения функций червя мозжечка на долговременное привыкание АСР, следует учитывать, что привыкание и сенситизация как формы неассоциативного обучения являются системным результатом согласованной работы различных отделов ЦНС, функционирующих в качестве интегрирующих и дифференцирующих элементов (Г.В.Гершуни, 1968, Thompson and Spenser, 1972, Poon and Young, 2006). На начальном этапе стимуляции в условиях постоянно изменяющейся активности ЦНС работа системы недостаточно скоординирована, вследствие чего возможна избыточность привыкания или сенситизации. В процессе обучения уровень взаимосодействия элементов системы повышается, что находит отражение в изменении параметров динамики реакции (в частности, значений коэффициентов линейной регрессии), а также в сохранении достигнутого при обучении уровня реакции, либо в ее спонтанном восстановлении, компенсирующем избыточную кратковременную сенситизацию или привыкание. Анализ динамики АСР у совокупной выборки адаптированных контрольных животных в описанных экспериментах (табл. 2, 4, 6-8) показывает, что у крыс с доминированием кратковременной сенситизации спонтанное восстановление проявляется как снижение амплитуды первой АСР в сеансе тестирования по сравнению с амплитудой последней АСР сеанса обучения, т.е. имеет место долговременная десенситизация. Напротив, у крыс с доминированием кратковременного угашения имеет место долговременное растормаживание, т.е. повышение амплитуды первой реакции (рис.2). При изменении активности медиального мозжечка может наблюдаться подавление как кратковременной сенситизации, так и кратковременного угашения с одновременным нарушением спонтанного восстановления амплитуды АСР в первой пробе сеанса тестирования. Нарушение спонтанного восстановления имеет место в подгруппах без выраженной динамики, т.е. именно тех, численность которых увеличивается при уменьшении количества крыс, демонстрирующих привыкание или сенситизацию.
Р
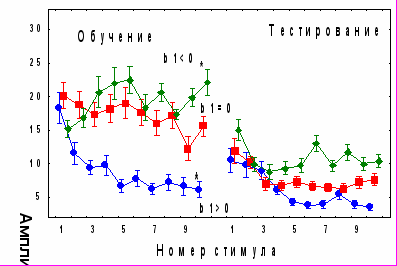 ис. 2. Динамика АСР у адаптированных к контексту контрольных крыс, принадлежащих к различным подгруппам в зависимости от индивидуального значения коэффициента b1. * - p<0,05 по сравнению с амплитудой первой реакции в день тестирования у крыс соответствующей подгруппы.
ис. 2. Динамика АСР у адаптированных к контексту контрольных крыс, принадлежащих к различным подгруппам в зависимости от индивидуального значения коэффициента b1. * - p<0,05 по сравнению с амплитудой первой реакции в день тестирования у крыс соответствующей подгруппы.Учитывая, что в структуре первой АСР сеанса тестирования доминирует ориентировочно-исследовательская составляющая, можно заключить, что при формировании приспособительного поведения в условиях интенсивной акустической стимуляции с функциями медиального мозжечка связаны механизмы долговременного растормаживания и долговременной десенситизации АСР, обеспечивающие оптимальный уровень ориентировочно-исследовательской составляющей активно-оборонительного поведения при повторном помещении животного в экспериментальную обстановку. Кроме того, возникновение положительной корреляции между показателями условного страха и спонтанного восстановления АСР при подавлении активности червя мозжечка свидетельствует об участии этого отдела мозга в обеспечении интеграции пассивно- и активно-оборонительных реакций.
Участие червя мозжечка в консолидации долговременного привыкания АСР и условного обстановочного страха.
При изучении вовлечения медиального мозжечка в механизмы консолидации различных видов оборонительного поведения в качестве одного из инструментов исследования использовали ингибитор синтеза белка циклогексимид (ЦГ). Аппликация ЦГ на червь мозжечка через 5 минут после обучения не оказывала влияния на спонтанное восстановление АСР (рис.3), но вызывала достоверное снижение коэффициента регрессии b2 (0,07±0,23 по сравнению с 1,03±0,36 в контроле, р<0,05 ). Дисперсионный анализ выявил различия в динамике АСР между контрольной и экспериментальной группами во второй половине сеансе тестирования (с 6 по 10 стимулы, p=0,0038); но не в первой его половине (p=0,58), (рис. 3.). Сходные данные получены при аппликации на червь мозжечка ингибитора синтеза мРНК актиномицина D: достоверные различия с контролем наблюдались во второй половине тестирования (p=0,0014), а коэффициент b2 у экспериментальных животных составил 0,28±0,21 по сравнению с 1,1±0,29 в контроле р<0,05). Ни ЦГ , ни актиномицин D при аппликации на червь мозжечка через 5 минут после обучения не оказывали существенного влияния на поведение замирания в день тестирования (рис.3).
Согласно полученным нами данным (рис.1), во второй половине сеанса тестирования у контрольных животных происходит угашение оборонительной составляющей АСР. Таким образом, ингибиторы синтеза белка и РНК при ведении в червь мозжечка избирательно подавляют привыкание оборонительной компоненты стартл-реакции.
При аппликации ЦГ на червь мозжечка через 2 часа после сеанса угашения, наблюдалось достоверное спонтанное восстановление реакции (Iсв=-5,3 ±2,1), а значения коэффициента b2 не отличались от контрольного (рис.4). Время замирания в сеансе тестирования у экспериментальных крыс было достоверно ниже, чем у контрольных (62,6 ±15,5 по сравнению с 109,9±13,5, р<0,05), при этом наблюдалась отрицательная корреляционная зависимость между возрастанием времени замирания и индексом спонтанного восстановления реакции ( r=-0,53, p=0,024), которой не было выявлено у животных, получавших физиологический раствор.
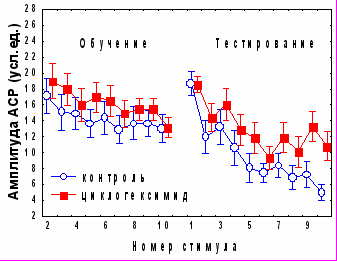
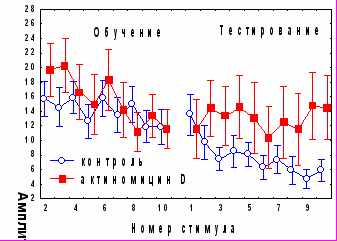
Рис. 3 Влияние циклогексимида и актиномицина D на динамику АСР при аппликации на червь мозжечка крыс через 5 минут после обучения
Аналогичное влияние оказывали моноклональные антитела к белку А3G7, обладающему нейроростовыми и нейротрофическими эффектами (Ельникова и др., 1992, 1995). У животных, которым через 2 часа после обучения апплицировали на червь мозжечка антитела к A3G7 в дозе 5 мкг (рис.4), наблюдалось достоверное спонтанное восстановление АСР (Iсв=-6,25± 2,4) и подавление консолидации/хранения поведения условного замирания (возрастание времени замирания в день тестирования по сравнению с днем обучения составило 21,2± 8,3 с, по сравнению с 54,2± 10,4 с в контроле). Сходные данные относительно избирательного влияния на угашение оборонительной составляющей АСР и на консолидацию обстановочного страха были получены нами ранее при введении в мозжечок антител к белку S100b и мозгоспецифичным лектинам через 2 часа после сеанса обучения (Sherstnev et al., 2000, 2003).
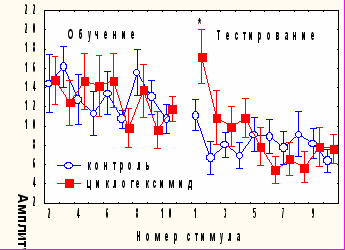
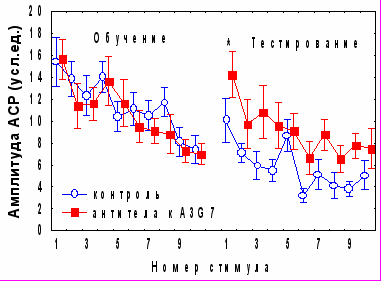
Рис. 4. Влияние циклогексимида и антител к белку A3G7 на динамику АСР при аппликации на червь мозжечка крыс через 2 часа после обучения * -p<0,05 по сравнению с амплитудой последней АСР в день тестирования
Таким образом, обнаружено, что через 5 минут после обучения с функциями червя мозжечка связаны механизмы консолидации долговременного привыкания оборонительной составляющей АСР, а через 2 часа – консолидация привыкания ориентировочно-исследовательской составляющей стартл-реакции и обстановочного условного замирания. Нарушение функций мозжечка на стадии консолидации приводит к разнонаправленным долговременным изменениям пассивно- и активно-оборонительных форм поведения (привыкания АСР и условного замирания), в то время как на этапе формирования эти изменения носят однонаправленный характер.
В немногочисленных исследованиях, посвященных данному вопросу, получены противоречивые сведения о временных параметрах участия мозжечка в процессах консолидации долговременной памяти при формировании различных видов поведения (Cooke еt al. 2004, Такehara et al., 2003). Высказываются мнения, что при формировании моторных навыков процессы консолидации кинематической внутренней модели, обеспечивающей быстрое движение к цели и основанной на сенсорной информации, и динамической внутренней модели, основанной на проприоцептивной информации (или копиях моторных команд) имеют разные временные параметры. (Krakauer et al., 1999, 2006). Полученные нами данные согласуются с этим предположением и указывают, что подобная разновременность характерна также для консолидации различных форм оборонительного поведения и, по крайней мере, отчасти связана с особенностями вовлечения мозжечка в эти процессы.
Участие нейромедиаторных систем мозжечка в процессах угашения АСР и формирования условного обстановочного страха.
На различных этапах формирования долговременного угашения АСР и условного обстановочного страха в черве мозжечка были выявлены изменения активности отдельных нейромедиаторных систем. Достоверных изменений содержания внеклеточного аспартата (базовый уровень в микродиализной пробе 6,3±0,58 fmol), во время обучения и тестирования обнаружено не было (рис.5). Достоверных изменений внеклеточного уровня глутамата (базовый уровень 35,3 ±7,0 fmol) в день обучения не выявлено. Через 24 часа после обучения содержание глутамата повышалось на 40% по сравнению с показателем, наблюдавшимся во время обучения, однако на фоне тестирования его значения не демонстрировали достоверных отличий от имевших место в день обучения (рис 5). Была обнаружена отрицательная корреляция между индивидуальными показателями динамики глутамата через 30 минут после обучения и амплитудой первой АСР в день обучения (r= -0,90, р<0,05 ), а также с амплитудами первых трех АСР день тестирования (r= -0,73, -0,92 и -0,87 р<0,05). Обнаружена положительная корреляция между абсолютными значениями уровня внеклеточного глутамата во время тестирования и индексом восстановления АСР (r= 0,88, p<0,01).
Исходное содержание глицина составляло 17,1± 7,9 fmol, и на фоне тенденции к его снижению во время обучения на 25 % по сравнению с базовым уровнем (р=0,083 по критерию Вилкоксона) наблюдалась положительная корреляция изменения содержания глицина в этой временной точке с возрастанием времени замирания в день тестирования по сравнению с днем обучения (r=0,92, р<0,01). Содержание глицина через 20 и 30 минут после обучения не отличалось от исходного уровня (рис.5). Перед началом тестирования содержание глицина достоверно повышалось по сравнению с сеансом обучения, однако во время тестирования, как это наблюдалось для глутамата, снижалось практически до исходного уровня и достоверных отличий от показателей, наблюдаемых в день обучения, обнаружено не было.
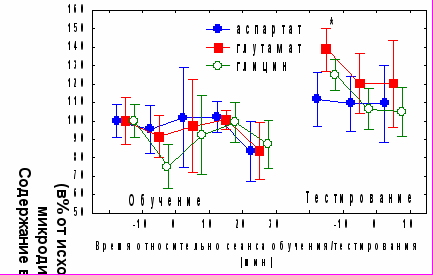 Рис. 5. Динамика изменений уровня аспаратата, глутамата и глицина в черве мозжечка на различных этапах формирования угашения АСР и условного замирания. * - p<0,05 по сравнению с исходным уровнем.
Рис. 5. Динамика изменений уровня аспаратата, глутамата и глицина в черве мозжечка на различных этапах формирования угашения АСР и условного замирания. * - p<0,05 по сравнению с исходным уровнем.Внеклеточное содержание ГАМК (базовый уровень 2,1± 0,94 fmol в пробе) достоверно повышалось в течение 10-30 минут после обучения (p<0,05 по критерию Вилкоксона) (рис.6А). Отмечена высокая индивидуальная вариабельность исходного уровня и изменений ГАМК. Через 24 часа после обучения и во время тестирования содержание ГАМК не отличалось от исходного, однако его повышение наблюдалось сразу после сеанса тестирования
А Б
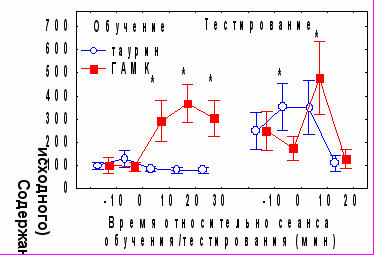
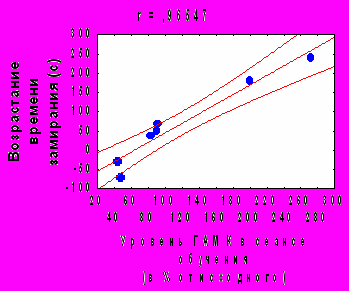
Рис. 6. А - динамика изменений уровня ГАМК и таурина в черве мозжечка на различных этапах формирования угашения АСР и условного замирания, Б -корреляционные зависимости между возрастанием времени замирания в сеансе тестирования по сравнению с сеансом обучения и изменением содержания ГАМК. * - p<0,05 по сравнению с исходным уровнем.
Как и для глицина, выявлена достоверная положительная корреляция между индивидуальными изменениями уровня ГАМК во время обучения и возрастанием времени замирания в день тестирования (рис.6Б).
Достоверное повышение содержания таурина (базовый уровень 1,9 fmol) было отмечено только во время тестирования. В остальных временных точках наблюдались чрезвычайно высокие индивидуальные различия в динамике содержания этого медиатора (рис.6А). Выявлена положительная корреляция абсолютных значений исходного уровня таурина с коэффициентами b1 (r=0,96, p<0,05) и b2(r=0,84, p<0,05), а также отрицательная корреляция между изменениями его содержания во время тестирования и индексом спонтанного восстановления АСР (r=0,88, p<0,05).
Аппликация на червь мозжечка антагониста NMDA глутаматных рецепторов APV, за 1 час до обучения не оказывая влияния на кратковременное угашение АСР, вызывала подавление долговременного привыкания ее ориентировочно-исследовательской составляющей (рис.7). Влияния APV на привыкание оборонительной компоненты АСР и поведение замирания не обнаружено.
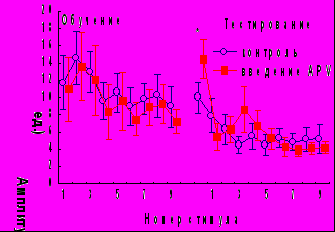
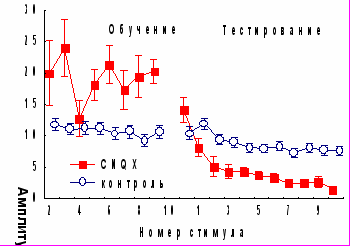
Рис. 7. Влияние антагонистов рецепторов глутамата на динамику АСР при введении за 1 час до начала обучения.
Антагонист АМРА-рецепторов глутамата CNQX вызывал кратковременную сенситизацию АСР F(1, 9,190)=4,44, p<0,01 с возрастанием числа животных, демонстрирующих сенситизацию (9 из 18) и снижением численности подгруппы с угашением (3 из 18). При этом CNQX стимулировал долговременное угашение ориентировочной составляющей АСР: индекс спонтанного восстановления в экспериментальной группе был достоверно выше, чем в контроле (p<0,05 по критерию Манна-Уитни), и повышение его происходило за счет подгруппы, которая в сеансе обучения демонстрировала сенситизацию. В день тестирования у экспериментальных животных наблюдалась стимуляция угашения АСР по показателю b2, за счет более быстрого снижения амплитуды 1-3 ответов, т.е. на стадии доминирования ориентировочно-исследовательской составляющей реакции (рис.7). Влияния CNQX на поведение замирания обнаружено не было.
Антагонист ГАМКА рецепторов бикукуллин при введении за 1 час до обучения вызывал повышение амплитуды АСР, не оказывая влияния на кратковременное угашение и спонтанное восстановление реакции, и нарушал привыкание АСР во второй половине сеанса, т.е., на стадии угашения оборонительной составляющей реакции (рис.8).
Факлофен, антагонист ГАМКБ рецепторов, в аналогичных условиях не оказывал влияния на исходную амплитуду АСР, но, как и бикукуллин, вызывал нарушение долговременного привыкания оборонительной составляющей реакции (рис.8). .
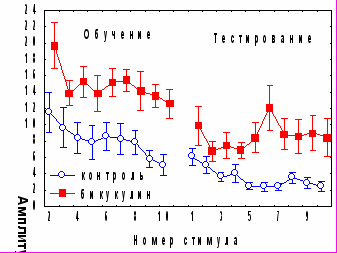
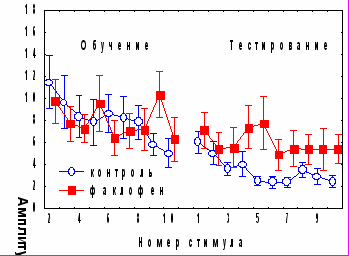
Рис. 8. Влияние антагониста ГАМКА рецепторов бикукуллина и антагониста ГАМКБ –рецепторов факлофена на динамику АСР при аппликации на червь мозжечка крыс за 1 час до начала обучения.
Введение таурина за 1 час до обучения приводило к нарушению кратковременного угашения (рис. 9) за счет уменьшения количества животных с b1>0 (1 из 19 по сравнению с 7 из 19 в контроле) и повышения количества крыс без выраженной тенденции в динамике АСР.
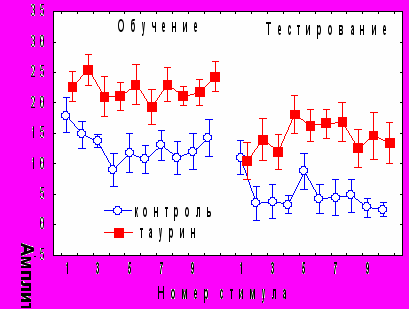
Рис. 9. Влияние таурина на динамику АСР при аппликации на червь мозжечка крыс за 1 час до начала обучения
В то же время, таурин стимулировал долговременное привыкание ориентировочной компоненты АСР и по амплитуде первого ответа в день тестирования различий между группами не наблюдалось. В сеансе тестирования у животных, получавших инъекции таурина, было нарушено привыкание оборонительной составляющей АСР. Полученные результаты согласуются с данными о положительной корреляции коэффициентов b1 и b2 с исходным уровнем таурина и отрицательной корреляции между уровнем таурина при тестировании и индексом спонтанного восстановления АСР. Влияния таурина на поведение замирания выявлено не было.
При изучении уровня биогенных аминов и их метаболитов в гомогенате червя мозжечка обнаружено возрастание уровня норадреналина через 4 часа после обучения и тенденция к его снижению через 24 часа, не достигающая уровня достоверности. Уровень серотонина повышался через 5 минут и 4 часа после обучения, а через 24 часа его содержание снижалось на 60% по сравнению с контролем (рис.10А). Уровень 5-ОИУК достоверно снижался через 4 и 24 часа после обучения. В условиях введения циклогексимида в червь мозжечка через 5 минут, но не через 2 часа после обучения снижения показателей активности серотонинергической системы не наблюдалось (рис. 10Б), таким образом, этот процесс зависит от синтеза белка в медиальном мозжечке.
А Б
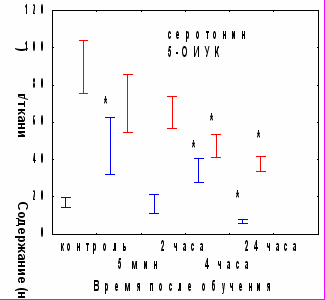
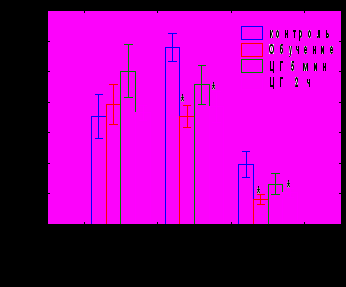 Рис. 10. А - показатели активности серотонинергической системы мозжечка в различные сроки после обучения. Б - влияние циклогексимида на содержание моноаминов через 24 часа после обучения. ЦГ 5 мин – введение циклогексимида через 5 минут после обучения, ЦГ 2 ч – введение циклогексимида через 2 часа после обучения.. * - р<0,05 по сравнению с контрольным уровнем
Рис. 10. А - показатели активности серотонинергической системы мозжечка в различные сроки после обучения. Б - влияние циклогексимида на содержание моноаминов через 24 часа после обучения. ЦГ 5 мин – введение циклогексимида через 5 минут после обучения, ЦГ 2 ч – введение циклогексимида через 2 часа после обучения.. * - р<0,05 по сравнению с контрольным уровнемРитансерин – антагонист 5-НТ2 серотониновых рецепторов при введении до обучения не оказывал влияния на кратковременное угашение и спонтанное восстановление АСР, однако вызывал нарушение угашения оборонительной составляющей реакции (рис11А).
А Б

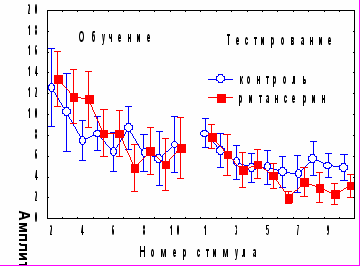
Рис. 11. Влияние ритансерина на динамику АСР. А - при аппликации на червь мозжечка крыс за 1 час до начала обучения, Б - за 1 час до начала тестирования.
У экспериментальных животных этой серии не наблюдалось также достоверного возрастания времени замирания в день тестирования по сравнению с днем обучения (показатель возрастания времени замирания составил 41,3±21,1с при контрольном уровне 77,4 ±9,6с, р<0,05). Введение ритансерина за 1 час до тестирования (рис.11Б) избирательно стимулировало угашение оборонительной компоненты АСР по данным дисперсионного анализа (для второй половины сеанса тестирования: F (1, 5, 175)=2,36, p<0,05) и по величине коэффициента b2 (0,63±0,15 по сравнению с 0,28±0,09, р<0,05). Влияния ритансерина на поведение замирания при введении перед тестированием обнаружено не было.
Таким образом, полученные данные свидетельствуют, что глутаматэргические синаптические процессы, опосредующие сенсорную информацию от мшистых волокон, избирательно вовлечены в обеспечение долговременного угашения ориентировочной составляющей АСР. В то же время, с изменениями активности серотонинергических афферентов и находящихся под их модуляторным воздействием тормозных ГАМК/глицинэргических интернейронов (Калиниченко, Мотавкин, 2005), связано формирование и реализация долговременного угашения оборонительной составляющей АСР, а также формирование обстановочного пассивно-оборонительного поведения замирания. Выявленные нами факты также указывают на участие тауринергических механизмов как в обеспечении кратковременного привыкания/сенситизации, так и долговременного растормаживания/десенситизации АСР.
