Тематические планы лекций, практических занятий, экзаменационные вопросы, примеры тестов тематические планы лекций по общей химии на 1 семестр ( 2-х часовые) Предмет и задачи химии. Химические дисциплины в системе медицинского образования
| Вид материала | Экзаменационные вопросы |
- Тематические планы лекций, практических занятий, экзаменационные вопросы, примеры тестов, 2655.04kb.
- Тематические планы лекций и практических занятий, экзаменационные вопросы, примеры, 902.02kb.
- Тематический план лекций по патофизиологии для студентов лечебного, педиатрического,, 493.28kb.
- Тематические планы лекций, практических занятий, элективных курсов, экзаменационные, 743.05kb.
- Тематические планы лекций и практических занятий. Экзаменационные вопросы, примеры, 976.53kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Тематические планы лекций и практических занятий 1 курс план лекций по истории фармации, 679.07kb.
- Тематические планы лекций и практических занятий. 1 курс план лекций по истории фармации, 424.2kb.
- Правительство Российской Федерации Государственный университет- высшая школа экономики, 257.48kb.
- Планы лекций и практических занятий по аналитической химии для студентов 2 курса очного, 4586.75kb.
Кинетика
Перед решением задач рекомендуется выучить следующие основные
понятия:
1) скорость химической реакции;
2) константа скорости химической реакции;
3) период полупревращения;
4) порядок и молекулярность реакции;
5) температурный коэффициент скорости реакции;
- энергия активации.
Необходимо знать:
1) кинетические уравнения химических реакций разного порядка;
- зависимость константы скорости химической реакции от различных
факторов;
3) методы определения значения энергии активации;
4) математическое выражение правила Вант-Гоффа;
5) уравнение Аррениуса;
6) связь между энтальпией реакции и энергией активации прямой и обратной реакций.
Обратить внимание на то, что:
- порядок реакции определяют, сопоставляя изменение величин начальной
концентрации (с0) и периода полупревращения (t0,5). Реакции, для которых наблюдается прямая зависимость между изменениями значений с0 и t0,5 относятся к реакциям нулевого порядка; реакции с обратной зависимостью величин с0 и t0,5 - к реакциям второго порядка; реакции, в которых t0,5 ≠ f(c0) — к реакциям первого порядка;
- единицы измерения константы скорости зависят от порядка кинетического
уравнения реакции;
- для реакций первого порядка молярные концентрации могут быть заменены
любым другим способом выражения состава системы (массовая доля, массовая концентрация и др.), но обязательно одинаковыми для с0 и ct;
- единицы измерения величин Ea и произведения RT, входящих в уравнение
Аррениуса:
k = Ae-Ea/RT
должны совпадать, так как их отношение стоит в показателе степени и должно быть безразмерной величиной;
5) приращение температур ∆t=t2-t1 (∆ T=T2-T1) в математическом выражении
правила Вант-Гоффа:
v2=v1γ (t2 - t1 )/ 10
или
k2=k1γ (t2 - t1 )/ 10
может иметь единицы измерения как в °С, так и в К, и следовательно, 10,
стоящая в знаменателе показателя степени температурного коэффициента γ,
тоже может иметь единицы измерения либо в °С, либо в К.
- В уравнении Аррениуса единицы измерения величины Еa должны быть
Дж/моль, так как единицы измерения газовой постоянной R –Дж(моль • К) и
в левой части уравнения стоит безразмерная величина k2/k1.
Учесть, что, если известны значения k1, k2, можно рассчитать:
1) энергию активации Еa;
2) константу скорости химической реакции при любой температуре;
3) температурный коэффициент Вант-Гоффа, период полупревращения.
примеры решения типовых задач
В системе 2NO(г) + O2(г) 2NO2(г) равновесные концентрации веществ составляют [NO] = 0,2 моль/л, [O2] = 0,3 моль/л, [NO2] = 0,4 моль/л. Рассчитать Кравн. и оценить положение равновесия.
Решение: В соответствии с законом действующих масс для обратных реакций:
[NO2]2
Кравн. = ;
[NO]2 [O2]
(0,4)2
Кравн. = = 13,3.
(0,2)2 0,3
Ответ: Кравн. > 1,следовательно, равновесие смещено вправо.
Рассчитайте тепловой эффект реакции получения этилового эфира аминобензоловой кислоты (полупродукта при получении анестезина) при стандартных условиях по уравнению реакции:
4C2H5O – CO - C6H4NO2(ж) + 9Fe(т) + 4H2O(ж) = 4C2H5O – CO – C6H4NH2(ж) + 3Fe3O4(т) ,
если известны стандартные теплоты образования участников реакции:
Вещество ∆Н0298, кДж/моль
C9H9O4 N(ж) - 463,2
H2O(ж) - 273,3
С9Н11О2N(ж) - 1759,0
Fe3O4(т) - 1068,0
Решение: По первому следствию из закона Гесса
H0р-ции = H0обр. ПРОД. Р-ЦИИ- H0обр.ИСХ. В-В (в расчетах учесть стехиометрические коэффициенты реагентов и продуктов);
H0р-ции = -7294 кДж/моль
Ответ: ∆Н0298 = - 7294 кДж/моль.
Рассчитать энтальпию гидратации сульфата натрия, если известно, что энтальпия растворения безводной соли Na2SO4(к) равна –2,3 кДж/моль, а энтальпия растворения кристаллогидрата Na2SO4 10Н2О(к) равна 78,6 кДж/моль.
Решение:
При растворении безводной соли происходит её гидратация и последующее её растворение кристаллогидрата в воде. Эти процессы могут быть выражены с помощью треугольника Гесса и следующих термодинамических уравнений:
Na2SO4(к) + 10H2O(ж) = Na2SO4 . 10H2O(к); ∆H1 =?
Na2SO4 . 10H2O(к) + H2O(ж) = Na2SO4(р-р); ∆H2 = +78,6 кДж/моль;
Na2SO4(к) + H2O(ж) = Na2SO4(р-р); ∆H3 = -23 кДж/моль
N

 a2SO4 . 10H2O(к)
a2SO4 . 10H2O(к)∆H1 ∆H2

Na2SO4(к) ∆H3 Na2SO4(р-р);
В соответствии с законом Гесса энтальпия процесса растворения безводной соли (∆H3) равна сумме энтальпии гидратации безводной соли до кристаллогидрата (∆H1) и энтальпии растворения кристаллогидрата (∆H2): ∆H3 = ∆H1 + ∆H2.
∆H1 = ∆H3 - ∆H2 = -2,3 – 78,6 = -80,9 кДж/моль.
Ответ: энтальпия гидратации сульфата натрия –80,9 кДж/моль.
При растворении 10 г хлорида аммония в 233 г воды температура понизилась на 2,80С. Определить тепловой эффект растворения соли, если удельная теплоемкость раствора 4,18 Дж/г град.
Решение:
∆H р-ния = +- Q/n, Cp=Q/m·∆Т
Где Q – количество теплоты, выделяющейся или поглощающейся при растворении соли;
n – количество растворяемого вещества.
Q = c m(р-ра) ∆t,
Где с – удельная теплоемкость, 4,18 Дж/г . град;
∆t – изменение температуры раствора при растворении соли.
n= m/M.
Так как температура раствора понизилась, ∆Н р-ния > 0;
∆H р-ния = + c mр-ра ∆t M / mсоли =
= 4,18 Дж/г град 243 г 2,8 град 53,5 г/моль /10 г = 15216 Дж/моль = 15,216 кДж/моль.
Ответ: при растворении соли поглотилось 15,216 кДж/моль теплоты.
Рассчитайте тепловой эффект реакции получения газообразного хлороформа при температуре 600К
СН4(г) + 3Сl2(г) = СНСl3(г) + 3НСl(г),
1 2 3 4
если известны стандартные теплоты образования и средние теплоёмкости участников реакции.
Участники реакции ………………….1 2 3 4
∆H0298, кДж/моль…………………...-75,9 0 -100,4 -92,3
Ср, Дж/(моль . К)…………………17,5 36,7 81,4 26,5
Решение:
∆Н298 х.р., =-100,4-3*(-92,3)-(-74,9)= - 306,4 кДж. моль= - 306,4*103 Дж/моль
∆Ср = 3*26,5 + 81,4 – (17,5 + 3 * 36,7) = 33,3Дж/моль·К
∆Нх.р.,600 = -306,4 * 103 + 33,3 * (600 - 298) = -20544 Дж/моль = -20,5кДж/моль
Рассчитать константу равновесия реакции окисления этанола в уксусный альдегид при 310 к.
Решение:
G0р-ции= - 2,303RTlnКравн;
G0р-ции= G0прод.ре-ции - G0исх.в-в;
G0(С2Н5ОН)= -174 кДж/моль
G0(СН3СОН)= -139,5 кДж/моль
G0(Н2О)=- - 237 кДж/моль
С2Н5ОН(ж) +1/2О2 СН3СНО(р-р) +Н2О(ж) ;
G0р-ции=-139,5+(-237)--174= - 202,5 кДж/моль
lgKравн=G0р-ции/2,3RT; lgKравн = - 202,5103 Дж/моль/(-2,303 8,31 Дж/моль 310 К)=34,2 34
Ответ: Kравн=1034,так как Kравн103, реакция практически необратима
Определить направление протекания реакции:Н2(Г)+I2(г) 2НI(Г) при 298 К и С(Н2)=С(I2)=0,01 моль/л; с(НI)=1,0 моль/л. K равн=2
Решение:
G0р-ции=RTlnC2(HI)/(c(H2)c(I2))-ln Kравн)- уравнение изотермы Вант - Гоффа;
G0р-ции=8,31298(ln 12/(0,010,01)-ln 2)=21091 Дж/моль=21,091 кДж/моль.
Ответ: G0р-ции0, поэтому реакция в прямом направлении не может идти самопроизвольно.
Вычислить константу равновесия образования метилового спирта СО(Г)+2Н2(Г)СН3ОН(Г), при стандартных условиях (с.у.) сделать заключение о практической обратимости реакции.
Решение:
Н0обр(СО) = -110 кДж/моль;
Н0обр(СН3ОН)= -239 кДж/моль;
Н0обр(Н2)= 0 кДж/моль;
S0обр(СО)=+198 Дж/мольК;
S0обр(СН3ОН)= +127 Дж/мольК;
S0обр(Н2)=+131 Дж/мольК;
Нр-ции=Н0обр(СН3ОН)- Н0обр(СО)+2Н0обр(Н2)= -239-(-110+0)=
= -129000 Дж/моль;
S0 р-ции= S0обр(СН3ОН)- S0обр(СО)+2 S0обр(Н2)=+127-198+2*131=
= -333 Дж/мольК.
G0р-ции=Н0-TS0= -129000-298(-333)= -29766 Дж/моль
ln Кравн= -G/RT= 29766/(8,31298)=12
Кравн= e12 = 1,65105
Ответ: Кравн= 1,65105, так как К103,то реакция при с.у. практически необратима
Во сколько раз изменится скорость прямой реакции 2CO(г) + O2(г) 2СО2(г) а)при повышении концентрации СО в 3 раза?
б) если уменьшить объем системы в 3 раза?
в) если увеличить давление в 2 раза?
а) v1= KC2(CO)C(O2) ;
v2= K(3C)2(CO)C(O2) ;
v2/v1=9.
Ответ: увеличится в 9 раз.
б) v1= KC2 (CO)C (O2) ;
v2= K(3C)2(CO)3C(O2) = 27КС2(СО)С(О2) ;
v2/v1=27.
Ответ: увеличится в 27 раз.
в) v1= KC2(CO)C(O2) ;
v2= K(2C)2(CO)2C(O2) = 8КС2(СО)С(О2) ;
v2/v1=8.
Ответ: увеличится в 8 раз.
Во сколько раз следует увеличить давление в системе 2SO2 + O2 2SO3, чтобы скорость прямого процесса возросла в 27 раз?
Решение:
v
=
2 Kx2C2(SO2)xC(O2)
v1 KC2(SO2)C(O2)
v2 / v1 = x3;
x3 = 27 ;
x = 3.
Ответ: следует увеличить давление в 3 раза.
Константа скорости распада пенициллина при 360С равна 610-6 сек -1, а при 410С она равна 1,210-5 сек -1. Вычислить температурный коэффициент реакции ().
Решение:
К2 = К1(t1-t2)/10
(41-36)/10 = K2/K1 = (1,210-5)/(0,610-6) = 2;
1/2 = 2 = 4.
Ответ: = 4.
Температурный коэффициент скорости реакции равен 2,8. Во сколько раз увеличится скорость реакции при повышении температуры от 20 до 750С?
t = 75 - 20 = 550C ;
v2/v1 = t / 10 = 2,8 55/10 = 2,8 5,5 287,98,
т.к. lg (v2/v1) = lg 2,8 5,5 = 5,5 lg 2,8 = 5,50,447 = 2,458,
откуда v2/v1 = 287,98, т.е. скорость возрастет в 288 раз.
Ответ: скорость возрастет в 288 раз.
Константа скорости реакции (СН3СО)2О + Н2О 2 СН3СООН при температуре 150С равна 0,0454 мин-1. Исходная концентрация (СН3СО)2О равна 0,5 мольл-1. Чему будет равна скорость реакции в тот момент, когда концентрация СН3СООН станет равной 0,1 мольл-1?
Решение:
v = KC((CH3CO)2O) ;
из уравнения реакции n((CH3CO)2O) : n(CH3COOH) = 1 : 2, следовательно,
если С(СН3СООН) = 0,1 мольл-1, то С (CH3CO)2O) = 0,05 мольл-1.
А т.к. Сисх((CH3CO)2O) = 0,5 мольл-1
С (CH3CO)2O) = 0,5 - 0,05 = 0,45 мольл-1.
v = KС (CH3CO)2O) = 0,04540,45 = 0,0204 мольл-1мин-1.
Ответ: в этот момент скорость реакции равна 0,0204 мольл-1мин-1.
Во сколько раз увеличится скорость реакции, протекающей при 298 К, если энергию активации Еа уменьшить на 4 кДж/моль?
Решение:
1)Используя уравнение Аррениуса находим отношение констант скоростей реакции
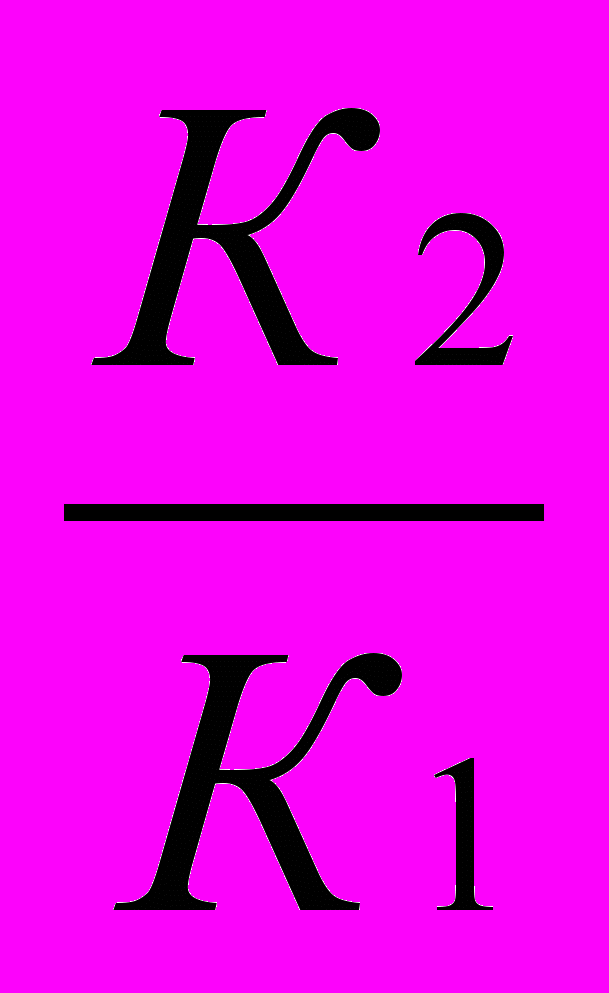 .
. 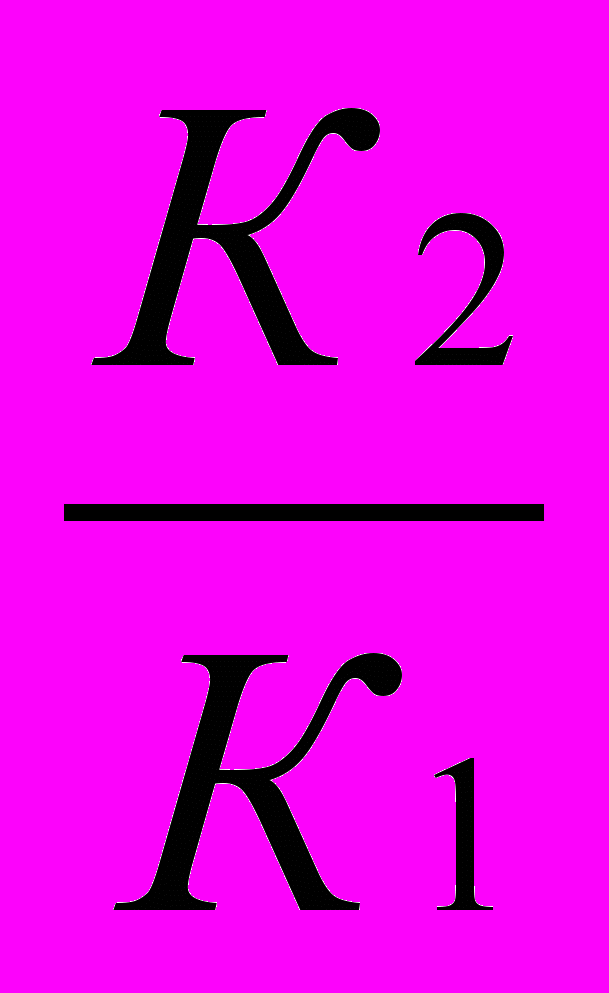 =
=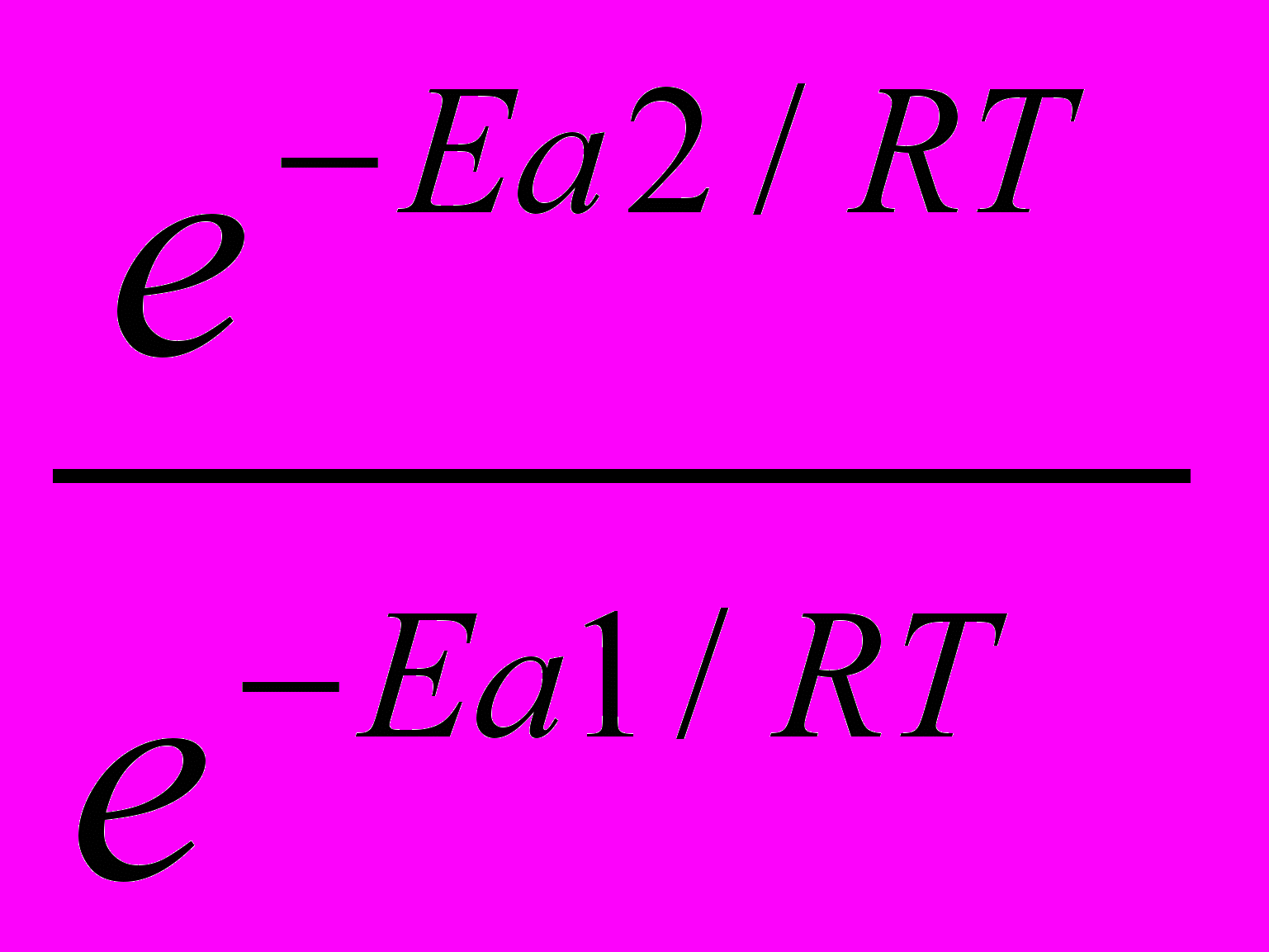 = еЕа1–Еа2
= еЕа1–Еа22)Логарифмируем полученное выражение:
3) ln
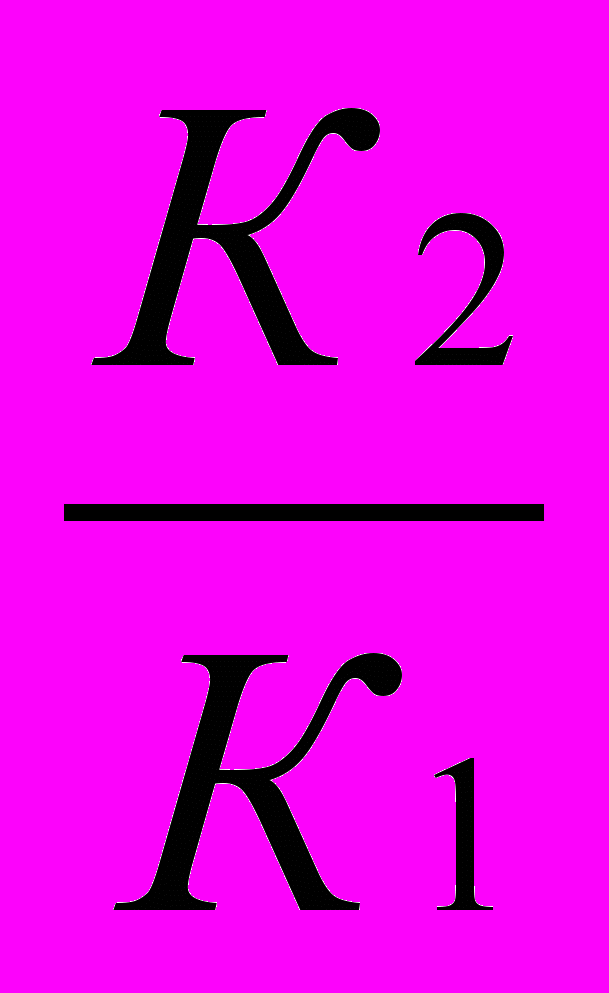 =
= 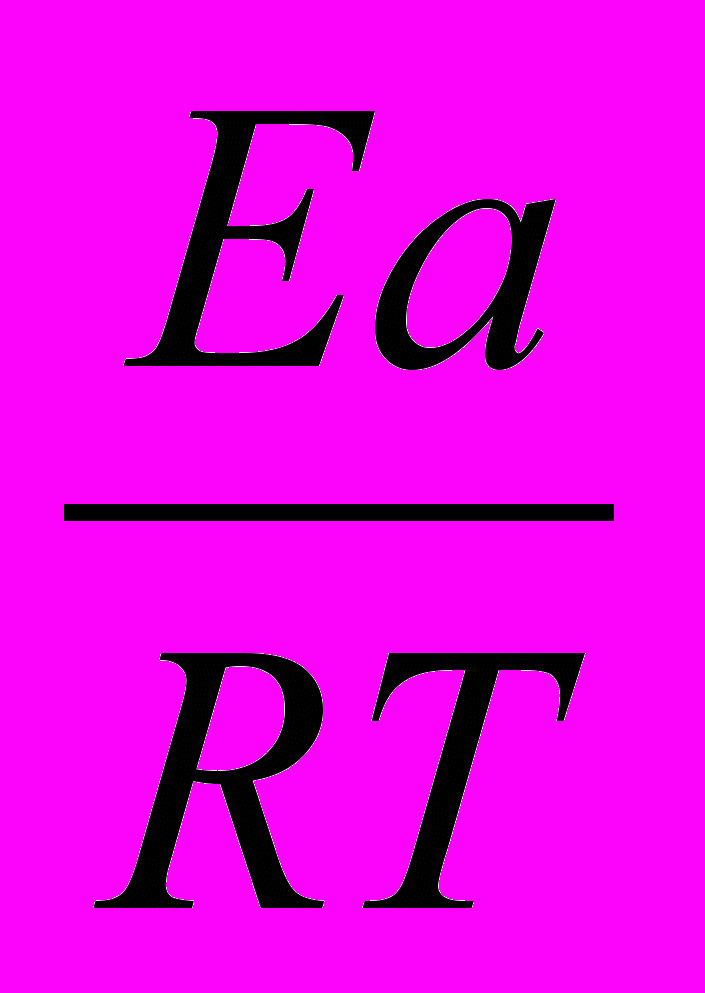 ; ln
; ln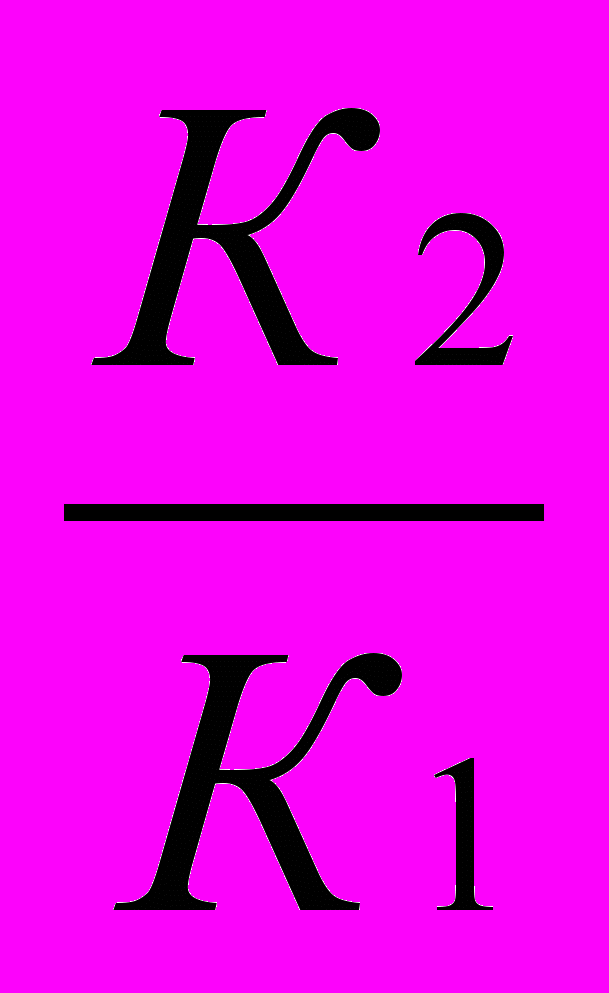 =
= 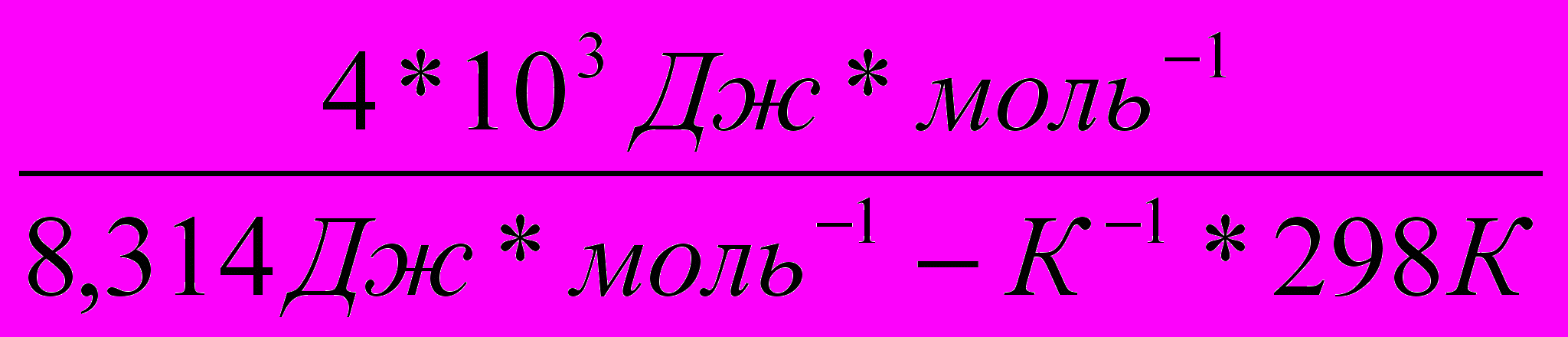 =1,61
=1,61Находим отношение констант:
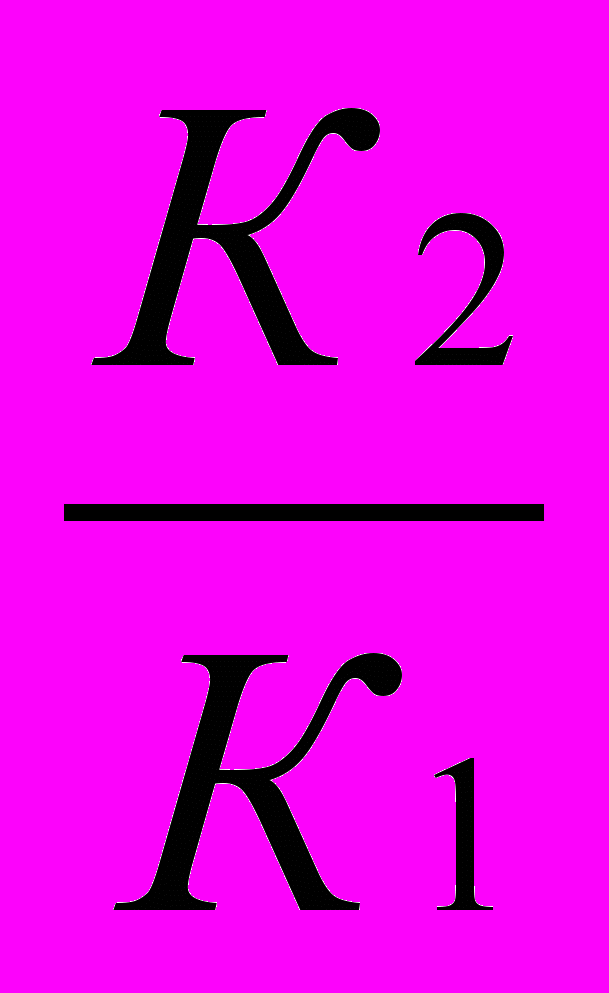 =5,03
=5,03Ответ: скорость реакции увеличится в 5 раз.
Вычислить температурный коэффициент (γ) константы скорости реакции разложения Н2О2 в температурном интервале 250С–550С при
Еа=75,4 кДж*моль-1.
Решение:
1) Используя уравнение Аррениуса находим отношение
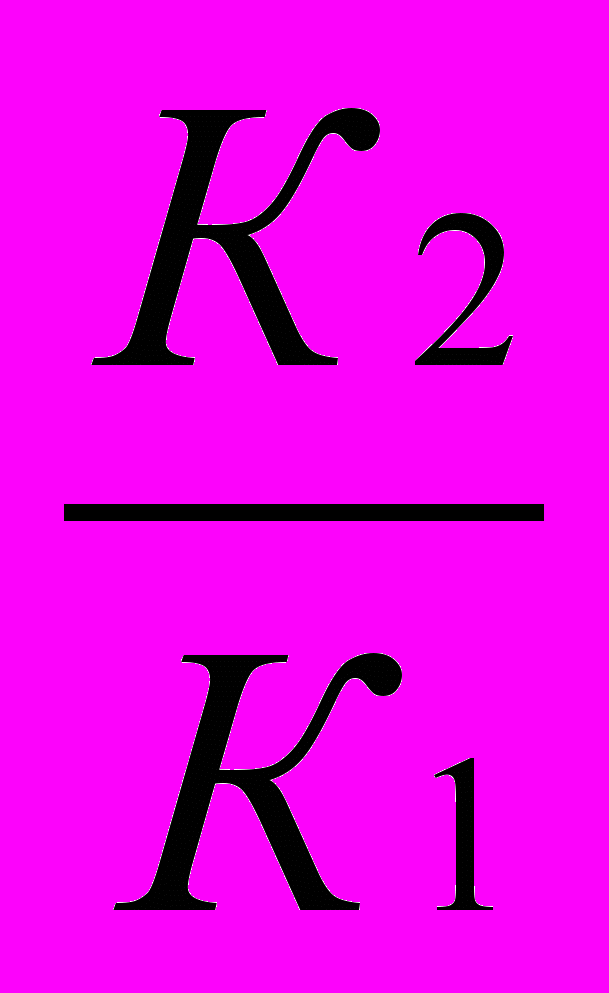 .
.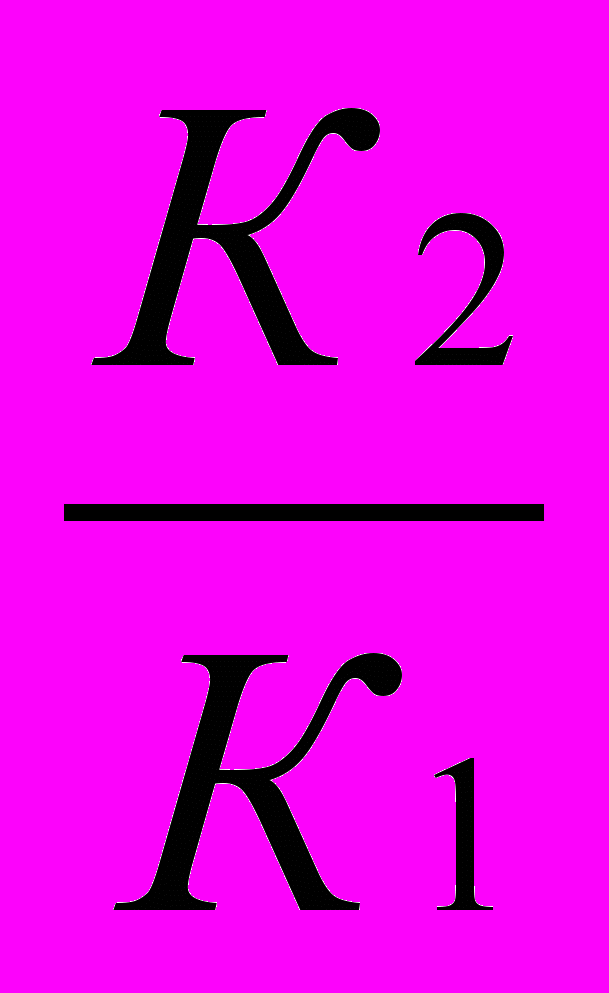 =
=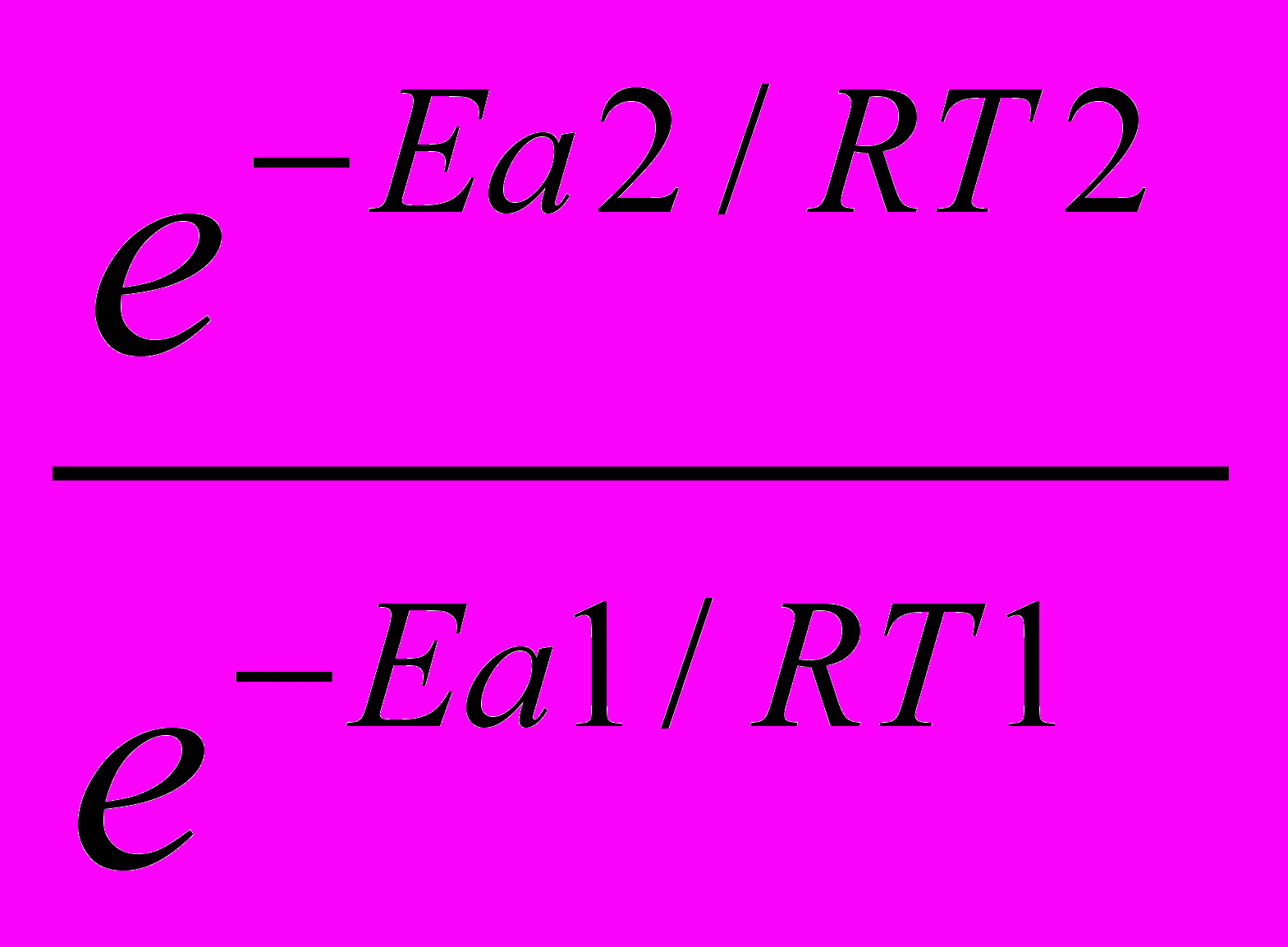 =
= 
2)Логарифмируем полученное выражение:
ln
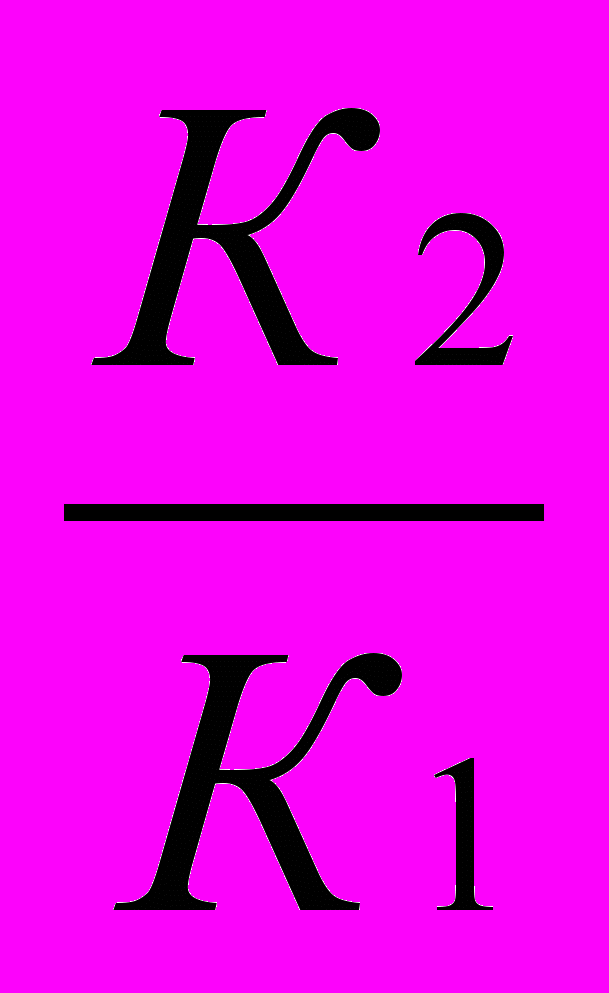 =
=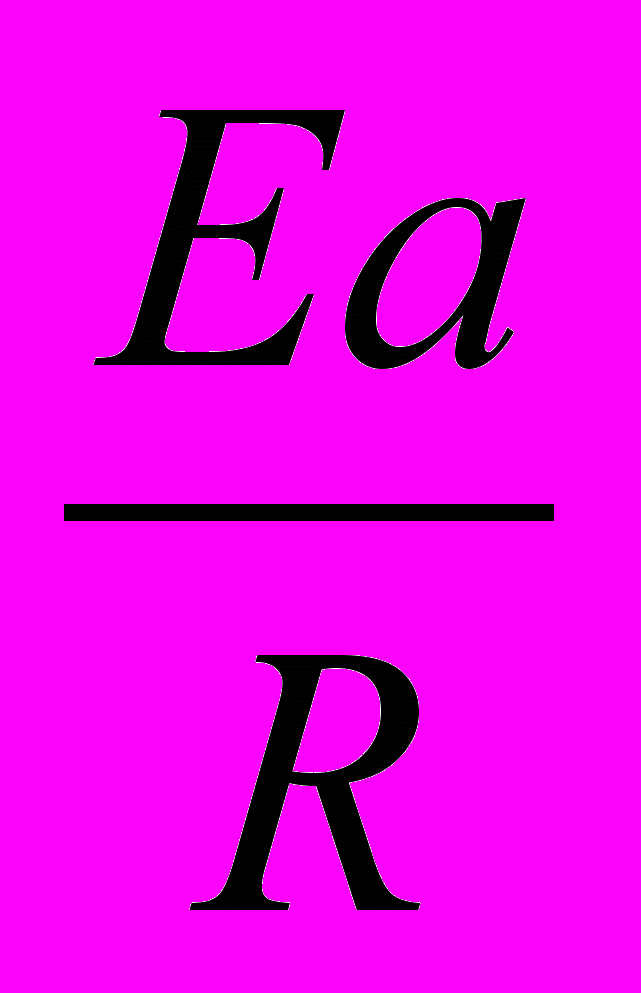 (1/Т1–Т2) или ln
(1/Т1–Т2) или ln 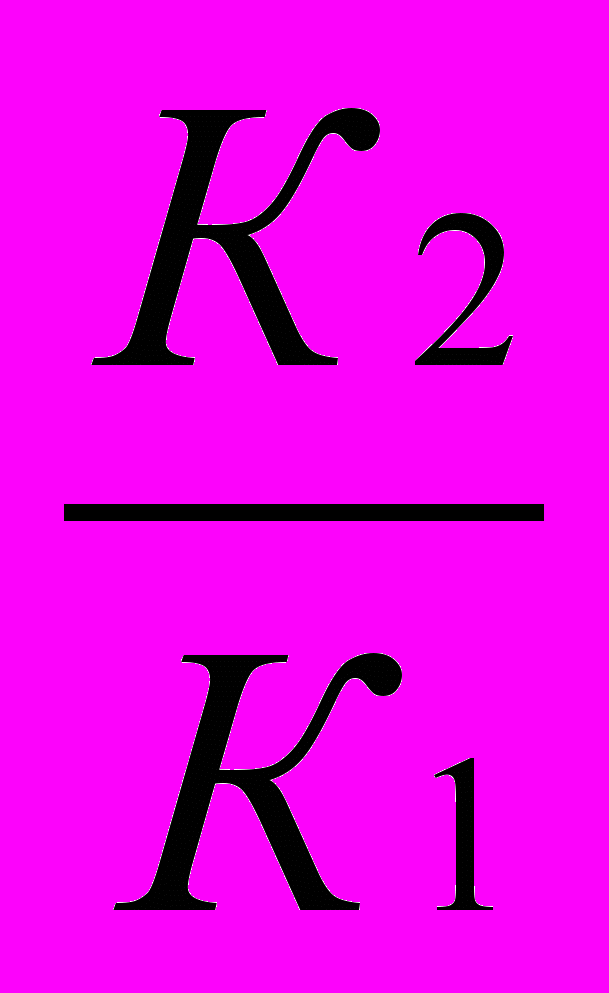 =
= 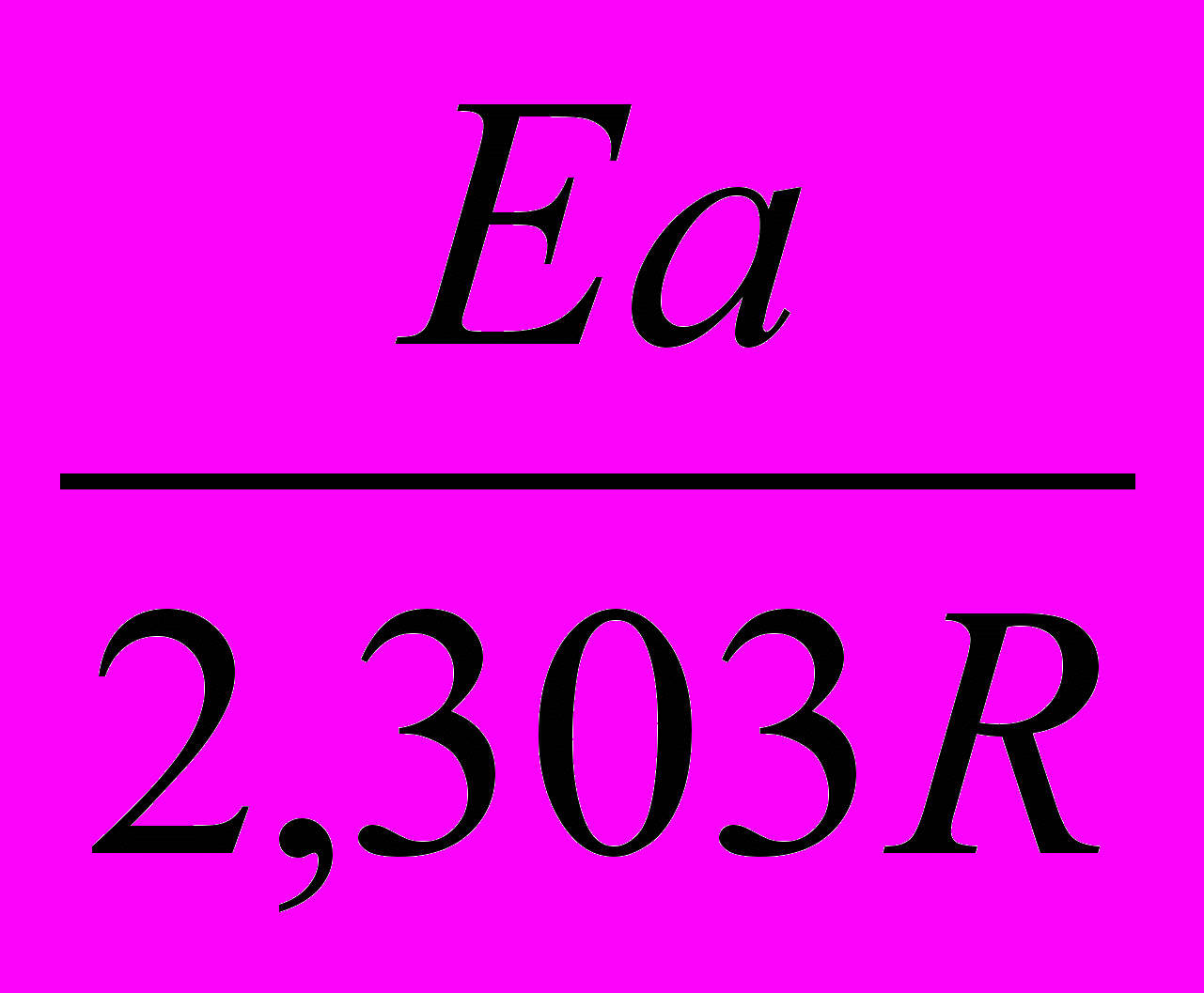
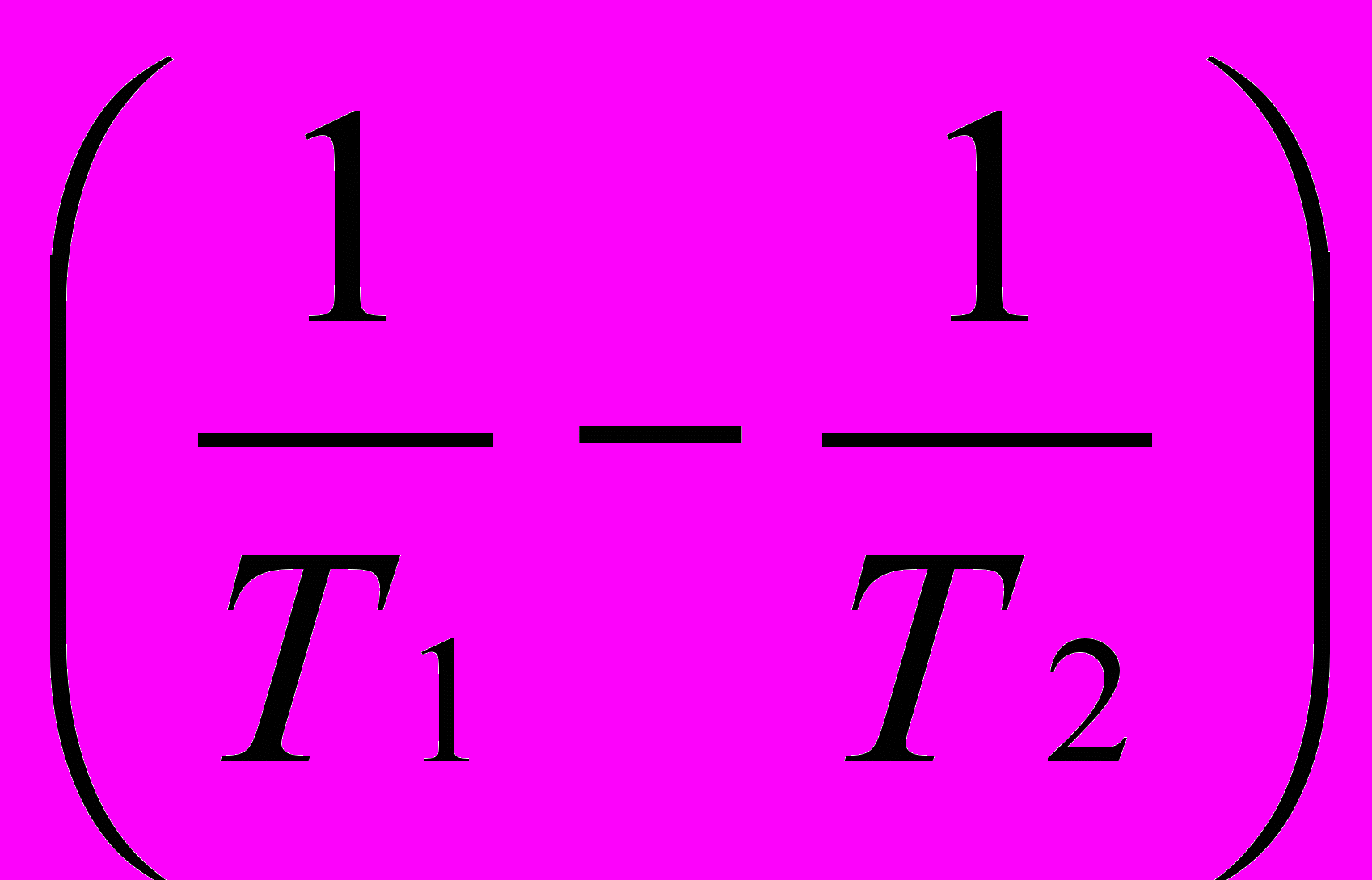
3) Находим логарифм
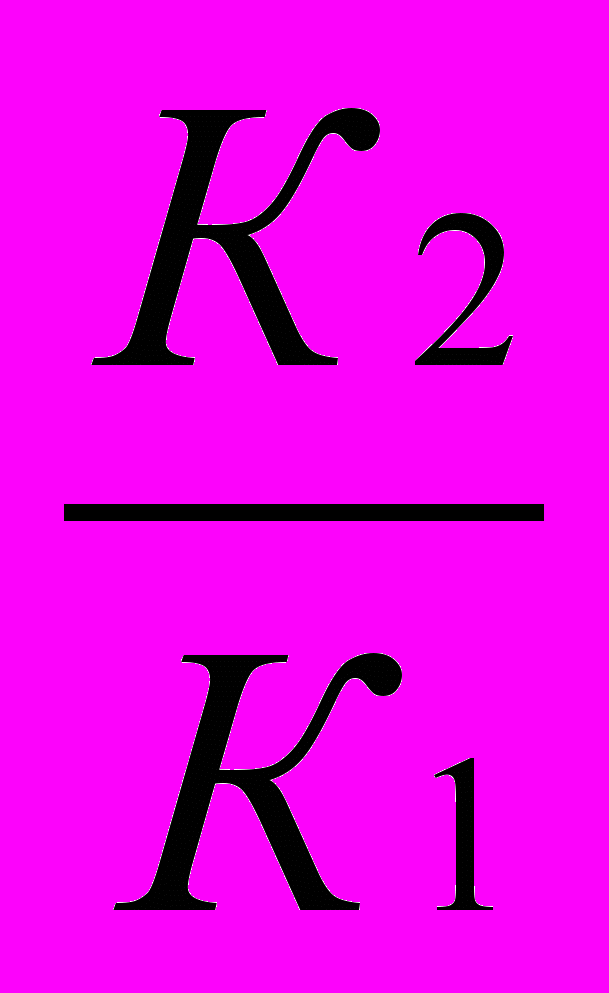
ln
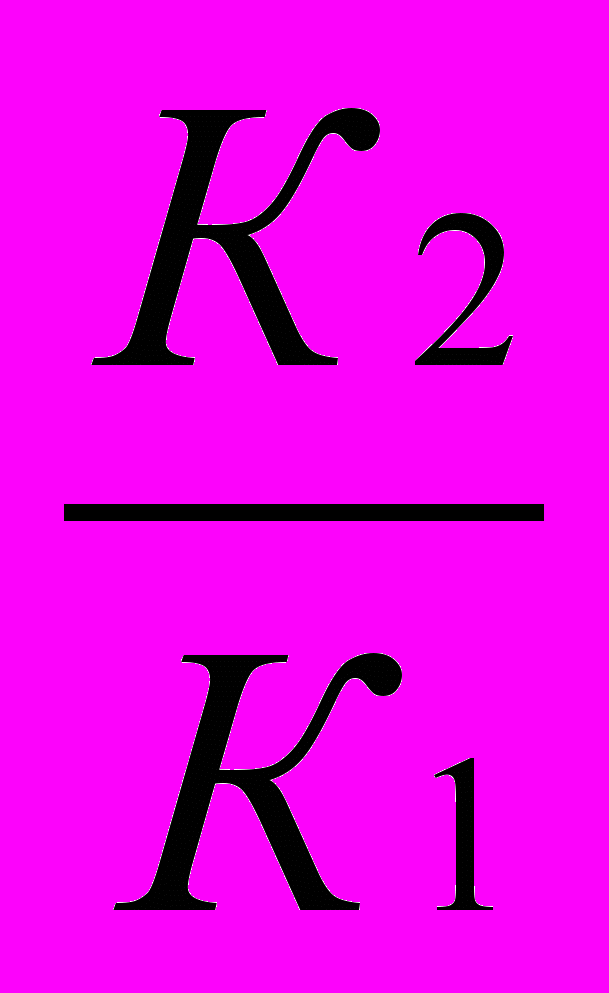 =
= 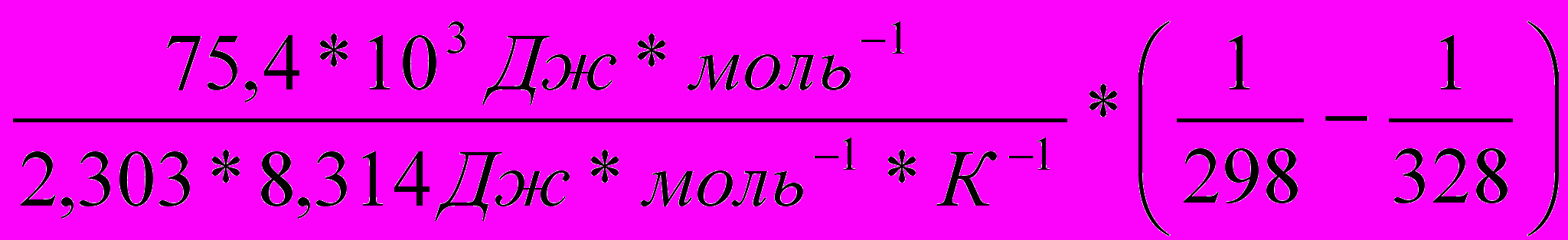 =1,211
=1,2114) Находим отношение
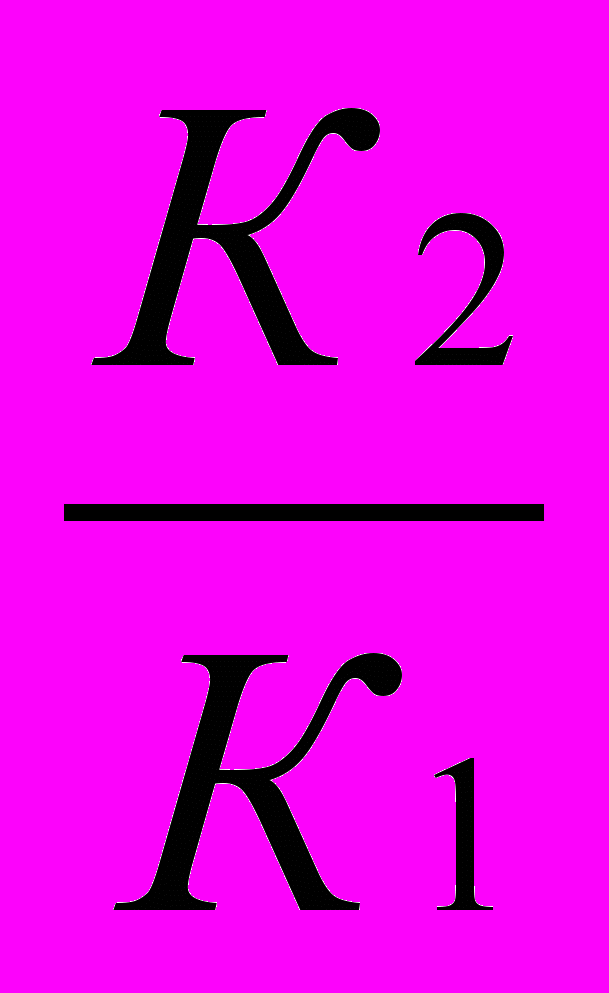 .
.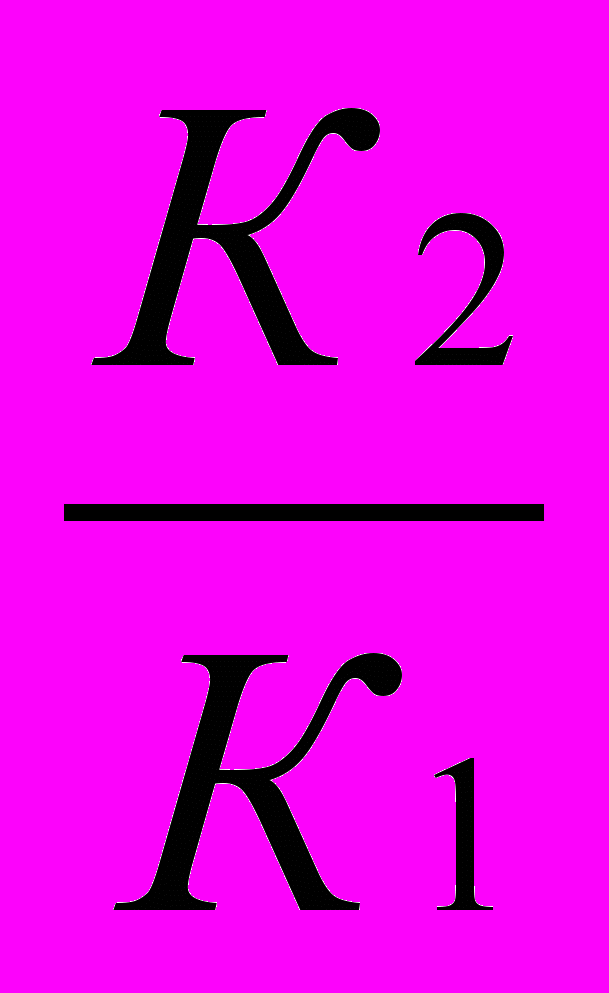 = 101,211=16,2
= 101,211=16,25)Используя закон Вант-Гоффа, находим γ.
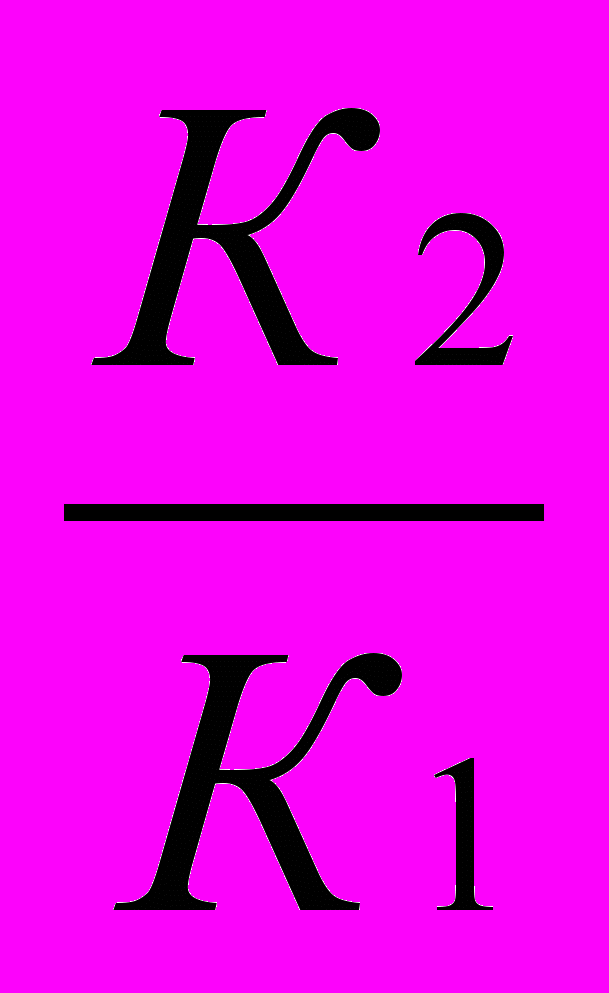 =γ
=γ ; γ3=16,2; γ=
; γ3=16,2; γ= =2,53
=2,53Ответ: γ=2,53
При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий – 192. Рассчитайте, какая часть введённого радионуклида останется в опухоли через 10 суток, если период полупревращения равен 74,08 суток.
Решение:
1) Т.к. реакция 1–го порядка, то период полупревращения рассчитывается по формуле: 0,5=
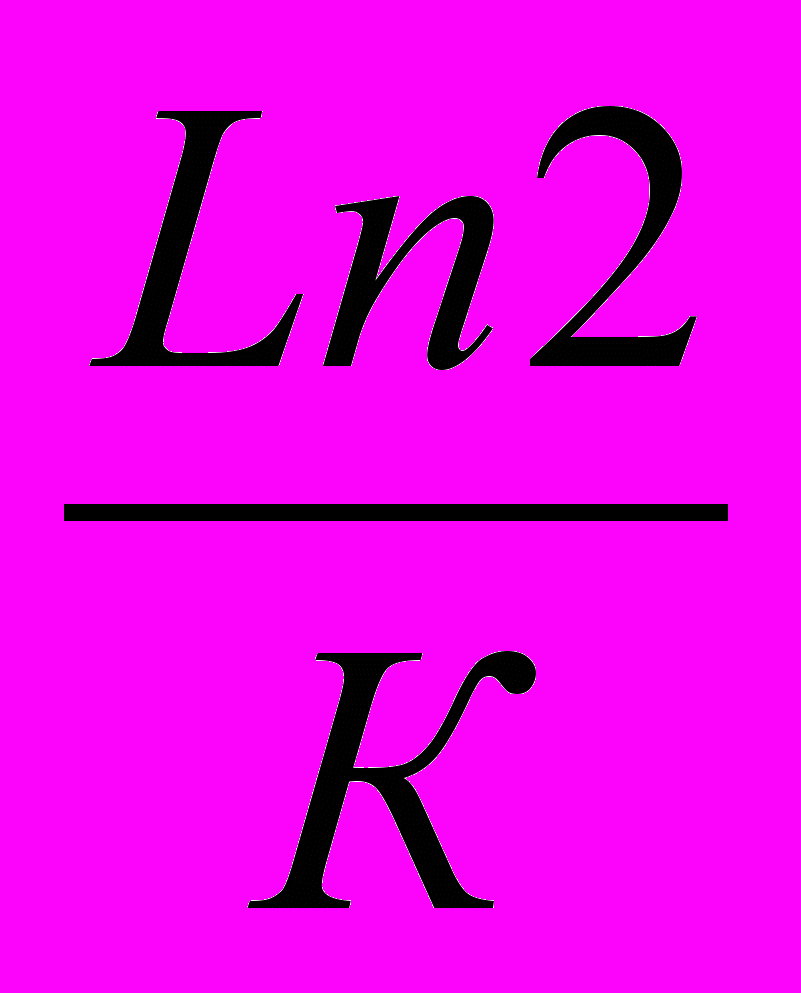
2) Находим константу скорости К=ln2/0.5 =
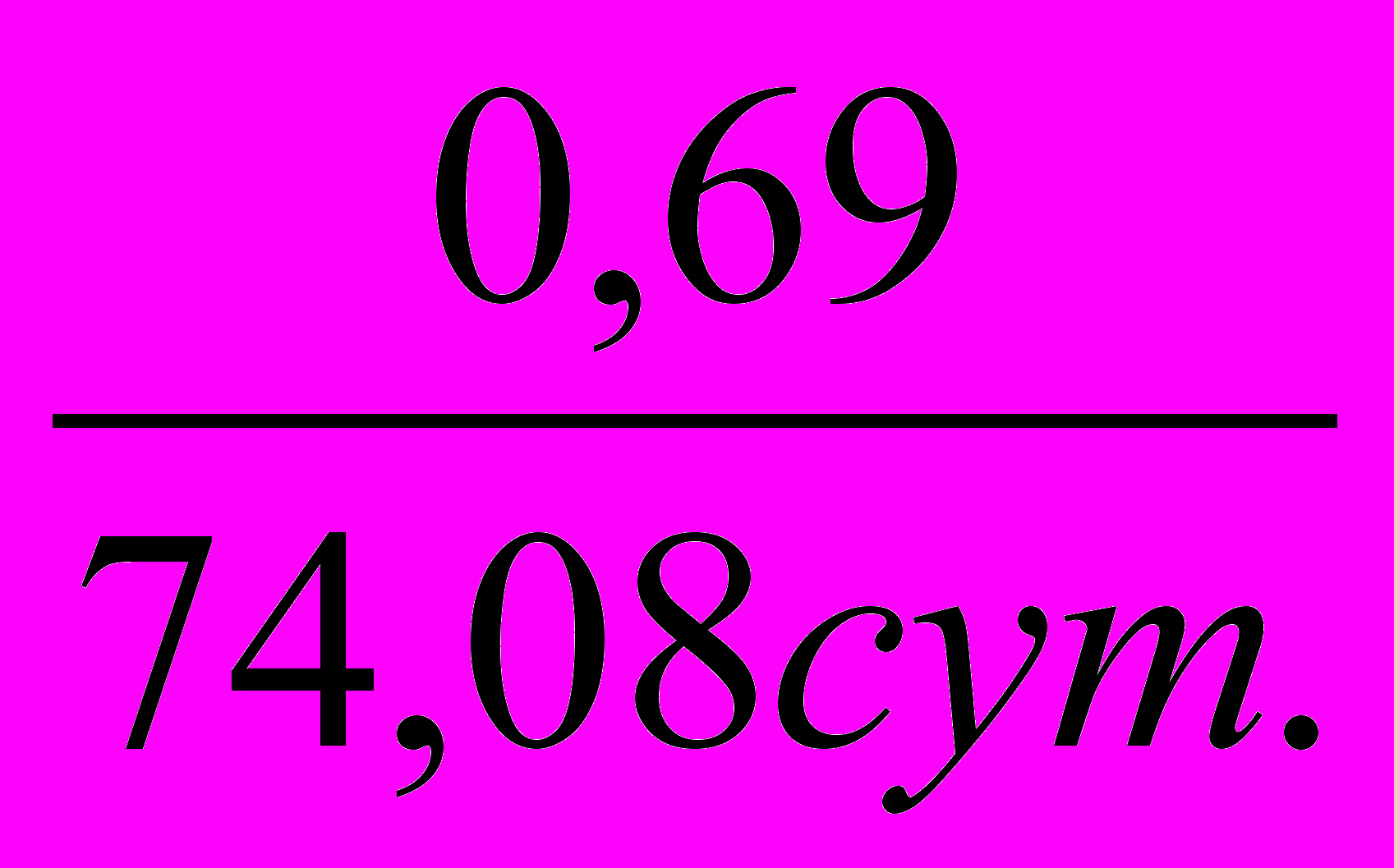 =9,3510-3сут.-1
=9,3510-3сут.-13) По кинетическому уравнению первого порядка (логарифмическая форма) находим ln

lnС=lnC0–Кt lnC–lnC0=-Кt ln
 =-Кt
=-Кt ln
 = - 9,3510-3сут-110суток=-9,3510-2
= - 9,3510-3сут-110суток=-9,3510-24.Находим

 =
= =0,91, т.е. 91%
=0,91, т.е. 91%Ответ: 91% введённого радионуклида останется в опухоли через 10 суток.
Какая доля (%) новокаина разложиться за 10 суток его хранения при 293 К, если константа скорости гидролиза новокаина при 313К равна 1*10-5сут.-1, а энергия активации (Еа) реакции равна 55,2 кДж/моль.
Решение:
1) По уравнению Аррениуса находим отношение
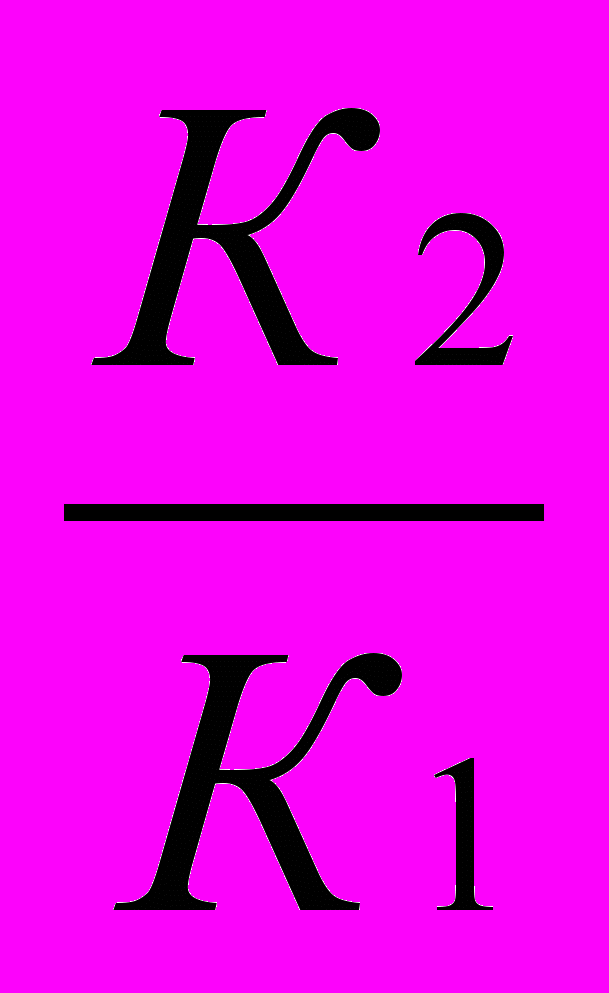
а)
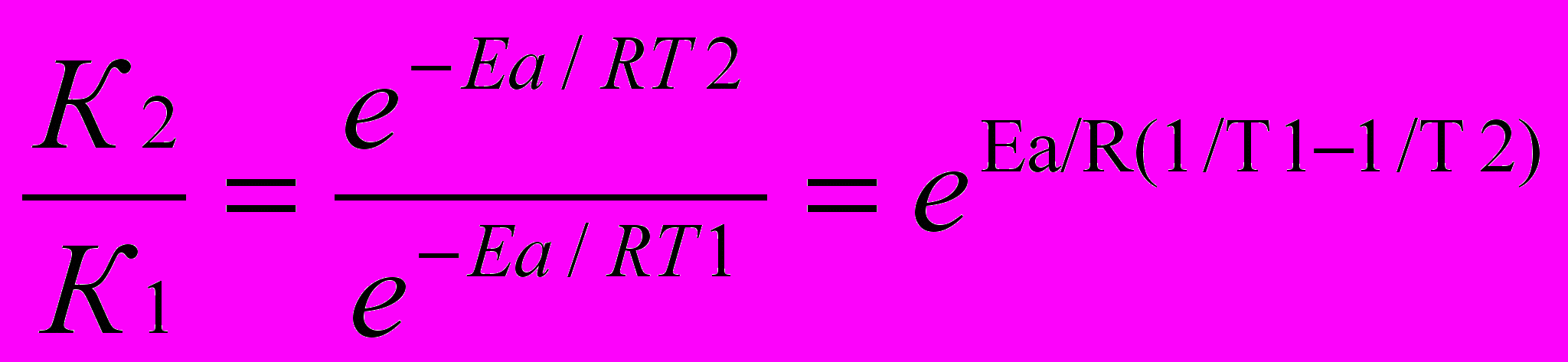
б) Логарифмируем полученное выражение
ln
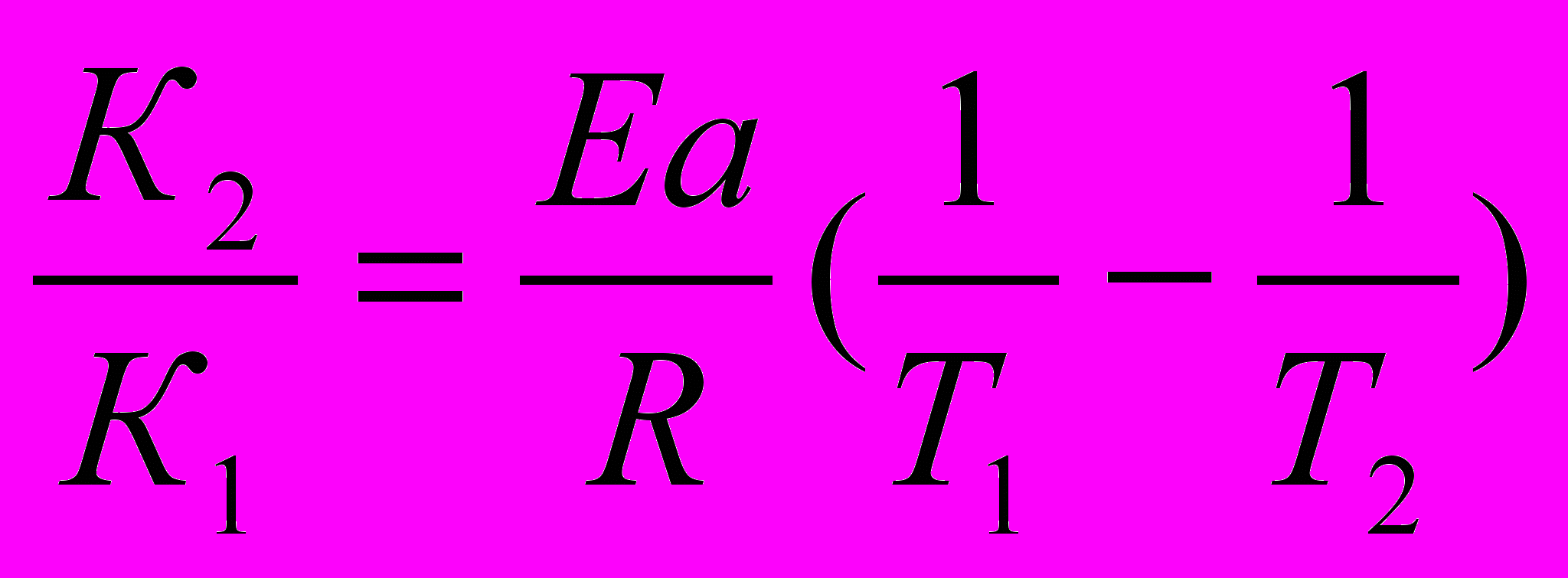
в) Приводим к общему знаменателю для удобства расчётов
ln
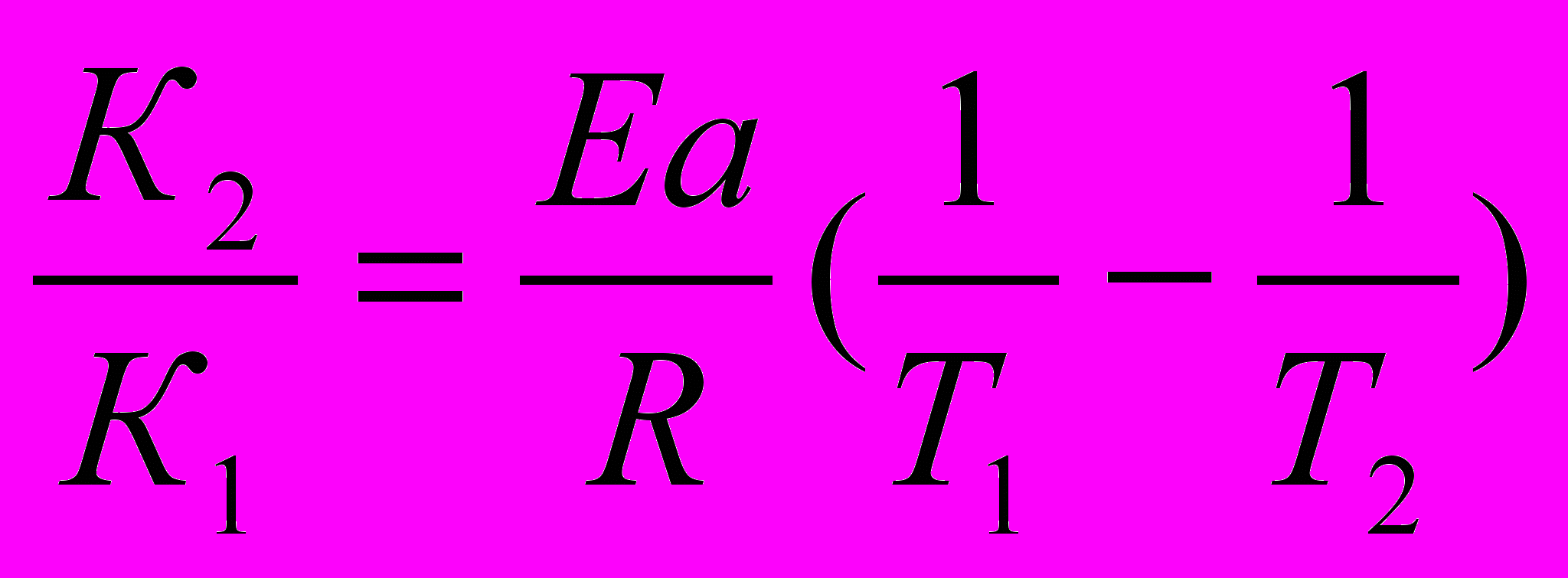 =
=
ln
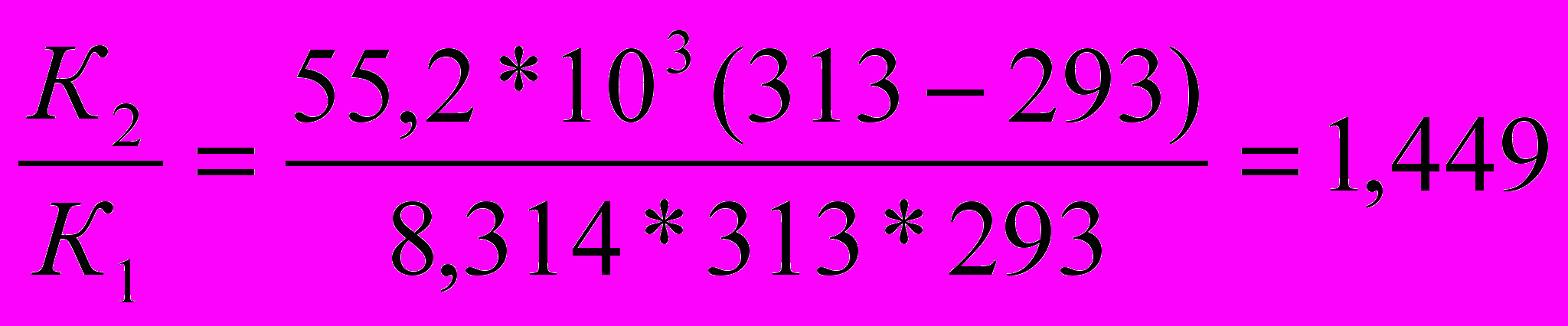
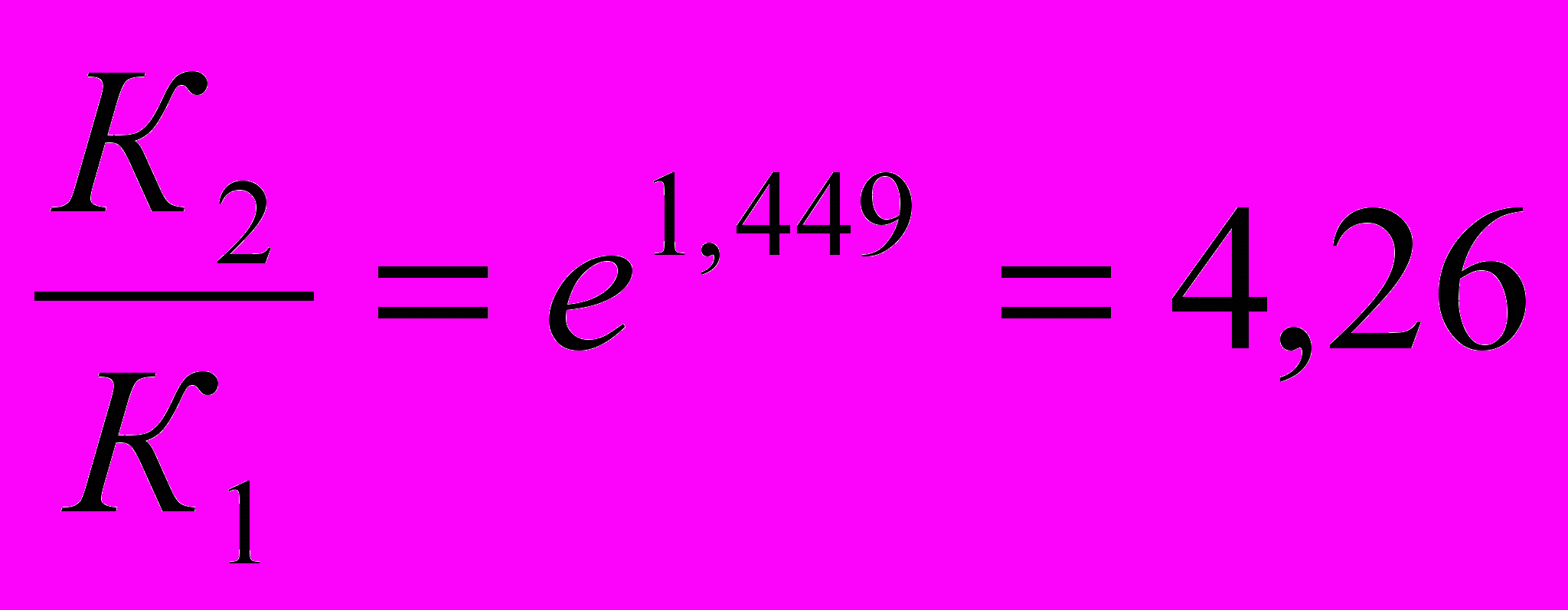
2) Находим константу скорости реакции первого порядка К1

3) По кинетическому уравнению первого порядка находим отношение С/С0
С=С0 е-Kt ;
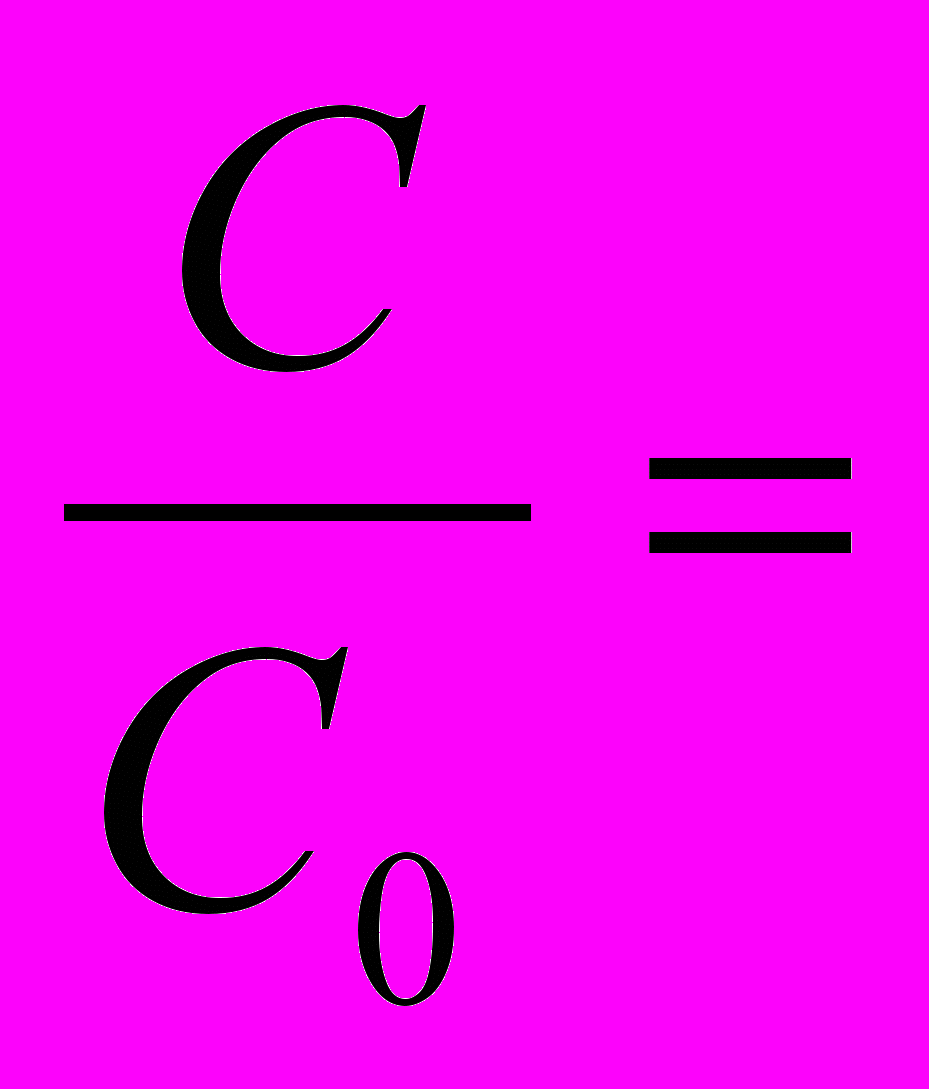 е-Kt = е-2,3510-6сут 10сут =0,99998 – осталось препарата неразложившегося.
е-Kt = е-2,3510-6сут 10сут =0,99998 – осталось препарата неразложившегося.4) Находим долю новокаина, разложившегося за 10 суток
W=
 = 1-
= 1-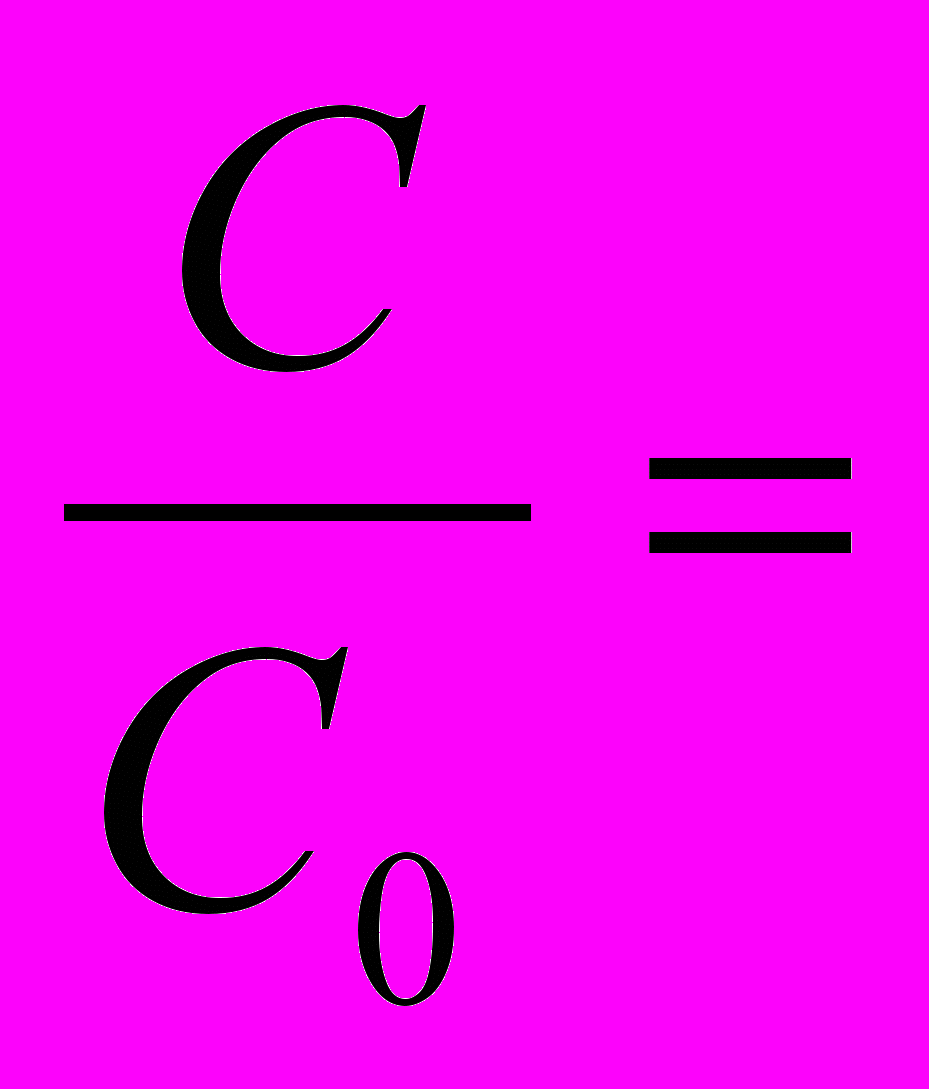 1-0,99998= 2 10-5 или 2*10-3 %
1-0,99998= 2 10-5 или 2*10-3 %Ответ: Новокаин практически не разлагается за 10 суток хранения при 293К.
Периоды полупревращения денатурации некоторого вируса равны: при 300С – 5 часов, а при 370С – 1,76 10-2часов. Денатурация описывается кинетическим уравнением первого порядка. Вычислите энергию активации процесса.
Решение:
1) Известно, что для реакций первого порядка значение константы К обратно пропорционально t0,5 , t0,5=
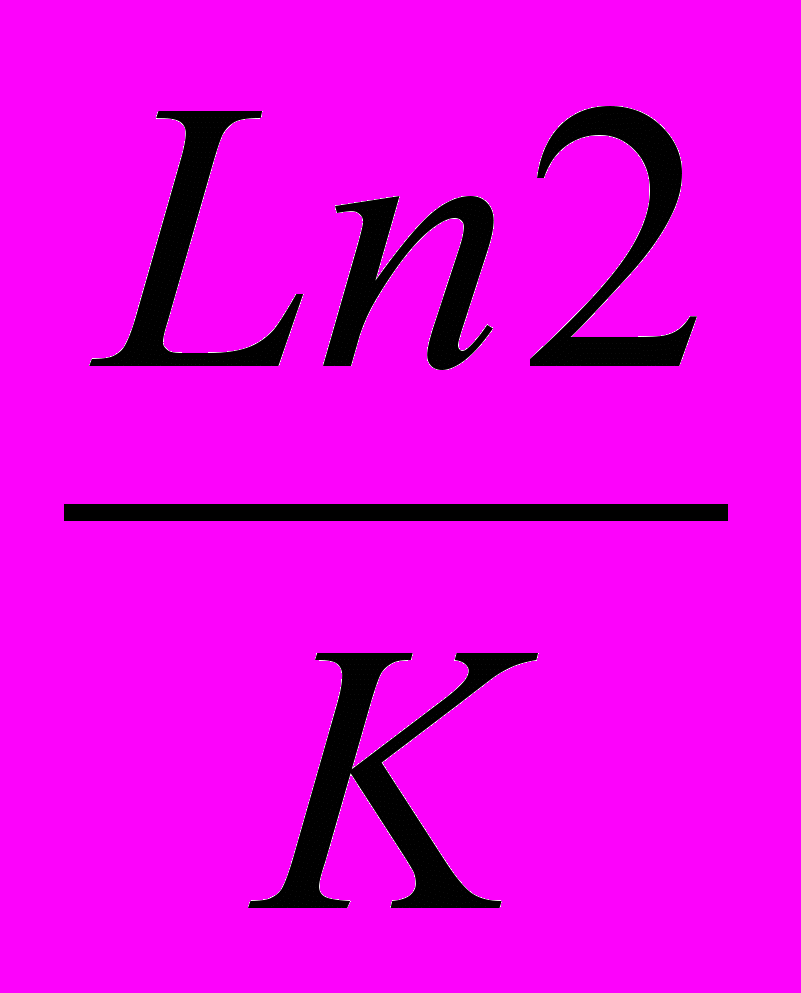 ,поэтому уравнение Аррениуса для двух температур можно представить следующим образом:
,поэтому уравнение Аррениуса для двух температур можно представить следующим образом:ln τ1(0,5)/ τ2 (0,5) =
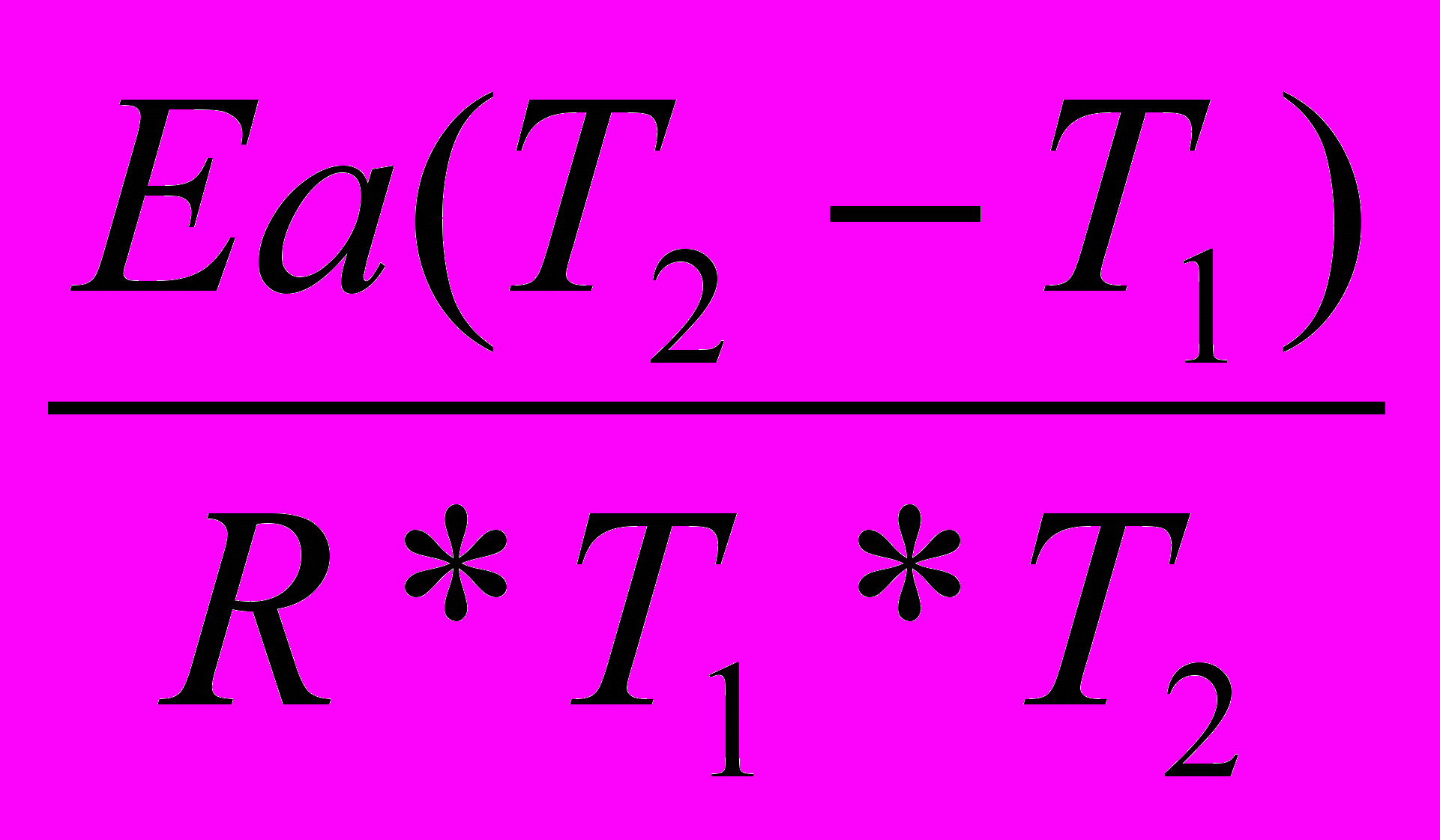 (вывод см. задача №4)
(вывод см. задача №4)2) Преобразуем это выражение относительно Еа.
Еа=
 Ln τ1 (0,5)/τ2 (0,5)
Ln τ1 (0,5)/τ2 (0,5) 3) Подставив в это выражение известные по условию задачи величины, получим
Еа=
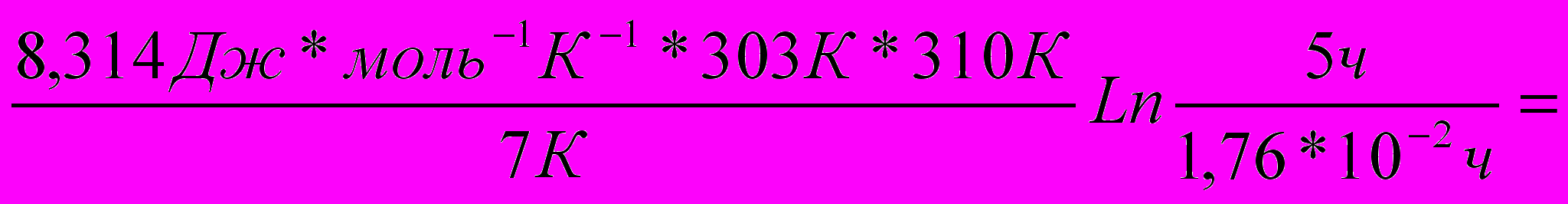 630 213 Дж моль-1 =
630 213 Дж моль-1 = =630,2кДж моль-1
Ответ: Еа= 630,2кДж моль-1
ВАриант I
- Ответить письменно на вопросы:
- Теплоемкость. Уравнение Кирхгофа.
- Химическая кинетика. Основные понятия. Закон действующих масс. Зависимость скорости реакции от температуры (закон Вант-Гоффа).
- Фазовые превращения: испарение, сублимация, плавление. Однокомпонентные системы. Диаграмма состояния воды.
2. Решить задачи:
Задача № 1. Теплота растворения NH4NO3 равна 26,78 кДж/моль. Рассчитать на сколько градусов понизится температура при растворении 20 г NH4NO3 в 180 г воды, если удельная теплоёмкость получившегося раствора равна 3,77 Дж/г ∙ К.
Задача №2. Определить направление протекания реакции: Н2 (г) + I2 (г) 2 НI (г) при 298 К и С(Н2)=С(I2)=0,01 моль/л. Кс=2.
Задача №3. Оцените, во сколько раз возрастёт скорость реакции разложения угольной кислоты при 310 К, если в присутствии катализатора карбогидразы энергия активации равна 49 кДж/моль, а без катализатора энергия активации равна 86 кДж/моль.
Задача №4. Какие из ниже перечисленных факторов приведут к смещению равновесия реакции влево?
2SO2 (г) + O2 (г) = 2SO3 (г), ∆Hр = -196,6 кДж
А)уменьшение реакционного объёма
Б) повышение температуры
В) увеличение реакционного объёма
Г) понижение температуры
Д) увеличение концентрации SO2
Е) увеличение концентрации О2
Вариант II
- Ответить письменно на вопросы:
- Энтальпия. Теплоты нейтрализации, растворения, гидратации.
- Теория активных бинарных столкновений. Понятие энергии активации. Уравнения Аррениуса.
- Фаза. Составляющие вещества. Компоненты. Число компонентов и число
степеней свободы.
- Решить задачи:
Задача № 1. При растворении 1 моль H2SO4 в 800 г воды температура повысилась на 22,4 К. Определить энтальпию растворения H2SO4, принимая удельную теплоемкость раствора равной 3,76 Дж/(г К).
Задача №2. Константа равновесия для реакции Н2 + I2 2НI при температуре 444С равна приблизительно 0,02. Будет ли происходить образование иодоводорода в газовой смеси, состоящей из Н2, I2 и НI, если концентрации этих веществ имеют следующие значения: С (Н2) =2 моль/ л, С(I2 ) =5 моль/л и С(НI) = 10 моль/л.
Задача №3. Константа скорости гидролиза аспирина при 250С составляет: 0,001 ч-1 ( при рН 2,5), и 10 сут-1 (при рН = 11). Рассчитайте период полупревращения реакции гидролиза аспирина при этих рН.
Задача №4. Какие из ниже перечисленных факторов приведут к смещению равновесия реакции вправо?
N2 (г) + O2 (г) 2NO (г), ∆Hр = 180,7 кДж
а) уменьшение концентрации О2 и N2
б) увеличение концентрации N2 и O2
в) уменьшение концентрации NO
г) применение катализатора
д) повышение давления
е) понижение температуры
ж) повышение температуры
Вариант III
- Ответить письменно на вопросы:
- II начало термодинамики, его формулировки. Энтропия и энергия Гиббса как критерии возможности самопроизвольного протекания процессов.
- Уравнение изотермы химической реакции, его анализ.
- Трёхкомпонентные системы. Закон Нернста. Коэффициент распределения.
- Решить задачи:
Задача № 1. Стандартная энтальпия растворения CuSO4 равна –66,5 кДж.моль-1, стандартная энтальпия гидратации до пентагидрата (CuSO4 5H2O) равна – 78,22 кДж моль–1. Вычислить стандартную теплоту растворения пентагидрата.
Задача №2. В системе 2NO(г) + O2 (г) 2 NO2 (г) равновесные концентрации веществ составляют [NO]=0,2 моль/л, [O2]=0,3 моль/л, [NO2]=0,4моль/л. Рассчитать Кс и оценить положение равновесия.
Задача №3. Определить энергию активации реакции Cu + (NH4)2S2O3 → CuSO4 + (NH4)2SO4
если константа скорости реакции при 400 С равна 1,816 10-4 мин-1, а при 600 С равна 3,996 10-4 мин-1.
Задача №4. Укажите все возможные способы повышения выхода иодоводорода по реакции:
Н2 (г) + I2 (г) 2HI (г), ∆Hр = -35,9 кДж
а) уменьшение концентрации I2 и H2
б) увеличение концентрации H2 и I2
в) уменьшение концентрации HI
г) применение катализатора
д) повышение давления
е) понижение температуры
Вариант IV
- Ответить письменно на вопросы:
- Энтропия – функция состояния системы. Изменение энтропии в изолированных системах. Статистический характер второго начала термодинамики. Энтропия и её связь с термодинамической вероятностью состояния системы. Формула Больцмана.
- Дифференциальные и интегральные уравнения необратимых реакций нулевого, первого порядков. Период полупревращения.
- Дробная и непрерывная перегонка. Экстракция.
- Решить задачи:
Задача № 1. При растворении 8 г CuSO4 в 192 г воды температура повысилась на 3,95 градуса. Определить энтальпию образования CuSO4 5H2O из безводной соли и воды, если известно, что энтальпия растворения кристаллогидрата составляет 11,7 кДжмоль-1,а удельная теплоемкость раствора равна 4,18Дж/(г К).
Задача №2. В организме превращение гликогена идёт по реакции:
(гликоген)n + H3PO4 (гликоген)n-1 + глюкозо-1-фосфат
Для реакции ∆о = -0,7 кал/моль, С(H3PO4)=10 ммоль/л,
С(глюкозо-1-фосфат)= 0,03 ммоль/л, C(гликоген)n = C(гликоген)n-1. Установить направление процесса (1 кал = 4,184 Дж).
Задача №3. Константа скорости гидролиза этилового эфира фенилаланина при рН = 7,3 ; t = 25ºС в присутствии ионов меди равна 2,67 10-3 с-1. Начальная концентрация эфира равна 0,2 моль /л. Чему будет равна скорость реакции по истечении двух периодов полупревращения?
Задача №4. Как изменить температуру, давление и концентрацию компонентов, чтобы увеличить концентрацию хлора в реакции:
4НСl + O2 (г) 2 Н2О (г) + 2Cl2 (г), ∆Hр = -114,5 кДж
а) увеличить температуру
б) уменьшить температуру
в) увеличить давление
г) уменьшить давление
д) уменьшить концентрацию НСl и O2
е) увеличить концентрацию Н2О и Cl2
ж) уменьшить концентрацию Н2О и Cl2
з) увеличить концентрацию НСl и O2
Вариант V
- Ответить письменно на вопросы:
- Качественная характеристика направления химических процессов (принцип Ле-Шателье).
- Кинетика сложных реакций. Обратимые, последовательные, параллельные, сопряжённые реакции.
- Взаимосвязь между коллигативными свойствами: относительным понижением давления пара, понижением температуры замерзания растворителя, повышением температуры кипения растворителя и осмотическим давлением разбавленных растворов нелетучих электролитов. Криоскопическая и эбулиоскопическая константы и их связь с температурой кипения и плавления растворителя.
2.Решить задачи:
Задача № 1. Энтальпия растворения в воде Na2SO3 10H2O равна
78,6 кДж/ моль. Рассчитать на сколько градусов понизится температура при растворении 0,5 моль этой соли в 1000 г воды принимая удельную теплоемкость раствора равной 4,18 Дж/ моль К.
Задача №2. Как повлияет изменение давление и температуры на равновесие следующих обратимых реакций:
2СО (г) СО2 (г) + С (к), ∆Н= -172,5 кДж
СО (г) + 2 H2 (г) СН3ОН (г), ∆Н= 193,3 кДж.
Задача №3. Вычислить температурный коэффициент реакции в интервале от 2000С до 3000С, если энергия активации равна 110, 8 кДж/ моль.
Задача №4. Для каких из приведённых реакций изменение давления не оказывает влияния на смещение равновесия:
А) Н2 (г) + S (т) H2S (г), ∆Hр = -20 кДж
Б) 2NO2 (г) N2O4 (г) , ∆Hр = - 57,4 кДж
В) 2 NO (г) +Cl2 (г) 2NOCl (г), ∆Hр = -73,6 кДж
Г) N2 (г) + O2 (г) 2NO (г), ∆Hр = 180,7 кДж
Д) Н2 (г) + I2 (г) 2HI (г), ∆Hр = -35,9 кДж
Е) 2SO2 (г) + O2 (г) 2SO3 (г), ∆Hр = -196,6 кДж
ЛИТЕРАТУРА:
- Ершов Ю.А., Попков В.А., Берлянд А.С. и др.
Общая химия. Биофизическая химия. Химия биогенных элементов. М., Высшая школа,2000 г; стр. 11 – 40, стр. 392 - 421.
- Мушкамбаров Н. Н. Физическая и коллоидная химия: Учеб. для фарм. ин-тов и фак-тов: Курс лекций, М., 2002. стр. 6-60; стр.61 – 114; стр. 175 - 232.
- Пузаков С.А. Сборник задач и упражнений по общей химии: Учеб. пособие /С.А. Пузаков, В.А. Попков и др. – М.: Высш. шк., 2004; стр. 22 – 35; стр. 44-57.
- Ершов Ю.А., Кононов А.М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. М.Высшая школа – 2001 г; стр. 55 – 59; стр. 62 – 64; стр. 68 - 73.
- Литвинова Т.Н. Задачи по общей химии с медико-биологической направленностью. – Ростов н/Д: «Феникс», 2001. – 128 с.
- Ленский А.С. Введение в бионеорганическую и биофизическую химию. М.- 1989 г.
