Развитие метода кинетической радиофлуорометрии для исследований ион-радикалов и их реакций в облученных неполярных растворах 01. 04. 17 химическая физика, в том числе физика горения и взрыва
| Вид материала | Автореферат диссертации |
СодержаниеDPA (DDPA-), молекул CCl4 (DCCl4), экспериментальных констант скорости реакции (k |
- Исследование роли парамагнитных интермедиатов в биологически важных процессах методами, 338.46kb.
- Механизмы образования и взаимодействий углеродных нанокластеров 01. 04. 17 химическая, 933.55kb.
- Программа-минимум кандидатского экзамена по специальности, 79.71kb.
- Календарно-тематическое планирование 10 класс, 727.51kb.
- Программа по физике для 10-11 классов общеобразовательных, 75.87kb.
- Н. Г. Чернышевского кафедра теоретической и математической физики рабочая программа, 152.3kb.
- Атом. Ион. Ионная химическая связь, 174.24kb.
- Горение гранулированной железоалюминиевой термитной смеси при получении железа и его, 356.74kb.
- Учебно-методический комплекс по дисциплине Молекулярная физика для специальности 010701, 480.43kb.
- Физика биологических систем, 39.45kb.
В данной главе рассмотрены результаты исследований ион-радикалов, образующихся при захвате первичных носителей заряда добавленными акцепторами, отличающимися от алканов.
Исследование анион-радикалов. Прежде всего, следует отметить, что наблюдение за кинетикой радиофлуоресценции оказывается весьма удобными для исследований анион-радикалов. Сам по себе захват электрона в алкановом растворе может быть легко определен по резкому замедлению носителя отрицательного заряда с помощью метода ВЭЭ. Это существенно облегчает идентификацию частиц, рекомбинация которых приводит к флуоресценции.
Использование метода ВМЭ. С применением метода ВМЭ были исследованы производные тетрафенилзамещенных циклопентадиена и его кремний- и германий-замещенных аналогов. Ранее было обнаружено, что анион-радикалы многих соединений из этого ряда обладает очень коротким (в масштабе электрохимического эксперимента) временем жизни. На рис. 16 показаны экспериментальные и расчетные кривые ВМЭ для растворов исследованных соединений (перечислены в подписи к рисунку). Согласие эксперимента и расчета позволило утверждать что в диапазоне времен до 50 нс наблюдаются анион-радикалы молекул растворенных соединений. Отметим, что анион-радикалы хлорсодержащих соединений были зарегистрированы в растворе впервые.
В диссертации также приводятся и другие примеры исследований вторичных анион-радикалов.
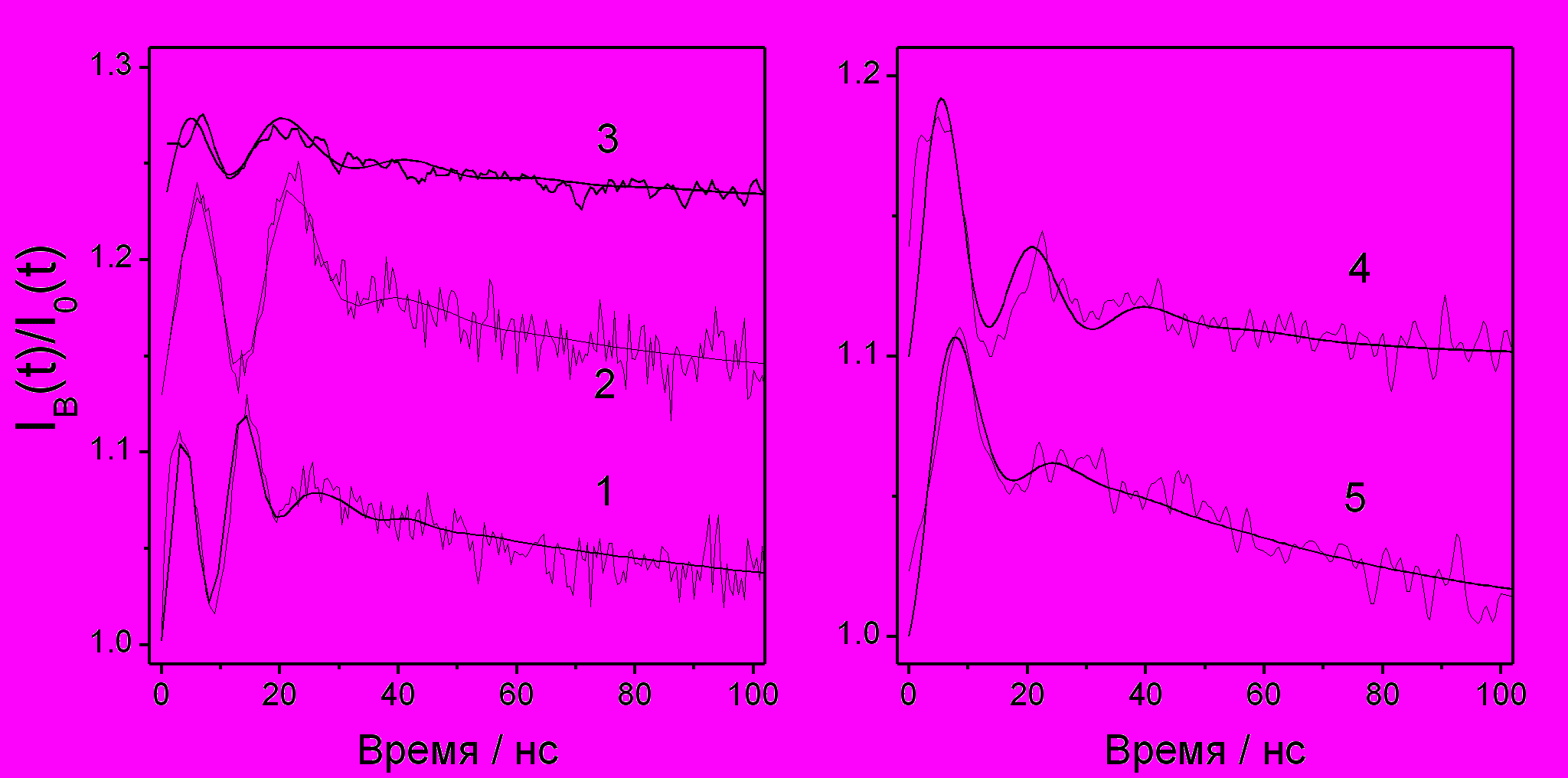
Рис. 16. Экспериментальные и расчетные (гладкие линии) кривые ВМЭ для растворов 0.3 мМ 1,2,3,4-тетрафенилциклопента-1,3-диена (кривая 1), 2,3,4,5-тетрафенил-1-гермациклопента-2,4-диена (2), 2,3,4,5-тетрафенил-1-силациклопента-2,4-диена (3), 2,3,4,5-тетрафенил-1-метилхлоро-гермациклопента-2,4-диена (4), 2,3,4,5-тетрафенил-1-дихлорогермациклопента-2,4-диена (5) в декане в поле 0.3 Т. Формулы для расчетов приведены в [3].
Использование метода «дорекомбинационного» тушения. С применением метода «дорекомбинационного» тушения исследована реакция переноса электрона от анион-радикалов дифенилацетилена (DPA) на молекулы CCl4
DPA-+ CCl4 DPA+ CCl3 + Cl- (15)
в н-гексане, н-додекане и сквалане (2,6,10,15,19,23-гексаметилтетракозан). На рис. 17 в полулогарифмических координатах показаны результаты вычисления отношения IC(t)/I0(t) для различных концентраций CCl4 при 293 К. Здесь же приведены результаты аппроксимации экспериментальных кривых зависимостью (3). При аппроксимации варьировалось только значение радиуса реакции. Коэффициенты диффузии D ион-радикалов DPA вычислялись по подвижности, измеренной с помощью метода ВЭЭ. Значения D для молекул CCl4 были рассчитаны с использованием литературных данных. Аналогичным образом проводились эксперимент и его обработка в гексане и сквалане. Результаты измерений и расчетов приведены в табл. 6.
Для примера стационарные значения скорости реакции (15) при различных концентрациях тушителя и температурах раствора вместе с линейной аппроксимацией экспериментальных точек приведены на рис. 18. Если из наклона аппроксимирующих прямых определить стационарные значения константы скорости этой реакции (ks), то соответствующие эффективные реакционные радиусы Re=ks/4D будут примерно на 0.1 нм больше, чем в табл. 6. Это подчеркивает важность учета нестационарных эффектов в кинетике диффузионно-контролируемых реакций в тех случаях, когда важно иметь более точное значение реакционного радиуса.
Таблица 6. Значения вязкостей растворителей, коэффициентов диффузии анион-радикалов DPA (DDPA-), молекул CCl4 (DCCl4), экспериментальных констант скорости реакции (k5=4ReDs) и эффективных радиусов (Re) реакции (15).
| Температура, К | н-Гексан | н-Додекан | Сквалан | ||||||
| 273 | 293 | 313 | 273 | 293 | 313 | 273 | 293 | 313 | |
| Вязкость, сПз | 0.38 | 0.31 | 0.26 | 2.27 | 1.49 | 1.07 | 114 | 36.1 | 14.6 |
| DCCl4, 10-10 м2/с | 29.0 | 36.5 | 45.1 | 7.6 | 11.2 | 15.4 | 0.46 | 1.2 | 2.5 |
| DDPA-, 10-10 м2/с, 10% | 9.8 | 13.5 | 17.6 | 2.4 | 4.0 | 6.0 | 0.12 | 0.48 | 1.6 |
| ks , 109 M-1с-1 10% a | 22 | 27 | 37 | 6.3 | 9.3 | 12.6 | 0.46 | 1.3 | 2.7 |
| Re, нм, 15% b | 0.76 | 0.71 | 0.79 | 0.83 | 0.80 | 0.74 | 1.1 | 1.0 | 0.9 |
а стационарные значения

Рис. 17. Экспериментальные () и расчетные кривые отношения IC(t)/I0(t) при концентрации CCl4 С=0.3 мМ(1), С=0.6 мМ (2), С=1.2 мМ (3). Линии – аппроксимация экспериментальных кривых с помощью выражения (5).
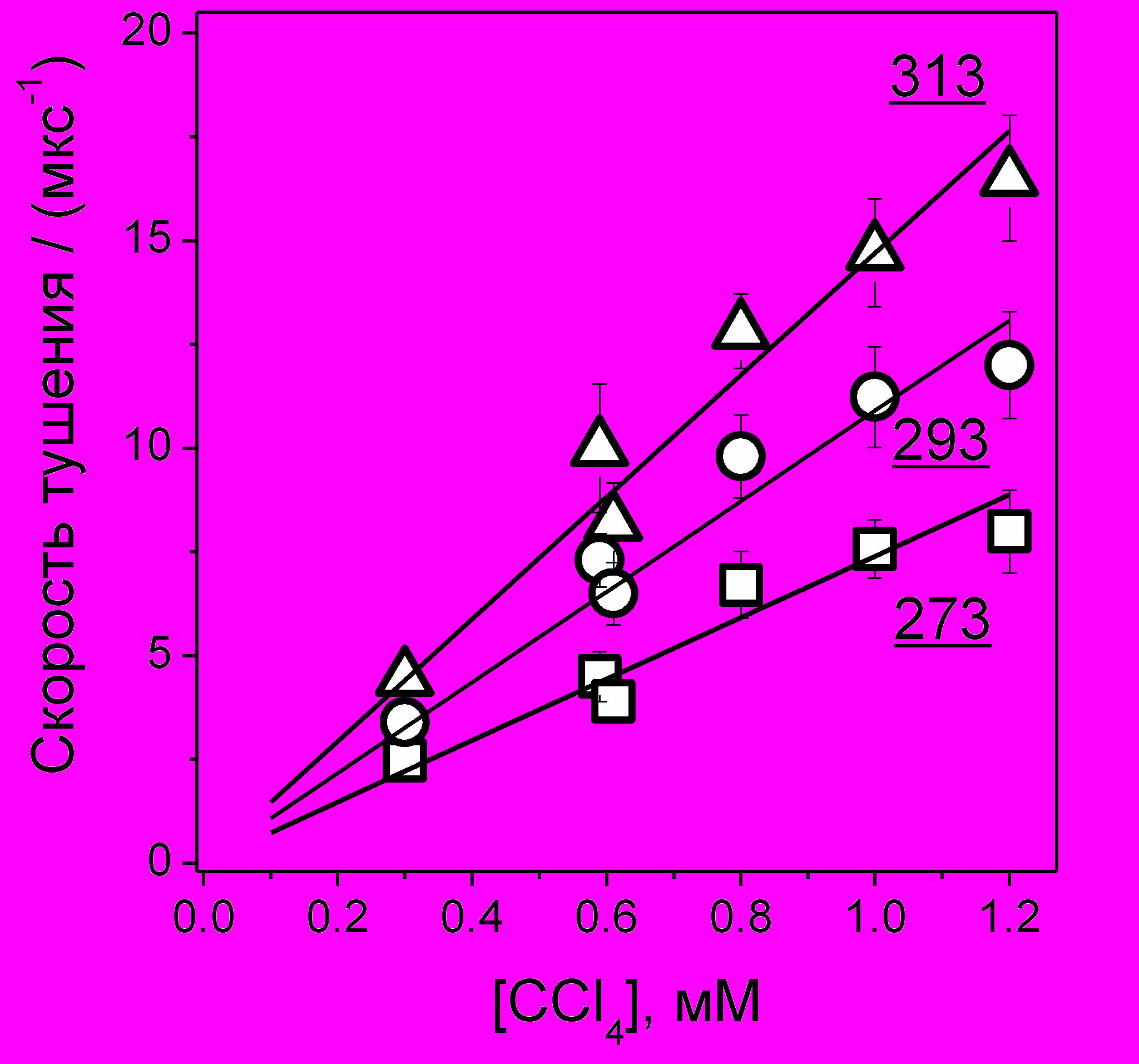 Рис. 18. Cкорость реакции (3) на стационарном участке при различных концентрациях CCl4 и температуре (указана на рисунке) растворов 0.03 М DPA в додекане. Константы скорости - в табл. 6.
Рис. 18. Cкорость реакции (3) на стационарном участке при различных концентрациях CCl4 и температуре (указана на рисунке) растворов 0.03 М DPA в додекане. Константы скорости - в табл. 6.Как следует из полученных данных, реакция (15) в маловязких алканах является диффузионно-контролируемой. При переходе к более вязкому сквалану эффективный радиус превышает геометрические размеры реагентов, т.е. становится существенным дистанционный перенос электрона. Наблюдаемые в сквалане значения Re могут быть получены с помощью соотношения (7) при значениях L=0.1-0.2, w0~1012-1013 c-1, т.е. значениях, типичных для реакций переноса электрона.
Вторичные катион-радикалы. В данном разделе рассмотрены результаты, полученные при исследовании неалкановых КР методами, перечисленными в гл. 2.
Катион-радикалы элементоорганических алифатических соединений. Тетраметилсилан (Me4Si), -герман (Me4Ge), -станнан (Me4Sn), гексаметилдигерман (Me6Ge2) и -дистаннан (Me6Sn2), полученные в ИОХ РАН им. Зелинского, были исследованы с помощью метода ВМЭ в алкановых растворах с добавлением 30 мкМ pTP. Кинетики спада интенсивности задержанной люминесценции растворов 0.1М Me4Si, Me4Ge и Me4Sn в н-гексане, нормированные на максимум интенсивности приведены на рис. 19. Для сравнения там же приведена кинетика, полученная для раствора 0.1 М гексаметилэтана (Me6C2). Поскольку время флуоресценции pTP* составляет около 1 нс, момент высвечивания кванта флюоресценции практически совпадает с моментом рекомбинации ион-радикальной пары. Кривая 1 спадает сравнительно медленно и имеет вид, характерный для случаев, когда флуоресценция обусловлена геминальной рекомбинацией стабильных ион-радикалов.
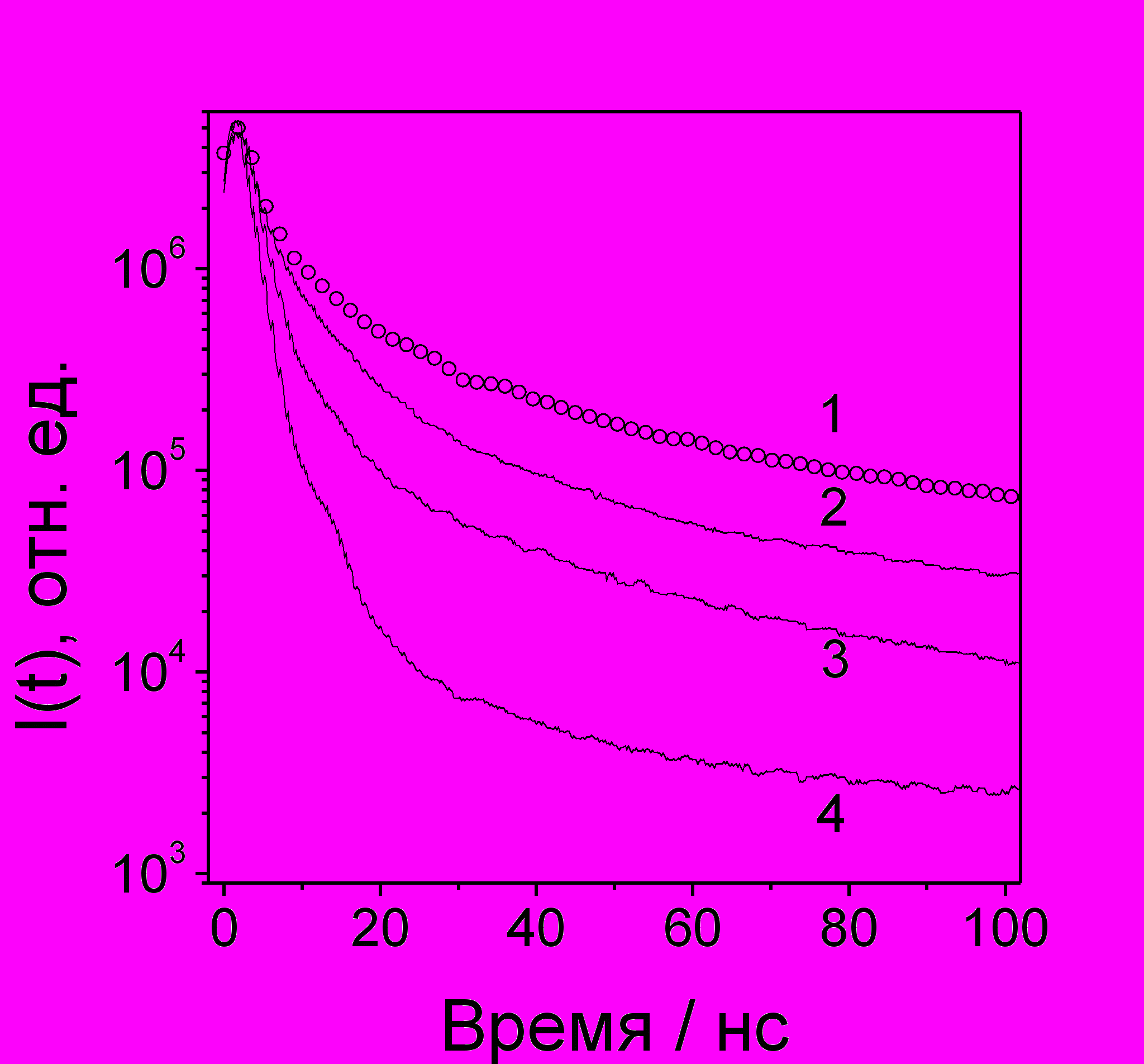
Рис. 19. Спад кинетики радиофлуоресценции растворов 0.1 М Me6C2 (кривая 1), Me4Si (2), Me4Ge (3), Me4Sn (4) + 310-5 М pTP в н-гексане при B=0, Т=293 К.
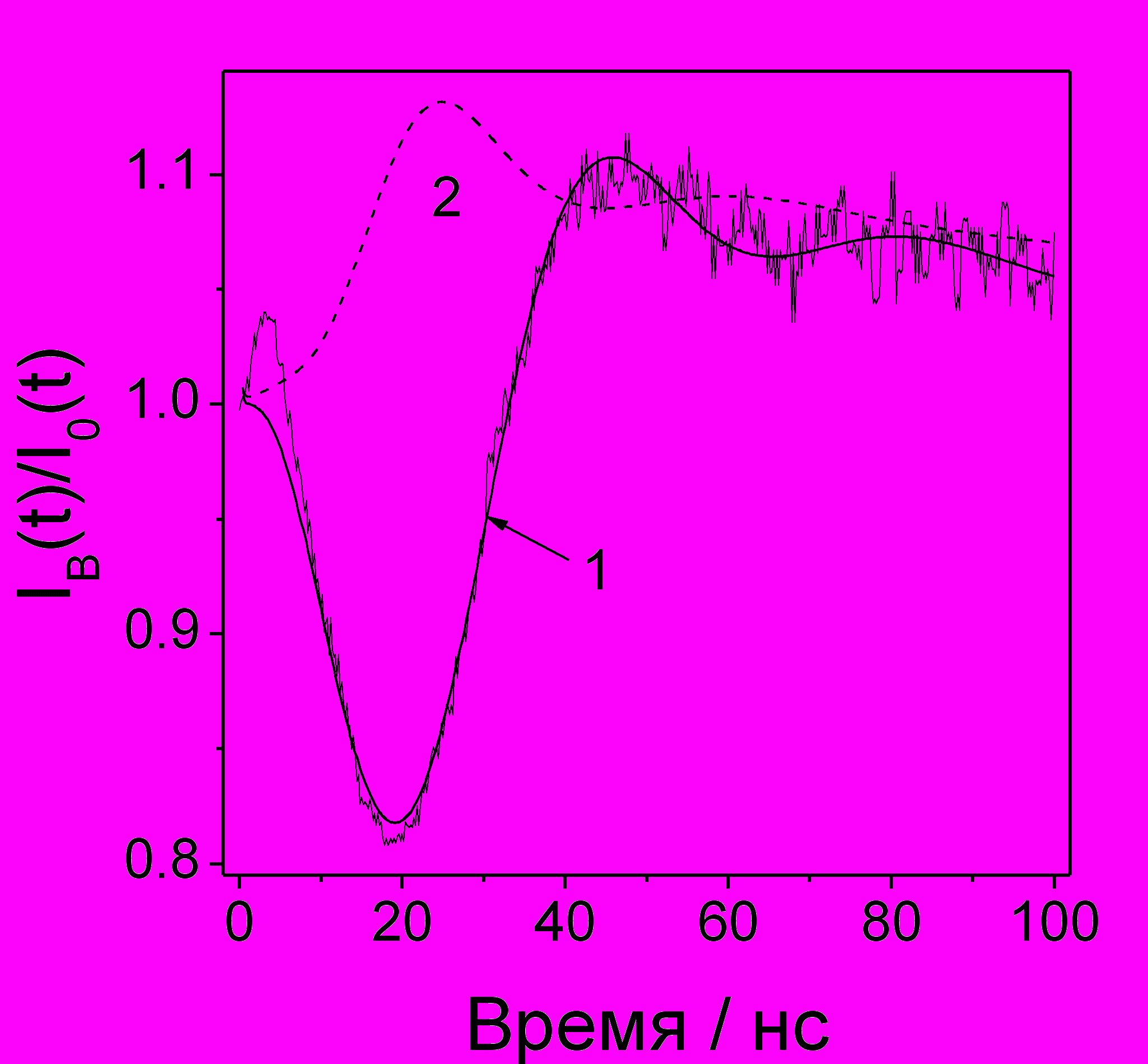
Рис. 20. Кривые ВМЭ для раствора 0.1 М Me4Si +30 мкМ рTP в н-гексане при B=0.7 Тл, 293 К. Зашумленная кривая - эксперимент, линии -расчет при g = 0.0023, T2=T0=23 нс. Кривая (1) получена при a(12H)=0, кривая (1) - a(12H)=0.245 мТ.
Причиной быстрого спада кривых флуоресценции в случае элементооргани-ческих соединений, скорее всего, является распад катион-радикалов соединений с образованием продуктов, ни один из которых не является ион-радикалом
Me4E+ Me3E+ + Me (16)
Отметим, что распад изучаемого КР происходит с подавлением образования возбужденных состояний люминофора и мало сказывается на виде кривых ВМЭ.
На рис. 20 приведены экспериментальная и расчетные кривые ВМЭ в растворе 0.1М Me4Si в магнитном поле 0.7 Т. Согласие между расчетом и экспериментом достигается в предположении, что Me4Si+ участвует в ВЭО, скорость которого контролируется диффузией. Me4Si+ в данном случае был идентифицирован по величине g-фактора, который совпадает со значением, измеренным в низкотемпературных матрицах. Высокая скорость обмена приводит к полному усреднению СТВ с протонами метильных групп. Отметим, что ВЭО также приводит к сравнительно короткой фазовой релаксации, поскольку примерно каждая двадцатая молекула содержит магнитный изотоп кремния. В КР Me429Si+ константа СТВ с 29Si составляет около 7 мТ и взаимодействие с таким ядром вызывает быстрое синглет-триплетное смешивание в ИРП.
Аналогичным образом были исследованы КР и других элементоорганических соединений. Показано, что в алкановых растворах g-факторы этих КР близки к таковым в низкотемпературных матрицах. Обнаружено, что между КР тетраметилзамещенных соединений и соответствующими молекулами происходит ВЭО со скоростью контролируемой диффузией или немного меньшей. В случае гексаметилзамещенных соединений электронного обмена обнаружено не было.
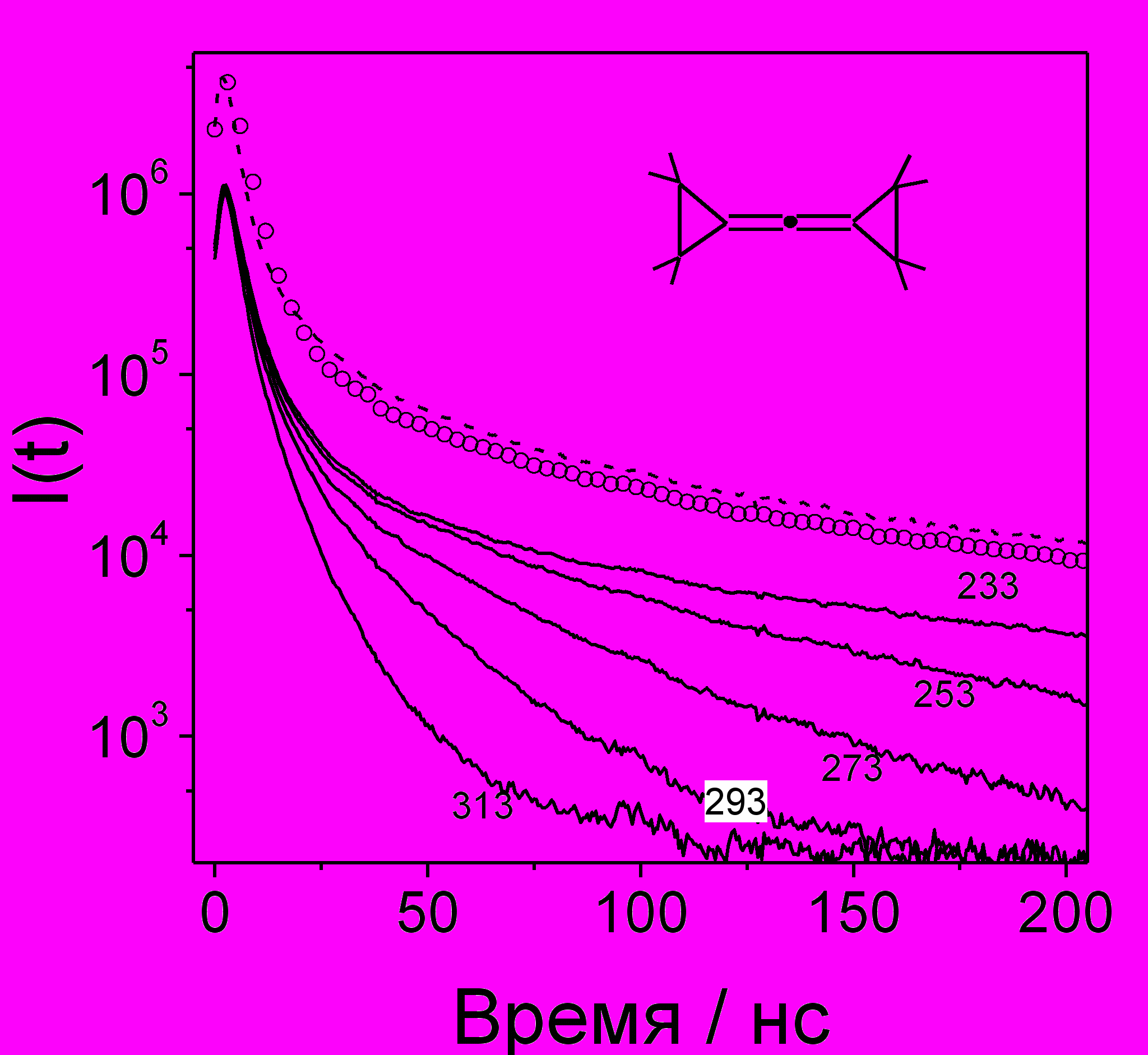
Рис. 21. Кинетика радиофлуоресценции растворов 30 мкМ pTP в н-октане при 233 К (пунктир) и 313 К (), этого же раствора с добавлением 0.01 М Me8-DCPM (температура - на рисунке). Кривые для растворов без Me8-DCPM сдвинуты вверх.

Рис. 22 Экспериментальная () и расчетная кривые ВМЭ для раствора 0.01 М Me8-DCPM в н-октане (+ 30 мкМ pTP) при 293 К. Расчет: квазиклассическое приближение при c=0.31мТ. B=0.1 Т, T=293 К.
Наблюдение мономолекулярного распада катион-радикалов. В диссертации также описан пример исследования термоактивированного мономолекулярного распада КР октаметил-бициклопропилиденметана (Me8-DCPM). Это соединение было получено от проф. Т. Балли (T. Bally, University of Fribourg, Switzerland). Схематическое изображение структуры этого соединения показано на рис. 21.
На этом рисунке приведены кинетики радиофлуоресценции растворов 0.01 М Me8-DCPM в н-октане при различных температурах. После добавления в раствор Me8-DCPM наблюдается резкая зависимость формы кинетик от температуры (см. рис. 21). Экспериментальная кривая ВМЭ в этом растворе (рис. 22) хорошо описывается в модели с a(24H)=0.14 мТ, что согласуется с квантовохимическими расчетами констант СТВ в Me8-DCPM+, выполненными Т. Балли. Были получены оценки энергии активации распада КР Me8-DCPM (Еа=7.8(1.5) ккал/моль), который, согласно квантовохимическим расчетам, происходит с раскрытием одного из трехчленных циклов и образованием дистонического катион-радикала (расчетное значение Еа=8-9 ккал/моль).
Транспорт органических ион-радикалов в алкановых растворах. Ион-радикалы, возникающие на ранних стадиях радиолиза являются реакционно-способными частицами и скорость их реакций часто контролируется диффузией. По этой причине данные о диффузионной подвижности ион-радикалов представляют несомненный интерес как сами по себе, так и для идентификации носителей заряда. В диссертации описываются основные результаты исследования транспортных свойств органических ион-радикалов в алканах с применением метода времяразрешенного электрического эффекта (ВЭЭ) [9,19,20].
На рис. 23 приведены экспериментальные кривые ВЭЭ, полученные для растворов дифенилацетилена (DPA) в различных алканах при 293 К. Корреляция между скоростью тушения кинетики электрическим полем и вязкостью растворителя качественно согласуется с часто используемой зависимостью подвижности ионов от вязкости const (правило Вальдена-Писаржевского). Практически полное совпадение кривых ВЭЭ в метилциклопентане, изо- и н-октанах - следствие слабого влияния функции распределения на ход кривых ВЭЭ, которое подтверждается и компьютерным моделированием.
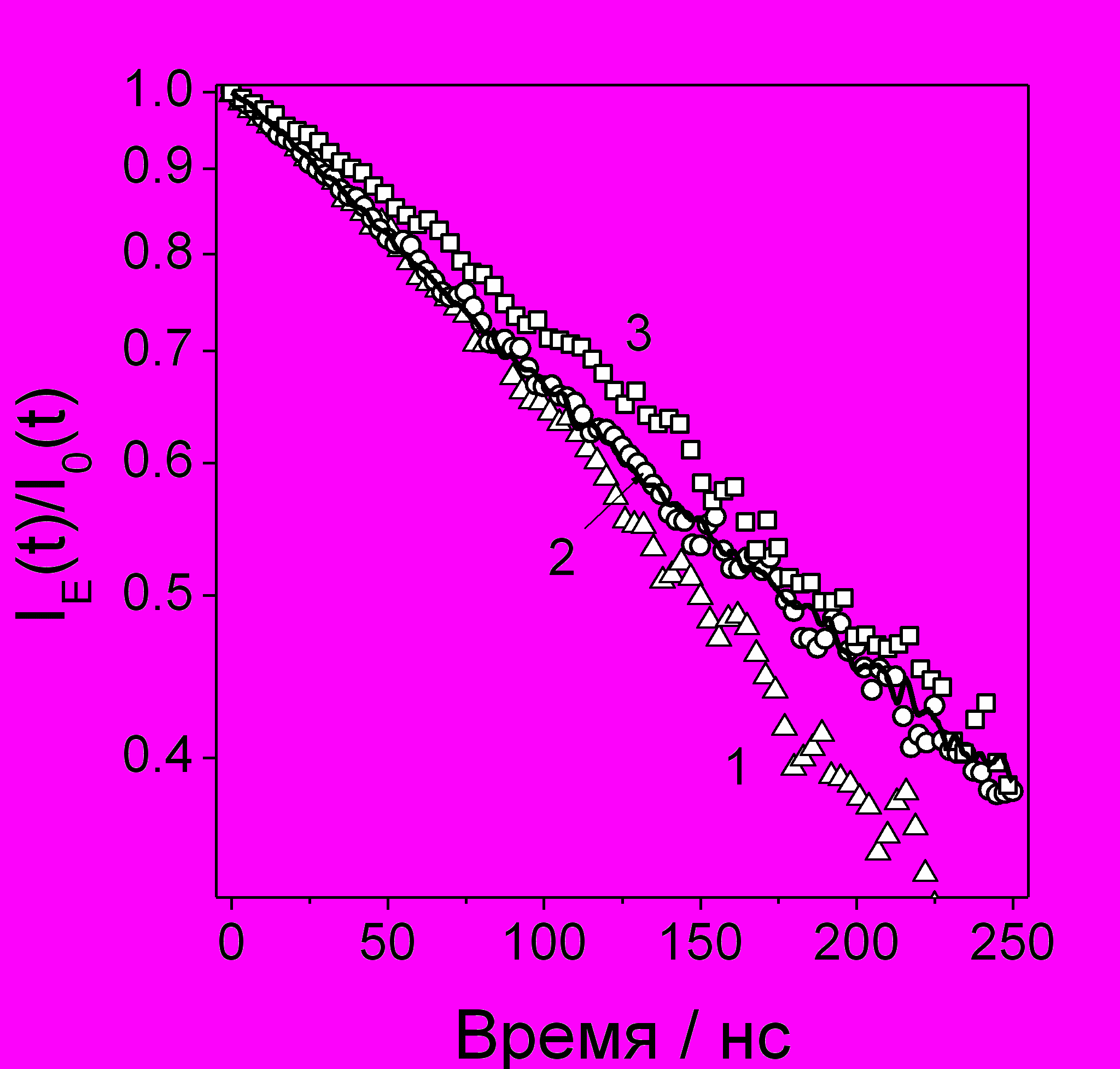
Рис. 24 Экспериментальное (линия) и расчетные отношения IE(t)/I0(t) для растворов 10 мМ DPA в н-декане при E=36 кВ/см. Подвижности мономерных (1) и димерных (2) ион-радикалов: (1, )- 1=2.310-4 см2/Вс, димеризации нет; (2, □) - 1=2.010-4 см2/Вс, димеризации нет; (3, ) - 1=2.310-4 см2/Вс, 2=1.610-4 см2/Вс, Константа скорости димеризации 6108 М-1с-1.
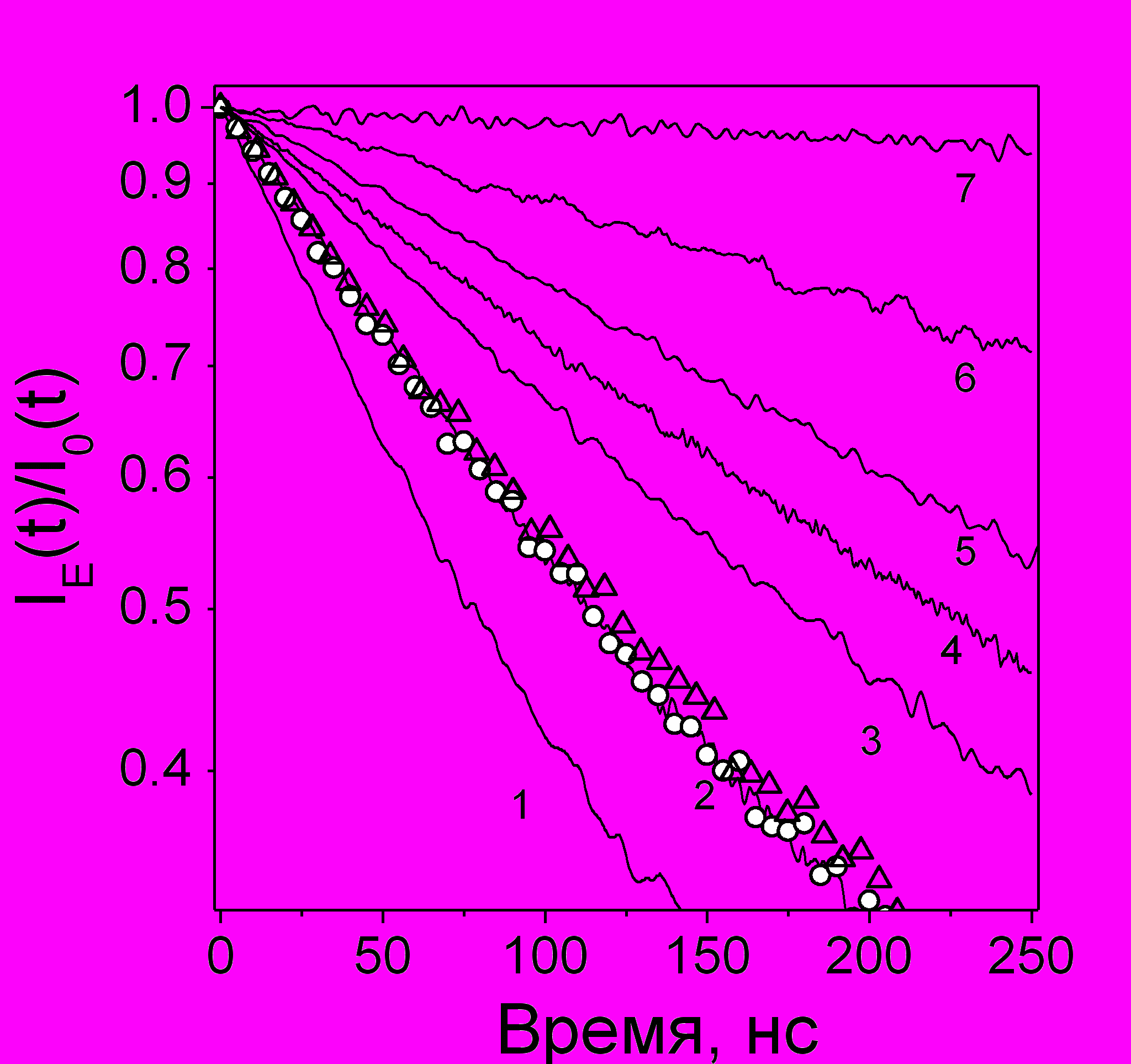
Рис. 23. Отношения IE(t)/I0(t) для растворов 10 мМ DPA в н-гексане (1), н-октане (2, линия), метил-циклопентане (2, ), изооктане (2, ), н -декане (3), циклогексане (4), циклогептане (5), н -гексадекане (6) и сквалане (7) при Е=36 кВ/см, T=293 К.
Для определения подвижности ион-радикалов DPA было проведено компьютерное моделирование эффектов ВЭЭ с учетом образования димерных ион-радикалов (рис. 24). Свидетельства в пользу их образования были получены измерениями ВЭЭ и ВМЭ при различных концентрациях DPA. Димеризация проявлялась как уменьшение подвижности носителя заряда на 30-50%. Также было проведено специальное исследование с целью выявить различие между подвижностями ион-радикалов ароматических соединений разного знака. С точностью эксперимента (10 %) такого различия обнаружено не было.
С помощью моделирования были определены подвижности ион-радикалов в различных слабополярных жидкостях, преимущественно алканов, при различных температура. В табл. 7 приведены экспериментальные данные с указанием энергии активации подвижности ион-радикалов DPA вблизи комнатной температуры.
Полуэмпирическая формула для оценки подвижности ион-радикалов в н-алкана
В ряде случаев желательно иметь способ оценить подвижность ион-радикала по легко определяемым характеристикам акцептора и растворителя. Для такой оценки в диссертации была предложена полуэмпирическая формула, которая имеет вид модифицированного соотношения Стокса-Эйнштейна:
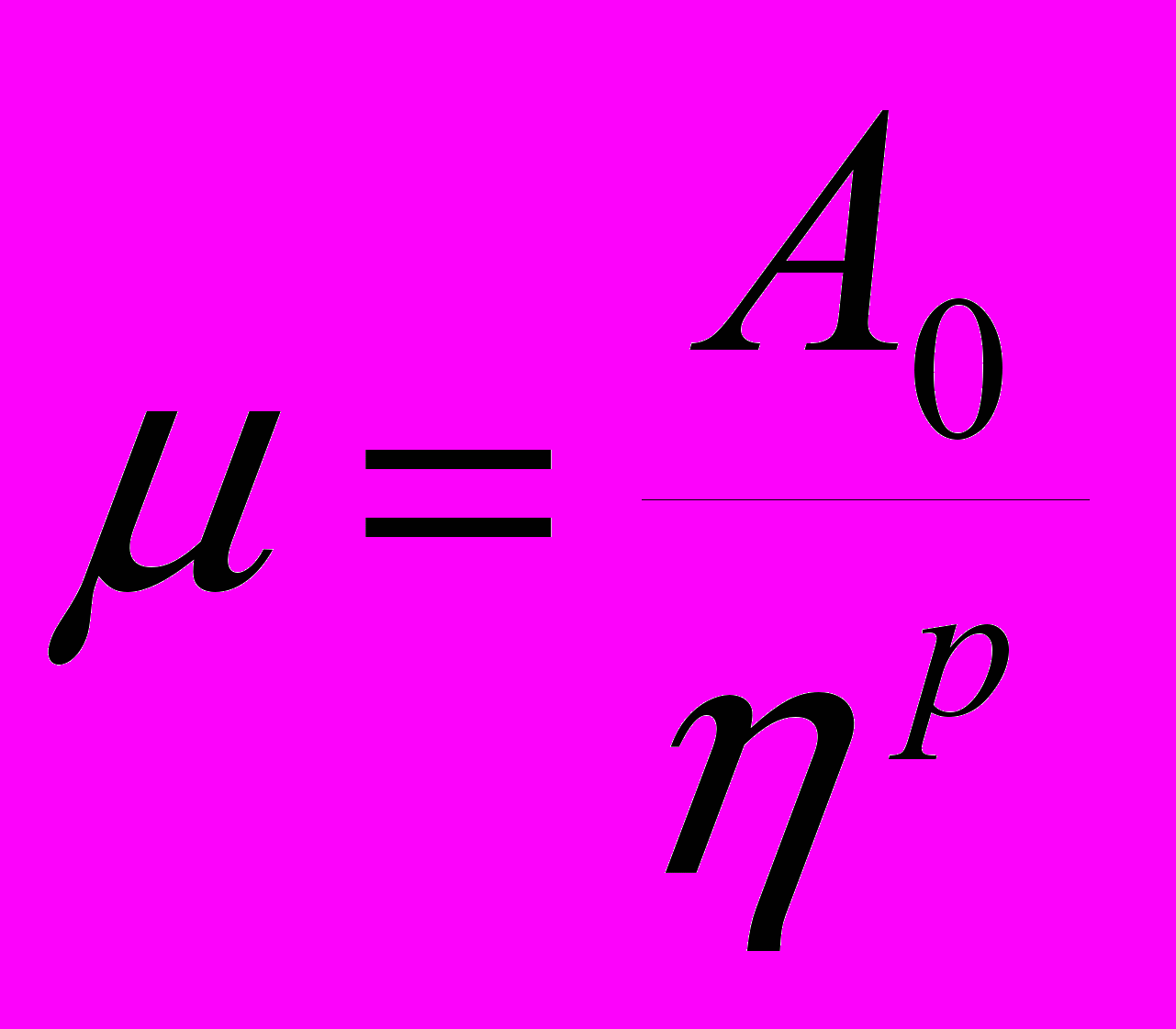 , (17)
, (17)где A0=a[exp(bVs/Vp)-c], В качестве индивидуальных характеристик растворителя и ион-радикала в нее входит отношение их молекулярных объемов Vs/Vp. х
Таблица 7. Значения подвижности ион-радикалов DPA () при 293 К и энергия активации их подвижности Еа вблизи 293 К.а
| Растворитель | , см2/Вс, 10 % | Еа, ккал/моль, (5-10) % | Растворитель | , см2/Вс, 10 % | Еа, ккал/ моль, 10 % |
| н-гексан | 5.510-4 | 1.8 | тетраметилпентадекан | 4.810-5 | 5.7 |
| н-гептан | 4.510-4 | 2.1 | сквалан | 1.610-5 | 10.9 |
| н-октан | 3.710-4 | 2.5 | циклопентан | 4.210-4 | 2.0 |
| н-нонан | 3.010-4 | 2.7 | метилциклопентан | 3.510-4 | 2.0 |
| н-декан | 2.410-4 | 2.9 | циклогексан | 2.010-4 | 3.6 |
| н-додекан | 1.610-4 | 3.5 | метилциклогексан | 2.910-4 | 2.5 |
| н-гексадекан | 8.510-5 | 4.4 | этилциклогексан | 2.510-4 | 2.9 |
| докозан | 9.510-5 (323K) | 5.6 | трет-бутил- циклогексан | 1.410-4 | 3.5 |
| 2-метилбутан | 6.710-4 | 1.6 | циклооктан | 8.010-5 | 4.1 |
| 3-метилпентан | 5.610-4 | 2.0 | тетраметилсилан | 9.010-4 | 1.4 |
| 2,3-диметилбутан | 3.610-4 | 2.4 | гексаметилдисилоксан | 2.010-4 | 2.0 |
| 2,2,4-триметилпентан | 3.810-4 | 2.4 | октаметилцикло- тетрасилоксан | 1.110-4 | 3.5 |
| гептаметилнонан | 9.710-5 | 5.0 | 2,2-диметоксипропан | 3.710-4 | 1.9 |
а исключая докозан
Формула содержит ряд параметров (p, a, b, c), которые подбирались таким образом, чтобы минимизировать среднеквадратичную разницу между расчетными и измеренными подвижностями ион-радикалов в различных алканах.
Для определения этих параметров в случае ароматических соединений в нормальных алканах от гексана (С6) до докозана (С22) были использованы данные о подвижностях ион-радикалов дифенила, DPA, транс,транс-дифенилбутадиена, дифенилбутадиина, тетраметилкватерфенила, 2,5-дифенил-1,3,4-оксадиазола, тетрафенилциклопентадиена, 9,10-дифенилантрацена, 1,2,3,4-тетрафенилнафталина (TPN), 1,2-дифенилиндола, 2,4,6,N,N-пентаметиланилина, TMPD, гексафторбензола (HFB), декафторбифенила, трифенилметана, триптицена (9,10-орто-бензол-9,10-дигидроантрацена, TC), полученные методом ВЭЭ при различных температурах.
Результат сравнения показан на рис. 25. Отметим, что столь большой массив данных о подвижностях ион-радикалов в слабополярных растворах был получен впервые. Сравнение с известными литературными данными показало, что предлагаемые значения параметров p, a, b и c дают близкие к экспериментальным значения подвижности и в случае других ион-радикалов, например, анион-радикалов фуллерена С60, антрахинона и др.
Вместе с тем, как показал анализ данных полученных для алифатических катион-радикалов в н-алканах, а также ион-радикалов в циклических и разветвленных алканах, единым образом выбрать эти параметры для любых растворителей и соединений не удается.
Исследование диффузии катион-радикалов триптицена.
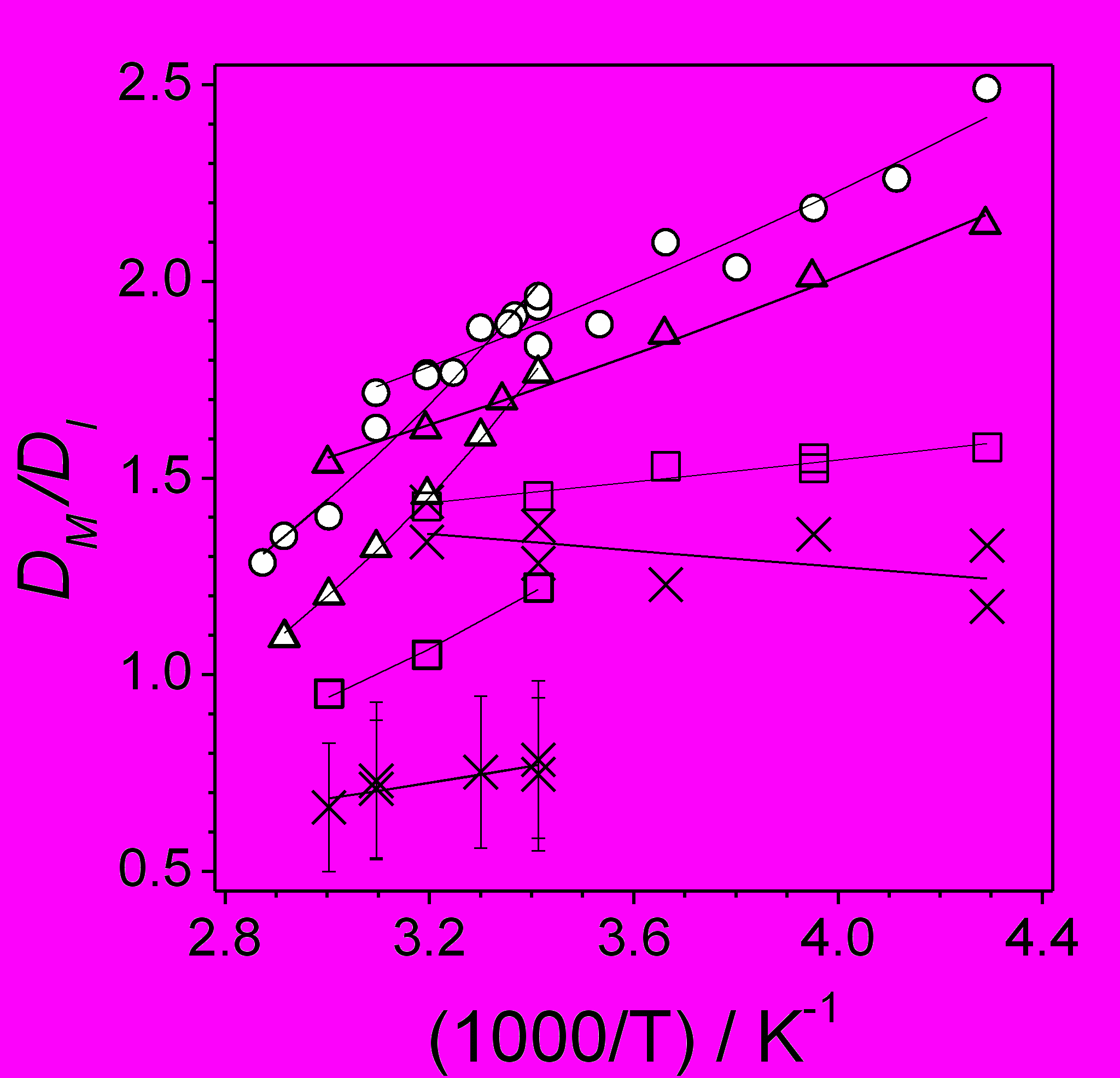
Отметим, что катион-радикалы трифенилметана и триптицена (TC) в более вязких н-алканах имеют подвижность, заметно отличающуюся от «ожидаемой» для ион-радикалов такого же молекулярного объема. В данной диссертационной работе, для того, чтобы изучить возможные причины «аномально» высокой подвижности TC+ было проведено сравнение коэффициентов диффузии КР (DI) и нейтральной молекулы (DM) ТС, а также ряда других соединений, ион-радикалы которых имели «обычную» подвижность. Данные о коэффициентах диффузии молекул были взяты из литературы. На рис. 26 показаны результаты вычислений для DPA, HFB, TPN и TC.
Для первых двух отношение DM/DI близко к 2, что согласуется с ранее опубликованными данными для небольших органических ион-радикалов в полярных и неполярных растворителях. В случае TPN, имеющего больший геометрический размер, по-видимому, более существенным становится гидродинамическое сопротивление движению, а не увеличение взаимодействия с растворителем за счет поляризации последнего. В этом случае эффект появления избыточного заряда уменьшается.
Интересным представляется тот факт, что в C16 КР TC диффундирует быстрее нейтральной молекулы. Автором диссертации высказано предположение, что причиной ускорения диффузии TC+ является быстрое стохастическое перераспределение заряда по несопряженным бензольным фрагментам КР. Ион с новым распределением заряда должен испытывать действие поля растворителя, поляризованного предшествующим распределением электронной плотности. Появление дополнительной случайной силы, действующей на КР TC, по-видимому, будет приводить и к флуктуациям коэффициента «вязкого» трения, действующего на ион, что в свою очередь, может привести и ускорению диффузии. Этот случай показывает, что взаимодействия ионов и растворителя по-прежнему остаются слабо исследованной областью. Отметим, что именно появление метода ВЭЭ позволило значительно расширить круг экспериментальных данных, касающихся диффузии ион-радикалов в неполярных растворах.