Тема 10. Методика формирования первоначальных химических понятий в 8 классе
| Вид материала | Документы |
- Тема Методика формирования понятий о свойствах отдельного химического элемента или, 165.46kb.
- Методика формирования новых понятий в курсе математики примерное содержание, 8.98kb.
- Урок чтения в 1 а классе. Тема: «Звуки [и], [г], [г, ], [п], [п, ], [т], [т, ], [р],, 46.9kb.
- Урок в 9 классе по теме «Бериллий, магний и щелочноземельные металлы.», 43.76kb.
- Закон и периодическая система химических элементов Д. И. Менделеева" Значение и место, 131.75kb.
- План. Сущность понятия. Содержание и объем понятия. Определение математических понятий., 84.97kb.
- Программа курса: Введение в специальность, 169.84kb.
- Урок 1 Тема: «Я и Мы», 2085.08kb.
- Теория и методика обучения и воспитания (литература), 47.67kb.
- Тема Теория и методика обучения праву, 39.43kb.
Тема 10. Методика формирования первоначальных химических понятий в 8 классе
1. Значение темы "Первоначальные химические понятия"
в 8 классе
Тема "Первоначальные химические понятия – первая тема школьного курса химии. Значение ее велико, т.к. она является залогом успешного овладения учащимися последующего материала. При изучении данной темы формируются фундаментальные понятия и представления, на основе которых, в дальнейшем, строятся теоретические концепции химии. Поэтому необходимо, чтобы ученики успешно усвоили важнейшие из этих понятий, и в первую очередь такие, как "атом", "молекула", "химическое явление", "химическая формула", "химическое уравнение", "вещество", "признаки химической реакций" и др. Глубокое понимание атомно-молекулярной сущности строения вещества облегчит учащимся восприятие в дальнейшем, теории строения вещества и других теоретических вопросов предмета химии. В рамках данной темы у учащихся формируется умение выявлять главные, типичные признаки веществ и явлений, группировать их на типы, классы и т.п., что позволит увидеть в классификации важнейших классов соединений и типов реакций не нагромождение фактов, а естественное объединение на основе определенных признаков.
Немаловажное значение имеет первое знакомство школьников с химическим экспериментом. При его самостоятельном выполнении учащиеся овладевают практическими умениями и навыками обращения с веществами и лабораторным оборудованием, а осуществление таких простейших операций, как растворение, взвешивание, нагревание, отстаивание, фильтрование, повышает уровень политехнической подготовки учащихся. Использование учебного химического эксперимента убедит учащихся в том, что знание химических процессов и условий их протекания дает возможность управлять химическими явлениями и процессами.
Значение вводной темы определяются еще и тем, что здесь закладывается основы химического языка.
Следует учесть, что о некоторых понятиях, таких как, атом, молекула, вещество, учащиеся получили представление ранее, на уроках природоведения, биологии, физики. Это дает возможность продолжать формирование и развитие знаний, умений, навыков на основе межпредметных связей.
Изучение первой темы курса химии имеет большое значение для формирования научного мировоззрения учащихся. Познавая с помощью атомно-молекулярного учения строение веществ, учащиеся убеждаются в материальности мира.
И, конечно же, огромная роль изучения первоначальных химических понятий заключается в развитии интереса учащихся к химии. Известно, что еще до начала изучения химии, в младших классах, у школьников возникает интерес к химии, и с первых же уроков химии необходимо поддерживать и развивать его. Этому способствуют новизна предмета, химический эксперимент, связь с жизнью и с другими науками, и то, что вводная тема дает массу возможностей для привлечения средств наглядности и различных форм занимательности.
Образовательные задачи темы. Изучение темы "Первоначальные химические понятия" предполагает постановку и решение следующих образовательных задач.
1. Обобщение и развитие эмпирических сведений о веществах, их свойствах и изменениях, полученных в курсе природоведения, биологии и физики; наполнение их новым химическим содержанием.
2. Раскрытие содержания первоначальных химических понятий, законов химии и химического языка.
3. Закрепление в химических терминах и символике основных понятий и законов химии и химического языка.
4. Формирование и подтверждение положений атомно-молекулярного учения, использование их для объяснения химических явлений и их закономерностей.
5. Ознакомление учащихся с некоторыми методами химической науки – простейшими лабораторными приемами работы с нагревательными приборами, штативом, химической посудой, реактивами, ведением лабораторного журнала и требованиями техники безопасности при работе в химической лаборатории.
6. Ознакомление учащихся с историческими фактами зарождения и развития химической науки.
Развивающие задачи темы. При изучении темы необходимо решение следующих задач по развитию учащихся.
1. Совершенствование мыслительных приемов сравнения, анализа, синтеза.
2. Развитие умений наблюдения и высказывания причинно-следственных суждений на основе химического эксперимента.
3. Развитие воображения учащихся, умения "заглянуть" вглубь вещества, используя модели молекул, атомов, кристаллических решеток.
4. Развитие умений высказывать соответствующие суждения, используя химическую терминологию, и наоборот, умение извлекать, заключенную в химической символике информацию, что способствует развитию мышления.
5. Развитие кругозора учащихся, введение их в круг химических понятий.
6. Развитие умения находить и объяснять межпредметные связи.
Воспитывающие задачи темы. Воспитание школьников всегда являлось важнейшей функцией школы в целом и предмета химии в частности. В теме "Первоначальные химические понятия" можно решить следующие воспитательные задачи.
1. Формирование научных убеждений (является ведущей воспитывающей задачей; осознание реальности существования атомов и молекул и материального единства мира на основе этих представлений).
2. Раскрытие и обсуждение трудностей, возникающих на пути научных открытий, и роли борьбы мнений, настойчивости и трудолюбия ученых-химиков на пути их преодоления.
3. Формирование интереса к предмету при изучении вводной темы (имеет особое значение, т.к. вносит огромный вклад в развитие мотивации учащихся к изучению химии и познанию в целом).
4. Воспитание трудолюбия, аккуратности, умения работать в группе, а также других нравственно-гражданских качеств личности школьника.
2. Место темы в курсе химии общеобразовательной школы
В настоящее время учебников по химии, рекомендованных и допущенных Министерством образования Российской Федерации для обучения учащихся школ, довольно велик. Авторы каждого из этих учебников предлагают свои подходы к изучению вводной темы школьного курса химии в 8 классе.
Согласно авторской программе и учебнику О.С. Габриеляна на изучение первоначальных химических понятий отводится 26 часов. Причем изложение понятий происходит в рамках нескольких тем: "Введение" - 3 часа; "Атомы химических элементов"- 9 часов; "Простые вещества" - 7 часов; "Изменения, происходящие с веществами" - 7 часов.
Гузей Л.С., Суровцева Р.П. в своем учебнике на изучение первоначальных понятий отводят 16–22 ч. из них 7/9 ч. отводится на тему "Предмет химии", 4/5 – на тему "Химический элемент" и 5/9 на тему "Количественные отношения в химии". Все три темы излагаются в начале учебника и следуют одна за другой. Предусмотрено проведение 2 практических работ: "Очистка загрязненной поваренной соли" и "Признаки химических реакций".
Согласно авторской программе и учебнику Минченкова Е.Е. и др. на изучение первоначальных химических понятий отводится 21 ч., в рамках темы "Важнейшие химические понятия. Включено проведение практических работ: приемы обращения с лабораторным оборудованием и изучение техники безопасности; прокаливание медной проволоки и взаимодействие мела с кислотой, как примеры химических явлений.
3. Основные понятия темы
Классификация первоначальных химических понятий. В теме "Первоначальные химические понятия", независимо от конкретного учебника химии изучается относительно много понятий, которые можно подразделить на группы: общенаучные понятия (масса, герметичность, диффузия, электрический ток, магнит и т.д. – около 30 понятий); химические понятия (химическое явление, реакция, количество вещества и т.д. – около 70 понятий); названия химических элементов, веществ и материалов – около 120 понятий; химические реакции – более 40; лабораторные опыты – около 20; демонстрационные опыты – около 30; расчетные задачи – около 10 типов; имена ученых – 10; несколько практических работ.
Каждая группа понятий образует соответствующую систему понятий. Распределение понятий по группам условно, они должны изучаться во взаимосвязи между собой. Некоторые понятия по данной классификации можно отнести к нескольким группам, например, атом и молекула, вещество простое и сложное и т.д. можно отнести как к первой, так и ко второй группе, понятие "относительная атомная масса химического элемента" – и ко второй и к третьей.
По мере изучения химии рекомендуется ведение учениками словаря химических терминов и понятий. Ниже приводится фрагмент словаря по теме (буква А).
Абразивные материалы (абразивы) – твердые вещества или материалы, которые используются для полировки, шлифовки, заточки или иной механической обработки поверхности различных изделий и деталей. К наиболее распространенным А. м. относят алмазы, корунд, карборунд, нитриды бора, песок и др.
Авогадро Амедео (1776-1856) – итальянский физик и химик. В 1811 г. высказал гипотезу о двухатомности молекул азота, водорода, хлора, кислорода, на основе чего дал формулировку одного из основных газовых законов, носящего его имя. Исходя из этого, предложил новый способ определения атомных и молекулярных масс веществ. Впервые правильно установил количественный атомный состав молекул некоторых веществ (воды, водорода, кислорода, азота, оксидов азота, хлора и др.). Изучая свойства азота, фосфора, мышьяка и сурьмы, обратил внимание на их аналогию. Автор четырехтомного труда "Физика весовых тел, или трактат об общей конституции тел" (1837-41), который стал первым руководством по молекулярной физике.
Авогадро число (Авогадро постоянная) – физическая величина (NA), названная в честь Авогадро А., указывающая число атомов, ионов, молекул или иных структурных частиц вещества в порции его количеством 1 моль. Это число равно 6,022×1023 (округленно – 6,02×1023, или 6×1023). В расчетах имеет размерность – 6,022×1023 моль-1.
Атом – сложная электронейтральная наименьшая частица элемента химического, состоящая из положительно заряженного ядра (составляет основу массы А.) и вращающихся вокруг ядра отрицательно заряженных электронов (образуют электронную оболочку атома). А. сохраняют свойства химического элемента и не разрушаются в ходе химических реакций. А. могут существовать в свободном виде и в связанном состоянии друг с другом, образуя в последнем случае более сложные частицы вещества – молекулы или кристаллы немолекулярного строения. А. одного вида образуют химический элемент и обозначаются химическим символом элемента. Напр., А. водорода – Н; А. кислорода – О; А. меди – Cu и т. д.
Атомная масса – значение массы атома, выраженное в относительных атомных единицах массы. Выбор особой единицы для измерения масс атомов связан с неудобством выражать А. м. в граммах из-за чрезвычайно малых масс атомов (10-22-10-24 г). Впервые понятие А. м. ввел Д. Дальтон (1808), он же впервые определил А. м. многих элементов, взяв за относительную единицу измерения массу атома водорода. В 1818 г. Й. Я. Берцелиус предложил определять А. м., исходя из атомной массы кислорода, приняв ее равной 100. В 1906 г. за единицу А. м. была принята кислородная единица, которая составляла 1/16 часть атомной массы кислорода. С 1961 г. за единицу А. м. принята 1/12 часть массы изотопа углерода 12С, которая называется атомной единицей массы (а.е.м.). По последним данным 1 а.е.м. = 1,6605402×10-27 кг. Чаще пользуются относительной атомной массой (Аr), т. е. значением, полученным отношением массы данного атома к 1/12 массы изотопа углерода с массой 12.
Аr =
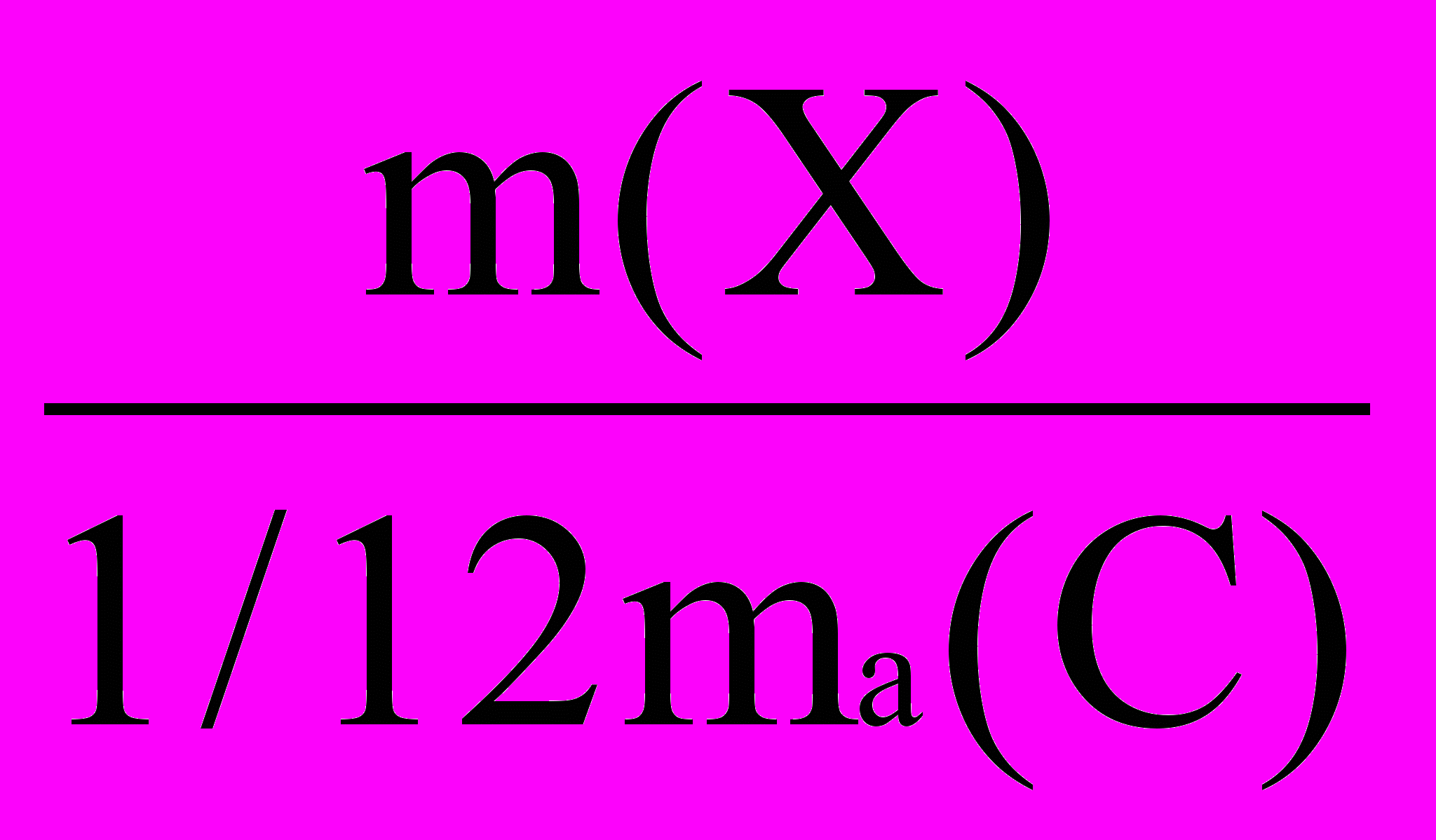
Средние значения атомных масс природных изотопов химических элементов приведены в периодической системе. В атомных единицах массы измеряются также массы ионов, молекул и других частиц вещества.
4. Межпредметные связи
Усвоение столь большого числа понятий было бы невозможным без применения в ходе преподавания темы межпредметных связей, то есть определенных знаний, полученных учащимися раннее при изучении других предметов.
В курсе природоведения учащиеся изучали такие понятия, как: тело, свойства тел, агрегатные состояния, свойства металлов, кислород и его обнаружение, углекислый газ и его обнаружение, фильтрование и др.
В курсе биологии изучены следующие понятия: вещества минеральные и органические, состав и дыхание семян, соли, кислоты, щелочи, крахмал, состав воздуха, превращение крахмала в сахар, удобрения (мочевина, суперфосфат, хлорид калия), химические элементы (калий, азот, фосфор), растворы, прокаливание, выпаривание и др.
В курсе физики изучались такие понятия, как: тело, вещество и его строение, материя, физические и химические явления, эксперимент – источник познания, гипотеза, физические величины и единицы измерения, диффузия, температура, масса атома и молекулы и др.
Задача учителя химии – выяснить, по каким учебникам изучались эти предметы, и уточнить конкретно, что изучалось, и на каком уровне. При этом было бы наивно полагать, что все ученика в классе весь изученный материал запомнили на 100%%. Но, тем не менее, опираться на межпредметные связи, безусловно, необходимо.
5. Методика проведения первого урока
От того, как будет проведен первый урок химии в 8 классе, зависит многое, в первую очередь, - настрой учащихся на изучение предмета. Поэтому к первому уроку нужно тщательно подготовиться, учитывая следующее: химия – новый предмет; обучаясь в младших классах, детей "не пускали" в химкабинет; возможно учащиеся еще не знакомы с учителем химии; химия в представлении одних – наука-волшебница, а для других – отрава и загрязнение внешней среды. В любом случае, определенный первоначальный интерес у учащихся к новому предмету имеется.
Цели и задачи первого урока (записать):
Варианты хода урока для возбуждения интереса.
а) Показать целый набор красивых и занимательных опытов.
б) Прочитать обширную лекцию с картинками, слайдами о роли химии в обществе.
в) Провести беседу на тему "Что такое химия, ее значение для человека". Выслушать высказывания детей (здесь можно заодно выявить речевые навыки и уровень знаний учащихся); дополнить сказанное и сделать логический вывод: "Вы кое-что знаете, но необходимо ваши знания расширить, углубить, уточнить. Для этого, прежде всего, определим, что изучает химия … и т.д."
По ходу определения предмета, целей и задач химии учитель показывает несколько химических опытов, например, гашение горящей свечи углекислым газом, взаимодействие хлорида железа (III) с роданидом калия, подчеркивая при этом и прикладное значение химических явлений и их сущность (на основе химических знаний).
Какой из вариантов, на ваш взгляд наиболее оптимален?
6. Тематический план темы "Первоначальные понятия химии"
Изучение темы "Первоначальные понятия химии" можно провести по следующему плану.
| № урока | Тема урока |
| 1 | Введение. Химия – наука о веществах |
| 2 | Практическая работа "Очистка воды" |
| 3 | Признаки химических реакций |
| 4 | Вещества и их свойства |
| 5 | Строение вещества |
| 6 | Состав вещества. Химический элемент |
| 7 | Относительная атомная масса химического элемента |
| 8 | Простые вещества. Сложные вещества |
| 9 | Семинарское занятие по пройденным темам |
| 10 | Количество вещества. Моль |
| 11. | Относительная молекулярная масса. Молярная масса. |
| 12. | Массовая доля элемента в веществе. |
| 13. | Решение расчетных задач |
| 14. | Определения состава вещества и вывод химической формулы |
| 15. | Решение расчетных задач |
| 16. | Валентность |
| 17. | Сущность химических реакций. Закон сохранения атомов. |
| 18. | Уравнения химических реакций |
| 19. | Реакция соединения и разложения |
| 20. | Семинарское занятие по пройденным темам |
| 21 | Обобщение темы и подготовка к контрольной работе |
| 22 | Контрольная работа по теме "Первоначальные понятия химии" |
| 23 | Анализ контрольной работы |
6. Методические рекомендации по формированию
первоначальных понятий химии
1.Метод перечисления и приведения конкретных примеров. Для формирования достаточно сложных понятий, когда запас знаний у учащихся еще невелик, можно использовать методику перечисления фактов или явлений, относящихся к данному понятию, с последующим высказыванием самими учащимися соответствующего суждения.
Например, формируя и уточняя понятия вещество и тело, можно использовать следующий подход. Учитель показывает учащимся две группы предметов:
Первая группа - стеклянная трубка, медная трубка, стальная трубка, резиновая трубка, пластмассовая трубка и другие трубки из различных веществ.
Вторая группа - стеклянный стакан, стеклянная трубка, стеклянная пластинка, стеклянная колба и другие предметы из стекла.
Далее учитель просит рассмотреть и назвать каждый предмет (тело) и вещество, из которого состоит тело. Затем ученики называют перечень физических тел и химических веществ, из которых состоят данные тела, и дают развернутый ответ на вопрос: "Чем отличается понятие тело от понятия вещество?"
2. Метод историзма. Вводный курс предоставляет обширный материал для применения принципа историзма, который дает возможность ставить проблемные ситуации перед учащимися, но, главное, знакомит их с методологией науки и творчеством выдающихся личностей. Например, при изучении понятия атом, учитель ставит вопрос: "Как древние философы могли прийти к выводу, что материя (все, что нас окружает) состоит из мельчайших частиц-атомов?".
Далее учитель читает выдержки из поэмы римского поэта и философа Лукреция Тита Кара (99-55гг. до н.э.) "О природе вещей".
Ветер, во-первых, неистово волны бичует,
Рушит громады судов и небесные тучи разносит.
...Стало быть, ветры — частицы, незримые нами,
Раз и по свойствам своим и по действиям могут сравниться
С водами мощных рек, обладающих видимым телом.
...Далее, запахи мы обоняем различного рода,
Хоть и не видим совсем, как в ноздри они проникают.
...И, наконец, на морском берегу, разбивающем волны,
Платье сыреет всегда, а на солнце, вися, высыхает.
Видеть, однако, нельзя, как влага на нем оседает,
Как и не видно того, как от зноя она исчезает.
Значит, дробится волна на такие мельчайшие части,
Что недоступны они совершенно для нашего взора…
Путем эвристической беседы учитель подводит учащихся к выводу: основой древнефилософских воззрений было наблюдение за явлениями природы и умозрительные рассуждения.
3.Расширение понятий; формирование мировоззрения и развитие учащихся. При изучении понятий физические и химические явления учитель предварительно ставит вопросы: "Что такое явление?"
Ученики:
"На какие группы можно разделить явления?"
Ученики:
"Явления какой группы самые простые, какой – самые сложные?"
Ученики:
"Какие явления (формы движения материи) изучает химия?" "Какова суть этих явлений?"
Ученики:
4. Применение логических цепочек. Например, при переходе к изучению понятий о разделении смесей можно построить следующую схему.
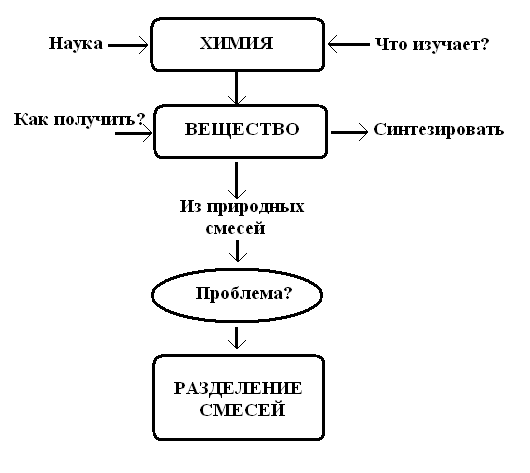
После обсуждения схемы (на основе логической последовательности) учитель начинает объяснение нового материала "Разделение смесей".
5.Формирование понятий через опыт – наблюдение – составление таблицы – самостоятельные выводы учащихся. Приступая к изучению признаков химических реакций, учитель ставит проблемный вопрос: "Химия изучает химические явления (химические реакции); следовательно, мы должны уметь ______________________________________________________________
Для этого мы должны знать каковы ______________________________________
___________________________________________________________________
Для решения проблемы учитель предлагает ученикам начертить в тетрадях таблицу (учитель может использовать доску, кодоскоп или мультимедийные возможности). Далее учитель последовательно проводит ряд опытов, ученики наблюдают и оформляют таблицу (пока без пятого столбца). На основе опытов ученики путем эвристической беседы делают вывод о типе явлений (заполняют пятый столбец) и перечисляют признаки химических реакций.
| Явление, опыт | Признаки явления | Исходные вещества | Что получили | Тип явления |
| 1. Изгибание стеклянной трубки | Трубка изменила форму | Стекло | Стекло | |
| 2. Горение магния | Яркая вспышка (свет); получение белого порошка | Магний | Оксид магния | |
| 3. Действие кислоты на мрамор (мел) | Выделение газа | Мрамор (мел) | Углекислый газ | |
| 4. И т.д. Пока- зать все признаки | | | | |
При отборе опытов важно, чтобы исходные вещества были хотя бы немного учащимся известны, так как на этом этапе обучения учащиеся еще не знакомы с химическими знаками, формулами и уравнениями реакций и база их знаний в области свойств веществ еще мала.
Для закрепления темы можно задать такие вопросы.
1. Наберите стакан холодной воды из водопроводного крана и поставьте его на некоторое время в теплое место. Обратите внимание на появление пузырьков газа на стенках сосуда. К какому типу относится явление? Почему?
2. Относятся ли горение магния и "горение" электролампочки к одному типу явлений?
3. К какому типу явлений относятся горение дров, свечение насекомых или глубоководных рыб?
4. Для получения краски нужного цвета и оттенка художники, рисуя картину, смешивают различные краски. Например, при смешивании желтого и синего – получается зеленый цвет. К какому типу явлений (физическим или химическим) относится такое превращение? и т.д.
6.Применение простейших средств для формирования абстрактных понятий. Понятия атомной массы, количества вещества усваиваются учащимися с трудом. Приведенный рисунок, вырезанный из бумаги, поможет ученику представить единицу измерения массы атомов и молекул.
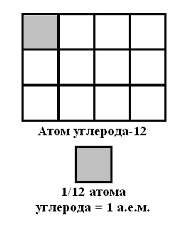
Далее учитель на примере реальных фактов доказывает учащимся, что человек сам разрабатывает и единицы измерения, и средства измерения.
7.Постановка проблемы перед изучением теоретического материала. Изучая определенный закон, учение или теорию, необходимо предварительно показать учащимся, что, во-первых, открытие имеет определенные предпосылки; во-вторых, решает определенные проблемы, в-третьих, - закон имеет теоретическое и практическое значение. Например, при изучении закона постоянства состава учитель может поставить вопрос: "Получить, например, оксид меди можно различными способами (_________________________________ ___________________________________________________________);
будут ли полученные вещества обладать одинаковым составом, свойствами, идентичностью???"
8.Работа с учебником. Научить учащихся работать с учебником на первых порах эффективнее, если тема в учебнике расписана с применением определенного алгоритма, например, составление формулы по валентности, решение расчетных задач и т.д.
9. Доказательство через эксперимент; одновременно развитие учащихся через постановку проблемных вопросов; воспитание мировоззрения. При изучении закона сохранения массы веществ учитель показывает опыты, иллюстрирующие закон; опыты, иллюстрирующие кажущиеся отклонения от закона, и просит учащихся объяснить результаты и сделать выводы. Далее на основе закона обсуждаются различные жизненные ситуации, публикации и телесюжеты.
7. Учебный химический эксперимент
Для решения задач, возложенных на данную тему, необходимо проведение многочисленных учебных опытов. Описание дано в работах: 1. Штремплер Г.И. Предпрофильная подготовка по химии. – М.: Дрофа, 2007. – 256 с. 2. Штремплер Г.И. МЕТОДИКА УЧЕБНОГО ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ШКОЛЕ. Учебно-методическое пособие для студентов химических специальностей. 2008 год. 284 с. Опубликовано на сайте химфака СГУ u/faculties/chemical/uch/ped/default.php
8. Внеклассное мероприятие
Учитывая возрастные особенности учащихся 8 класса, внеклассное мероприятие по теме можно провести по соответствующему сказочному сценарию, в виде вечера "Посвящение в химики" или дидактической игры и т.д. В методической литературе разработок подобных мероприятий достаточно, например: 1. Штремплер Г.И., Пичугина Г.А. Дидактические игры в обучении химии /Учебное издание/ Москва: Дрофа, 2003,2005 (два издания). - 96 с.: ил.; 2. Злотников Э.Г., Веселова Т.А., Штремплер Г.И. и др. Внеклассная работа по химии. 8-11 кл. /Учебное издание/ Москва: Гуманитар. изд. центр ВЛАДОС, 2004. – 133 с. (серия Библиотека учителя химии). 3. Штремплер Г.И. Некоторые формы внеклассной работы по химии. – Ош, 1989. – 58 с.
9. Итоговый контроль и учет знаний учащихся
Учитывая значимость темы, необходимо планировать итоговый контроль и учет знаний учащихся. Его можно провести в виде зачета на оценку, общественного смотра знаний, тестирования (см. Штремплер Г.И. Тесты, вопросы и ответы по химии. Книга для учащихся 8 – 11 классов общеобразовательных учреждений Москва: Просвещение, 1999-2001 три издания. - 112 с. Штремплер Г.И. Химия: Тестовые задания: 11 класс. – М.: ВЛАДОС, 2001. – 64 с.), в виде контрольной работы по индивидуальным карточкам или с применением других форм.
Пример карточки.
1. В одном опыте при сжигании водорода массой 40,0г получено 360,4 воды. В другом эксперименте при полном разложении 40,0г воды получен водород массой 4,44г. Согласуются ли данные этих опытов друг с другом и соответствуют ли они закону постоянства состава?
2. В теле человека содержится примерно 2% калия, 1,1% фосфора, 0,01%железа. Рассчитайте массу каждого из указанных элементов в вашем теле.
3. Найдите массу атома железа, если масса атома углерода равна 1,99*100–23г.
4. Оцените правильность суждений: «Все вещества состоят из молекул», «Все вещества состоят из атомов»:
а) оба суждения верны;
б) оба суждения неверны;
в) первое суждение верно, второе неверно,
г) первое суждение неверно, второе верно.
5. Классифицируйте явления на физические (Ф) и химические (Х):
а) испарение воды; б) плавление парафина;
в) загрязнение воздуха выхлопными газами;
г) ржавление железа; д) сгорание угля.
е) переход красного фосфора в белый.
6. Физический смысл закона сохранения массы веществ:
а) при протекании химических реакций атомы не разрушаются;
б) масса веществ до реакции равна массе веществ после реакции;
в) современные весы позволяют определить массу с высокой точностью;
г) материя неуничтожима.
7. Химическое понятие «количество веществ» обозначает:
а) порцию вещества, измеренную в молях;
б) число структурных частиц вещества, равное 6*1023;
в) массу вещества;
г) навеску вещества, измеренную в молях.
8. Какие из перечисленных ниже уравнений реакций относятся к реакциям соединения, а какие к реакциям разложения? Расставьте коэффициенты.
а) Mg + O2→MgO
б) (CuOH)2CO3→ CuO + CO2↑ +H2O↑
в) CaO + H2O→Ca(OH)2
г) Cu (OH)2→CuO + H2O
д) CuSO4*5H2O→CuSO4 + H2O↑
9. Правильна ли запись: N = (V:Vm)NA? Что она означает?
10. Можно ли на основании только лишь внешних признаков точно определить, к какому типу явлений относится данный процесс? Свое суждение подтвердите примерами.
11. В соединениях: HgO, K2S, B2O3, ZnO, MnO2, Cu2O, FeS, Cl2O7, K2CrO4, NH4Cl – число двухвалентных элементов равно: а) 5; б)7; в)9; г) 6.
ВОПРОСЫ И ЗАДАНИЯ
1. Каково значение темы «Первоначальные понятия химии» в курсе химии средней школы?
2. Каковы образовательные задачи темы? Дайте характеристику понятий и терминов, наиболее важных, на ваш взгляд, изучаемых в данной теме.
3. Дайте краткий обзор терминов и понятий, изучаемых в данной теме.
4. Каковы развивающие задачи темы?
5. Каковы воспитывающие задачи темы?
6. Как используются межпредметные связи при изучении данной темы?
7. Запишите на доске основные этапы первого урока в 8 классе по химии и дайте краткий комментарий к плану.
8. Приведите примеры методических приемов формирования отдельных понятий при изучении данной темы.
9. Приведите пример лабораторного опыта, проводимого учениками при изучении данной темы.
10. Приведите пример демонстрационного опыта, проводимого при изучении данной темы.
11. Приведите пример практической работы, проводимой при изучении данной темы.
12. Составьте пример карточки для итоговой проверки знаний учащихся после изучения темы.
