Опыт внедрения отечественного мдэа-абсорбента на крупнотоннажных производствах аммиака, как пример эффективной энергосберегающей технологии
| Вид материала | Документы |
- Пояснительная записка к курсовому проекту по курсу: «Процессы и аппараты химической, 61.26kb.
- Пяткова И. Н., зам директора автоматизация библиотеки вуза: опыт внедрения, проблемы,, 88.23kb.
- Эффект от внедрения системы, 46.35kb.
- Международный форум «Информационные технологии в управлении», 111.39kb.
- Программа семинара "Оптимизация и повышение эффективности работы тэс за счет внедрения, 35.35kb.
- Планирование ресурсов, включая возможность выбора статьи расходов на различные технологии., 106.76kb.
- C5- разработка энергосберегающей технологии производства магнитно-абразивных порошков, 31.2kb.
- Методы окисления в химической технологии бав, 114.42kb.
- «Харьковские стройматериалы» «фундамент» и «стены» региона, 48.33kb.
- Темы курсовых работ по дисциплине «онот», 26kb.
Опыт внедрения отечественного МДЭА-абсорбента на крупнотоннажных производствах аммиака, как пример эффективной энергосберегающей технологии.
Авторы: А.К. Аветисов, С.В. Суворкин, А.М. Соколов, Ю.К. Байчток, Г.В. Косарев, Н.В. Язвикова, Н.В. Дудакова, Н.А. Костиков
Снижение энергетических затрат в производстве NН3 является одной из наиболее актуальных задач при модернизации действующих агрегатов. Одним из путей снижения энергоёмкости существующих агрегатов является уменьшение затрат тепла в отделении абсорбционной очистки за счёт замены МЭА (моноэтаноламин) – раствора абсорбентом на основе метилдиэтаноламина (МДЭА).
В результате проведенных исследований в лаборатории химической кинетики ФГУП «НИФХИ им. Л.Я. Карпова» предложен состав абсорбента на основе МДЭА российского производства, отвечающий необходимым требованиям по абсорбционной емкости, термохимической стабильности, коррозионной активности и кинетике процесса.
Разработан комплекс организационно-технических мероприятий по переводу отделения абсорбционной очистки агрегатов синтеза аммиака АМ-70 и АМ-76 на новый МДЭА-абсорбент. Технические и экономические показатели предлагаемой технологической разработки подтверждены её успешным внедрением на ряде предприятий азотной промышленности (см. Таблица 1). В Таблице 2 приведены основные показатели технологического режима работы агрегатов на указанных предприятиях при работе отделения очистки конвертированного газа от диоксида углерода на МЭА–растворе и на МДЭА–абсорбенте.
По исходным данным, разработанным в нашей лаборатории, был выполнен рабочий проект отделения абсорбционной очистки нового агрегата производства аммиака АМ-80, который был успешно пущен в эксплуатацию в 2006 году на АО «Ахема» в г. Ионава, Литва.
Разработан комплекс мероприятий по подготовке оборудования к замене абсорбента; оформлены и аттестованы методики аналитического контроля рабочего раствора МДЭА-абсорбента; также осуществляется техническое сопровождение реконструкции и обучение технического персонала.
Немаловажно, что помимо 15-40% снижения удельного расхода низкопотенциального тепла на стадию абсорбционной очистки конвертированного газа от СО2, реконструкция отделения очистки с внедрением МДЭА-абсорбента позволяет:
- снизить нагрузки на циркулирующие насосы за счёт снижения циркуляции абсорбента по сравнению с работой при тех же нагрузках на МЭА-абсорбенте;
- снизить скорость коррозии аппаратуры и сократить смолоотложение на поверхности теплообменной аппаратуры,
- сократить технологические потери абсорбента (деградация и унос с ПГС) от 0.5 кг/т NНз для МЭА–абсорбента до 0.1 кг/т NНз для МДЭА–абсорбента;
- увеличить производительность отделения очистки на 20-30%.
Новый МДЭА-абсорбент более безопасен и менее токсичен, чем используемый ранее моноэтаноламин.
Срок окупаемости модернизации отделений очистки с учётом стоимости реконструкции оборудования и реактивов не превышает 1÷1.5 года.
Таблица 1. Перечень работ по реконструкции отделений абсорбционной очистки конвертированного газа от СО2 агрегатов синтеза аммиака с заменой МЭА раствора на МДЭА-абсорбент, проведенных с научно-техническим сопровождением сотрудников лаборатории химической кинетики ФГУП «НИФХИ им. Л.Я. Карпова»
| Дата | Предприятие | Агрегат | Реконструкция |
| Октябрь 2001 | ОАО «Невинномысский Азот» | АМ-70 | Замена МЭА на МДЭА |
| Июнь 2004 | ОАО «НАК Азот» г. Новомосковск | АМ-70 | Замена МЭА на МДЭА |
| Июнь 2005 | ОАО «Череповецкий Азот» | АМ-76 | Замена МЭА на МДЭА |
| Июнь 2006 | ОАО «Невинномысский Азот» | АМ-70 | Увеличение мощности до 1700 тонн NH3 в сутки с переходом на однопоточную схему регенерации МДЭА-абсорбента |
| Октябрь 2006 | ОАО «Кемерово Азот» | АМ-76 | Замена МЭА на МДЭА с увеличением мощности до 1700 тонн NH3 в сутки |
| Октябрь 2006 | ОАО «Ахема» г. Ионава (Литва) | АМ-80 | Безик проектирование отделения абсорбционной очистки |
| Август 2007 | ОАО «НАК Азот» г. Новомосковск | АМ-70 | Увеличение мощности до 1650 тонн NH3 в сутки |
| Сентябрь 2007 | ОАО «Минудобрения» г. Россошь | АМ-76 | Замена МЭА на МДЭА с увеличением мощности до 1700 тонн NH3 в сутки |
| Октябрь 2007 | ОАО «Гродно Азот» (Белоруссия) | АМ-76 | Замена МЭА на МДЭА с увеличением мощности до 1700 тонн NH3 в сутки |
| Сентябрь 2008 | ОАО «Кемерово Азот» | АМ-70 | Замена МЭА на МДЭА |
| Ведутся работы | ОАО «Ахема» г. Ионава (Литва) | АМ-70 | Замена МЭА на МДЭА с увеличением мощности до 1700 тонн NH3 в сутки |
Таблица 2. Основные показатели технологического режима работы отделений абсорбционной очистки агрегатов синтеза аммиака до модернизации и после перевода на МДЭА-модифицированный
| Наименование показателя | Размерность | АМ-70 ОАО «Невинномысский Азот» | АМ-70 НАК «Азот» г. Новомосковск | АМ-76 ОАО «Череповецкий Азот» | АМ-76 КОАО «Азот» г. Кемерово | АМ-80 АО «Ахема» г. Ионава | ||||
| МЭА | МДЭА | МЭА | МДЭА | МЭА | МДЭА | МЭА | МДЭА | МДЭА | ||
| Производительность по NH3 | т NH3/ч | 61.3 | 70.5 | 52.3 | 71 | 57 | 60.4 | 57.5 | 71.3 | 64.5 |
| Концентрация СО2 в газе после абсорбера | ppm | 55 | 50 | 263 | 40 | 74 | 20 | 58.5 | 22 | 40 |
| Концентрация Н2 в чистой фракции СО2 | % об. | 0.024 | 0.018 | 0.048 | 0.015 | 0.009 | ~ 0 | 0.004 | 0.003 | 0.024 |
| Средний удельный расход тепла в отделении очистки | ккал/нм3 СО2 | 1505 | 1148 | 2051 | 1190 | 1300 | 890 | 1320 | 946 | 890 |
| Суммарная циркуляция раствора абсорбента (снижение расхода пара Р=40 ати) | м3/ч | 1250 | 1100 (4 т/час) | 1412 | 1150 (6 т/час) | 1200 | 1000 (5,3 т/час) | 1330 | 1150 (4,3 т/час) | 890 |
Влияние соотношений Lа/Cu и K/Cu в солевом трегерном катализаторе CuCl2-KCl-LaCl3 на показатели реакции Дикона. Кинетика и возможный механизм реакции.
Аглулин А.Г. Научно-исследовательский физико-химический институт им. Л.Я. Карпова, лаборатория химической кинетики, 105064, г. Москва, ул. Воронцово поле, 10,
e-mail: aglulin_alex@mail.ru
Кинетическое исследование реакции Дикона на катализаторе CuCl2-KCl-LaCl3/силикагель КСК-2 с мольными соотношениями компонентов 1:1:0,33 было проведено при 350-425°С безградиентным методом вдали от равновесия этой реакции и в отсутствии диффузионных ограничений в объеме солевого расплава на носителе. Особенность этого исследования от проведенных ранее заключалась в более широком варьировании парциального давления хлора (РCl2) при низких и высоких уровнях PHCl и PO2. Установленные закономерности реакции, отличающиеся от известных из литературы, характеризуются половинным порядком по кислороду и отрицательным половинным по хлору. Усредненный кинетический порядок по хлористому водороду близок к половинному при PHCl < (PHCl)мин и не зависит от уровней парциальных давлений кислорода и хлора. Выше (PHCl)мин он становится нулевым. С ростом температуры от 350 до 400°С величина (PHCl)мин изменяется от 8 до 18 кПа. В условиях нулевого порядка по хлористому водороду реакция описывается уравнением
r = k (PO2 /РCl2)0,5
Наблюдаемая энергия активации реакции составляет ~ 20 ккал/моль.
Изучено влияние состава катализатора на величину константы скорости реакции при PHCl > (PHCl)мин. В отличие от медькалиевой системы, варьирование мольного отношения K/Cu от 0,1 до 1,0 в катализаторе при постоянном отношении La/Cu не влияет на активность катализатора. При изменении мольного отношения La/Cu от 0,15 до 2,0 наблюдается рост величины константы скорости реакции за счет предэкспоненциального члена, несмотря на повышение энергии активации. Полученная информация согласуется с нашим предположением о природе активных центров реакции Дикона. На этой основе ускоряющее действие хлорида лантана в катализаторе можно объяснить присутствием катионов лантана во внешней сфере координационнонасыщенных ионов меди (CuCl42-, Cu2Cl62-). Повышенные ионные потенциалы (отношение заряда иона к его радиусу) таких противоионов, по сравнению с ионами M+, должны привести к более высокой, чем в системах CuCl2-МCl (М – ионы щелочных металлов), концентрации координационноненасыщенных ионов меди и активности катализаторов.
С учетом полученных закономерностей реакции и информации о структуре и свойствах солевых расплавов предложен двухцентровый механизм реакции Дикона, включающий стадии диссоциативной адсорбции кислорода и хлора и взаимодействия адсорбированных кислорода и хлористого водорода. Механизм учитывает конкуренцию кислорода и хлора на координационноненасыщенных ионах меди.
Влияние природы щелочного катиона (М) в солевом трегерном катализаторе CuCl2-MCl и соотношений M/Cu на скорость окисления хлористого водорода до молекулярного хлора (реакция Дикона). Особенности солевого катализа в этой реакции.
Аглулин А.Г. Научно-исследовательский физико-химический институт им. Л.Я. Карпова, лаборатория химической кинетики, 105064, г. Москва, ул. Воронцово поле, 10,
e-mail: aglulin_alex@mail.ru
Медьсодержащие солевые трегерные катализаторы в условиях реакции Дикона представляют собой пленку расплава, диспергированного на поверхности носителя. Кинетическое исследование реакции проводили безградиентным проточно-циркуляционным методом в интервале температур 350-425°С вдали от равновесия и при контролируемом полном использовании активных центров в объеме солевого расплава. Их доступность для реактантов объясняется аномально высокими растворимостями и коэффициентами диффузии хлористого водорода и хлора в хлоридных средах. Скорость окисления хлористого водорода в объемах относили к грамму меди катализатора.
Установлено, что природа щелочного металла (М) и соотношение М/Cu в системе CuCl2-MCl не изменяют кинетические закономерности реакции, ранее выявленные на катализаторе CuCl2-КCl с эквимолярным соотношением хлоридов. Реакция на исследованных катализаторах характеризуется выходом на нулевой порядок по HCl при величинах (PHCl)мин > 3 кПа. В этой области условий скорость реакции описывается уравнением:
r = k PO2 / РCl2
В отличие от других исследователей, падение скорости реакции при PHCl < (PHCl)мин нами объясняется образованием в солевом расплаве оксидно-оксихлоридной микрофазы. Повышение парциального давления хлора в этих условиях, как нами показано, способно снимать микрофазовую неоднородность расплава и увеличивать наблюдаемую скорость окисления HCl. При отсутствии микрофазовой неоднородности (гомогенности солевого расплава) повышение величины РCl2, согласно кинетике, тормозит скорость реакции.
Получены два типа влияния мольного отношения M/Cu (в интервале 0,1-1,5) в системах CuCl2-MCl на константу скорости реакции (k): постоянный рост величины k (Cu-Li и Cu-Na) и экстремальный с максимумом M/Cu = 0,5 (Cu-K и Cu-Cs). Рост величины k за счет предэкспоненты свидетельствует об увеличении числа активных центров реакции. Учитывая невозможность адсорбции кислорода на ионах Cu2+, роль активных центров, по нашему мнению, могут играть координационноненасыщенные ионы двухвалентной меди. Они образуются при гетеролитической диссоциации координационнонасыщенных комплексов (CuCl42-, Cu2Cl62- и др.). Такое равновесие определяется ионными потенциалами (отношение заряда иона к его радиусу) внешнесферных противоионов М+. Наибольшее поляризирующее воздействие ионов лития и натрия на связь внутри комплекса коррелирует с активностью катализаторов на их основе. Меньшие ионные потенциалы ионов цезия и калия определяют повышенную устойчивость координационнонасыщенных комплексов меди в катализаторах CuCl2-СsCl и CuCl2-КCl и, соответственно, пониженную скорость реакции.
Проведенное исследование позволило обосновать и сформулировать новые представления о механизме реакции Дикона.
СЕЛЕКТИВНОЕ ХЛОРИРОВАНИЕ БЕНЗОЛА ДО
п-ДИХЛОРБЕНЗОЛА НА ГЕТЕРОГЕННОМ КАТАЛИЗАТОРЕ
Алферова Е.А., Занавескин Л.Н., Швец В.Ф.
Научно-исследовательский физико-химический институт им. Л.Я. Карпова,
Москва, ул. Воронцово поле, 10; aflerova@rambler.ru
Российский химико-технологический университет им. Д.И. Менделеева,
Москва, Миусская пл., 9
В последние время наблюдается увеличение потребности в п-дихлорбензоле (п-ДХБ). Это происходит, не смотря на то, что традиционные рынки его потребления, как компонента в составе дезодорантов воздуха в помещениях и в качестве средства борьбы с молью, вполне сформировались и практически не подвержены изменению. Рост потребления п-ДХБ определяется его использованием в качестве сырья для производства важнейшего технологического пластика - полифенилсульфидных смол.
До недавнего времени большая часть потребности в ДХБ покрывалась за счет их выделения из кубовых продуктов производств хлорбензола (ХБ). Однако это относится только к странам располагающим значительными мощностями по ХБ. Учитывая крайне малый объем производства ХБ в России можно заключить, что сегодня существует актуальная задача создания производства п-ДХБ с целью обеспечения сырьем отечественной химической промышленности. В основу такого производства должен быть положен метод селективного хлорирования бензола до п-ДХБ.
Целью работы стал выбор селективного катализатора получения п-ДХБ, изучение процесса хлорирования бензола до п-ДХБ и разработка технологии его производства.
Эксперименты проводились на установке периодического или непрерывного действия в стеклянном реакторе с мешалкой. Анализ реакционных газов после их абсорбции осуществлялся титриметрически; реакционная масса анализировалась хроматографически.
В результате проведенных экспериментов было показано, что хлорид железа (III) не может быть использован как селективный катализатор для получения п-ДХБ, т.к. обеспечивает сравнительно низкую селективность 64%.
Исследован ряд гетерогенных катализаторов процесса селективного получения п-ДХБ. Выбран силикагель КСК как доступный, селективный катализатор, обеспечивающий высокую скорость хлорирования.
Изучена зависимость скорости и селективности реакции хлорирования бензола до п-ДХБ на силикагеле с разном размером зерна. Установлено, что при уменьшении размера зерен катализатора конверсия ХБ и селективность образования ДХБ уменьшаются на 9% и 7,4%, соответственно.
Исследована кинетика 11 реакций, протекающих при хлорировании бензола до п-ДХБ. Показано, что все кинетические уравнения имеют первый порядок по хлору и органическому веществу; определены кинетические параметры для этих уравнений.
Определены оптимальные условия проведения процесса: катализатор силикагель КСК (фр. 3-5 мм), температура 100°С, мольное соотношение бензола к хлору 1:2,02-2,04.
Разработана технологическая схема селективного получения п-ДХБ на силикагеле КСК. Проведен расчет материального баланса и определены расходные коэффициенты для технологической схемы получения п-ДХБ.
Промышленное внедрение адсорбционных методов газоразделения для получения чистой углекислоты и водорода.
Авторы: Ю.К. Байчток, С.В. Суворкин., Ю.И. Шумяцкий, А.К. Аветисов, Г.В. Косарев, Н.В. Дудакова, А.Ю Рапов., В.И. Сорокин
Технологии адсорбционного разделения газовых смесей являются апробированными и широко используемыми процессами в различных отраслях мировой промышленности. Однако, следует отметить, что в настоящее время на Российском рынке в основном представлены установки разделения разовых смесей зарубежных фирм: UOP, Linde AG, Air Liquide, в то время как отечественные разработки на Российском рынке представлены незначительно. В качестве одного из примеров отечественных производителей адсорбционных установок можно привести НПО «Гелиймаш», которое выпускает установки разделения воздуха методом безнагревной короткоцикловой адсорбции
Лаборатория химической кинетики НИФХИ им. Л.Я. Карпова также внесла свой вклад в развитие отечественной адсорбционной техники газоразделения. Сотрудниками этой лаборатории разработаны и введены в эксплуатацию на ОАО «Айс-Фили» и ОАО «Череповецкий Азот» установки глубокой очистки и осушки углекислого газа. Технологический процесс, основанный на последовательной адсорбционной очистке углекислого газа на активированных углях, осушке на синтетических цеолитах до точки росы ниже -75 °С и, при необходимости, глубокой доочистке в ректификационной колонне, позволяет получать товарную углекислоту с чистотой до 99.9995%. Углекислота такого качества широко востребована в производстве напитков, в технологии сварки металлов, а также в производстве полимеров, в частности, поликарбоната.
Вторая область применения адсорбционных методов газоразделения, в которой специализируется наша лаборатория, – это выделение водорода из водородсодержащих газовых смесей методом безнагревной короткоцикловой адсорбции (КЦА). В основе предлагаемой технологии лежит адсорбционный процесс разделения газообразных смесей, основанный на различной поглотительной способности адсорбентов (уголь, цеолит и др.) по отношению к компонентам разделяемой газовой смеси. Технология КЦА характеризуется малым временем цикла адсорбции, что обеспечивает сравнительно небольшие размеры адсорберов. Регенерация адсорбента осуществляется сбросом давления и продувкой его частью продукционного водорода. Процесс КЦА позволяет получить чистый водород с высокой степенью извлечения его из смеси.
Сотрудниками лаборатории была разработана и построена опытно-промышленная установка получения водорода из природного газа на ТЭЦ-20 ОАО «Мосэнерго». Эта установка содержала блок паровой каталической конверсии метана под давлением и блок выделения водорода методом КЦА. Производительность установки – 20 нм3Н2/час, чистота водорода – 99,9% об. Установка проработала 8 лет.
В настоящее время нами ведутся работы по созданию промышленной установки выделения водорода из продувочных газов синтеза метанола на ОАО «Невинномысский Азот». Эта установка рассчитана на производство 3 500 нм3/час водорода с концентрацией не ниже 99% об. при номинальном давлении сырья– 44 кг/см2 (абс.) и концентрации водорода в нем – 46% об. Поскольку сырье содержит высококипящие компоненты, вплоть до парафинов, установку можно разделить на два блока: блок предсорбции, где происходит поглощение паров парафинов на активированном угле, и блок адсорбционного разделения газовой смеси методом КЦА, где осуществляется выделение продукционного водорода. Полученный водород может быть возвращен на установку синтеза метанола или использован в других процессах, например, в производстве аммиака.
ПОЛУЧЕНИЕ СИНТЕТИЧЕСКИХ АПАТИТОВ В ПРИСУТСТВИИ ОРГАНИЧЕСКИХ ДОБАВОК
Бельская Л.В., Голованова О.А., Солоненко А.П.
Омский государственный университет им. Ф.М. Достоевского, г. Омск,
Проспект Мира, 55а, LudaB2005@mail.ru
Известно, что апатиты бывают физиогенного (кости, зубы) и патогенного (кальцификаты сердечных клапанов, мочевые, почечные, зубные камни и др.) происхождения. В последнее время существенно возрос интерес к изучению данных минералов, поскольку неорганическая часть костей и многих патогенных образований человека представлены минералом гидроксилапатитом (ГА) - Ca10(PO4)6(OH)2. ГА в химическом плане наиболее близок минеральной составляющей кости, он прекрасно совместим с мускульной тканью и с кожным покровом, после имплантации он может напрямую срастаться с костной тканью в организме.
Значительная роль при образовании ГА принадлежит органическому веществу, поэтому целью модельного эксперимента было изучение влияния органических добавок на состав образующейся твердой фазы. Для этого были приготовлены три серии растворов без добавок, а также с добавками белка (казеина), аминокислот (глутаминовой кислоты и серина) и глюкозы.
Во всех случаях РФА показал, что твердая фаза представляет собой ГА. Присутствие в растворе добавок глюкозы способствует формированию хорошо окристаллизованного осадка в достаточно короткие сроки (время созревания осадка – 1 месяц). Отмечено также увеличение количества осадка при повышении содержания глюкозы в фазе. Напротив, в присутствии белка в растворе наблюдается ухудшение кристаллической структуры осадка, а также замедление образования твердой фазы. Можно предположить, что наличие в среде белка стабилизирует коллоидные частицы за счет сил адсорбционного взаимодействия, тем самым, препятствуя коагуляции и формированию агрегатов, которые могут являться центрами кристаллизации при образовании ГА. Исследование состава осадков методом ИК-спектроскопии показало, что белок и глюкоза входят в состав всех получаемых осадков. Для твердых фаз, кристаллизующихся в присутствии белка, наблюдается уширение полос поглощения молекул воды (3440 и 1650 см-1) и фосфат ионов (1090, 1042, 961, 600 и 567 см–1), а также относительное увеличение поглощения карбонатов (дублет 1460 и 1420, 876 см-1). Известно, что при таких закономерностях наблюдается уменьшение размеров кристаллов и снижение степени кристалличности осадка. На ИК-спектрах осадков из раствора с глюкозой наблюдается обратная тенденция.
При изучении кинетики кристаллизации ГА in vitro в присутствии аминокислот было отмечено значительное уменьшение массы твердой фазы, полученной из растворов с добавками аминокислот, по сравнению с раствором без добавок. Это связано с ингибированием процесса кристаллизации на стадии роста зародышей, вызванного адсорбцией аминокислот на растущей поверхности, а также конкуренцией органических молекул и твердой фазы за ионы кальция вследствие образования прочных растворимых комплексов с аминокислотами.
Таким образом, показано, что присутствие исследуемых органических веществ (белок, глюкоза, аминокислоты) оказывает влияние на структуру и состав ГА, а также сроки его образования. Кристаллизация с белком протекает медленнее и окристаллизованность осадка хуже, чем в случае с глюкозой. Следовательно, можно говорить об ингибирующем действии белка и промотирующей роли глюкозы в процессе формирования ГА в физиологических условиях.
Получение нанодисперсий в роторных аппаратах
с модуляцией потока
Биглер В.И.1, Юдаев В.Ф.2
1ГОУ ВПО «Южно-Уральский государственный университет» филиал в г. Златоусте
456209 Челябинская обл., г. Златоуст, ул. Тургенева, 16
2 ГОУ ВПО «Московский государственный университет технологии и управления»
В широком смысле к нанодисперсиям относят эмульсии и суспензии, в которых частицы дисперсной фазы имеют размеры менее 100 нм. Для получения таких композиций необходимо обеспечить, с одной стороны, высокую концентрацию энергии в малых объёмах, а с другой стороны – равномерно распределить полученные в локальных областях микрочастицы по всему объёму обрабатываемой среды. В роторных аппаратах с модуляцией потока (РАМП) [1] механическое, гидроакустическое и кавитационное диспергирование удачно сочетаются с гомогенизирующим действием турбулентных течений.
Конструктивно РАМП представляет собой коаксиально расположенные в камере озвучивания статор и ротор, который приводится во вращательное движение электродвигателем. В боковых цилиндрических стенках ротора и статора выполнены отверстия предпочтительно прямоугольной формы. При вращении ротора с угловой скоростью отверстия статора периодически перекрываются, площадь проходного сечения потока изменяется, в результате чего расход Q через аппарат пульсирует с частотой
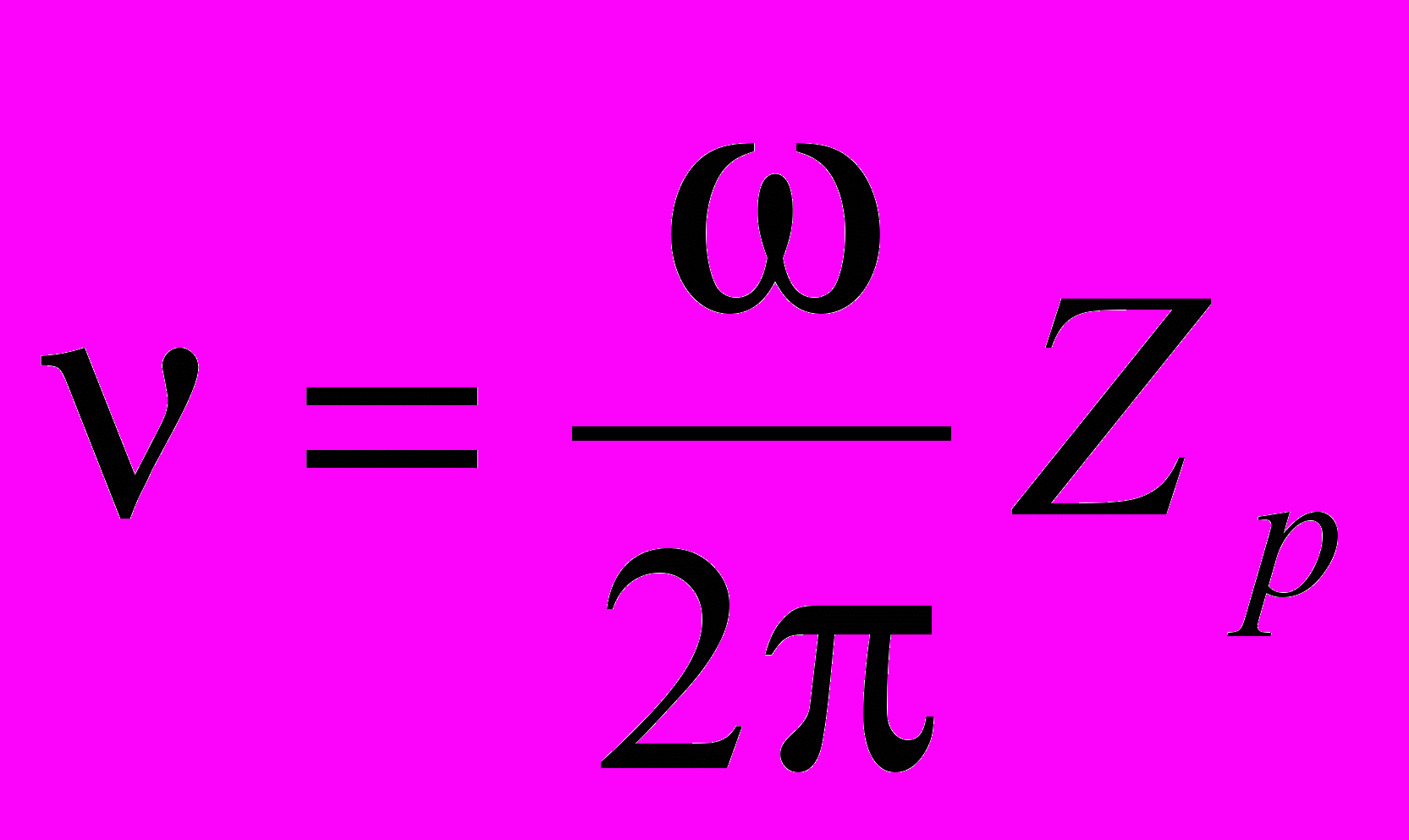 , , | (1) |
где Zp – число отверстий в роторе аппарата. При изменении объёмной скорости потока в нём возбуждаются импульсы давления, форма которых пропорциональна скорости изменения расхода.
По сути, роторный аппарат с модуляцией потока является генератором импульсов переменного давления, амплитуда которых, и, следовательно, степень диспергирования зависят от коэффициента модуляции объёмной скорости
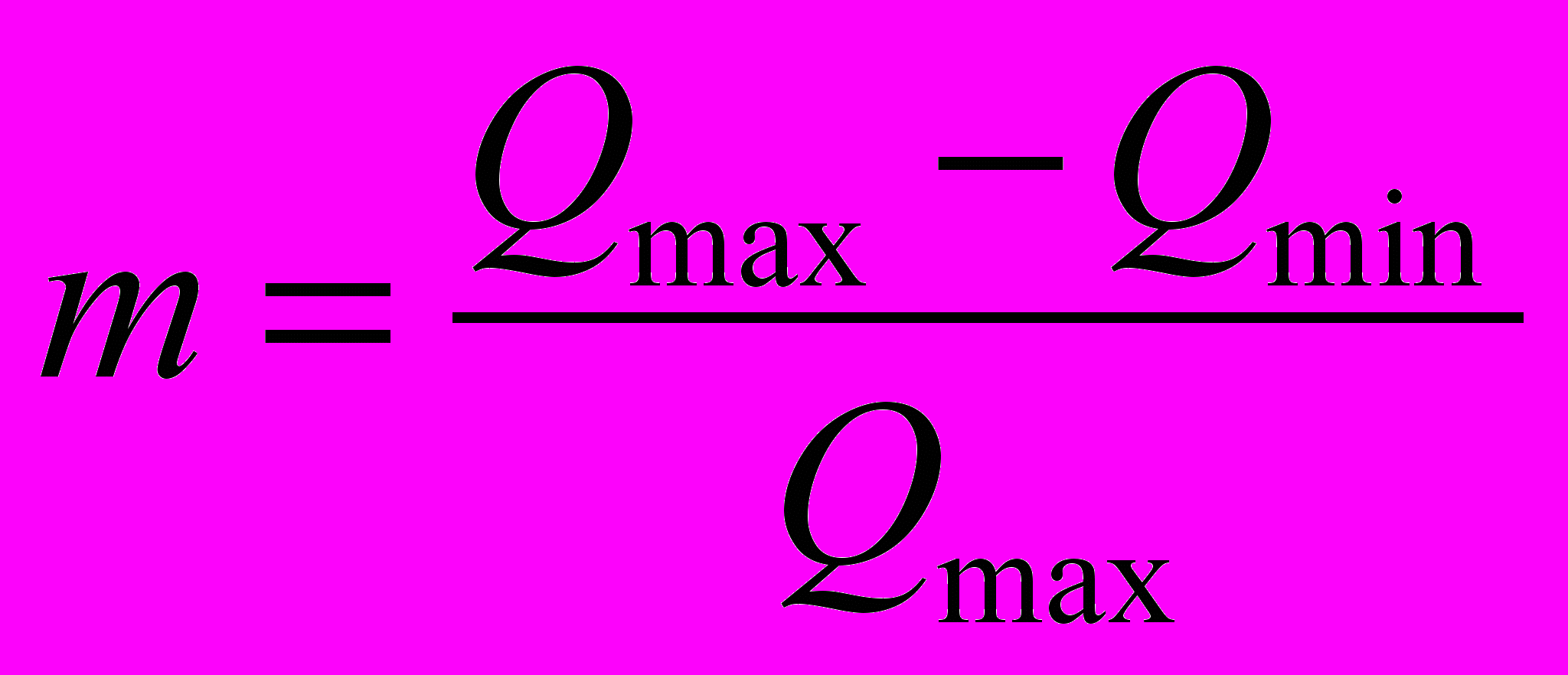 , , | (2) |
где Qmax и Qmin соответственно максимальное и минимальное значения объёмной скорости за период колебаний.
Проведённые нами исследования показали, что диспергирование до наноразмеров возможно только при глубокой модуляции потока (m > 0,9), что является необходимым (но недостаточным!) условием для реализации такого режима работы аппарата, при котором в обрабатываемой жидкости наряду с импульсами переменного давления возбуждаются мощные кавитационные импульсы с частотой следования, равной частоте перекрывания (1) каждого отверстия статора.
Наиболее эффективным для нанодиспергирования режимом работы аппарата оказался режим импульсной акустической кавитации при повышенных статических давлениях в полостях аппарата, причём определённое нами оптимальное значение числа кавитации = р0/рт (р0 – статическое давление в камере аппарата; рт – амплитуда импульсов переменного давления) лежит в пределах от 0,5 до 0,7.
В этом режиме были получены дисперсии окиси цинка в воде при соотношении Т-Ж 1:9. Дисперсность частиц оценивалась по скорости осаждения. В исходной суспензии порошок полностью осаждался после встряхивания за 12 минут, а в обработанной за 72 часа наблюдений отстоялась только 40% порошка.
КРИСТАЛЛИЗАЦИЯ ОДНОВОДНОГО ОКСАЛАТА КАЛЬЦИЯ (АНАЛОГА МИНЕРАЛА УЕВЕЛЛИТА)
Голованова О.А.
Омский государственный университет им. Ф.М. Достоевского
644077, Омск, пр. Мира 55 А, golovanoa2000@mail.ru
Среди минеральных фаз, слагающих почечные камни человека, наиболее распространены сферолитовые агрегаты одноводного оксалата кальция (СаС2О4∙Н2О). Они являются продуктами кристаллизации при высоком пересыщении, существующем в почке. При исследовании процесса кристаллизации одноводного оксалата кальция важно установить влияние на образование данного соединения органических и неорганических примесей, которые являются неотъемлемой составляющей физиологического раствора.
Существует мнение, что зарождение кристаллов СаС2О4∙Н2О происходит преимущественно посредством гетерогенной нуклеации, а рост осуществляется в кинетическом режиме. Кроме того, известно, что при кристаллизации оксалата кальция образуется от одной до трёх гидратированных форм, формирование которых зависит от рН среды, температуры, пересыщения и соотношения форм Са2+ и С2О42-. Это характеризует непостоянство химической системы, в которой представляется возможным изучать влияние термодинамических и кинетических параметров на формирование гидратов при данной совокупности условий. Из существующих фаз термодинамически устойчивым считается моногидрат (СаС2О4∙Н2О, уэвеллит; СОМ) и метастабильный тетрагональный гидрат (СаС2О4∙(2 + х) Н2О, х ≤ 0,5, уэдделлит). Кроме того, в ряде работ указывается на возможность образования кристаллогридрата оксалата кальция состава: СаС2О4∙хН2О, 3≥ х >2,5 (СОТ). Термодинамический (пересыщение) и кинетический факторы (образование зародыша, рост и агрегация) играют важную роль в патогенном образовании почечных камней. В то время как кристаллы дигидрата оксалата кальция COD образуются в моче, моногидрат (СОМ) намного чаще встречается в камнях. Кроме того, термодинамически не стабильный тригидрат (СОТ) может являться предшественником формирования оксалатного камня.
Важным является поиск ответа на вопрос, что определяет образование той ли иной кристаллической фазы оксалата кальция? Анализ литературных данных показывает, что формирование оксалатов кальция различного состава во многом зависит от условий проведения экспериментов по кристаллизации В составе оксалатных камней часто присутствуют такие элементы, как фосфор и сера, различные аминокислоты и другие добавки которые могут оказывать влияние на кристаллизацию. Было изучено влияние компонентов физиологического раствора на фазовый состав осадка оксалата кальция.
Результаты РФА и ИК-спектроскопии осадков, полученных в присутствии неорганических и органических добавок при разных значениях рН, свидетельствуют об образовании почти во всех испытанных условиях только одноводного оксалата кальция.
Только в присутствии карбонат-ионов при рН=4,5 и рН=6,0 на рентгенограммах наряду с рефлексами уэвеллита обнаружен пик, соответствующий 2-водному или 2,25-вод-ному оксалатам кальция.
Таким образом, экспериментальные данные свидетельствуют, что на образование одноводного оксалата кальция не влияют такие факторы, как рН раствора, температура и введение в систему неорганических и органических добавок.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант № 06-05-65165).
