Структура и взаимодействие наследственных и средовых факторов предрасположенности к развитию атопических болезней у детей
| Вид материала | Автореферат |
- Опубликовано в журнале «Здоровье для всех» 2008, 181.65kb.
- План: Взаимодействие детского сада и семьи по вопросам речевого развития. Обогащение, 42.97kb.
- Программа дисциплины «Психогенетика» образовательная профессиональная программа подготовки, 145.73kb.
- Содержание Введение 3 Основная часть:, 341.45kb.
- Расписание лекций заведующей кафедры инфекционных болезней у детей фпк и пп спбгпма, 52.91kb.
- Индивидуализация скоростно-силовой подготовки волейболисток на основе генетической, 368.2kb.
- План лекций по биологической химии для студентов лечебного факультета, 66.35kb.
- Ов курса «Патологическая физиология» для самостоятельного изучения, 13.37kb.
- Мутационная изменчивость, 50.04kb.
- Применение нутрицевтиков при комплексном санаторном лечении бронхиальной астмы и атопического, 248.85kb.
Результаты исследований и их обсуждение
В основную группу исследования были включены 336 детей, с различными проявлениями атопической патологии, включая бронхиальную астму, персистирующий и/или сезонный аллергический ринит (поллиноз), атопический дерматит. Диагнозы атопических болезней у всех пациентов были подтверждены с использованием клинико-генеалогического, аллергологического и функционального методов исследования.
В контрольную группу были включены 88 практически здоровых детей, без проявлений аллергических реакций и болезней на момент осмотра и в анамнезе, и наследственной отягощенности аллергическими реакциями и болезнями по крайне мере в двух поколениях родственников (сибсы и родители).
14
Распределение детей по полу и возрасту в основной и контрольной группах не различалось (р>0,05).
Мальчиков было 244 (72,61%) и 61 (69,32%), соответственно, девочек 92 (21,42%) и 27 (30,68%), соответственно. Детей 3-6 лет было 61 (18,75%) и 21 (23,86%), 7-11 лет – 118 (35,12%) и 30 (34,09%), 12-18 лет – 155 (46,13%) и 37 (42,05%), соответственно.
Отягощение наследственности аллергическими реакциями и болезнями было выявлено у 271 (80,65%) больного основной группы, у 65 (19,35%) - выявлено не было (рисунок 1).
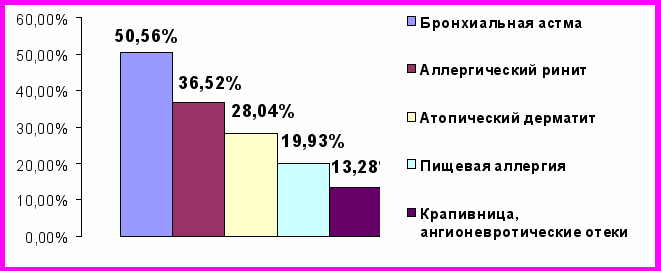
Рисунок 1. Аллергические реакции и болезни у родственников пробандов
Наиболее часто регистрируемыми аллергическими реакциями и болезнями у родственников пробандов являются бронхиальная астма 137 (50,56%), персистирующий/сезонный аллергический ринит 99 (36,52%), атопический дерматит 76 (28,04%), пищевая аллергия 54 (19,93%), крапивница и ангионевротические отеки 36 (13,28%).
Наличие атопии является ведущим биологическим фактором риска, развития аллергических болезней - бронхиальной астмы, аллергического ринита, атопического дерматита и их сочетанных проявлений. Высокий уровень сенсибилизации к экзогенным аллергенам по данным кожного тестирования был выявлен у 159 (56,98%) из 279 обследованных больных. Высокий уровень общего и специфических IgE в сыворотке крови был выявлен у 191 (78,60%) из 243 обследованных пациентов. У 82 (33,74%) пациентов из 243 обследованных больных уровень общего Ig E превышал 500 МЕ/мл (рисунок 2).
15
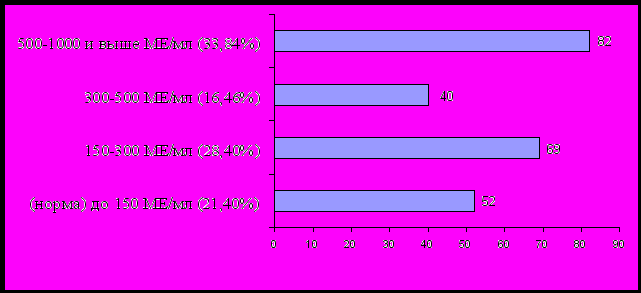
Рисунок 2. Уровень общего IgE у пациентов основной группы
У детей основной группы был выявлен широкий диапазон аллергических реакций и болезней: пищевая аллергии у 171 (50,89%), атопический дерматит у 167 (49,70%), персистирующий аллергический ринит у 214 (63,69%), сезонный аллергический ринит (поллиноз) у 184 (54,76%), бронхиальная астма у 272 (80,95%), лекарственная аллергия у 140 (41,67%), эпидермальная аллергия и аллергия на укусы насекомых у 96 (28,57%), крапивница и/или ангионевротические отеки у 41 (12,20%) пациента (рисунок 3).
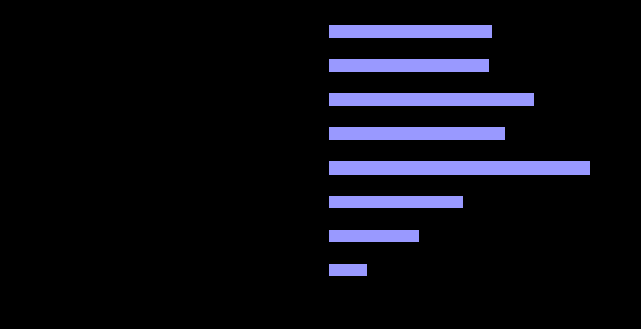
Рисунок 3. Частота аллергических реакций и болезней у пациентов основной группы
Наиболее часто встречаемыми сочетаниями аллергических болезней у детей основной группы были:
16
I атопический дерматит, персистирующий и/или сезонный аллергический ринит (n=64);
II бронхиальная астма и сезонный аллергический ринит (поллиноз) (n=56);
III бронхиальная астма и атопический дерматит (n=53)
IV бронхиальная астма и персистирующий аллергический ринит (n=79)
V бронхиальная астма, персистирующий /сезонный аллергический ринит (поллиноз), атопический дерматит у одного индивида (n=84)
Из 336 пациентов основной группы родители 145 (43,15%) детей, по данным опроса, не отмечали экологически неблагоприятных особенностей и значительного аллергенного окружения в среде проживания, в семьях 191 (56,85%) пациента родители отмечали неблагоприятные экологические особенности и выраженность аллергенного окружения в среде проживания семьи.
Мы изучили экологические особенности и выраженность аллергенного окружения в среде проживания детей основной группы (таблица 2).
Таблица 2
Экологические особенности и выраженность аллергенного окружения в среде проживания детей основной группы
| Экологические особенности и выраженность аллергенного окружения в среде проживания детей основной группы | Количество больных n=191 |
| Заводы/промышленные/химические производства/ крупные транспортные магистрали | 85 (44,50%) |
| Наличие старой мягкой мебели и игрушек, книг на открытых полках | 118 (61,78%) |
| Курение родственников дома | 39 (20,42%) |
| Проживание животных, птиц, наличие аквариумных рыб | 91 (47,35%) |
| Выращивание растений дома | 114 (59,68%) |
| Сырость и наличие очагов плесневых вегетаций | 70 (36,64%) |
Выраженность аллергенного окружения в среде проживания больных атопическими болезнями в большей мере было обусловлено особенностями микроэкология и недостаточным обеспечением гипоаллергенного режима в быту: 61,78% семей пользуются старой мягкой мебелью и мягкими игрушками, 59,68% выращивают домашние растения и держат животных, птиц и аквариумных рыб 47,35%.
17
Курение родственников в квартире/доме отмечали 20,42% больных атопическими болезнями.
Экологически неблагоприятные особенности в среде проживания - повышенную влажность в квартире и наличие очагов плесневых вегетаций отмечали 36,64% семей, о наличие заводов, промышленных и химических предприятий, крупных транспортных магистралей заявили 44,50% детей и их родителей.
Из 336 детей основной группы 332 (95,83%) пациентам и/или родителям были известны причины-триггеры, провоцировавшие обострение аллергических болезней.
Таблица 3
Триггеры развития аллергических реакций и обострения
аллергических болезней
| Триггеры развития аллергических реакций и обострения аллергических болезней у детей основной группы | Количество больных n=322 |
| Домашняя и библиотечная пыль | 95 (29,50%) |
| Пыльца растений | 120 (37,27%) |
| Физическая нагрузка | 170 (53,79%) |
| Эмоциональная нагрузка | 59 (18,32%) |
| Резкие запахи, в том числе табачный дым | 67 (20,81) |
| Пищевые продукты | 93 (28,88%) |
| Сырость и наличие очагов плесневых вегетаций | 32 (9,94%) |
| Резкая смена погодных условий (сырость, ветер, холод) | 119 (36,96%) |
| ОРВИ | 159 (49,38%) |
| Контакт с животными, птицами | 63 (19,56%) |
Наиболее часто причинами обострения атопических болезней и развития аллергических реакций у детей основной группы были физическая нагрузка (53,79%) острая респираторная вирусная инфекция (ОРВИ) (49,38%), контакт с пыльцой растений (37,27%), домашней и библиотечной пылью (29,50%), резкая смена погоды на сырость, ветер, холод (36,96%) и резкие запахи, в том числе табачный дым (28,88%).
18
Анализ генетической компоненты предрасположенности к развитию
атопических болезней у детей
С развитием молекулярно-генетических технологий анализ наследственных основ атопических болезней был направлен на поиск конкретных генов, определяющих структуру наследственной компоненты предрасположенности. Было показано, что в патогенезе атопических болезней принимает участие множество разных, в том числе функционально взаимосвязанных генов, способных формировать «генные сети» (Jarvis D., Burney P. et al., 1997, Anderson W., Kalberg С, Edwards L. et al., 2000, Баранов В.С. и др., 2000, 2009, Dallongeville J., Helbecque N. et al., 2003, Балаболкин И.И., Брянцева О.Н., 2008).
У 237 детей с атопическими болезнями (основная группа) и их 88 практически здоровых сверстников (контрольная группа) нами был проведен анализ распределения частот аллелей и генотипов генов ферментов первой (CYP1A1 (4887C>A, 4889A>G, 6235T>C), CYP2C19 (G681A), CYP2C9 (A1075C, C430T), CYP2D6 (G1934A)) и второй фаз биотрансформации ксенобиотиков ( GSTM1, GSTT1, MTHFR (667C>T), NAT2 (481C>T, 590G>A, 857G>A), регулирующих взаимодействие организма с окружающей средой и генов, кортикостероидного GR (1220A>G), β2-адренергического ADRB2 (46A>G, 79C>G) рецепторов, фактора некроза опухолей α TNFA (308G>A) и гена липоксигеназы -5 ALOX5, играющих ключевую роль в патогенезе атопических болезней и определяющих чувствительность к фармацевтическим препаратам патогенетической терапии атопических болезней.
Выявлена ассоциация полиморфных вариантов генов ALOX5 (VNTR), GR (1220A>G), TNFA (308G>A), CYP1A1 (6235T>C) и GSTM1(делеция) с развитием атопических болезней у детей (рисунок 4).
Определены генотипы повышенного риска развития атопических заболеваний у больных детского возраста.
Семейство P-450 CYP1 метаболизирует полициклические ароматические углеводороды (ПАУ) – основные компоненты табачного дыма. Ген CYP1A1 кодирует белок, контролирующий начальный метаболизм, приводящий к образованию канцерогенов (Баранов В.С. и др., 2000, Глотов А.С., Наседкина Т.В., 2005)
В работе были изучены три полиморфизма гена первой фазы биотрансформации CYP1A1 (4887C>A, 4889A>G, 6235T>C).
19
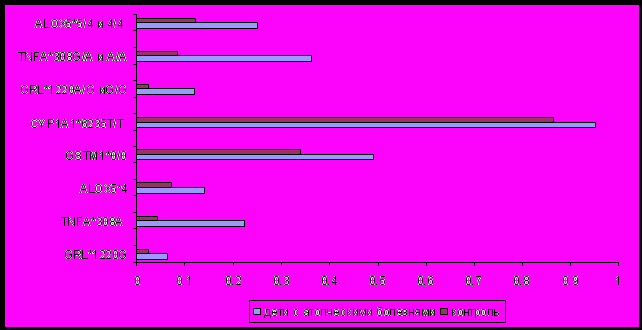
Рисунок 4. Частоты генотипов и аллелей генов, ассоциированных с атопическими болезнями у детей.
Достоверные различия распределения частот аллелей и генотипов были выявлены только для полиморфизма 6235T>C гена CYP1A1: аллель CYP1A1*6235С и гетерозиготный генотип CYP1A1*6235Т/С достоверно чаще встречался в группе контроля по сравнению с основной группой пациентов (р<0,01). Отношение шансов для детей с генотипом CYP1A1*6235Т/С составляет 0,32 (95%CI 0,14-0,76), а для детей с генотипом CYP1A1*6235Т/Т - 3,10 (95%CI 1,31-7,32). Т.о. CYP1A1*6235Т/С - является генотипом пониженного риска, а CYP1A1*6235Т/Т – генотипом повышенного риска развития атопических болезней у детей.
Мутантные аллели генов GSTT1 и GSTM1 второй фазы биотрансформации ксенобиотиков характеризуются наличием протяженных делеций, следствием чего является полное отсутствие соответствующих ферментов, их называют «нулевыми» аллелями (Глотов А.С., Наседкина Т.В., и др., 2005, Баранов В.С. и др., 2009). Частота гомозигот по «нулевому» аллелю GSTM1 в российской популяции составляет около 40%, частота гомозигот по «нулевому» аллелю GSTT1 - 15-20% (Gra O., Mityaeva O., et al., 2010). Многочисленные данные проведенных исследований свидетельствуют об ассоциации «нулевых» вариантов генов ферментов GSTT1 и GSTM1 с развитием атопической бронхиальной астмы (БА) и атопического дерматита (Макарова О.Г, Сафронова, В.А., и др 2006, Брагина Е.Ю., Фрейдин М.Б., и др., 2007, Баранов В.С. и др., 2009, Федорова Ю.Ю., Карунас А.С. и др., 2010).
20
В ходе нашего исследования делеционных полиморфизмов генов семейства GST (GSTM1 и GSTT1) была выявлена ассоциация гена GSTM1 с риском развития атопических заболеваний: генотип, гомозиготный по делеционному полиморфизму (0/0), достоверно чаще встречается в выборке пациентов, чем в группе здорового контроля (р<0,025). Отношение шансов для носителей генотипов, гомозиготных по делеционному полиморфизму гена GSTM1, составляет 1,88 (95%CI 1,13-3,14), т.е. GSTM1*0/0 – является генотипом повышенного риска развития атопических болезней у детей.
Ген глюкокортикоидного рецептора GR локализован на длинном плече хромосомы 5. Изучаемый полиморфизм 1220A>G гена GR, приводящий к замене аспарагина на серин в позиции 363, ассоциирован с измененной чувствительностью к кортикостероидам (Баранов В.С. и др., 2000).
В результате анализа распределения частот аллелей и генотипов полиморфизма 1220A>G гена GR отмечено достоверное увеличение частоты аллеля GR*1220G и генотипов GR*1220A/G и GR*1220G/G в группе пациентов с атопическими болезнями по сравнению с индивидами контрольной группы (р<0,025). Отношение шансов для детей с генотипами GR*1220G/A и GR*1220G/G составляет 5,58 (95%CI 1,30-24,01). Аллель G можно рассматривать как аллель повышенного риска развития атопической патологии (OR=5,49; 95%CI 1,29-23,32) у детей.
Арахидонат 5-липоксигеназа является ключевым ферментом в биосинтезе лейкотриенов и липоксинов из арахидоновой кислоты и кодируется геном липоксигеназы -5 (ALOX5). Установлено, что ингибирование этого фермента лекарственными препаратами сопровождается улучшение показателей функции внешнего дыхания при бронхиальной астме (Богорад А.Е., 2005, Lam S., Chan H., Le Riche J.С. et al., 1988, Anderson W., Kalberg С, Edwards L. et al., 2000).
В гене ALOX5 выявлен полиморфизм вариабельного числа тандемных повторов (VNTR) шестинуклеотидного мотива [5’-GGGCGG-3’], варьирующим от 2 до 8 раз. Показано, что число тандемных повторов шестинуклеотидного мотива [5’-GGGCGG-3’] любым кроме пяти ("не-5") характеризуются снижением экспрессии гена ALOX 5 и практически отсутствием эффекта терапии ингибиторами лейкотриенов (Богорад А.Е., 2005, Lam S., Chan H., Le Riche J.С. et al., 1988, Anderson W., Kalberg С, Edwards L. et al., 2000).
21
В настоящей работе выявлена достоверно более высокая частота аллеля 4 (р<0,05) и генотипов 5/4 и 4/4 (p<0,025) полиморфизма VNTR гена ALOX5 в группе пациентов с атопическими болезнями по сравнению с группой контроля. Показатель отношения шансов для детей генотипов 5/4 и 4/4 гена ALOX5 составил 2,41 (95%CI 1.17-4,99). Показатель отношения шансов для генотипов 5/4 и 4/4 составил 2,41 (95%CI 1,17-4,99). Т.о. генотипы 5/4 и 4/4 и аллель 4 гена ALOX5 можно рассматривать в качестве аллеля и генотипов повышенного риска развития атопических болезней у детей.
Фактор некроза опухолей α (TNFA) - мощный провоспалительный цитокин, продуцируемый преимущественно макрофагами и моноцитами. Существуют данные об ассоциации полиморфизма 308 G>A гена TNFA с развитием бронхиальной астмы и уровнем IgE в сыворотке крови. Показано достоверное увеличение аллеля TNFA*308А у больных бронхиальной астмой по равнению с популяционной выборкой. Риск развития бронхиальной астмы у лиц с редким аллелем TNFA*308А гена TNFA возрастает в 2,4 раза (Останкова Ю.В., Иващенко Т.Э., Келембет Н.А., 2005, Shin Y.D., Park B.L., Kim L.H. et al., 2004).
В нашей работе была выявлена достоверно более высокая частота аллеля TNFA*308А полиморфизма 308G>A гена TNFA и генотипов, «несущих» этот аллель (TNFA*308G/A и TNFA*308A/A), в группе больных атопическими болезнями по сравнению с группой контроля (p<0,001). Отношение шансов для носителей генотипов TNFA*308G/A и TNFA*308A/A составляет 6,13 (95%CI 2,69-13,96). Таким образом, аллель TNFA*308А (OR=6,46; 95%CI 2,93-14,23) и генотипы TNFA*308G/A и TNFA*308A/A гена TNFA можно рассматривать в качестве аллеля и генотипов повышенного риска развития атопических болезней у детей.
Анализ ассоциаций генов предрасположенности к развитию сочетанных проявлений аллергических болезней у детей
В основной группе больных атопическими болезнями, наиболее часто встречающимися сочетанными проявлениями атопии были:
I атопический дерматит, персистирующий и/или сезонный аллергический ринит (n=56);
II бронхиальная астма и сезонный аллергический ринит (поллиноз) (n=26);
III бронхиальная астма и атопический дерматит (n=49)
IV бронхиальная астма и персистирующий аллергический ринит (n=46)
V бронхиальная астма, персистирующий /сезонный аллергический ринит, атопический дерматит у одного индивида (n=60)
22
Проведенный анализ распределения частот аллелей и генотипов исследованных генов CYP1A1 (4887C>A, 4889A>G, 6235T>C), CYP2C19 (G681A), CYP2C9 (A1075C, C430T), CYP2D6 (G1934A) GSTM1, GSTT1, MTHFR (667C>T), NAT2 (481C>T, 590G>A, 857G>A), GR (1220A>G), ADRB2 (46A>G, 79C>G), TNFA (308G>A) ALOX5 (VNTR) выявил ассоциацию полиморфных вариантов генов ALOX5 (VNTR) и TNFA (308G>A) с развитием сочетанного аллергического поражения различных органов и систем, включая бронхиальную астму, атопический дерматит, персистирующий и/или сезонный аллергический ринит (поллиноз).
Достоверно более высокая частота аллеля TNFA*308А и генотипов, «несущих» этот аллель (TNFA*308G/A и TNFA*308A/A), была во всех группах пациентов, страдающих различными сочетанными проявлениями атопических болезней (I, II, III, IV и V), по сравнению с группой контроля (p<0,001). Показатель отношения шансов для носителей генотипов TNFA*308G/A и TNFA*308A/A составляет в I группе 12,58 (95%CI 4,85-32,64), во II группе 4,69 (95%CI 1,44-15,23), в III группе 4,41 (95%CI 1,63-11,92), в IV группе 6,18 (95%CI 2,27-16,84) и в V группе 4,40 (95%CI 1,67-11,58). Т.о., аллель TNFA*308А и генотипы TNFA*308G/A и TNFA*308A/A можно рассматривать в качестве аллеля и генотипов, ассоциированных с повышенным риском развития любых комбинированных проявлений атопической патологии у детей (рисунок 5).
Выявлена достоверно более низкая частота аллеля 6 (p<0,025) и генотипа 5/6 у пациентов всех пяти групп (I, II, III, IV и V) по сравнению с группой контроля (p<0,025) и достоверно более высокая частота аллеля 4 и генотипа 5/4 полиморфизма VNTR гена ALOX5 у пациентов групп I и V по сравнению с контролем (р<0,05) (рисунок 5). Отношение шансов для носителей генотипов 5/4 и 4/4 гена ALOX5 у детей I группы составило 3,09 (95%CI 1,26-7,56), у детей V группы – 2,91 (95%CI 1,22-6,95). Отношение шансов для носителей генотипа 5/6 у детей I группы составил 0,07 (95%CI 0,01-0,56), в III группе - 0,07 (95%CI 0,01-0,57), в IV группе - 0,08 (95%CI 0,01-0,64) и в V группе - 0,12 (95%CI 0,03-0,56). Таким образом, генотип 5/6 гена ALOX5 можно рассматривать как генотип, связанный с пониженным риском развития различных проявлений атопической патологии, а генотип 5/4 – в качестве генотипа, ассоциированного с повышенным риском развития атопических болезней у детей данной выборки (рисунок 5).
23
Для каждого сочетанного проявления аллергических болезней, включая бронхиальную астму, аллергический персистирующий и/или сезонный ринит и атопический дерматит были выявлены полиморфные варианты генов, определяющие своеобразие каждой группы сочетаний, что позволяет говорить о них как об отдельных клинко-патогенетический вариантах течения атопического процесса у детей.
Развитие атопического дерматита и аллергического персистирующего или сезонного ринита было ассоциировано с полиморфными вариантами генов CYP2С19 и CYP2C9 (рисунок 6); бронхиальной астмы и сезонного аллергического ринита (поллиноз) - с полимофизмами генов GR, CYP1A1, NAT2 (рисунок 7); бронхиальной астмы и аллергического персистирующего - с полиморфизмами генов GR, NAT2,GSTM1(рисунок 8); бронхиальной астмы и атопического дерматита – с полиморфизмами генов ALOX5, CYP2C9 (рисунок 9); бронхиальной астмы, атопического дерматита, аллергического персистирующего и сезонного ринита у одного индивида - с полиморфными вариантами генов CYP2C9, GR, MTHFR, ALOX5 (рисунок 10).






26
Комплексный анализ наследственных и средовых факторов, обуславливающих развитие сенсибилизации организма у детей
Возрастающее количество фактов подтверждает важную роль в патогенезе атопических болезней, взаимодействия между генами и факторами окружающей среды. Возможные модели этих взаимодействий дают только предположительные оценки риска развития сенсибилизации организма и тяжести течения атопических болезней: внешняя среда может, как усиливать фенотипическую экспрессию аллельного
варианта гена, так и уменьшать.
У детей основной группы, отмечавших различные экологические особенности и выраженность аллергенного окружения в среде проживания (отсутствие или наличие заводов, промышленных и химических предприятий, крупных транспортных магистралей; повышенной влажности и наличие очагов плесневых вегетаций в квартире/доме, старой мягкой мебели и мягких игрушек, домашних растений, животных, птиц и аквариумных рыб, курящих в доме/квартире родственников) мы проанализировали выраженность сенсибилизации организма по данным кожных скарификационных проб, выраженность проявления атопии по результатам определения уровня общего и специфических Ig E к экзогенным аллергенам в сыворотке крови, и частоты полиморфных вариантов генов системны биотрансформации ксенобиотиков и генов, определяющих чувствительностью к фармацевтическим препаратам противоаллергической патогенетической терапии, по данным молекулярно-генетического исследования.
279 пациентов, выполнивших кожный скарификационный тест с неинфекционными аллергенами были распределены на четыре подгруппы в зависимости от степени выраженности сенсибилизации к неинфекционным аллергенам и особенностей экологических условий и выраженности аллергенного окружения в среде проживания.
117 (41,94%) детей показали легкую степень выраженности сенсибилизации организма, 56 (20,08%) из них, отмечавшие удовлетворительные условия и гипоаллергенное окружении в среде проживания были включены в 1 группу, 61 (21,86%), отмечавшие различные экологические особенности и выраженность аллергенного окружения в среде проживания были включены во 2 группу.
162 (58,06%) пациента показали среднюю и высокую степень выраженности сенсибилизации организма, 64 (22,94%) из них отмечавшие удовлетворительные условия и гипоаллергенное окружении в среде проживания были включены в 3 группу,
27
98 (35,12%), отмечавшие различные экологические особенности и выраженность аллергенного окружения в среде проживания были включены в 4 группу.
Распределение детей в группах по полу и возрасту достоверно не различалось (р>0,05).
Таблица 3
Уровень общего Ig E в сыворотке крови у 4 групп пациентов.
| Уровень общего IgE в сыворотке крови | ниже 150 МЕ/мл (норма) | 150-300 МЕ/мл | 300-500 МЕ/мл | выше 500МЕ/мл |
| 1 группа (n=39) | 18 (46,16%) | 13 (33,33%) | 3 (7,69%) | 5 (12,82%) |
| 2 группа (n=53) | 11 (20,75%) | 20 (37,74%) | 13 (24,53%) | 9 (16,98%) |
| 3 группа (n=57) | 6 (10,53%) | 15 (26,32%) | 10 (17,54%) | 26 (45,61%) |
| 4 группа (n=94) | 17 (18,09%) | 21 (22,34%) | 14 (14,89%) | 42 (44,68%) |
Уровень общего IgE до 150 МЕ/мл (норма) в 1 группе детей встречался достоверно чаще чем в 3 группе (р<0,01; Х2(df1)=13,834) и в 4 группе (р<0,025; Х2(df1)=9,799; OR=3,882; 95%CI 1,710-8,816). Показатель отношения шансов OR=0,1373; 95%CI 0,04780-0,3941 и OR=0,2576; 95%CI 0,1134-0,5849 для детей с выраженной сенсибилизацией группы 3 и 4, свидетельствует об отрицательной ассоциации уровня IgE до 150 МЕ/мл с выраженной сенсибилизацией организма, вне зависимости от экологических условий проживания и выраженности аллергенного окружения в среде проживания.
В группах 3 и 4 с выраженной сенсибилизацией организма, достоверно чаще встречался уровень общего IgE выше 500 МЕ\мл, по сравнению с группами 1 и 2 с легкой степенью сенсибилизации организма. Показатель отношения шансов свидетельствует о положительная ассоциация уровня общего IgE выше 500 МЕ/мл с выраженной сенсибилизацией организма, вне зависимости от условий проживания пациентов - (р<0,0025; Х2(df1)=9,939; OR=5,703; 95%CI 1,948-16,694 и р<0,003; Х2(df1)=9,101;OR=4,100; 95%CI 1,689-9,952) для 3 группы по сравнению с 1 и 2; и (р<0,0015; Х2(df1)=10,890; OR=5,492; 95%CI 1,974-15,282 и р<0,0015; Х2(df1)=10,287;OR=3,949; 95%CI 1,731-9,006) для 4 группы по сравнению с 1 и 2.
28
186 пациентам был проведен молекулярно-генетический анализ распределения частот аллелей и генотипов, исследованы генов.
Степень выраженности кожных скарификационных проб у детей, проживающих в разных экологических условиях и выраженности аллергенного окружения была ассоциирована с полиморфными вариантами генов системы биотрансформации ксенобиотиков первой (CYP1A1 (4889A>G), CYP2C9 (C430T), CYP2D6 (G1934A)) и второй фазы биотрансформации ксенобиотиков (NAT2 (481C>T, 590G>A), а также генов медиаторов воспаления и сопутствующих факторов (TNFA (308G>A), MTHFR (C667T)) (рисунок 11).
Таким, образом, факторами, обуславливающими риск развития сенсибилизации организма является: выраженность проявления атопии (уровень общего и специфических IgE в сыворотке крови), экологические особенности и выраженность аллергенного окружения в среде проживания ребенка, индивидуальные (генетические особенности) (рисунок 11).

29
Анализ наследственных и средовых факторов, обуславливающих развитие тяжелых обострений атопических болезней у детей
Недостаточная эффективность терапии и невозможность контролировать острые проявления атопических болезней приводит к развитию неотложных состояний угрожающих жизни пациента и требующих интенсивной терапии в условиях специализированного стационара и/или отделения реанимации и интенсивной терапии.
Поиск причин и факторов, способствующих развития тяжелых обострений атопических болезней в настоящее время остается актуальным.
Тяжелое обострение бронхиальной астмы обусловлено персистирующим воспалением дыхательных путей, проявляющихся частыми приступами, а также продолжительным, более 6-8 ч, нарушением бронхиальной проходимости в виде астматического состояния с развитием дыхательной недостаточности и нарушением дренажной функции легких.
Системные стероиды (СС) используются для лечения БА в течение 40 лет, играя значительную роль в терапии этого заболевания.
Мы разделили пациентов на 2 группы, в зависимости от потребности в использовании СС для купирования обострений бронхиальной астмы и достижения контролируемого течения болезни.
В 1 группу были включены 214 (64,58%) из 336 пациентов, которые никогда не применяли СС для купирования обострений и достижения контролируемого течения болезни.
Во 2 группу включили 122 (36,31%) пациента, которым для купирования острых проявлений и достижения контроля атопических болезней, и бронхиальной астмы, в частности, требовалась терапия СС (парентерально или внутрь).
Распределение детей в 1 и 2 группах по полу и возрасту достоверно не различалось (р>0,05).
Поздняя постановка диагноза заболевания, недостаточное знание его патогенеза, современных подходов к лечению ведут к позднему назначению адекватной противовоспалительной терапии, полипрагмазии, увлечению антибактериальными препаратами и нестероидными противовоспалительными средствами.
30
На основании изучения анамнеза нами было установлено, что срок появления первых симптомов бронхиальной астмы и срок постановки диагноза бронхиальной астмы далеко не всегда соответствовали друг другу. Порой до постановки диагноза проходили годы.
Таблица 4
Время постановки диагноза и назначения адекватного лечения
у детей с различной потребностью с терапии системными стероидами
| | В течение 1 года после первых проявлений болезни | В течение 2 лет | В течение 3 и более лет течения бронхиальной астмы |
| 1 (n=165) | 94 (56,97%) | 28 (16,97%) | 43 (26,06%) |
| 2 (n=107) | 36 (33,64%) | 20 (18,70%) | 51(47,66%) |
Большинству больных в 1 группе в течение первого года проявлений атопических болезней был правильно поставлен диагноз БА и назначена противоаллергическая терапия 94 (56,97%), в отличие от больных 2 группы - 36 (33,64%) (р<0,001; Х2 =13,233). Большинству пациентов 2 группы, напротив, диагноз БА и назначение противоаллергической терапии были сделаны спустя 3 и более лет после первых проявлений болезни 51 (47,66%), по сравнению с детьми 1 группы 43 (26,06%) (р<0,001; Х2 =12,456). Показатель отношения шансов (OR=0,3830 95%CI (0,2309-0,6351)) свидетельствуют, что постановка правильного диагноза и назначение адекватного лечения в течение первого года проявлений болезни, является фактором пониженного риска развития острых неотложных состояний, требующих введения СС для купирования обострений атопических болезней, а постановка диагноза в течение 3 проявлений болезни (OR=2,584 95%CI (1,544 - 4,323)) –является фактором повышенного риска развития обострений атопических болезней, требующих введения СС. Таблица 5
Уровень общего IgE у пациентов с тяжелыми обострениями
бронхиальной астмы и группы сравнения
| Уровень общего Ig E в сыворотке крови | ниже 300 МЕ/мл | 300-500 МЕ/мл | 500-800МЕ/мл | 800 МЕ/мл и выше |
| Дети 1 группы (n=140) | 55 (39,29%) | 30 (21,43%) | 31 (22,14%) | 24 (17,14%) |
| Дети 2 группы (n=81) | 22 (27,16%) | 17 (20,99%) | 16 (19,75%) | 26 (32,10%) |
31
У детей 2 группы достоверно чаще выявлялся уровень общего Ig E выше 800 МЕ/мл, по сравнению с детьми группы 1 (32,10%против17,14%) р<0.02 X2 (df1)=5,730 OR=2,285 CI95% (1,203-4,338). Показатель отношения шансов свидетельствует, что уровень IgE 800 МЕ/мл и выше является показателем повышенного риска развития тяжелых обострений и потребности в использовании СС для купирования приступов бронхиальной обструкции.
Количество пациентов с уровнем Ig E ниже 300 МЕ/мл было больше в группе 1 (39,29%) по сравнению с группой 2 (27,16%), однако, достоверных различий выявлено не было. Количество детей с уровнем Ig E 300-500 и 500-800 группах 1 и 2 также достоверно не различалось (р>0,05).
В группе 1 пациенты достоверно чаще имели отягощение наследственности одним аллергическим заболеванием 100 (59,52%) по сравнению с больными группы 2 - 48 (46,60%) (p<0,05). В группе 2, напротив пациенты достоверно чаще имели отягощение наследственности 2 и более атопическими болезнями 55 (53,40%) больных по сравнению с пациентами 2 группы 68 (40,76%). Показатель отношения шансов свидетельствует, что отягощение наследственности не более одним атопическим заболеванием является фактором пониженного риска развития тяжелых обострений БА, требующих введения СС (OR=0,5935 95%CI(0,3118-0,9734), а отягощение наследственности двумя и более аллергическими болезнями – фактором повышенного риска развития тяжелых обострений БА, требующих введения СС (OR=1,685 95%CI(1,027-2,764))).
В результате проведения молекулярно-генетического анализа распределения частот аллелей и генотипов полиморфных генов, была выявлена ассоциация развития тяжелых обострений бронхиальной астмы, требующих введения СС с полиморфными вариантами гена кортикостероидного рецептора GR (1220A>G) и цитохрома CYP2C9 (681 G>A).
Таким, образом, факторами, определяющими риск развития тяжелых обострений БА у детей обусловлен выраженностью атопии, наследственной отягощенности и накоплением аллергических болезней в роду, своевременным началом адекватной
терапии бронхиальной астмы и генетическими (индивидуальными) особенностями пациента (рисунок 12).
32

Исследование структуры и взаимодействия наследственных и средовых факторов, предрасполагающих к развитию бронхиальной астмы у детей
Бронхиальная астма – одна из важнейших проблем современной педиатрии. Это заболевание, начавшись у детей, в большинстве своем продолжается и в зрелом возрасте, может быть причиной не только инвалидности, но и смертельных исходов. Поэтому БА является не только крупной клинической, но и социальной проблемой.
В общей когорте детей (n=336) основной группы 272 (80,95%) пациента страдали бронхиальной астмой различной степени тяжести.
Для анализа факторов, предрасполагающих к развитию БА и обуславливающих тяжесть течения и чувствительность к патогенетической терапии, мы разделили всех 336 пациентов на четыре группы в зависимости от наличия БА и тяжести течения бронхиальной астмы: в группу 1 были включены пациенты с БА легкого персистирующего течения, во 2 - пациенты с БА среднетяжелого течения, в 3 – пациенты с БА тяжелого течения. Пациенты с проявлениями атопического дерматита, персистирующего /сезонного аллергического ринита служили группой сравнения 0.
Достоверных различий распределения детей по возрасту и полу в группах с БА различной степени тяжести и группой сравнения 0 выявлено не было (р>0,05).
В результате проведения молекулярно-генетического анализа распределения частот аллелей и генотипов полиморфных генов, была выявлена ассоциация развития БА с полиморфными вариантами генов β2-адренергического ADRB2 (46A>G), кортикостероидного GR (1220A>G) рецептора, генов биотрансформации ксенобиотиков CYP2C9 (A1075C) и MTHFR (C667T) (рисунок 13).
33

Мы изучили влияние факторов окружающей среды, выраженность проявлений атопии и сенсибилизации организма, обуславливающие тяжесть течения бронхиальной астмы, потребность и чувствительность к препаратам патогенетической терапии.
Таблица 6
Факторы внешней среды, сопровождающие пациента в быту
| Условия и проживания и выраженность аллергенного окружения | Заводы/Химические производства/ Транспортные магистрали вблизи места проживания | Пылесборники: мягкая мебель, мягкие игрушки, книги на открытых полках | Курение родственников дома | Проживание животных, птиц, наличие аквариумных рыб | Выращивание растений дома | Сырость и наличие плесневых вегетаций |
| Группа сравнения n=64 | 15(23,44%) | 30(46,86%) | 11(17,19%) | 22(34,38%) | 22 (34,38%) | 9(14,06%) |
| Легкая БА n=62 | 16(25,81%) | 25(43,32%) | 5(8,06%) | 14(22,58%) | 24(38,71%) | 14(22,58%) |
| Средне-тяжелая БА n=68 | 20(29,41%) | 24(35,29%) | 9(13,24%) | 22(32,35%) | 25(36,76%) | 19(27,94%) |
| Тяжелая БА n=142 | 34 (23,94%) | 39 (27,46%) | 14 (9,86%) | 33 (23,24%) | 43 (30,28%) | 29 (20,42%) |
Дети группы 0 (14,06%) реже отмечали наличие сырости и плесневых вегетаций в жилых помещениях проживания, по сравнению с детьми с БА различной степени тяжести 1 (22,58%), 2 (27,94%), и 3 (20,42%). Достоверные различия были выявлены между группами 0 и 2 (р>0,03 Х2 (df1)= 5,003; OR=0,3359 95%CI (0,1375-0,8205). Других различий выявлено не было (р>0,05).
34
IgE-опосредуемые реакции, являются патогенетической основой атопической БА у детей. Повышенный уровень общего Ig E был выявлен у 44 из 61 (72,13%) пациентов группы 0, у 40 из 50 (80,00%) детей группы 1, у 44 из 54 (81,48%) детей группы 2, и у 93 из 125 (74,40%) больных группы 3 (таблица 7).
Таблица 7
Уровень IgE в сыворотке крови пациентов с бронхиальной астмой
и пациентов группы сравнения
| Уровень Общего Ig E в сыворотке крови | Ниже 300МЕ/мл | 300-500 МЕ/мл | выше 500МЕ/мл |
| Группа сравнения n=44 | 22 (50,00%) | 8 (18,18%) | 14 (31,82%) |
| Легкая БА n=40 | 14 (35,00%) | 9 (22,50%) | 17 (42,50%) |
| Среднетяжелая БА n=44 | 14 (31,82%) | 11 (25,00%) | 19 (43,18%) |
| Тяжелая БА n=93 | 27 (29,03%) | 19 (20,43%) | 47 (50,54%) |
Количество больных с уровнем общего Ig E ниже 300 МЕ/мл преобладало в группе 0 (50,00%) по сравнению с группами 1 (35,00% р>0,05 Х2 (df1)= 3,908 OR=2,571 95%CI (1,094-6,045), 2 (31,82% ) и 3 (29,03% р>0,002 Х2 (df1)= 10,346 OR=3,444 95%CI (1,660-7,148).
Количество пациентов с уровнем общего Ig E выше 500 МЕ/мл постепенно возрастало по мере увеличения тяжести течения БА, однако, достоверных различий в группах 1,2,3 и группе сравнения выявлено не было (р>0,05).
Таблица 8
Показатели функции внешнего дыхания у детей с наличием и различной степенью
тяжести бронхиальной астмой
| Изменения функции внешнего дыхания / группы больных БА | Нормальные показатели ФВД | Изменения ФВД на фоне противоаллергической терапии | ||
| Нарушение ФВД на уровне периферических бронхов | Умеренные генерализованные нарушения ФВД | Выраженные генерализованные нарушения ФВД + снижение ФЖЕЛ | ||
| Группа сравнениия n=44 | 30(56,60%) | 15(28,30%) | 4 (7,55%) | 4 (7,55%) |
| Легкая БА n=40 | 24(44,44%) | 16(29,63%) | 7(12,96%) | 7(12,96%) |
| Средне-тяжелая БА n=44 | 23(36,51%) | 28(44,44%) | 4(6,35%) | 8(12,70%) |
| Тяжелая БА n=93 | 25(19,84%) | 58(46,03%) | 19(15,08%) | 24(19,05%) |
35
ФВД в пределах нормальных значений встречалось реже по мере увеличения тяжести течения БА, так в группе 0 частота ФВД (норма) была (56,60%), в группе 1, 2 и 3 (44,44%, 36,51% и 19,84% соответственно). Достоверные различия были выявлены для группы 0 по сравнению с группой 2 (р>0,05 Х2 (df1)= 3,910 OR=2268 95%CI (1,074-4,789)) и 0 по сравнению с группой 3 (р>0,0001 Х2 (df1)= 21,992 OR=5,270 95%CI (2,622-10,589)).
ФВД с нарушениями бронхиальной проходимости на уровне периферических отделов, напротив, чаще отмечалась у пациентов 2 (44,44% и 3 (46,03% по сравнению с группой 0 - (28,30%). А группы 0 и 1 (29,63%) достоверно не различались (р>0,05). Достоверные различия были выявлены для группы 3 по сравнению с группой 0 - р>0,05 Х2 (df1)= 4,150 OR=2,161 95%CI (1,081-4,321)).
Частота детей с ФВД с умеренными генерализованными нарушениями была выше в 1 (12,96%) и 3 (15,08%) группах по сравнению с группой 0 (7,55%), однако, достоверных различий выявлено не было (р>0,05).
ФВД с выраженными генерализованными нарушения со снижением ФЖЕЛ также, чаще встречались в группах 1 (12,96%), 2 (12,70%) и 3 (19,05%) по сравнению с группой 0 (7,55%), однако, достоверных различий выявлено не было.
К аллергенам домашней пыли и клещей домашней пыли легкая степень сенсибилизации достоверно реже встречалась в группе 3 (43,36%) по сравнению с группой сравнения (62,22%) р>0,05 Х2 (df1)= 3,858 OR=0,4648 95%CI (0,2289-0,9440). Высокая степень сенсибилизации к аллергенам домашней пыли и клещей домашней, чаще отмечалась в группах 1 (10,00%) и 3 (17,70%) по сравнению с группой сравнения (4,44%). Однако, достоверных различий выявлено не было (р>0,05).
