Диабетической стопы
| Вид материала | Документы |
- Пролонгированная внутриартериальная лекарственная терапия в лечении деструктивных форм, 74.97kb.
- Синдром диабетической стопы II-V cт. (Wagner). При ишемической форме, 485.79kb.
- Пути усовершенствования тактики и хирургического лечения гнойно-некротических осложнений, 97.88kb.
- Синдрома диабетической стопы, 747.13kb.
- Лечение больных с гнойно-некротическими процессами при синдроме диабетической стопы, 258.22kb.
- "Сахарный диабет. Синдром диабетической стопы", 66.36kb.
- Клинико-экономический анализ консервативной тактики лечения пациентов с синдромом диабетической, 457.09kb.
- Общий план строения сустава. 11. Добавочные образования суставов и их функциональные, 33.63kb.
- Предотвратить миллионы ампутаций, 109.1kb.
- Опыт клинического применения ультразвуковой кавитации в лечении гнойных осложнений, 103.98kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
С учетом данных обследования пациентов, различные варианты диабетической стопы были представлены в виде трёх основных форм: нейропатическая инфицированная форма диагностирована у 67 (62%), ишемическая форма – у 15 (14%) и нейроишемическая – у 26 (24%) пациентов (табл. 2)
Таблица 2.
Распределение пациентов по формам СДС
| Форма СДС | Основная группа | Контрольная группа | ||
| | Кол-во | % | Кол-во | % |
| Нейропатическая инфицированная форма | 25 | 60,97 | 42 | 62,68 |
| Нейроишемическая форма | 10 | 24,39 | 16 | 23,88 |
| Ишемическая форма | 6 | 14,63 | 9 | 13,43 |
| Всего | 41 | 100 | 67 | 100 |
Медикаментозная терапия включала комбинацию прямых и непрямых антикоагулянтов (фраксипарин, клексан, фрагмин, гепарин), дезагрегантов (курантил, аспирин), простагландинов (вазапростан), гликозаминогликанов (сулодексид) и спазмолитиков (папаверин, но-шпа). Антиоксидантная терапия с применением препаратов витамина Е, липоевой кислоты (тиоктацид, берлитион), которые оказывают лечебный эффект на периферическую полинейропатию.
В комплексном лечении гнойно-некротических форм СДС в последнее время большое значение придается внутриартериальному способу введения лекарственных веществ.
В связи с этим, нами был разработан способ ретроградной катетеризации артерий стопы. После удаления гнойно-некротического очага использовали для катетеризации культи ветвей артерий стопы (ветви a.dorsalis pedis, a.tibialis posterior и пальцевые артерии). Катетеризацию проводили во время операций: экзартикуляций и ампутаций пальцев, резекций стопы на различных уровнях. Катетер вводился ретроградно до уровня средней или верхней трети голени и фиксировался в культе артерии во время операции, в последующем проводилась комплексная терапия с локальным регионарным введением лекарственных средств. Длительность катетеризации составляла до двух недель и определялась сроками заживления основной раны.
В связи с разнонаправленностью патогенеза различных форм диабетической стопы применена дифференцированная хирургическая тактика лечения. В основе лечения нейропатической инфицированной стопы придерживались ряда принципиальных позиций: иммобилизация или разгрузка поражённой конечности с возможным применением ортопедических средств коррекции, компенсация СД, хирургическое лечение гнойно-некротического очага с последующим пластическим закрытием раневого дефекта, рациональная антибиотикотерапия.
При ишемической форме тактика лечения строилась в соответствии с характером поражения сосудов и с объемом гнойно-некротического поражения стопы. Отсутствие магистрального кровотока, вследствие окклюзии бедренной или подколенной артерии на фоне сахарного диабета приводит, как правило, к развитию влажной гангрены стопы с присоединением интоксикации, декомпенсацией диабета и угрозой для жизни больного. Нами, как и большинством авторов (Ким О.А., Иванов С.В., Крагин Ф.С., 1996; Оганесян С.С., Джаладян В.С., 1996; Чур Н.Н. с соавт., 2003) такое состояние расценивается как бесспорное показание для высокой ампутации конечности. При сохранении магистрального кровотока выполнялись органосохраняющие операции: некрэктомии, ампутации пальцев, резекции стопы.
Особенностью хирургического лечения гнойно-некротических поражений стопы являлось широкое раскрытие гнойного очага с его санацией, ампутация пальцев или сегментов стопы с последующим пластическим закрытием раны на дренажно-промывной системе, с применением внутрикожного шва из рассасывающихся полимерных шовных материалов.
Хирургическое лечение, включающее только одноэтапную хирургическую обработку, выполнено у 32 (78%) больных основной группы, и у 54 (80,6%) контрольной группы (таблица 3).
Таблица 3
Варианты одноэтапного хирургического лечения
| Тип операции | Основная группа | Контрольная группа | ||
| | Кол-во больных (n=32) | % | Кол-во больных (n=54) | % |
| Некрэктомия в пределах мягких тканей стопы | 6 | 18,75 | 7 | 12,96 |
| Экзартикуляция пальцев и/или резекция плюсневых костей | 12 | 37,5 | 14 | 25,92 |
| Ампутация, экзартикуляция пальца, пальцев | 6 | 18,75 | 18 | 33,3 |
| Трансметатарзальная резекция или резекция на уровне сустава Лисфранка, Шопара | 8 | 25 | 15 | 27,7 |
У 22 (20,4%) больных закрытие раневого дефекта после радикальной хирургической обработки выполнялось только после полного очищения раны, поскольку имелись противопоказания для первичной пластики послеоперационной раны. Свободная аутодермопластика на стопе выполнена 10 (9,3%) больным, пластика ротированными кожно-фасциальными лоскутами - 5 (4,6%), закрытие раны вторичными швами у 7 (6,5%) пациентов.
В основной группе у 9 (21,9%) больных закрытие раневого дефекта выполнялось только после полного очищения раны. В контрольной группе, отсроченная кожная пластика выполнена у 13 (19,4%) больных.
Операции на стопе проводили на уровне жизнеспособных тканей, сохранивших кровоток, при условии возможности закрытия образовавшегося дефекта стопы кожным лоскутом. Первичная пластика полнослойным кожным лоскутом на дренажно-промывной системе, позволяла одновременно ликвидировать гнойный очаг и создавало условия для заживления раны.
В настоящее время при ампутациях нижних конечностей у больных с синдромом диабетической стопы мягкие ткани соединяются наложением классического чрескожного узлового шва. Однако в условиях диабетической ангиопатии и нейропатии, а также при наличии гнойно-некротических процессов в дистальных участках конечностей, после ушивания кожной раны чрескожными узловыми швами часто возникают краевые некрозы, которые долго не заживая, становятся причиной возникновения раневой инфекции. Узловые швы ведут к образованию странгуляционных борозд в краях раны, изъязвлению, прорезыванию краев раны.
Нами разработан способ ушивания кожной раны при операциях у больных с СДС. После завершения ампутации нижней конечности на любом уровне соединение краев кожной раны осуществляем следующим образом: атравматической иглой с синтетической абсорбируемой нитью на основе полигликолидов накладываем внутрикожный непрерывный шов, в который захватываем только глубокие слои дермы с каждой стороны кожной раны, протягивая нить сближаем края раны. При таком захвате дермы, как правило, не возникает местного нарушения кровообращения, а механическая прочность дермы позволяет удерживать края раны в полном соприкосновении до полного заживления. После купирования воспалительного процесса в ране, нити не удаляли, а остающийся в ране шовный материал в последующем подвергался биодеградации.
Применение внутрикожного шва с использованием рассасывающегося полимерного материала давало возможность хорошо адаптировать края раны и оптимизировать условия ее регенерации.
Видовой состав возбудителей хирургической инфекции у больных гнойно-некротическими формами СДС до лечения характеризовался достаточным разнообразием. Среди патогенов преобладали грамположительные микроорганизмы, которые были представлены преимущественно стафилококками: St. aureus – 58,5%, другие (коагулазонегативные) стафилококки (St.saprophyticus, St. epidermidis, St. hominis, St. warneri) – 40,4%. Среди грамотрицательных бактерий преобладали неферментирующие бактерии (Pseudomonas aeruginosa), которые выявлены у 35 (37,2%) пациентов. Представители кишечной группы (Escherichia coli, Proteus) стали причиной гнойного процесса на стопе у 22 (23,4%). Стрептококки выявлены у 17(18,1%) больных. У 30 (31,9 %) больных встречались сочетания двух, а у 14 (14,9 %) больных сочетание трех возбудителей, в основном энтеробактерий и стафилококков.
Закрытое ведение раны у больных обеих групп предупреждало вторичное инфицирование, а в ряде случаев при повторных посевах микрофлора не высевалась (таблица 4).
Таблица 4
Видовой состав возбудителей хирургической инфекции у больных с гнойно-некротическим формами СДС на 5-7 сутки лечения в группах сравнения
| Вид возбудителя | Основная группа (n =36) | Контрольная группа (n = 58) |
| St. aureus | 4 (11,1 %) | 6 (10,3 %) |
| Pseudomonas aeruginosa | 2 (5,5 %) | 4 (6,9 %) |
| St.saprophyticus | 3 (8,3 %) | 4 (6,9 %) |
| St. epidermidis | - | 2 (3,4 %) |
| Str. pyogenus | - | 1 (1,7%) |
| Escherichia coli | 1 (2,7%) | 2 (3,4 %) |
| St. hominis | - | 1 (1,7%) |
| Посев роста не дал | 26(72,2%) | 38(65,5%) |
Как видно из таблицы, в исследуемых группах, в ранах ушитых на дренажно-промывной системе при определении видового состава возбудителей у 64 (68%) больных посев роста не дал. В этих случаях, при повторных посевах раневого отделяемого, микрофлора не высевалась. Закрытое ведение раны с применением споробактерина позволило в 72,2 % случаев элиминировать патогенную флору в послеоперационной ране. В контрольной же группе больных с традиционной терапией антибиотиками посев роста не дал в 65,5%.
До настоящего времени, в доступной нам литературе мы не встретили данных об исследовании качественного и количественного состава микрофлоры кишечника и её влиянии на частоту возникновения и развития хирургической инфекции при синдроме диабетической стопы.
Анализ результатов качественного и количественного состава микрофлоры кишечника у больных с гнойно-некротическими формами диабетической стопы до операции показал, что нарушение нормального состава микрофлоры различной степени выявлено у 93 (86,1%). Дисбактериоз I степени был выявлен у 25 (23,1%) пациентов, II у 36 (33,3%), III у 32 (29,6%). (Табл. 5).
Они затрагивали как аэробный, так и анаэробный компонент кишечного биоценоза. Наиболее часто выявлялось значительное уменьшение количества основных бактериальных симбионтов облигатной флоры - бифидобактерий. Нормальное количество бифидобактерий (108-1010 колониеобразующих единиц (КОЕ) в г) выявлено лишь у 30 (27,8%) из наблюдаемых больных. Снижение их числа до 105 - 107 КОЕ/г было у 42 (38,9%) пациентов. У 36 (33,3%) больных зарегистрировано еще большее угнетение бифидофлоры.
Таблица 5.
Количественный и качественный состав микрофлоры толстого кишечника у больных с диабетической стопой (до лечения)
| Удельное содержание микроорганизмов lg КОЕ/г фекалий (M±m) | |||||||||
| Bifidobacterium | Escherichia coli | | St. aureus | Proteus | Candida spp. | Общ. кол-во УПМ | |||
| общее кол-во | лактозопозит. | лактозонегат. | Гемо лит. | Lactobacillus | |||||
| 5,5± 0,5 | 8,39± 0,1 | 8,09± 0,5 | 7,09± 0,36 | 6,86± 0,9 | 6,25± 0,7 | 6,72± 0,5 | 5,25± 0,17 | 5,20± 0,3 | 6,77± 0,54 |
| n=108 | n=108 | n=98 | n=25 | n=43 | n=108 | n=13 | n=14 | n=5 | n=51 |
УПМ – условно-патогенные микроорганизмы
В анализах кала у 76 (70,4%) человек отмечен дефицит лактозопозитивнных эшерихий (менее чем 107 КОЕ/г), у 91 (84,3%) - лактобацилл (менее чем 107 КОЕ/г). У 43 (39,8%) пациентов выявлены эшерихии с гемолитической активностью с довольно высоким удельным содержанием вплоть до 107 в грамме. У 25 (23,1%) больных были обнаружены лактозонегативные эшерихии в количестве 105 и более колониеобразующих единиц (КОЕ) в грамме.
ТаблВ связи с дефицитом облигатной микрофлоры отмечалось увеличение числа условно-патогенных микроорганизмов. Наиболее часто обнаруживались Staphylococcus aureus, в том числе в разведениях 105-107 у 13 (12%) человек.
Патологическая колонизация толстого кишечника протеем до начала лечения отмечена у 14 (13%). У 5(4,6%) больных содержание грибов рода Candida были выше, чем 104 КОЕ в грамме. Количественный дефицит наиболее важных представителей нормального биоценоза кишечника приводило к увеличению количества ассоциаций условно-патогенных микроорганизмов.
Обращала на себя внимание изменение состояния микробиоценоза кишечника от вида и глубины поражения гнойно-некротическим процессом у больных с СДС (табл. 6). С гангреной части стопы (IV стадии по Wagner) обследовано 33 пациентов, остеомиелитом костей стопы (III ст.) -29, флегмоной стопы (II-III ст.) – 21, гнойно-некротической раной стопы (II ст.) 25 больных.
У 15 (13,9%) пациентов с сухой гангреной (6 человек), гнойно-некротической раной (8 человек) и остеомиелитом костей стопы (1 больной), признаков нарушения микрофлоры кишечника не выявлено.
Таблица 6
Частота дисбактериоза кишечника при различных видах поражения СДС
-
Вид поражения СДС(стадии по Wagner)
Степень дисбактериоза
I (n - 25)
II (n -36)
III (n - 32)
Сухая гангрена
(IV ст.) n =16
3(18,8%)
7(43,8%)
6(37,5%)
Влажная гангрена (IV ст.) n =11
1(9%)
4(36,4%)
6(54,5%)
Флегмона стопы
(II-III ст.) n =21
4(19,1%)
8(38,1%)
9(42,9%)
Гнойно-некротическая рана (II ст.) n =17
8(28,6%)
4(14,3%)
5(31%)
Остеомиелит костей стопы (III ст.) n =28
9(31%)
13(27,6%)
6(20,7%)
Всего n =93
25(26,9%)
36(38,7%)
32(34,4%)
Основываясь на проведенных клинических и экспериментальных исследованиях (Никитенко В.И., 1985, 1990; Жигайлов А.В., 1996; Третьяков А.А., 1998; Есипов В.К.. 1999; Тарасенко В.С., 2000; Кудашев С.Г., 2002; Симоненко Е.В., 2002; Копылов В.А., 2005; Хотян А.Р., 2006) мы полагаем, что развитие дисбактериоза кишечника у больных с гнойно-некротическими формами диабетической стопы обусловлено нарушением механизмов колонизационной резистентности под влиянием многих факторов. Основными, из которых являются: развитие инфекционного процесса на фоне сахарного диабета, стрессы, операция, проведение нерациональной антибиотикотерапии, нарушение иммунного статуса. В условиях нарушенного баланса кишечной флоры, повышенной проницаемости слизистой оболочки кишечника, иммуннодефицитного состояния возрастает уровень бактериальной транслокации (Spath G., 1994; Berg R.,1993; Шендеров Б.А., 1997).
Для определения лечебной эффективности споробактерина при гнойно-некротической форме диабетической стопы результаты лечения сравнивались у двух групп больных – комплексная послеоперационная терапия у 41 больного (основная группа) дополнена применением жидкого споробактерина. В контрольной группе (67) больных проводилась традиционная (антибактериальная) комплексная терапия.
У больных, с СДС в лечении которых применялся споробактерин, отмечалось более раннее купирование эндогенной интоксикации. У пациентов основной группы средний срок нормализации лейкоцитарной формулы составил 2,10±0,17 дня, в контрольной 2,67±0,22 дня (р<0,05). Средние сроки нормализации температуры у больных основной группы составили 2,12±0,2 дня, против 2,84±0,25 дня в контрольной (р<0,05). (таблица 7).
При анализе клинических признаков воспаления в ранах, ушитых наглухо нами установлено, что у пациентов, получавших споробактерин, происходит достоверно более быстрое купирование отека (к 2,3±1,1 суткам по сравнению с 4±0,9 сутками в контроле) и исчезновение инфильтрации краев раны (к 3,3±1,8 суткам по сравнению с 5,3±1,9 сутками в контроле).
Таблица 7.
Данные клинических показателей течения послеоперационного периода в исследуемых группах (М±m)
| Группы наблюдения Клинический признак (сутки) | Основная группа | Контрольная группа |
| Срок нормализации вечерней t˚ тела | 2,12±0,2* | 2,84±0,25 |
| Срок нормализации лейкоцитоза | 2,10±0,17* | 2,67±0,22 |
| Купирование отёка стопы | 2,3±1,1* | 4±0,9 |
| Купирование инфильтрации краёв послеоперационной раны | 3,3±1,8* | 5,3±1,9 |
Примечание: * разница существенная и достоверная (р≤0,05).
Раневой процесс в тканях стопы до операции развертывался преимущественно по некротическому и дегенеративно-воспалительному типам (рис. 2). Цитологическое исследование отпечатков ран показало, что при поступлении в стационар у 23-26% пациентов цитология раневого процесса носила дегенеративно-воспалительный характер; у 52-59% больных отмечен некротический тип цитограмм; у 18-22% больных цитология раневого процесса соответствовала воспалительному типу.
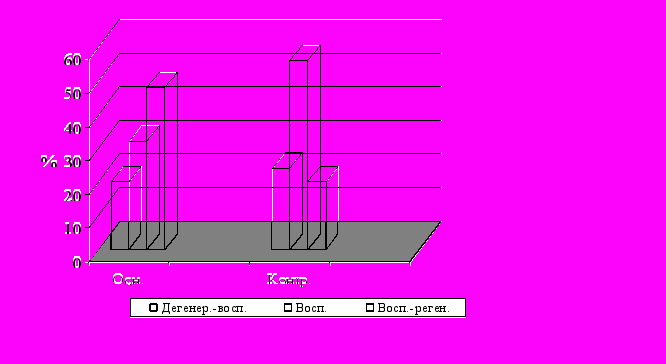
После радикальной хирургической обработки ран и первичной пластики на ДПС, у больных на 5 сутки наблюдения (рис. 3) послеоперационной раны воспалительная цитологическая картина выявлена в 32% цитограмм основной группы, а в контрольной группе в 56%. Воспалительно-регенераторные типы цитограмм определялись в 48% основной группы, и в два раза меньше в контрольной, что свидетельствовало о незавершенности периода очищения на данном этапе. На 10 сутки после операции (рис. 4) в основной группе у 85% больных цитограммы соответствовали регенераторному типу, и лишь у 64% больных контрольной группы отмечен регенераторный тип цитограмм.
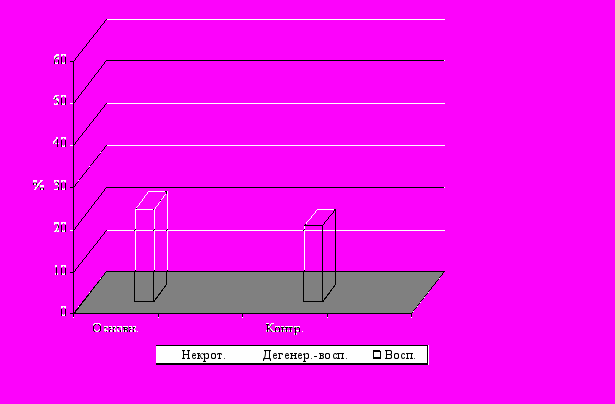
Рис.2
Цитологическая картина гнойных ран (n = 30) при поступлении (% типов цитограмм)