Высшее профессиональное образование т. Я. Дубнищева концепции современного естествознания
| Вид материала | Документы |
- Учебно-методический комплекс концепции современного естествознания высшее профессиональное, 2306.3kb.
- Учебно-методический комплекс концепции современного естествознания высшее профессиональное, 2307.28kb.
- С. Г. Хорошавина концепции современного естествознания курс лекций, 6750.33kb.
- С. Г. Хорошавина концепции современного естествознания курс лекций, 5892.74kb.
- В. М. Найдыш Концепции современного естествознания, 8133.34kb.
- Учебно-методический комплекс дисциплины концепции современного естествознания Специальность, 187.08kb.
- Концепции Современного Естествознания, 274.86kb.
- Программа курса «Концепции современного естествознания», 168.05kb.
- Программа дисциплины Концепции современного естествознания Специальность/направление, 456.85kb.
- Бюллетень новых поступлений в нб согу за период с 05. 2011 по 10. 2011гг, 975.89kb.
В современную эпоху вся вода на Земле образует водную оболочку — гидросферу. Значение воды как мощного фактора, преобразующего планету, изучено достаточно хорошо. Действие воды на поверхности и в глубинах Земли связано с ее свойствами. Вода может находиться в трех агрегатных состояниях и способна растворять в себе многие вещества.
Природная вода содержит различные вещества разных концентраций. Так, самая чистая дождевая вода содержит растворенных веществ в количестве около 50 мг/л. Масса воды на Земле составляет всего около 0,025 % общей массы Земли. Она содержится в атмосфере в виде паров, составляет океаны, моря и континентальные воды, образует подземные воды в толщах осадочных пород. Большая часть воды сосредоточена в Мировом океане (до 86,5 %). Средняя глубина океана 3,8 км, общая масса воды в нем 1420 • 1018 кг. Океаническая вода содержит примерно 3,5 % растворенных веществ. Количество растворенного вещества в граммах, содержащегося в 1 кг морской воды, получило название солености океана.
Среди растворенных веществ (расположены по степени убывания количества вещества) есть катионы:
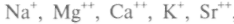 , анионы:
, анионы: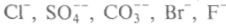 , соляная и серная кислоты. Другие элементы, содержащиеся в небольшом количестве, играют важную роль в химических процессах океана и в жизни морских организмов, например азот, фосфор, кремний, которые усваиваются морскими растениями и животными. В морской воде растворены также кислород, азот, сероводород, углекислота, которые тесно связаны с атмосферой и живыми объектами моря. Среди них первое место по концентрации занимает углекислота, которая присутствует в разных формах, образуя карбонатную систему динамического равновесия. В Мировом океане ее в 60 раз больше, чем в атмосфере. С карбонатной системой связаны ионы кальция и весь комплекс растворенных веществ. Верхней границей гидросферы является поверхность открытых водоемов, а нижняя находится в глубинах Земли, в слоях с температурой порядка 374 °С.
, соляная и серная кислоты. Другие элементы, содержащиеся в небольшом количестве, играют важную роль в химических процессах океана и в жизни морских организмов, например азот, фосфор, кремний, которые усваиваются морскими растениями и животными. В морской воде растворены также кислород, азот, сероводород, углекислота, которые тесно связаны с атмосферой и живыми объектами моря. Среди них первое место по концентрации занимает углекислота, которая присутствует в разных формах, образуя карбонатную систему динамического равновесия. В Мировом океане ее в 60 раз больше, чем в атмосфере. С карбонатной системой связаны ионы кальция и весь комплекс растворенных веществ. Верхней границей гидросферы является поверхность открытых водоемов, а нижняя находится в глубинах Земли, в слоях с температурой порядка 374 °С.Воду еще с древних времен рассматривали как основу жизни. У Аристотеля она входила в число четырех неуничтожимых элементов, или «начал», и ее соединение с другими «началами» —
291
 землей, огнем и воздухом — порождало все многообразие мира. Г. Ка-вендиш и А. Лавуазье открыли свойства воды (1783). Кавендиш, исследуя свойства кислорода (недавно открытого), смешивал в лаборатории одну часть этого «воздуха» с двумя частями «горючего воздуха» (водорода) и пропускал через эту смесь электрический ток. Смесь вспыхивала, а на стенках колбы появлялись капельки жидкости — обычной воды. Лавуазье провел серию таких опытов, показавших, что вода не является элементом. Через пару лет ему удалось установить, что вода образуется из одной весовой части водорода и 6,5 частей кислорода (позже Гей-Люссак и Гумбольдт уточнили соотношение — 1:8). Так узнали, что вода — это Н20, и вслед за Лавуазье стали называть «горючий воздух» водородом. К XIX в. свойство воды быть элементом трансформировалось в свойство быть растворителем и важнейшим компонентом объектов живой и неживой природы. Изучение молекулярной структуры веществ привело к пониманию исключительной способности молекул воды образовывать связи с частицами почти всех веществ. Вода — это простейшее соединение водорода с кислородом, по массе вода состоит из 11,19 % водорода и 8,81 % кислорода. Вследствие существования трех изотопов водорода и шести изотопов кислорода существует 36 изотопных разновидностей воды.
землей, огнем и воздухом — порождало все многообразие мира. Г. Ка-вендиш и А. Лавуазье открыли свойства воды (1783). Кавендиш, исследуя свойства кислорода (недавно открытого), смешивал в лаборатории одну часть этого «воздуха» с двумя частями «горючего воздуха» (водорода) и пропускал через эту смесь электрический ток. Смесь вспыхивала, а на стенках колбы появлялись капельки жидкости — обычной воды. Лавуазье провел серию таких опытов, показавших, что вода не является элементом. Через пару лет ему удалось установить, что вода образуется из одной весовой части водорода и 6,5 частей кислорода (позже Гей-Люссак и Гумбольдт уточнили соотношение — 1:8). Так узнали, что вода — это Н20, и вслед за Лавуазье стали называть «горючий воздух» водородом. К XIX в. свойство воды быть элементом трансформировалось в свойство быть растворителем и важнейшим компонентом объектов живой и неживой природы. Изучение молекулярной структуры веществ привело к пониманию исключительной способности молекул воды образовывать связи с частицами почти всех веществ. Вода — это простейшее соединение водорода с кислородом, по массе вода состоит из 11,19 % водорода и 8,81 % кислорода. Вследствие существования трех изотопов водорода и шести изотопов кислорода существует 36 изотопных разновидностей воды.Физические свойства воды совершенно аномальны. Самое удивительное из них — это способность ее при нормальных условиях быть жидкостью. Молекулы похожих на нее химических соединений (H2S или H2Se) намного тяжелее воды, но при этих условиях газообразны. Свойства гидридов (водородных соединений элементов), расположенных в тех же вертикальных столбцах таблицы Менделеева, должны меняться монотонно с ростом атомной массы. В шестой группе помимо кислорода находятся сера, селен, теллур, полоний, атомные массы кото растут: 32, 78, 127, 209 соответственно. При переходе от тяже элементов к легким свойства растут монотонно лишь для первых четырех. Так, температуры кипения и плавления снижаются линейно, т.е. область жидкой фазы гидридов становится все более холодной. И если бы для воды эта зависимость сохранилась, она была бы жидкой лишь в диапазоне от -80 до -95 °С, а при более высоких температурах была бы газом. Конечно, это свойство, как и другие, очень важно для всей биосферы. Кроме того, совершенно аномален сам диапазон существования воды в жидкой фазе — 100 °С.
Тройная точка воды, т.е. равновесие воды, льда и пара, наблюдается при температуре 0,01 °С и давлении 611 Па (рис. 8.1). Переохлажденная вода, т. е. остающаяся в жидком состоянии ниже 0°С, ведет себя странно: с одной стороны, плотность ее уменьшается при понижении температуры, с другой — приближается к
292
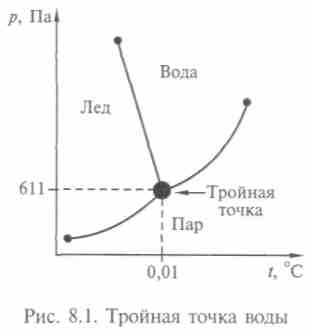
плотности льда. Переохлажденную воду получают в тонких капиллярах или в масляной эмульсии. Необычайно велики пределы допустимых значений переохлаждения и перегрева воды: можно продержать ее в жидком состоянии при температуре от -40 до +200 °С.
В отличие от большинства других жидкостей при повышении температуры ее удельный объем уменьшается, а плотность увеличивается, достигая минимума (соответственно максимума) при 4 °С. В обычных жидкостях плотность всегда уменьшается с уменьшением температуры. Получается, что с ростом температуры растет средняя тепловая скорость молекул воды, они сильнее расталкивают друг друга, но в воде при этом плотность растет, а не уменьшается. При замерзании объем воды увеличивается до 10 %. Плотность воды больше плотности льда. При плавлении кристаллов, когда регулярность упаковки ионов нарушается, плотность уменьшается на 2—4 %. Это свойство воды предохраняет водоемы от сплошного промерзания, спасая в них жизнь. Лед — плохой проводник теплоты.
Очень высока теплоемкость воды — при плавлении льда она увеличивается более чем вдвое. Поэтому моря и океаны являются гигантскими термостатами, сглаживая все колебания температуры воздуха. Кстати, эти же функции может выполнять и водяной пар в атмосфере. Отсутствие водяного пара в пустынях приводит к резким колебаниям ночной и дневной температур. В отличие от обычных жидкостей с ростом температуры в интервале от 0 до 150 °С теплопроводность воды растет, а вязкость уменьшается. При плавлении льда теплоемкость испытывает скачок от 37,8 до 75,6 Дж/(моль • К), т.е. в 2 раза. Значит, нужно больше затратить теплоты для поднятия температуры воды на 1 К. Этот скачок теплоемкости после плавления означает, что в воде появились очень энергоемкие процессы, на которые нужно истратить подводимую теплоту. И эти процессы сохраняются, пока вода находится в жидком состоянии. У переохлажденной воды эта аномалия теплоемкости еще больше.
Электропроводность воды зависит от примесей, но даже в очищенной воде она не нулевая. Это связано с частичной диссоциацией ее на ионы
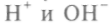 . Диэлектрическая постоянная воды также аномальна — достигает 81 (у других жидкостей — менее 10). В переменных электрических полях она начинает зависеть не только от частоты приложенного поля, сильно уменьшаясь для высо-
. Диэлектрическая постоянная воды также аномальна — достигает 81 (у других жидкостей — менее 10). В переменных электрических полях она начинает зависеть не только от частоты приложенного поля, сильно уменьшаясь для высо-293
 кочастотных полей, но и от пространственных колебаний полей. Аномальна вода и в отношении распространения в ней звука. Под действием жесткого излучения вода распадается на свободные радикалы
кочастотных полей, но и от пространственных колебаний полей. Аномальна вода и в отношении распространения в ней звука. Под действием жесткого излучения вода распадается на свободные радикалы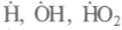 , при этом образуются водород и перекись
, при этом образуются водород и перекисьводорода. Обычно с ростом температуры растет сжимаемость жидкостей (степень уменьшения объема с ростом давления), но так вода себя ведет только при высоких температурах. При низких температурах вода ведет себя совсем иначе — при температуре 45 °С сжимаемость имеет минимум. Такие явления обычно свидетельствуют о наличии противоположных процессов — обычного и аномального.
Аномальность свойств воды связана со строением ее молекул и структуры в разных агрегатных состояниях. Сравнение с родственными воде жидкостями — гидридами шестой группы — показывает, что вода выпадает из плавной зависимости температур кипения и плавления этих жидкостей. Если бы она была обычной жидкостью, то кипела бы при -76 °С, а замерзала бы при -100 °С.
294
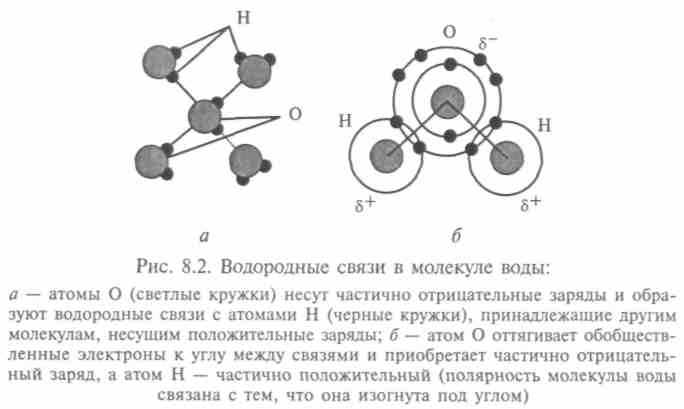
Главное отличие воды — в водородных связях (рис. 8.2), обусловленных квантово-механическими особенностями взаимодействия протона с атомами — способностью его к туннелированию. Хорошая модель молекулы воды — правильный тетраэдр. Ядра в молекуле Н2O образуют равнобедренный треугольник с двумя протонами в основании и кислородом в вершине. Угол НОН равен 105°, расстояние О—Н равно 0,957 • 10-8 м, а Н—Н только 1,54 • 10-8 м. Эту конструкцию окружает электронное облако, причем во льду каждая молекула связана четырьмя водородными связями с ближайшими молекулами. В этом состоянии расстояние между

молекулами равно 2,76 • 10-8 м. Поэтому можно считать, что радиус молекулы воды порядка 1,38 • 10-8 м, т.е. ее дипольный момент равен 1,5 • 10-29 Кл • м. Так что связь сильно направлена, и пространственная организация атомов имеет четкую структуру. Примерно такая же упорядоченность сохраняется и при плавлении льда, и расстояние между молекулами не более 2,9 • 10-8 м. Отсюда некоторая рыхлость структуры, которая и вызывает часть аномалий в свойствах воды. Рост температуры вызывает аномальную плотность, рост давления, разрушающий связи между молекулами, — аномальную вязкость. Кооперативность — другое важное свойство водородной связи. Оно означает, что образование одной водородной связи дает возможность образования следующей и т.д. Это происходит из-за того, что две молекулы Н2O, образуя водородную связь, вступают в щелочно-кислотное взаимодействие: одна молекула становится более кислой, а другая — более щелочной (рис. 8.3). Поэтому для образования последовательности водородных связей требуется уже меньше энергии. К образованию водородных связей способны и другие молекулы, например HF или NH3. Но эти и другие вещества не обладают уникальным спектром, в котором отражаются особенности водородной связи воды. При образовании молекулы воды остаются два неспаренных (кислородных) электрона, которые играют решающую роль при образовании молекулярной структуры воды. Конфигурация молекулы такова, что возможны пять валентных структур. Чисто электростатическому взаимодействию соответствуют три структуры, дающие энергию 14,4 Дж/моль. В суммарную энергию водородной связи входит и энергия дело-кализации заряда, связанная с понижением энергии по отношению к структуре 1, вызванной гибритизацией с четырьмя другими структурами (эта энергия равна 33,6 Дж/моль). Дисперсионное взаимодействие также вносит вклад порядка 7,2 Дж/моль. Итог: 20,4 Дж/моль, что близко к экстремальному значению. Таким образом, электронная структура молекулы воды определяет условия объединения отдельных молекул в сложную трехмерную конструкцию. Это делает ее идеальным (и даже единственным) матери-
295
 алом для построения разветвленной сети водородных связей. Такая структура наиболее совершенна во льду.
алом для построения разветвленной сети водородных связей. Такая структура наиболее совершенна во льду.Комплекс молекул воды (Н20)2 (димера) существует в водяном пару (в свободном виде), в жидкой воде и во льду. Но, как установил Л. Полинг, лед не является кристаллом с полной упорядоченностью даже при О К. Структура льда достаточно рыхлая: каждая полость окружена шестью молекулами Н20, а каждая молекула — шестью полостями. Размер этих полостей таков, что в них может разместиться одна молекула, не нарушая каркаса водородных связей. Еще в начале XX в. У. Брэгг методом рентгено-структурного анализа показал, что во льду каждая молекула окружена четырьмя другими молекулами, но расположение атомов водорода этим методом не устанавливалось. Это удалось уловить лишь спектроскопическими исследованиями его ученику Берналу. Оказалось, что каждый атом кислорода связан с четырьмя атомами водорода, которые находятся на линии О—О, при этом со «своими» атомами — прочной ковалентной связью, а с «чужими» — водородной, но ни один из них не фиксирован на месте. Он «знает» только свою связь О—О, но может на этой линии занимать два положения (около «своего» и «чужого») и примерно одинаковое время. Расстояние между каждой парой О—О сохраняется неизменным и равным 2,76 • 10-10 м. Поэтому в присутствии внешнего электрического поля «перескоки» атомов водорода становятся более направленными и лед обладает высокой электропроводностью.
Структуру белков нельзя постичь, если не изучить структуру воды — среды, где они образуются. Поскольку в отсутствие молекулярной структуры плотность жидкой воды должна быть порядка 1,8 г/см3, а она равна 1 г/см3, то должна быть в ней структура, мешающая плотной упаковке. Впоследствии установили, что каждую молекулу воды в жидком состоянии окружают не 6, а 4,4 молекулы (так называемое координационное число, у льда оно равно 4). Значит, при таянии число соседей средней молекулы возрастает всего на 0,4. Концентрация дефектов структуры во льду относительно невелика (1/2,5 млн молекул), а в воде она возрастает в 25 тысяч раз (1/200 молекул). Попытка описывать воду как лед с большим числом дефектов оказалась несостоятельной.
Направленность водородных связей проявляется в необычности воды, образующейся при плавлении льда. Оказалось, они рвутся сразу, а не постепенно, как у других кристаллов, когда молекулы накапливают энергию, переходя из одной энергетической ямы в другую. Во льду лишь отдельные молекулы вырываются из структуры, сразу оказываясь без водородных связей на другом энергетическом уровне. Хотя между уровнями происходит обмен, по мере роста температуры все меньше молекул возвращается назад. По данным Л.Полинга, при 0°С лишь 15% водородных связей оказываются разорванными, т. е. в жидкой воде сохраняется гек-
296
сагональная структура. Даже в газообразном состоянии водородные связи сохраняются, исчезая лишь при температуре 600 °С. Заполнение пустот молекулярной конструкции льда при плавлении, как показал в 60-е гг. О. Самойлов, ведет к увеличению плотности. При нагревании пустоты заполняются больше и плотность растет. Но при нагревании идет еще и термическое расширение воды. В интервале температур от 0 до 4 °С преобладает процесс заполнения пустот, при более высоких температурах начинается расширение и плотность падает. Этим объясняются способность воды к переохлаждению и перегреву, высокая теплоемкость и др.
Водородные связи в биосистемах ведут к необычным электростатическим явлениям — в соседних точках флуктуации поляризации становятся коррелированными. Если период приложенного переменного электрического поля сравним с длиной водородных связей (около 3 • 10-10 м), то две соседние молекулы могут оказаться в противоположно направленных полях и диполи этих молекул будут стремиться развернуться в разные стороны. Но они связаны водородной связью, и это им может не удаться. И диэлектрическая проницаемость воды в таком поле зависит лишь от атомно-молекулярных механизмов перераспределения заряда. Эти механизмы определяют процессы возбуждения и передачи нервного импульса, слияния клеток и пр., ведь все эти процессы в живой природе происходят через водную прослойку электролитов.
Протон может находиться как около «своего» атома кислорода (на расстоянии порядка 10-10 м), так и вблизи «чужого» (на расстоянии от «своего» около 1,7-10-10 м), т.е. наряду с обычным димером НО — Н...ОН2 оказывается нестабильной ионная пара НО... Н — ОН2. В этом случае возрастает дипольный момент молекулы до 8 • 10-29 Кл • м. Последнее состояние имеет место для границы раздела фаз, возможно, в этом состоянии находится вода вокруг клеточных мембран живых организмов. Можно сказать, что вода «помнит» свое происхождение, тогда как другие жидкости не обладают этой способностью.
Химические свойства воды связаны с полярностью молекулы и строением ее электронной оболочки. Вода легко вступает в химические соединения, образуя гидроокиси. Щелочные и щелочноземельные металлы разлагают воду при обычной температуре — образуются водород и гидроокись. При повышенной температуре со всеми металлами происходит такая же реакция. Взаимодействие с водой ведет к коррозии металлов. В воде растворяется гораздо больше веществ, чем в любой другой жидкости. Молекулы растворяемого вещества отделяются друг от друга и смешиваются с молекулами растворителя. Из-за своей полярной природы вода растворяет ионные вещества и другие полярные соединения. А соединения, не имеющие заряда, в воде не растворяются,
297

 между ними образуется поверхность раздела. Это обстоятельство очень важно для процессов внутри живых структур. Распадение вещества на ионы при растворении называется диссоциацией.
между ними образуется поверхность раздела. Это обстоятельство очень важно для процессов внутри живых структур. Распадение вещества на ионы при растворении называется диссоциацией.Вещество является кислотой, если оно диссоциирует в воде с образованием ионов водорода, и основанием, если способно в растворе присоединять ионы водорода или образовывать гидро-ксилионы ОН. Если в растворе не образуется ни то, ни другое, вещество называют солью. Кислотность или щелочность раствора характеризуется показателем рН, шкала которого охватывает значения от 0 до 14. Эта шкала логарифмическая, т.е. на ней отложены логарифмы концентрации водородных ионов. Кислотность раствора с рН5 в 10 раз больше, чем с рН6, и в 100 раз больше, чем с рН7. Раствор с рН6 содержит одну миллионную моля ионов водорода на 1 л, нейтральной среде соответствует рН7, ниже идут более кислые среды, а выше — щелочные.
Уникальные свойства воды в живой материи связаны и с малыми размерами ее молекул, их полярностью (неравномерным распределением зарядов в молекуле — дипольностью воды) и способностью соединяться друг с другом водородными связями. Водородные связи слабее, чем ионные, но оказываются важными при свойствах воды как превосходного растворителя, особенно для полярных молекул. К таким веществам относятся ионные соединения, например соли, у которых заряженные частицы (ионы) диссоциируют в воде при растворении, или неионные соединения — сахара и простые спирты, в молекулах которых есть заряженные группы (типа ОН-группы).
Когда вещество переходит в раствор, его молекулы или ионы могут более свободно двигаться, и реакционная способность возрастает. Большая часть реакций в клетке идет в водном растворе. Такие гидрофильные свойства полярных молекул важны в обеспечении стабильности мембран, белковых молекул, нуклеиновых кислот и других субклеточных структур. Неполярные вещества, такие как липиды, с водой не смешиваются и разделяют водные растворы на отдельные компоненты, как их разделяют мембраны. Поэтому неполярные части молекул водой отталкиваются и в присутствии воды притягиваются друг к другу, или обладают гидрофобным эффектом, например, сливание капелек масла в большую каплю и нерастворение ее в воде. Свойство воды — растворителя важно для транспортировки по организму разных веществ (это происходит в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений).
Долгое время воду считали пассивной средой, обеспечивающей протекание важных биохимических процессов и реакций. В начале 60-х гг. Л. Полинг опубликовал свои исследования влияния анестетиков на прохождение сигналов болевой чувствительности. Анестетики — вещества, нарушающие прохождение этих сиг-
298
налов у высших животных: четыреххлористый углерод, закись азота («веселящий» газ), сероуглерод и даже инертные газы. Оказалось, что парциальное давление паров анестетика, соответствующее этому порогу, пропорционально давлению кристаллизации гидрата этого анестетика при нуле градусов. Значит, образование гидратов связано с основами жизнедеятельности, в данном случае с включением сигнала боли. Рентгеноструктур-ный анализ гидратов анестетиков показал, что их молекулы находятся в пустотах каркаса, построенного из молекул воды. Следовательно, они представляют собой механические «включения», а не соединения при помощи химических связей. Их назвали клатратами, или клеточными соединениями.
В 70-е гг. появились работы, выполненные под руководством академика А. Николаева, в которых сообщалось об обнаружении клатратов в жидком состоянии и исследовании фазовых переходов в них вблизи критической точки. Академиком Э. Галимовым была обнаружена универсальная закономерность, выполняющаяся на любом уровне организации биосистем. Процессы вблизи критической точки могут идти обратимым образом, а микроскопический механизм этой обратимости связан с замедлением диффузии вблизи критического состояния. Оказалось, что в этой области процессы происходят по нелинейным законам и критические флуктуации концентраций веществ являются самоподдерживающимися, включающими способность к самокопированию. Дальнейший анализ происходящих в воде процессов может найти практическое применение во многих областях — от медицины и наркологии до самовоспроизводящихся химических машин и автоматов футурологии.
