Высшее профессиональное образование т. Я. Дубнищева концепции современного естествознания
| Вид материала | Документы |
Содержание7.4. Строение веществ в разных агрегатных состояниях Твердые тела |
- Учебно-методический комплекс концепции современного естествознания высшее профессиональное, 2306.3kb.
- Учебно-методический комплекс концепции современного естествознания высшее профессиональное, 2307.28kb.
- С. Г. Хорошавина концепции современного естествознания курс лекций, 6750.33kb.
- С. Г. Хорошавина концепции современного естествознания курс лекций, 5892.74kb.
- В. М. Найдыш Концепции современного естествознания, 8133.34kb.
- Учебно-методический комплекс дисциплины концепции современного естествознания Специальность, 187.08kb.
- Концепции Современного Естествознания, 274.86kb.
- Программа курса «Концепции современного естествознания», 168.05kb.
- Программа дисциплины Концепции современного естествознания Специальность/направление, 456.85kb.
- Бюллетень новых поступлений в нб согу за период с 05. 2011 по 10. 2011гг, 975.89kb.
Наш мир состоит не из 105 элементов, а из огромного числа их соединений. Формулы и модели, построенные химиками, должны объяснять состав химических соединений и их свойства. Как отмечал историк науки Дж. Партингтон, «стремление иметь свой собственный набор формул явно рассматривалось как проявление независимости мышления каждого химика».
256
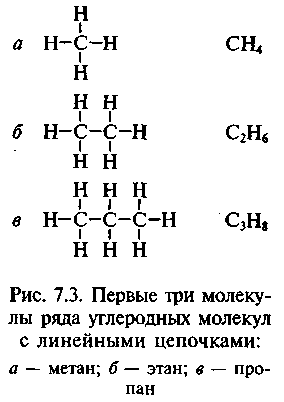
Так, Ф. Кекуле предложил для уксусной кислоты 19 формул — каждая формула объясняла одну реакцию (1861). Но здравый смысл подсказывал, что вещество должно иметь молекулы определенной формы. С позиции геометрии было только определенное количество возможностей построения некоторой модели молекулы, и ни одна из них не объясняла всех свойств веществ. Как только Кекуле предложил простую гексагональную схему для объяснения ароматических соединений, он столкнулся с проблемой локализации химических связей. Понимая, что четырехвалент-ность углерода ведет к тому, что каждый атом углерода имеет одну неза-действованную связь, он принял идею чередующихся одинарных и двойных связей (рис. 7.3, а). Но тогда могут быть получены два изомера (рис. 7.3, б): первый — с двойной связью между добавленными атомами хлора, второй — с одинарной. Но таких изомеров не существует ни с хлором, ни с другими добавленными группами. И в 1872 г. Кекуле предложил идею о том, что связи постоянно «изменяют положение между чередующимися секциями, как пара распахивающихся дверей» (рис. 7.3, в).
Кекуле не придавал большого значения своим формулам, используя их только в качестве символов для объяснения реакций. В то же время А.М.Бутлеров, напротив, считал, что каждому веществу должна отвечать своя формула с реальным, пусть и не определенным отношением к действительной структуре. Он писал: «Для каждого тела возможна будет в этом смысле одна рациональная формула, и когда сделаются известными общие законы зависимости химических свойств тел от их химического строения, то подобная формула будет отражением всех этих свойств».
Энергетическая неравноценность разных химических связей определяла в теории Бутлерова химическую активность веществ. В некотором роде он осуществил синтез представлений атомистики с непрерывностью химических отношений идеей, отвергнутой Ж.Прустом и Дж.Дальтоном. Появилась новая характеристика — непрерывность изменения энергии химических связей.
Теория Бутлерова называется теорией химического строения потому, что в ней химическая связь и химическая энергия — основа объединения атомов в молекулы. Валентность стала структурной характеристикой связанного атома. Так, водород при переходе из одного соединения в другое меняет свои при-
257
 знаки: в НС1 он предстает как катион, в Н—СН3 и Н—Н — как ковалентно связанный атом, а в Н—Na — как анион. Тогда реакционная способность отдельных фрагментов молекулы определяется энергией связи: для Н—СН3 Е = 412, Н—С (СН3)2 Е = 335, Н—С (С6Н5)з Е=67 кДж/моль. Теория Бутлерова установила порядок связей и стала действенным орудием органического синтеза. Были синтезированы многие лекарства, красители, взрывчатые вещества. Но в производстве использовалось дорогое органическое сырье, способы получения многих необходимых веществ не были понятны. Например, при выращивании кристаллов с определенными дефектами в решетке было непонятно, как избавиться от других дефектов.
знаки: в НС1 он предстает как катион, в Н—СН3 и Н—Н — как ковалентно связанный атом, а в Н—Na — как анион. Тогда реакционная способность отдельных фрагментов молекулы определяется энергией связи: для Н—СН3 Е = 412, Н—С (СН3)2 Е = 335, Н—С (С6Н5)з Е=67 кДж/моль. Теория Бутлерова установила порядок связей и стала действенным орудием органического синтеза. Были синтезированы многие лекарства, красители, взрывчатые вещества. Но в производстве использовалось дорогое органическое сырье, способы получения многих необходимых веществ не были понятны. Например, при выращивании кристаллов с определенными дефектами в решетке было непонятно, как избавиться от других дефектов.В понятие структуры вошло понятие энергетическая прочность химических связей. Понятие «свойство вещества» расчленилось на два: химические свойства макроскопического тела и реакционная способность отдельных структурных элементов, всей молекулы и всего вещества как совокупности молекул. Свойства вещества оказались зависящими не только от его состава, но и от структуры молекул. На основе учения о валентности была разработана теория строения молекул. Под молекулярной структурой понимают сочетание определенного числа атомов, закономерно расположенных в пространстве и связанных друг с другом посредством химической связи.
Вскоре были открыты оптические и геометрические изомеры органических соединений, которые можно объяснить только разным пространственным расположением молекул. В 1874 г. Я. Вант-Гофф и Бель выдвинули стройную концепцию, получившую название стереохимии. Они расширили теорию Бутлерова, описав изменения свойств вещества под влиянием таких факторов, как зеркальная изомерия, эффекты вращений вокруг какой-то связи и др. Вант-Гофф в книге «Химия в пространстве» высказал мысль о том, что четырехвалентный атом углерода в органических соединениях, расположенный в центре тетраэдра, в вершинах которого находятся связанные с углеродом атомы или атомные группы, является асимметрическим. Из анализа оптических свойств органических соединений он заключил, что любое соединение, вызывающее в растворе поворот плоскости поляризации, содержит атом углерода.
Изучением структур неорганических соединений занялся швейцарский химик А. Вернер и создал координационную теорию комплексных соединений. В «комплексах» вокруг центрального атома группируются в большом количестве атомы, радикалы и даже молекулы из-за возникновения так называемых вторичных валентностей. На основе его теории в наши дни объясняется химическое строение таких веществ, как гемоглобин, хлорофилл, ферменты, лаки. Он обнаружил предсказанные ранее оптически ак-
258
тивные неорганические изомеры — соединения железа, кобальта и хрома. Так оптическая активность перестала быть связанной только с атомами углерода.
Сразу же после открытия электрона начали предприниматься попытки связать его с природой химической связи. Немецкий физик Й. Штарк ввел понятие валентных электронов, связав валентность элемента с числом электронов на периферии атома.
Начало квантовой химии было положено работами Ф.Лондона и В.Гайтлрра (1927). Они уже говорили об электронном облаке, и вероятность нахождения электрона в какой-то области определяли как квадрат волновой функции. Первые расчеты молекулы водорода показали, что ковалентную связь образуют два электрона с антипараллельными спинами. При этом увеличивается электронная плотность между двумя атомами почти до 20 %, что приводит к уменьшению энергии системы и ее стабилизации. Поэтому пребывание двух таких электронов энергетически более выгодно, чем нахождение одного электрона в поле своего ядра. Так как у атома водорода только один неспаренный электрон, он функционирует как одновалентный элемент. У гелия в нормальном состоянии нет неспаренных электронов — два электрона находятся на одной орбитали. Поэтому возбуждение атома гелия требует больших затрат энергии — 1672 Дж/моль. Такие энергии в ходе обычных химических реакций не наблюдаются, и гелий ведет себя как инертный газ.
Для расчета достаточно сложных молекул американский физик и химик Л. Полинг в 30-е гг. XX в. усовершенствовал и применил метод атомных орбиталей. Его резонансная теория валентности — это попытка объяснить структуру таких молекул, как бензол. По этой теории связи между атомами углерода в молекуле бензола грубо могут описываться как дробные. Такое описание подтверждается данными электронной дифракции и инфракрасной спектроскопии: если расстояние между атомами углерода с одинарной связью равно 1,54 10-10 м, с двойной — 1,33 10-10 м, то измерение для связей бензола дает 1,40 • 10-10 м, т.е. промежуточное значение между измерениями для одинарной и двойной связи.
Полинг писал: «Мы можем сказать... что молекула не может быть удовлетворительно представлена любой отдельно взятой структурой валентной связи и оставить попытки связать ее структуру и свойства со структурой и свойствами других молекул... Но с помощью понятия резонанса мы можем дать объяснение свойствам молекулы, прямо и просто оперируя свойствами других молекул. Для нас удобно говорить о резонансе молекул среди нескольких электронных структур». Хотя теория резонанса не опирается концептуально на квантовую механику, но она применяется при расчете таких свойств молекул, как стабильность во время реакции. Уравнение Шредингера записывается для каждой из ре-
259

 зонансных структур, потом волновые функции объединяются линейно, но к каждому уравнению добавляется свой фактор, зависящий от того «влияния», которое каждая идеальная структура осуществляет. Наибольшую известность (и две Нобелевские премии) Полингу принесли расчеты атомной структуры молекул белков. Но трудности вычислений «заморозили» выполнение намеченной обширной программы химических исследований (точные расчеты были сделаны только для водорода, а остальные — на приближениях к водороду), и особого прогресса в развитии химии как науки до широкого использования ЭВМ не произошло.
зонансных структур, потом волновые функции объединяются линейно, но к каждому уравнению добавляется свой фактор, зависящий от того «влияния», которое каждая идеальная структура осуществляет. Наибольшую известность (и две Нобелевские премии) Полингу принесли расчеты атомной структуры молекул белков. Но трудности вычислений «заморозили» выполнение намеченной обширной программы химических исследований (точные расчеты были сделаны только для водорода, а остальные — на приближениях к водороду), и особого прогресса в развитии химии как науки до широкого использования ЭВМ не произошло.Исследовать молекулярные структуры с помощью рентгеновского излучения начали М.Лауэ, Г. и У.Брэгги, П.Дебая и др. Развивался рентгеноструктурный анализ, использовались дифракция рентгеновских лучей и электронов, спектроскопические методы и метод ядерного магнитного резонанса, что позволило определить строение огромного числа молекул. Это и повлияло на развитие методов молекулярной спектроскопии — для наблюдений стали использовать высокочувствительные спектрографы, а для обработки данных — быстродействующие ЭВМ. Наиболее ценным интеллектуальным достижением химии является точное установление молекулярных структур огромного числа веществ — от чистейшей воды и сложных бронзовых сплавов до белка родопсина в палочках сетчатки глаза человека.
Переход от структурной химии к учению о химических процессах — переход на еще более высокий уровень знаний, когда объекты изучаются более разносторонне. При обсуждении теории Бутлерова выяснилось, что связи не должны быть «жесткими». На усилении динамических факторов в понятии структуры настаивал известный химик Н. А. Меншуткин. Масс-спектроскопические и радиоспектроскопические методы дали информацию о динамических аспектах молекул, но не поколебали основных положений структурной химии. В 60-е гг. XX в. выяснилось, что часть систем, которые ранее интерпретировались как качественно отличные друг от друга изомеры, «можно описать как процессы миграции определенной группы атомов между атомными центрами в качественно неизменной молекуле» (Ю.Жданов, Л.Олехнович и В.Минкин). То, что валентность может быть не целочисленной, обнаружилось в новых соединениях, но введение координационного числа не прояснило ситуацию. Квантовая химия вместо валентности свободного атома ввела понятие спин-валентности — числа электронов с неспаренными спинами на внешних орбитах. Вместо подсчета целого числа связей атома с другими атомами рассчитывается сумма кратностей всех его связей, которая может быть и не целочисленной. Теория резонанса Полинга вызвала в свое время острые философские дискуссии. Можно считать, что она явилась удобной моделью: как и в случае с интерпретацией квантовой теории, модель резонансной структуры оказалась далекой от при-
260
вычных описаний природы и вызвала некоторое смущение части философов и естествоиспытателей проблемой использования моделей вообще.
Наличие или отсутствие связи между атомами изображают в виде графических или структурных формул. Появился термин «топология молекул». Как известно, топология — это раздел математики, который изучает свойства тел, не зависящие от их формы и размеров, или неметрические свойства. Молекулы же обладают как метрическими (длины химических связей, углы между ними и т.п.), так и неметрическими (могут быть циклическими и нециклическими, как бензол и н-бутан соответственно, и т.п.) свойствами. Топология молекулярных систем связана с их свойствами.
7.4. Строение веществ в разных агрегатных состояниях
Все вещества могут находиться в разных агрегатных состояниях — твердом, жидком, газообразном и плазменном. В древности считали: мир состоит из земли, воды, воздуха и огня. Агрегатные состояния веществ соответствуют этому наглядному разделению. Опыт показывает, что границы между агрегатными состояниями весьма условны. Газы при низких давлениях и невысоких температурах рассматриваются как идеальные, молекулы в них соответствуют материальным точкам, которые могут только сталкиваться по законам упругого удара. Силы взаимодействия между молекулами в момент удара пренебрежимо малы, сами соударения происходят без потерь механической энергии. Но с увеличением расстояния между молекулами приходится учитывать и взаимодействие молекул. Эти взаимодействия начинают сказываться при переходе из газообразного состояния в жидкое или твердое. Между молекулами могут возникнуть разного рода взаимодействия.
Силы межмолекулярного взаимодействия не обладают насыщаемостью, отличаясь от сил химического взаимодействия атомов, приводящего к образованию молекул. Они могут быть электростатическими при взаимодействии между заряженными частицами. Опыт показал, что квантово-механичес-кое взаимодействие, зависящее от расстояния и взаимной ориентации молекул, пренебрежимо мало при расстояниях между молекулами более 10-9 м. В разреженных газах им можно пренебречь или считать, что потенциальная энергия взаимодействия практически равна нулю. При небольших расстояниях
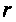 эта энергия мала, при
эта энергия мала, при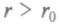 действуют силы взаимного притяжения
действуют силы взаимного притяжения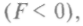
при
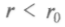 - взаимного отталкивания
- взаимного отталкивания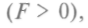 а присилы
а присилы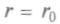
притяжения и отталкивания молекул уравновешены и F= 0. Здесь силы определены по связи их с потенциальной энергией
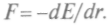 Но частицы движутся, обладая неким запасом кинетической энер-
Но частицы движутся, обладая неким запасом кинетической энер-261

 гии. Пусть одна молекула неподвижна, а другая сталкивается с ней, имея такой запас энергии. При сближении молекул силы притяжения совершают положительную работу и потенциальная энергия их взаимодействия уменьшается до расстояния
гии. Пусть одна молекула неподвижна, а другая сталкивается с ней, имея такой запас энергии. При сближении молекул силы притяжения совершают положительную работу и потенциальная энергия их взаимодействия уменьшается до расстояния 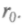 При этом кинетическая энергия (и скорость) растет. Когда расстояние станет меньше
При этом кинетическая энергия (и скорость) растет. Когда расстояние станет меньше 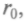 силы притяжения сменятся силами отталкивания. Работа, совершаемая молекулой против этих сил, отрицательна.
силы притяжения сменятся силами отталкивания. Работа, совершаемая молекулой против этих сил, отрицательна.Молекула будет сближаться с неподвижной молекулой до тех пор, пока ее кинетическая энергия не перейдет полностью в потенциальную. Минимальное расстояние d, на которое молекулы могут сблизиться, называют эффективным диаметром молекулы. После остановки молекула начнет удаляться под действием сил отталкивания с возрастающей скоростью. Пройдя вновь расстояние
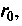 молекула попадет в область сил притяжения, которые замедлят ее удаление. Эффективный диаметр зависит от начального запаса кинетической энергии, т.е. это величина не постоянная. При расстояниях, равных
молекула попадет в область сил притяжения, которые замедлят ее удаление. Эффективный диаметр зависит от начального запаса кинетической энергии, т.е. это величина не постоянная. При расстояниях, равных 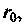 потенциальная энергия взаимодействия имеет бесконечно большое значение или «барьер», препятствующий сближению центров молекул на меньшее расстояние. Отношение средней потенциальной энергии взаимодействия к средней кинетической энергии
потенциальная энергия взаимодействия имеет бесконечно большое значение или «барьер», препятствующий сближению центров молекул на меньшее расстояние. Отношение средней потенциальной энергии взаимодействия к средней кинетической энергии 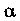 и определяет агрегатное состояние вещества: для газов
и определяет агрегатное состояние вещества: для газов 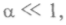 для жидкости
для жидкости 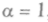 , для твердых тел
, для твердых тел 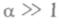
Конденсированные среды — это жидкости и твердые тела. В них атомы и молекулы расположены близко, почти соприкасаясь. Среднее расстояние между центрами молекул в жидкостях и твердых телах порядка (2 —5) • 10-10 м. Примерно одинаковы и их плотности. Межатомные расстояния превышают расстояния, на которые электронные облака проникают друг в друга настолько, что возникают силы отталкивания. Для сравнения, в газах при нормальных условиях среднее расстояние между молекулами порядка 33 • 10-10 м.
В жидкостях межмолекулярное взаимодействие сказывается сильнее, тепловое движение молекул проявляется в слабых колебаниях около положения равновесия и даже перескоках из одного положения в другое. Поэтому в них имеют место только ближний порядок в расположении частиц, т. е. согласованность в расположении только ближайших частиц, и характерная текучесть.
Твердые тела характеризуются жесткостью структуры, обладают точно определенными объемом и формой, которые под влиянием температуры и давления меняются много меньше. В твердых телах возможны состояния аморфное и кристаллическое. Существуют и промежуточные вещества — жидкие кристаллы. Но атомы в твердых телах вовсе не неподвижны, как можно было бы подумать. Каждый из них все время колеблется под влиянием упругих сил, возникающих между соседями. У большинства элементов и соединений под микроскопом обнаруживают кристаллическую структуру.
262
Так, зерна поваренной соли имеют вид идеальных кубиков. В кристаллах атомы закреплены в узлах кристаллической решетки и могут колебаться только вблизи узлов решетки. Кристаллы составляют истинно твердые тела, а такие твердые тела, как пластмасса или асфальт, занимают как бы промежуточное положение между твердыми телами и жидкостями. Аморфное тело имеет, как и жидкость, ближний порядок, но вероятность перескоков мала. Так, стекло можно рассматривать как переохлажденную жидкость, у которой повышена вязкость. Жидкие кристаллы обладают текучестью жидкостей, но сохраняют упорядоченность расположения атомов и обладают анизотропией свойств.
Химические связи атомов (и о н о в) в кристаллах такие же, как и в молекулах. Структура и жесткость твердых тел определяются различием в электростатических силах, связывающих вместе составляющие тело атомы. Механизм, связывающий атомы в молекулы, может приводить к образованию твердых периодических структур, которые можно рассматривать как макромолекулы. Подобно ионным и ковалентным молекулам, существуют ионные и ковалентные кристаллы. Ионные решетки в кристаллах скреплены ионными связями (см. рис. 7.1). Структура поваренной соли такова, что у каждого иона натрия имеется шесть соседей — ионов хлора. Этому распределению соответствует минимум энергии, т. е. при образовании такой конфигурации выделяется максимальная энергия. Поэтому при понижении температуры ниже точки плавления наблюдается стремление образовывать чистые кристаллы. С ростом температуры тепловая кинетическая энергия достаточна для разрыва связи, кристалл начнет плавиться, структура — разрушаться. Полиморфизм кристаллов — это способность образовывать состояния с разной кристаллической структурой.
Когда распределение электрического заряда в нейтральных атомах меняется, может возникнуть слабое взаимодействие между соседями. Эта связь называется молекулярной или ван-дер-ваальсо-вой (как в молекуле водорода). Но силы электростатического притяжения могут возникать и между нейтральными атомами, тогда никаких перестроек в электронных оболочках атомов не происходит. Взаимное отталкивание при сближении электронных оболочек смещает центр тяжести отрицательных зарядов относительно положительных. Каждый из атомов индуцирует в другом электрический диполь, и это приводит к их притяжению. Это действие межмолекулярных сил или сил Ван-дер-Ваальса, имеющих большой радиус действия.
Поскольку атом водорода очень мал и его электрон легко сместить, он часто притягивается сразу к двум атомам, образуя водородную связь. Водородная связь ответственна и за взаимодействие друг с другом молекул воды. Ею объясняются многие уникальные свойства воды и льда (рис. 7.4).
263



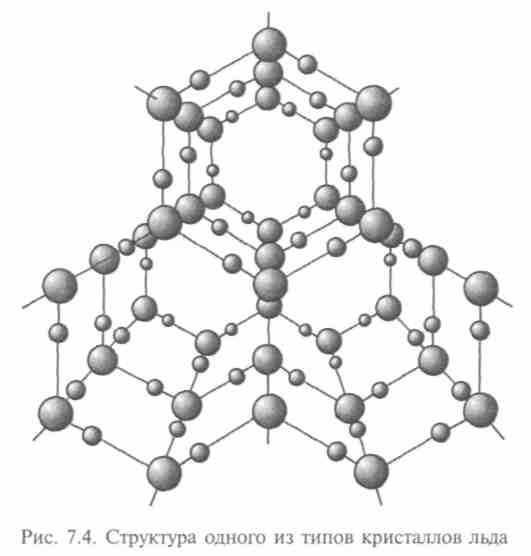
Ковалентная связь (или атомная) достигается из-за внутреннего взаимодействия нейтральных атомов. Примером такой связи служит связь в молекуле метана. Разновидностью углерода с сильной связью является алмаз (четыре атома водорода заменяются четырьмя атомами углерода).
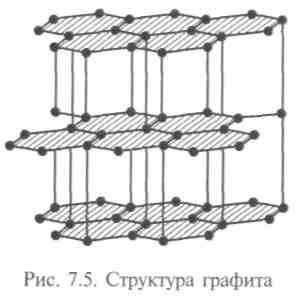
Так, углерод, построенный на ковалентной связи, образует кристалл в форме алмаза. Каждый атом окружен четырьмя атомами, образующими правильный тетраэдр. Но каждый из них является одновременно вершиной соседнего тетраэдра. В других условиях те же атомы углерода кристаллизуются в графит. В графите они соединены тоже атомными связями, но образуют плоскости из шестиугольных сотовидных ячеек, способных к сдвигу. Расстояние между атомами, расположенными в вершинах шестигранников, равно 0,142 нм. Слои расположены на расстоянии 0,335 нм, т.е. связаны слабо, поэтому графит пластичен и мягок (рис. 7.5). В 1990 г. возник бум исследовательских работ, вызванный сообщением о получении нового вещества — фуллерита, состоящего из молекул углерода — фуллеренов. Эта форма углерода молекулярная, т.е. минимальным элементом является не атом, а молекула. Она названа в честь архитектора Р.Фуллера, который в 1954 г. получил патент на строительные конструкции из шестиугольников и пятиугольников, составляющих полусферу. Молекула из 60 атомов углерода диаметром 0,71 нм была открыта в 1985 г., потом были обнаружены молекулы
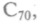
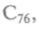
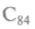 и т.д. Все они имели устойчивые поверхности,
и т.д. Все они имели устойчивые поверхности,264
но наиболее устойчивыми оказались молекулы С60 и С70. Логично предположить, что графит использован как исходное сырье для синтеза фуллере-нов. Если это так, то радиус шестиугольного фрагмента должен быть 0,37 нм. Но он оказался равным 0,357 нм. Это различие в 2 % связано с тем, что атомы углерода располагаются на сферической поверхности в вершинах 20 правильных шестигранников, унаследованных от графита, и 12 правильных пятигранников, т.е. конструкция напоминает футбольный мяч. Получается, что при «сшивании» в замкнутую сферу часть плоских шестигранников превратилась в пятигранники. При комнатной температуре молекулы С60 конденсируются в структуру, где каждая молекула имеет 12 соседей, отстоящих друг от друга на расстоянии 0,3 нм. При Т = 349 К происходит фазовый переход 1-го рода — решетка перестраивается в кубическую. Сам кристалл — полупроводник, но при добавлении щелочного металла в кристаллическую пленку С60 возникает сверхпроводимость при температуре 19 К. Если в эту полую молекулу внедрить тот или иной атом, его можно использовать как основу для создания запоминающей среды со сверхвысокой плотностью информации: плотность записи достигнет 4-1012 бит/см2. Для сравнения — пленка ферромагнитного материала дает плотность записи порядка 107 бит/см2, а оптические диски, т.е. лазерная технология, — 108 бит/см2. Этот углерод обладает и другими уникальными свойствами, особенно важными в медицине и фармакологии.
В кристаллах металлов проявляет себя металлическая связь, когда все атомы в металле отдают «в коллективное пользование» свои валентные электроны. Они слабо связаны с атомными остовами, могут свободно двигаться по кристаллической решетке. Около 2/5 химических элементов составляют металлы. В металлах (кроме ртути) связь образуется при перекрывании вакантных орбиталей атомов металла и отрыва электронов из-за образования кристаллической решетки. Получается, что катионы решетки окутаны электронным газом. Металлическая связь возникает, когда атомы сближаются на расстояние, меньшее размеров облака внешних электронов. При такой конфигурации (принцип Паули) растет энергия внешних электронов, и ядра соседей начинают притягивать эти внешние электроны, размывая электронные облака, равномерно распределяя их по металлу и превращая в электронный газ. Так возникают электроны проводимости, объясняющие большую электрическую проводимость металлов. В ионных и ковалентных кристаллах внешние электроны практически связаны, и проводимость этих твердых тел очень мала, их называют изоляторами.
265
Внутренняя энергия жидкостей определяется суммой внутренних энергий макроскопических подсистем, на которые ее можно мысленно разделить, и энергий взаимодействия этих подсистем. Взаимодействие осуществляется через молекулярные силы с радиусом действия порядка 10-9 м. Для макросистем энергия взаимодействия пропорциональна площади соприкосновения, поэтому она мала, как и доля поверхностного слоя, но это не обязательно. Ее называют поверхностной энергией и следует учитывать в задачах, связанных с поверхностным натяжением. Обычно жидкости занимают больший объем при равном весе, т. е. имеют меньшую плотность. Но почему объемы льда и висмута уменьшаются при плавлении и даже после точки плавления некоторое время сохраняют эту тенденцию? Получается, что эти вещества в жидком состоянии более плотны.
В жидкости на каждый атом действуют его соседи, и он колеблется внутри анизотропной потенциальной ямы, которую они создают. В отличие от твердого тела эта яма неглубока, так как дальние соседи почти не влияют. Ближайшее окружение частиц в жидкости меняется, т. е. жидкость течет. При достижении определенного значения температуры жидкость закипит, во время кипения температура остается постоянной. Поступающая энергия расходуется на разрыв связей, и жидкость при полном их разрыве превращается в газ.
Плотности жидкостей значительно больше плотностей газов при тех же давлениях и температурах. Так, объем воды при кипении составляет только 1/1600 объема той же массы водяного пара. Объем жидкости мало зависит от давления и температуры. При нормальных условиях (20 °С и давлении 1,013 • 105 Па) вода занимает объем 1 л. При понижении температуры до 10 °С объем уменьшится только на 0,0021, при увеличении давления — в два раза.
Хотя простой идеальной модели жидкости пока нет, микроструктура ее достаточно изучена и позволяет качественно объяснить большинство ее макроскопических свойств. То, что в жидкостях сцепление молекул слабее, чем в твердом теле, заметил еще Галилей; его удивило, что на листьях капусты скапливаются большие капли воды и не растекаются по листу. Пролитая ртуть или капли воды на жирной поверхности принимают из-за сцепления форму маленьких шариков. Если молекулы одного вещества притягиваются к молекулам другого вещества, говорят о смачивании, например клей и дерево, масло и металл (несмотря на огромное давление, масло удерживается в подшипниках). Но вода поднимается в тонких трубочках, называемых капиллярными, и поднимается тем выше, чем тоньше трубка. Иного объяснения, кроме эффекта смачивания воды и стекла, ту т быть не может. Силы смачивания между стеклом и водой больше, чем между молекулами воды. Со ртутью — эффект обратный: смачивание ртути и стекла слабее, чем силы сцепления между атомами ртути. Галилей заметил, что смазанная жиром иголка может держаться на воде, хотя это противоречит закону Архимеда. Когда иголка плавает, мож-
266
но заметить небольшой прогиб поверхности воды, стремящийся как бы распрямиться. Силы сцепления между молекулами воды достаточны, чтобы не позволить иголке провалиться в воду. Поверхностный слой как пленка защищает воду, это и есть поверхностное натяжение, которое стремится придать форме воды наименьшую поверхность — шаровую. Но по поверхности спирта иголка уже не будет плавать, потому что при добавлении спирта в воду уменьшается поверхностное натяжение, и иголка тонет. Мыло тоже уменьшает поверхностное натяжение, поэтому горячая мыльная пена, проникая в трещины и щели, лучше отстирывает грязь, особенно содержащую жир, тогда как чистая вода просто свернулась бы в капельки.
Плазма — четвертое агрегатное состояние вещества, представляющее собой газ из совокупности заряженных частиц, взаимодействующих на больших расстояниях. При этом число положительных и отрицательных зарядов примерно равное, так что плазма электрически нейтральна. Из четырех стихий плазма соответствует огню. Чтобы перевести газ в состояние плазмы, нужно его ионизовать, оторвать электроны от атомов. Ионизацию можно осуществить нагреванием, воздействием электрического разряда или жесткого излучения. Вещество во Вселенной находится в основном в ионизованном состоянии. В звездах ионизация вызывается термически
 , в разреженных туманностях и межзвездном газе — ультрафиолетовым излучением звезд. Из плазмы состоит и наше Солнце, его излучение ионизует верхние слои земной атмосферы, называемые ионосферой, от ее состояния зависит возможность дальней радиосвязи. В земных условиях плазма встречается редко — в лампах дневного света или в дуге электросварки. В лабораториях и технике плазму чаще всего получают электрическим разрядом. В природе это делают молнии. При ионизации разрядом возникают электронные лавины, подобные процессу цепной реакции. Для получения термоядерной энергии используют метод инжекции: разогнанные до очень больших скоростей газовые ионы впрыскиваются в магнитные ловушки, притягивают к себе электроны из окружающей среды, образуя плазму. Используют и ионизацию давлением — ударными волнами. Этот способ ионизации — в сверхплотных звездах и, возможно, в ядре Земли.
, в разреженных туманностях и межзвездном газе — ультрафиолетовым излучением звезд. Из плазмы состоит и наше Солнце, его излучение ионизует верхние слои земной атмосферы, называемые ионосферой, от ее состояния зависит возможность дальней радиосвязи. В земных условиях плазма встречается редко — в лампах дневного света или в дуге электросварки. В лабораториях и технике плазму чаще всего получают электрическим разрядом. В природе это делают молнии. При ионизации разрядом возникают электронные лавины, подобные процессу цепной реакции. Для получения термоядерной энергии используют метод инжекции: разогнанные до очень больших скоростей газовые ионы впрыскиваются в магнитные ловушки, притягивают к себе электроны из окружающей среды, образуя плазму. Используют и ионизацию давлением — ударными волнами. Этот способ ионизации — в сверхплотных звездах и, возможно, в ядре Земли.Всякая сила, действующая на ионы и электроны, вызывает электрический ток. Если он не связан с внешними полями и не замкнут внутри плазмы, она поляризуется. Плазма подчиняется газовым законам, но при наложении магнитного поля, упорядочивающего движение заряженных частиц, она проявляет совершенно необычные для газа свойства. В сильном магнитном поле частицы начинают крутиться вокруг силовых линий, а вдоль магнитного поля они движутся свободно. Говорят, что это винтообразное движение смещает структуру силовых линий поля и поле «вморожено» в плазму. Разреженная плазма описывается системой частиц, а более плотная — моделью жидкости.
267
Высокая электропроводность плазмы — главное отличие ее от газа. Проводимость холодной плазмы поверхности Солнца (0,8 10-19 Дж) достигает проводимости металлов, а при термоядерной температуре (1,6 10-15 Дж) водородная плазма проводит ток в 20 раз лучше меди при нормальных условиях. Поскольку плазма способна проводить ток, к ней часто применяют модель проводящей жидкости. Она считается сплошной средой, хотя сжимаемость отличает ее от обычной жидкости, но это отличие проявляется только при течениях, скорость которых больше скорости звука. Поведение проводящей жидкости исследуется в науке, называемой магнитной гидродинамикой. В космосе всякая плазма является идеальным проводником, и законы вмороженного поля имеют широкое применение. Модель проводящей жидкости позволяет понять механизм удержания плазмы магнитным полем. Так, из Солнца выбрасываются плазменные потоки, влияющие на атмосферу Земли. Сам поток не имеет магнитного поля, но и постороннее поле не может в него проникнуть по закону вмороженности. Плазменные солнечные потоки выталкивают посторонние межпланетные магнитные поля из окрестностей Солнца. Возникает магнитная полость, где поле слабее. Когда эти корпускулярные плазменные потоки приближаются к Земле, они сталкиваются с магнитным полем Земли и вынуждены обтекать его по тому же закону. Получается некая каверна, где собрано магнитное поле и куда не проникают плазменные потоки. На ее поверхности скапливаются заряженные частицы, которые были обнаружены ракетами и спутниками, — это внешний радиационный пояс Земли. Эти идеи использовались и при решении задач удержания плазмы магнитным полем в специальных устройствах — токамаках (от сокращения слов: тороидальная камера, магнит). С полностью ионизованной плазмой, удерживаемой в этих и других системах, связывают надежды на получение на Земле управляемой термоядерной реакции. Это дало бы чистый и дешевый источник энергии (морская вода). Ведутся работы и по получению и удержанию плазмы при помощи сфокусированного лазерного излучения.
