Высшее профессиональное образование т. Я. Дубнищева концепции современного естествознания
| Вид материала | Документы |
Содержание7.2. Развитие представлений о составе веществ. Законы стехиометрии |
- Учебно-методический комплекс концепции современного естествознания высшее профессиональное, 2306.3kb.
- Учебно-методический комплекс концепции современного естествознания высшее профессиональное, 2307.28kb.
- С. Г. Хорошавина концепции современного естествознания курс лекций, 6750.33kb.
- С. Г. Хорошавина концепции современного естествознания курс лекций, 5892.74kb.
- В. М. Найдыш Концепции современного естествознания, 8133.34kb.
- Учебно-методический комплекс дисциплины концепции современного естествознания Специальность, 187.08kb.
- Концепции Современного Естествознания, 274.86kb.
- Программа курса «Концепции современного естествознания», 168.05kb.
- Программа дисциплины Концепции современного естествознания Специальность/направление, 456.85kb.
- Бюллетень новых поступлений в нб согу за период с 05. 2011 по 10. 2011гг, 975.89kb.
Представление о веществе в естествознании менялось в соответствии с уровнем развития знаний и использования веществ.
В Древней Греции появилась гениальная догадка — тела образованы различными комбинациями атомов (неделимых). Такое объяснение — сведение сложного к простому (редукции) не отражало многообразия сложного мира, но дало науке многое. Тенденция к поиску «элементарных кирпичиков» мироздания, порожденная атомистической концепцией, оказалась плодотворной в объяснении свойств тел. Но она не позволяет понять макроскопические свойства тел, ведь применительно к отдельному атому нельзя говорить ни о давлении, ни о температуре, ни о плотности. И «целое» не является суммой «частей», оно обладает более сложными свойствами. Это приводит к размышлениям о сущности редукционизма и методов познания. Ученые установили, что все вещества построены из молекул, которые, в свою очередь, состоят из устойчивых групп соединенных друг с другом атомов.
Молекула — наименьшая устойчивая частица вещества, сохраняющая его свойства. Понятие молекулы появилось в кинетической теории газов (см. гл. 4), и на основании развитой физической теории удалось путем исследования макроскопического поведения газов оценить размеры молекул. В жидкостях или твердых телах, где молекулы расположены достаточно плотно, их размеры можно оценить по плотности веществ. Прямое доказательство существования молекул было получено при изучении броуновского движения Ж. Перреном.
Установление связи между структурой и свойствами на молекулярном уровне строения веществ — одна из основных задач исследования. Молекула состоит из ядер атомов и электронной оболочки, образованной их внешними электронами. В зависимости от строения и состава молекулы обладают разной степенью устойчивости по отношению к внешним воздействиям, что определяет многие их свойства. Исследование устойчивости молекул раскрывает их природу и реакционную способность. Такими физическими методами, как спектроскопия, ядерный или парамагнитный резонанс и др., изучают разнообразные и сложные химические
245


 процессы. Относительное расположение атомных ядер в молекулах может быть измерено методами рентгеноструктурного анализа, электронографии или нейтронографии и др. В основном свойства и строение молекул определяются при исследовании макроскопических образцов веществ.
процессы. Относительное расположение атомных ядер в молекулах может быть измерено методами рентгеноструктурного анализа, электронографии или нейтронографии и др. В основном свойства и строение молекул определяются при исследовании макроскопических образцов веществ.Химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи. Взаимодействие электронных оболочек атомов порождает химические связи, создающие определенные конфигурации атомов, отличающие один тип молекулы от другого. Если атомные конфигурации подходят друг к другу, возникает структура, несколько большая, чем до этого была совокупность из атомов по отдельности. Получается насыщенная молекула, присоединить к ней еще какой-то атом почти невозможно. Насыщаемость молекул определяет их постоянный состав для данного вещества и связана с валентностью — способностью атома образовывать химические связи. Инертные газы с трудом образуют химические соединения, так как имеют устойчивую электронную оболочку. Внешняя оболочка атома, которая содержит орбитали самых высоких энергий атома, называется валентной.
Понятие валентности, введенное в науку для описания свойства одного изолированного атома, постепенно стало отражать свойства связанного атома, т.е. атома, находящегося в молекуле и изменившего свои свойства под влиянием других атомов. Его впервые использовал (1853) английский химик Э.Франкленд. Тогда валентность элемента выражалась числом атомов водорода, которое может присоединить или которым можно заменить один атом рассматриваемого элемента. Вместе с немецким химиком А. Кольбе он установил трехвалентность азота, фосфора, мышьяка и четырехвалентность углерода. Они отметили, что валентность зависит как от состояния атомов рассматриваемого элемента, так и от химической природы другого реагента: углерод в соединении с кислородом может образовывать и СО, и СO2. Значит, валентность позволяет оценить формулу химического соединения. Так пришли к понятию стехиометрической валентности.
Немецкий химик Кекуле заключил (1857), что одни элементы могут замещать в ряде соединений три атома водорода, а другие — только один или два. Он ввел понятие химического сродства, означающее число атомов водорода, которое может заменить данный элемент. Число единиц сродства и есть валентность. Под валентностью понимали целочисленную величину, отражающую количество единиц сродства свободного атома любого элемента. Считалось, что атом водорода имеет одну единицу сродства, атом кислорода — две и т.д. Поэтому говорили, что атом углерода при образовании диоксида связывает все четыре единицы сродства, а при образовании оксида — только две: O=С=O и =С=O. Шотландский химик А. Купер предложил обозначать химические связи между атомами в соединениях с помощью черточек (1858). Теории Ке-
246
куле и Купера объясняли строение и сложных радикалов, и органических соединений — молекула представлялась целостным образованием, которое складывается из атомов за счет полного взаимного насыщения единиц сродства. Они практически одновременно обнаружили способность атомов углерода соединяться друг с другом в длинные молекулы-цепочки, это свойство углерода и породило огромное разнообразие его соединений. Простота и наглядность объяснений вели к аддитивному мышлению.
Современные представления о химической связи основаны на современной теории валентности. Термин «связь» оказался очень точен. Случайных связей не бывает — существуют правила их возникновения. При образовании связи атомы приближаются к достижению наиболее устойчивой электронной конфигурации, т. е. имеющей более низкую энергию. Они могут терять (приобретать) электроны или обобществлять их до достижения такой же конфигурации, как у благородного газа этого же периода, т.е. до значения 2 или 8. Существуют и взаимодействия между атомами, когда электронная оболочка не локализована в отдельных связях — сопряженные.
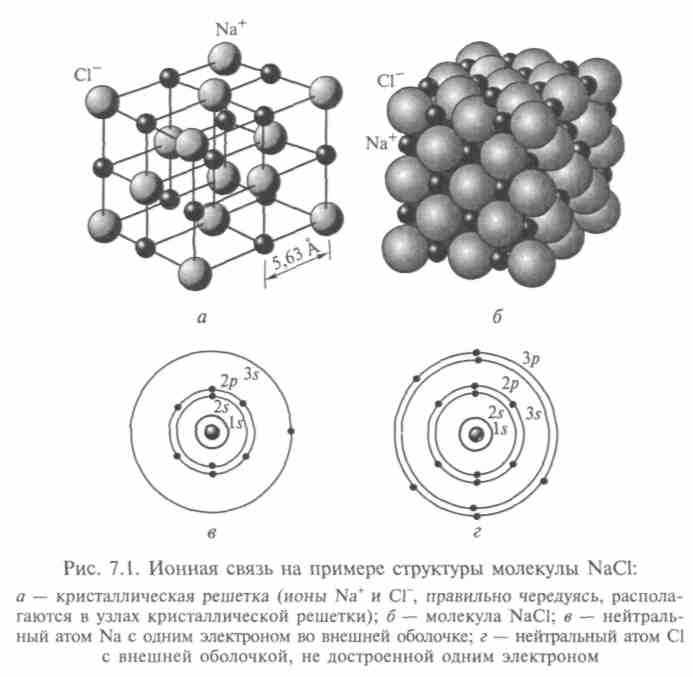
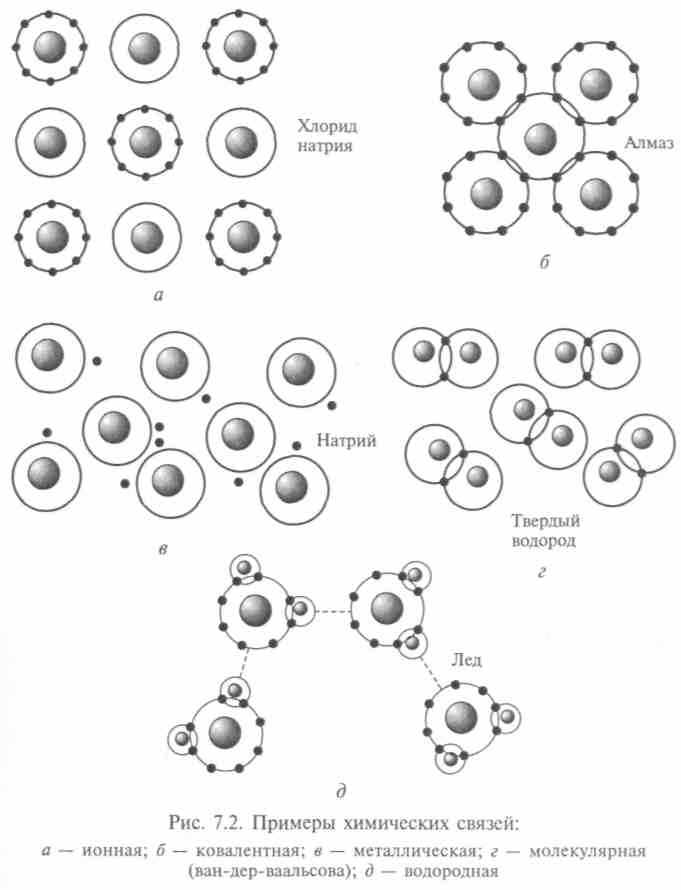
Ионная связь, основанная на переносе валентных электронов от одного атома к другому и электростатическом притяжении этих образовавшихся ионов, — самый распространенный вид связи. Молекула представляется электрическим диполем, а центры ионов в нем расположены на определенном расстоянии друг от друга, называемом длиной связи. Простейшая кристаллическая структура молекулы NaCl показана на рис. 7.1, а схема ее ионной связи NaCl — на рис. 7.2, а. Для хлорида калия, например, длина связи равна 1,3 • 10-10 м.
При ковалентной связи прочное соединение нейтральных атомов достигается за счет более глубокого взаимодействия между ними (рис. 7.2, б), например связь атомов углерода в кристалле алмаза или в молекуле Н2. Прочность такой связи обусловлена обменным резонансом — атомы колеблются с одинаковой собственной частотой, и при связывании их суммарная энергия становится меньше, чем в изолированном состоянии. Электрон 1 притягивается ядром 2, и электрон 2 притягивается ядром 1. Электроны должны иметь противоположно направленные спины, тогда (по принципу Паули) они находятся в наинизшем состоянии и орбиты отдельных атомов сливаются в одну орбиталь, охватывающую пространство обоих атомов водорода и имеющую почти эллиптическую форму. Говорят, что происходит «перекрытие» собственных функций обоих электронов, это становится энергетически выгодно — системы удерживаются вместе.
В молекулах газов сохраняется 5 %-я вероятность того, что электрон несколько смещен к одному из атомов. Молекулы щелочно-галоидных соединений имеют небольшой дипольный момент, их
247




центры тяжести расположены на некотором расстоянии. В молекуле воды две однократно занятые
 -орбитали атома кислорода частично сливаются с
-орбитали атома кислорода частично сливаются с  -орбиталью атома водорода, но из-за электростатического отталкивания между обоими ядрами водорода валентный угол не 90, а 105°. Форма молекул с ковалентными связями определяется формой электронных орбиталей. Большинство органических соединений существуют благодаря ковалентной связи.
-орбиталью атома водорода, но из-за электростатического отталкивания между обоими ядрами водорода валентный угол не 90, а 105°. Форма молекул с ковалентными связями определяется формой электронных орбиталей. Большинство органических соединений существуют благодаря ковалентной связи.Металлическая связь проявляется, когда атомы металла обобществляют валентные электроны, слабо связанные с атомными остовами. Эти электроны образуют электронный газ, перемещающийся по кристаллической решетке (рис. 7.2, в).
Молекулярная связь отражает слабое взаимодействие между соседними атомами, например взаимодействие между атомами водорода в твердом Н2 (рис. 7.2, г). Силы электростатического притяжения могут возникнуть и между нейтральными атомами: при сближении их возникает отталкивание из-за отрицательно заряженных электронных оболочек, но при этом смещается центр
248
масс отрицательных зарядов относительно положительных. И каждый из атомов индуцирует в другой электрический диполь, что ведет к взаимному притяжению. Это притяжение связывают с действием сил межмолекулярного взаимодействия (сил Ван-дер-Ваальса), которые на порядок меньше по величине, но имеют радиус действия, превосходящий размеры молекул.
Водородная связь слабее ковалентной или ионной связи в 15 — 20 раз. Она возникает, если атом водорода помещен между
249

 двумя электроотрицательными атомами (рис. 7.2, д). Водородная связь определяет ассоциацию молекул типа димеров воды — (Н20)2. На слабой водородной связи «держатся» полимеры, входящие в состав биомолекул, т. е. и жизнь.
двумя электроотрицательными атомами (рис. 7.2, д). Водородная связь определяет ассоциацию молекул типа димеров воды — (Н20)2. На слабой водородной связи «держатся» полимеры, входящие в состав биомолекул, т. е. и жизнь.Ионная и ковалентная связи — это предельные случаи химических связей. Чаще всего встречаются молекулы с промежуточными типами связей. Более полное представление о типах связей дают карты электронных плотностей, получаемые из расчетов на ЭВМ. Так квантовая механика атома объяснила проблемы химической связи молекул с позиции физики.
Существуют и очень короткие связи — одинарные, двойные, тройные и даже четверные (в них участвуют сразу 8 электронов), которые обнаруживают между атомами рения, молибдена или хрома. Расстояния между атомами в молекулах очень малы — порядка (1 — 4) • 10-10 м. Так, молекула Н2 состоит из двух связанных между собой атомов, расстояние между ядрами которых, или длина связи, составляет 7,5 • 10-11 м. У молекулы кислорода, также состоящей из двух атомов, длина связи равна 1,2 • 10-10 м. Молекулы различаются и размерами: молекула O2 с 16 электронами больше молекулы Н2 с двумя. Более сложные молекулы имеют и более сложные форму и строение. При образовании молекулы перекрытие электронных облаков ведет к возникновению между ядрами некоторого отрицательного заряда, которое цементирует молекулу и стягивает ядра к области перекрытия. Энергия этого взаимодействия — порядка 1000 кДж/моль (у N2 — 940 кДж/моль, Cs — 42 кДж/моль). Для сравнения: энергия межмолекулярного взаимодействия составляет порядка 100 кДж/моль, так что отличить их по энергии трудно. Важно выделить главную черту химической связи — обобществление валентных электронов и перенос заряда, если связь образуется между разными атомами.
Опыт У.Никольсона и А.Карлейна (1800) по разложению воды с помощью электрического тока впервые показал связь химических и электрических взаимодействий, но только через столетие появилась теория, описывающая природу химической связи. Теория Й. Берцелиуса (1819), основанная на электростатическом взаимодействии зарядов, не могла объяснить образование молекул из двух одинаковых атомов и фактически касалась лишь ионной связи, поскольку электрическая природа других видов химической связи не столь очевидна. Сокрушительный удар по теории Берцелиуса нанесла неведомая ему тогда наука — органическая химия.
Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее изолированных атомов, то она может существовать, т. е. ее связь устойчива. Для измерения энергии связи одной молекулы используют энергию, отнесенную к одному молю (числу граммов, равному относительной
250
молекулярной массе) и деленную на число Авогадро N. Эта величина для O2 равна 487,2 кДж/моль, а для Н2 — 432,6 кДж/моль, т. е. меняется незначительно.
Устойчивым считается состояние, в котором потенциальная энергия минимальна, поэтому при образовании молекулы атомы находятся в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия. Расстояние от вертикальной оси до дна ямы соответствует равновесию — на этом расстоянии находились бы атомы, если бы прекратилось тепловое движение. Точки левее дна соответствуют отталкиванию, правее — притяжению. Крутизна кривой тоже информативна: чем круче кривая, тем больше сила взаимодействия между атомами. Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям. Это просто объяснить: ведь для того чтобы выбраться из ямы, нужна энергия, равная ее глубине. Поэтому глубину ямы можно назвать энергией связи частиц.
7.2. Развитие представлений о составе веществ. Законы стехиометрии
Химия занимается изучением естественных и искусственных объектов на молекулярном уровне. Она позволяет изменять окружающий мир, затрагивая практически все стороны нашей жизни. По выражению Менделеева, «высшую цель науки составляет... постижение неизменяющегося среди переменного». Получение веществ с необходимыми свойствами — эта задача объединяет всю химическую науку. По предмету исследования химию разделяют на органическую и неорганическую. Выделение аналитической химии связано с методами исследования. Появление биологической и физической химии обусловлено близостью предметов и методов исследования со смежными науками. Появились химия твердого тела, химия поверхности, химия комплексных соединений, химия растворов, химия полимеров, химия нефти и др. Связь науки с требованиями человеческой практики подтверждает вся история химии, которая есть единый закономерный процесс решения основной проблемы, а не совокупность разных химических наук. Менделеев определил химию как учение об элементах и их соединениях, а теперь кажется, что важнее в химии является учение о процессах, а не о готовых формах материи.
Свойства вещества зависят от четырех факторов: элементного и молекулярного состава; структуры; кинетических факторов протекания химического процесса; степени организации вещества. Молекулой назвали наименьшую частичку вещества, сохраняющую его свойства, но молекулы становились все сложнее. К ним
251

 стали относить полимеры, кристаллы, т. е. агрегаты. Учение о составе веществ называют первой концептуальной системой химии.
стали относить полимеры, кристаллы, т. е. агрегаты. Учение о составе веществ называют первой концептуальной системой химии.Поскольку человек искал необходимые вещества для обеспечения своей жизнедеятельности, химические знания копились с древнейших времен. Этот путь можно условно разделить на несколько этапов, каждый из которых связан с ценностями общества и возможностью их достижения в выбранное время.
Донаучный этап был ориентирован на поиски «философского камня», «эликсира долголетия», получение золота и серебра из других веществ. Родиной алхимии считается Древний Египет. Там в строжайшей тайне сохранялись способы выплавки металлов, получения сплавов для монет. Расширение торговли требовало научиться превращать свинец или железо в золото. Алхимическая направленность знаний и рецептов связывалась с астрологией и магией. Семь планет связывали с семью известными тогда металлами. Арабы, вторгшиеся в VII в. в Египет, перефразировали слово «хеми» в «аль хеми», так впоследствии и появилась алхимия. Джабир (европейское имя Гебер) считал, что все семь металлов образованы из серы и ртути. В XII—XIV вв. в связи с поисками эликсира, помогающего превращению этих элементов в золото, была открыта серная и азотная кислоты, изучены процессы брожения, появились вино и уксус. Постепенно возникали и иные цели. Так, Парацельс считал, что равновесие в организмах может быть достигнуто с помощью определенных химических соединений, использующих минералы. На основе серы, ртути и соли, используя их свойства — горючесть, летучесть и твердость, он создал ятрохимию. Каждому из этих свойств он сопоставил микрокосм человека — душу, дух и тело. Болезни вызывает избыток или недостаток каких-то элементов. И ятрохимия отделилась от алхимии. Во второй половине XVII в. период алхимии исчерпал себя. Но бьш накоплен опыт по различным превращениям веществ, конструированию приборов и технике экспериментов, были открыты новые вещества и новые металлы (платина, висмут), изучены необычные свойства многих веществ. И все более ощущалось, что существует какой-то предел превращаемости веществ. В то же время больших успехов достигла техническая химия — развивались металлургия, производство стекла, бумаги. Развитие ремесел, фармацевтики, промышленности требовало получения новых веществ. В это время возрождение идей атомизма П. Гассенди привело к формулировке понятия молекулы как мельчайшей частички, сохраняющей свойства вещества.
Формирование химии как науки связано с именем Р. Бойля. Он отделил химию от ремесленных и медицинских целей, развил атомистические представления, объясняя формой, расположением и движениями частиц превращения веществ и их свойства. Бойль выделял мельчайшие частички — атомы, которые могут образовывать большие — кластеры, и поставил вопрос о происхождении свойств веществ, связывая их с составом вещества. Под химическим элементом он понимал предел разложения веществ и выдвинул программу их изучения. Видя основную задачу химии в изучении состава тел, требовал, чтобы элементы состава при соеди-
252
нении давали исходное вещество, т.е. ввел синтез как критерий верности анализа. По выражению Энгельса, «Бойль делает из химии науку», вводя в химию индуктивный метод. На идее атомистического строения были созданы кинетическая теория газов Бой-ля, Ломоносова, Д.Бернулли. М.В.Ломоносов сумел соединить представления о строении веществ и кинетическую теорию теплоты. Его гипотетико- дедуктивный метод привел его к формулировке закона сохранения вещества и движения.
Понятие химического элемента у Лавуазье также связывалось с веществами, не подвергающимися дальнейшему разложению, и он включил в свою систему, помимо азота, водорода, кислорода, серы и др., известь, магнезию, глинозем. Но он понял важность точного измерения количества веществ, участвующих в реакции. Количественные методы привели к открытию новых элементов — кобальта (1735), металлического никеля (1751), водорода (1776) (ранее наблюдаемого Бойлем в 1766 г., Ломоносовым в 1745 г., Г.Кавендишем в 1766 г.), кислорода (1771 — 1774) (Пристли, Шееле, Лавуазье), фтора (1771) и т.д. Точными измерениями Лавуазье установил закон сохранения массы, не зависящий от характера реакции.
Стимулировала введение количественных методов анализа состава веществ проблема горения, которая стала основной в химии XVIII в. Для объяснения процесса И. Бехером и Г. Шталем была предложена теория флогистона — невесомой субстанции, содержащейся во всех горючих телах и выделяющейся при горении. После открытия Шееле сложного состава воздуха Лавуазье разработал теорию образования металлов из руд и пришел к кислородной теории горения. И флогистон был изгнан из химии, как и теплород из физики. Проведенные тогда Кавендишем опыты показали, что образующиеся при горении газы конденсируются в воду. Так Лавуазье понял, что вода — продукт соединения двух газов и назвал второй газ водородом, так как он образует воду и горит в присутствии кислорода.
На пути рационализации химии Лавуазье предпринял первую попытку систематизировать химические элементы. Классификация Лавуазье основана на соединениях кислорода (кислоты, основания, соли, органические вещества). Так учение о составе веществ стало частью рациональной науки, но до XIX в. оно составляло всю химию. Развитие промышленного производства требовало расширения сырьевой базы, понимания происходящих в химических реакциях процессов.
Понятие химического соединения отражало развитие представлений об элементах. В 1773 г. И.Рихтер показал, что химические элементы взаимодействуют между собой в строго ограниченных количествах, сохраняющихся в виде пропорциональных чисел при переходе от одного сложного вещества к другому. Эту упорядоченность он назвал стехиометрией, т. е. мерой элементов, входящих в
253


 состав химического вида. Закон Рихтера стали называть законом эквивалентов.
состав химического вида. Закон Рихтера стали называть законом эквивалентов.Закон постоянства с о с т а в а установил французский химик Ж. Пруст (1799) — любое химическое соединение обладает строго неизменным составом, атомы прочно притягиваются, и этим химическое соединение отличается от смесей. Его неизменный состав не зависит от способа получения.
Пруст писал: «Природа дала химическому соединению постоянный состав и тем самым поставила его в совершенно особое положение по сравнению с раствором, расплавом или смесью». Возникла дискуссия, поднятая Ж.Прустом и К.Бертолле, о возможности существования соединений постоянного и переменного состава, которая не окончена и сейчас. Казалось, что можно получить вещество, повторяющее состав, с такими же свойствами. Ф.Велер создал в лаборатории мочевину (1828), А. Кольбе — уксусную кислоту (1845), П.Бертло впервые получил один из жиров (1854), а А.М.Бутлеров — один из Сахаров. Эти искусственные соединения обладали свойствами природных, т.е. не зависели от способа его получения.
Долгое время считалось, что исключения из этого свидетельствуют лишь о неточности или ошибочности опыта (изомеры). Но Бутлеров впоследствии это опроверг, получив изобутан — вещество, имеющее одинаковый с бутаном состав (по 4 атома углерода и по 10 атомов водорода), но отличное по свойствам: бутан кипит при -0,5 °С, а изобутан — при -10,2 °С.
Дж.Дальтон открыл закон кратных отношений: если определенное количество одного элемента вступает в соединение с другим элементом в нескольких весовых отношениях, то количества второго элемента относятся между собой как целые числа. Он полагал, что все атомы каждого отдельного элемента одинаковы и обладают определенным атомным весом. Поскольку абсолютное значение атомного веса нельзя установить, можно использовать относительные веса. Выбрав за единицу вес атома водорода, Дальтон составил первую таблицу атомных весов. Он теоретически обосновал закон Пруста, развил атомистические представления, показав, что все вещества состоят из молекул, а молекулы — из атомов. Кроме того, он ввел и обозначения атомов — составных частей молекул и отметил возможность «обмена» атомами при реакциях.
Атомные веса элементов более точно определял шведский химик Й.Берцеллиус. Он отметил, что в солях наблюдаются простые и постоянные отношения между атомами кислорода основания и атомами кислорода кислоты. В 1826 г. он опубликовал свою таблицу атомных весов по отношению к кислороду, вес которого был принят за 100. Почти все значения атомных весов были столь точны, что сохранились до сих пор, но в отличие от определений Дальтона они не были целыми числами. Берцеллиус ввел обозначения элементов по первым буквам греческого или латинского названия, которые используют и сейчас.
254
Эти три закона стехиометрии (эквивалентов, постоянства состава и кратных отношений) стали основанием химии. Утверждение дискретности химической организации вещества стало ведущим представлением вплоть до создания квантовой химии.
Развитие молекулярной физики позволило к этому времени иначе взглянуть на свойства вещества в простейшем агрегатном состоянии, появились эмпирические газовые законы: Бойля—Ма-риотта, Гей-Люссака и Шарля, связывающие параметры газов. Эти эмпирические законы удалось вывести из идеи молекулярного строения вещества Д. Бернулли и М. В.Ломоносову. В 1811 г. А. Аво-гадро установил, что при одинаковых условиях равные объемы газов содержат одинаковое число молекул. Это значит, что грамм-молекула любого газа при одинаковых условиях (давлении и температуре) занимает одинаковый объем. При нормальных условиях он равен 22,41 л, и в этом объеме содержится 6,02 • 1023 молекул газа. Это число получило название числа Авогадро.
Основные принципы теории и законы химии, единые понятия были утверждены на первом Международном конгрессе химиков (1860, Карлсруэ). Химия тесно связана с производством, поэтому ее основная задача — получение веществ с нужными свойствами. Ее реализация требует умения осуществлять качественные превращения веществ, т.е. решить задачу происхождения свойств веществ. И на первом этапе свойства веществ определялись элементным и молекулярным составом.
Учение о составе веществ сильно зависело от возможностей анализа, и понятие химического элемента изменялось с развитием методов. Из эмпирико-аналитической сформировалась атом-но-теоретическая концепция. Из сопоставления периодичности химических свойств веществ и атомных масс элементов были построены периодические системы химических элементов Д. И. Менделеевым (1869) и Мейером (1870). По выражению Зелинского, это открытие явилось «открытием взаимной связи всех атомов в мироздании». Показателем химического элемента стало его место в Периодической системе. Тогда было известно 62 химических элемента, но Менделеев предсказал на основе установленной зависимости свойства элементов с предположительными атомными весами 44, 68 и 72. Вскоре они были открыты: галлий (1875), скандий (1879) и германий (1886). В конце века был открыт аргон, которому не было места в таблице, но после открытия гелия на Солнце и других инертных газов для них создали новую группу таблицы. Тогда еще не был понятен смысл закона, не понимал его и сам автор таблицы. Этот смысл открылся только после того, как выяснили структуру атома. Но уже в XIX в. периодический закон стал «фундаментом общей химии», упорядочил химические свойства, придал новое содержание проблеме соотношения состава и свойства.
255
 В 1897 г. И.Ридберг заключил, что периодичность свойств элементов и их атомная масса являются функцией порядковых номеров элементов в таблице. После открытия электрона, рентгеновского излучения, сложного состава атома, радиоактивности и искусственных ядерных реакций стало понятно, что это место определяется не атомной массой, а зарядом ядра атома. Поэтому понятие химического элемента связано с одинаковым зарядом ядра атома. В эту совокупность включаются и разные изотопы — атомы с различной атомной массой. Поскольку при химических превращениях любой атом сохраняет заряд ядра, то он остается атомом данного элемента. Сам атом меняется, так как меняется его электронная оболочка, отвечающая за химические свойства. В таблицу входят 90 природных и около 15 искусственных (радиоактивных) элементов.
В 1897 г. И.Ридберг заключил, что периодичность свойств элементов и их атомная масса являются функцией порядковых номеров элементов в таблице. После открытия электрона, рентгеновского излучения, сложного состава атома, радиоактивности и искусственных ядерных реакций стало понятно, что это место определяется не атомной массой, а зарядом ядра атома. Поэтому понятие химического элемента связано с одинаковым зарядом ядра атома. В эту совокупность включаются и разные изотопы — атомы с различной атомной массой. Поскольку при химических превращениях любой атом сохраняет заряд ядра, то он остается атомом данного элемента. Сам атом меняется, так как меняется его электронная оболочка, отвечающая за химические свойства. В таблицу входят 90 природных и около 15 искусственных (радиоактивных) элементов.Квантовая теория периодичности свойств элементов создавалась в 30-е гг. XX в. В связи с пониманием природы химических связей как обменных взаимодействий валентных электронов четко определилось понятие химического соединения — это качественно определенное вещество, состоящее из одного или нескольких элементов, атомы которых за счет химической связи объединены в частицы (молекулы, комплексы, монокристаллы или другие агрегаты). Впоследствии были открыты макромолекулы полимеров, которые состоят из повторяющихся, химически связанных структурных единиц — частей мономерных молекул с одинаковыми химическими свойствами. Сложно организованной единицей являются молекулярные ассоциаты. Более крупная структурная единица, называемая молекулярным агрегатом, состоит из атомов и молекулярных блоков, причем при образовании агрегата изменяется фазовое состояние вещества.
Аналитическая химия развилась из учения о составе веществ, которое дало ключ к решению проблемы генезиса свойств веществ, возможность планировать и осуществлять реакции, выполняющие определенную цель. Появились новые технологии, в России с 1807 г. стал издаваться специальный «Технологический журнал», в котором публиковались статьи по химии и технологии производства кислот, щелочей, солей.
