Закономерности процесса фосфатирования магний-литиевых сплавов 02. 00. 05 электрохимия
| Вид материала | Закон |
Содержание1 – 0,34 М H3PO4 + NaOH; 2 Взаимосвязь электрохимического поведения магний-литиевых сплавов с процессами, протекающими при их фосфатировании В пятой главе |
- Магний – это тот необходимый минерал, который организм не может сам вырабатывать. Магний, 23.43kb.
- Закономерности превращения, 589.18kb.
- «производство отливок из сплавов цветных металлов», 38.25kb.
- Тема: сварка алюминия и его сплавов, 56.75kb.
- Дисциплины, 15.02kb.
- Жаропрочность платины, палладия и их сплавов, 427.22kb.
- Литейные свойства металлов и сплавов, 213.86kb.
- Гост 1639-78: лом и отходы цветных металлов и сплавов общие технические условия, 1661.44kb.
- Вопросы вступительных экзаменов в докторантуру PhD по специальности «Материаловедение, 27.1kb.
- Кремний- магний, 561.2kb.
о мере смещения потенциала в анодную область наблюдалось дальнейшее увеличение наклона поляризационных кривых в 3-3,5 раза, связанное с пересыщением приэлектродного слоя катионами растворяющегося сплава, увеличением адсорбции и прочности связи с частицами, вызывающими пассивирование поверхности.
По сравнению с чистым фосфорнокислым раствором в нитрат-фосфатном и фосфат-фторидном растворах (рис. 4, кривые 1-3) прослеживалось снижение скорости анодного растворения магния. Пассивирующее действие фторид-ионов проявлялось при значительно меньшей его концентрации по сравнению с фосфатами (0,05 моль/л F¯ против 0,34 моль/л H3PO4). Ингибирующим действием, но в меньшей степени, чем фторид-ионы, по отношению к магнию обладают и нитрат-ионы (рис. 4, кривая 2). В нитрат-фторидном растворе торможение процесса электрохимического растворения магния усиливается (рис. 4, кривая 4). При совместном присутствии нитрат-, фторид- и фосфат-ионов в растворе при заданном соотношении их концентраций (рис. 4, кривая 5) снижение скорости растворения магния было менее существенным.
Представления о конкурирующей адсорбции между компонентами раствора, основанные на учении, развитом Я.М. Колотыркиным, позволяют объяснить специфику анодного растворения магния в исследуемых растворах. В нашем случае, возможно, что при достаточной концентрации менее агрессивной, но обладающей большей адсорбционной способностью частицы (F¯, NO3¯), будет иметь место частичное подавление ею более активного компонента.
Учет ионного состава системы в условиях проведения экспериментов (рН 2,7) дает возможность предположить участие дигидрофосфат-ионов (Н2РО4¯) в активировании поверхности. В пользу данной точки зрения свидетельствует экспериментально установленное возрастание скорости электрохимического растворения магния с ростом концентрации фосфатов.
Одновременно было установлено в чистом фосфорнокислом растворе при увеличении его кислотности (рН от 2,7 до 1,8) ускорение электрохимическое растворения магния во всей исследованной области потенциалов. Растворение магния в данных условиях по аналогии с сернокислым раствором может происходить через образующуюся пассивную пленку, состояшую из Mg(OH)2 или МgO, и скорость анодного процесса определяется отводом ионов Mg2+ от поверхности этого слоя в объем раствора. Подвод ионов гидроксония из объема раствора к поверхности Mg(OH)2 / МgO смещает вправо равновесие реакции: Mg(OH)2 ⇄ Mg2+ + 2 ОН‾, что вызывает увеличение скорости растворения этих соединений и соответственно магния.
Частицами, принимающими участие в пассивирующей адсорбции, могут быть гидроксид-, нитрат- и фторид-ионы. О пассивирующем действии нитрат- и фторид-ионов на магнии в условиях наших экспериментов свидетельствуют смещение стационарного потенциала в область положительных значений и снижение скорости анодного процесса в модельных растворах с увеличением их концентрации.

| Рис. 5. Анодные поляризационные кривые на магниевом ВДЭ в растворе (pH 2,7) 0,34 М H3PO4 + 0,17 M HNO3 + 0,05 M F ֿ + NaOH, снятые при различных скоростях вращения электрода (об/мин): 1 – 0; 2 – 500; 3 – 800; 4 – 1600; 5 – 2000; 6 – 2800 |
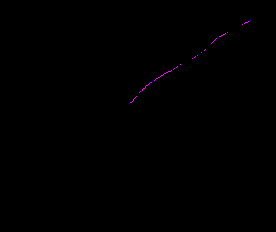
| Рис. 6. Зависимость предельного анодного тока от скорости вращения магниевого ВДЭ при Е = -0,9 В в растворе (pH 2,7) 0,34 М H3PO4 + 0,17 M HNO3 + 0,05 M F ֿ + NaOH |
Наиболее существенное замедляющее действие фторидной добавки на магнии наблюдалось при ее концентрации в нитрат-фосфатном растворе более 0,05 моль/л. В этом растворе с ростом анодной поляризации на вольтамперных кривых фиксировалось наличие площадки предельного анодного тока. С помощью вращающегося дискового магниевого электрода (ВДЭ) в нитрат-фосфат-фторидном растворе в области потенциалов предельного тока (Е = -1,1÷-0,9 В) было установлено увеличение скорости электрохимического растворения (рис. 5). Причем предельный ток линейно зависит от корня квадратного из скорости вращения дискового электрода (рис. 6). Этот результат может рассматриваться как аргумент в пользу диффузионного торможения растворения магния через пористую пассивную пленку, образующуюся на его поверхности в данных условиях.
Своеобразным оказалось влияние фторид-ионов и на скорость саморастворения магния при его анодной поляризации. В деаэрированных фосфат-нитратных растворах во всей исследованной области потенциалов наблюдается типичный для кислых электролитов положительный дифференц-эффект. Величина дифференц-эффекта определялась по формуле:
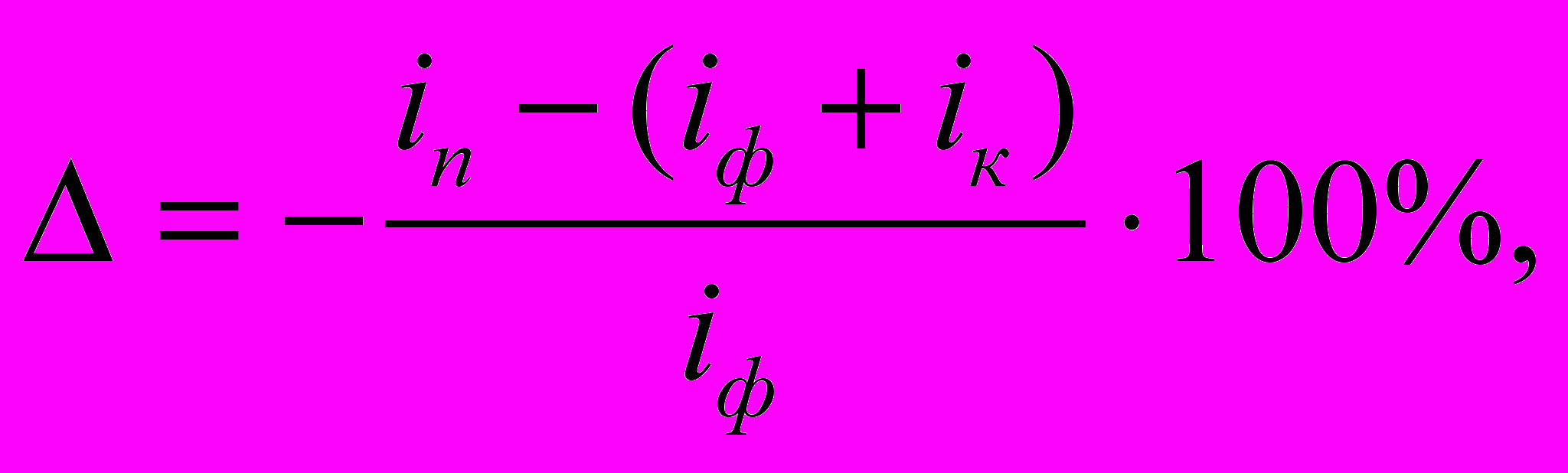 где iп – суммарная скорость растворения анодно-поляризуемого магния с учетом саморастворения; iф – скорость растворения магния, отвечающая закону Фарадея; iк – плотность тока коррозии в отсутствии внешней поляризации; iс = iп – iф – ток саморастворения. Значения скоростей растворения магния, необходимые для расчета величины дифференц-эффекта, представлены в табл. 1.
где iп – суммарная скорость растворения анодно-поляризуемого магния с учетом саморастворения; iф – скорость растворения магния, отвечающая закону Фарадея; iк – плотность тока коррозии в отсутствии внешней поляризации; iс = iп – iф – ток саморастворения. Значения скоростей растворения магния, необходимые для расчета величины дифференц-эффекта, представлены в табл. 1. | Табл. 1. Значения iп, iф, iк, скорости саморастворения (ic) магниевого ВДЭ (ω = 500 об/мин) и величины дифференц-эффекта его при анодной поляризации |
| Состав р-ра, рН = 2,7 | Е, В | iп·102, А/см2 | iф·102, А/см2 | ir·102, А/см2 | iс·102, А/см2 | Δ, % |
| 0,34 М Н3РО4 + 0,17 M HNO3 + NaOH | -1,55 | 7,26 | 2,11 | 6,01 | 5,15 | +40,3 |
| -0,90 | 15,0 | 9,61 | 6,01 | 5,39 | +6,35 | |
| 0,34 М Н3РО4 + 0,17 M HNO3 + 0,01 M Fˉ +NaOH | -1,55 | 6,33 | 2,06 | 3,90 | 4,27 | -18,0 |
| -0,90 | 10,6 | 8,14 | 3,90 | 2,46 | +17,7 | |
| 0,34 М Н3РО4 + 0,17 M HNO3 + 0,05 M Fˉ +NaOH | -1,55 | 9,74 | 2,33 | 3,81 | 7,41 | -155 |
| -0,90 | 11,7 | 11,4 | 3,81 | 0,31 | +30,7 | |
| 0,34 М Н3РО4 + 0,17 M HNO3 + 0,09 M Fˉ +NaOH | -1,55 | 12,1 | 2,63 | 3,45 | 9,47 | -229 |
| -0,90 | 7,00 | 6,89 | 3,45 | 0,11 | +48,5 |
В фосфорнокислых растворах, содержащих фторид-ионы, при малых анодных поляризациях для магния отмечены величины отрицательного дифференц-эффекта (ОДЭ). При значительных анодных потенциалах дифференц-эффект меняет знак с отрицательного на положительный. Столь неоднозначное влияние фторид-иона на электрохимическое поведение магния при различных анодных потенциалах свидетельствует о сложном соотношении термодинамических и кинетических факторов, определяющих вероятность и скорость отдельных сопряженных реакций. При малых анодных потенциалах наблюдаемое увеличение скорости саморастворения металла, что характерно для ОДЭ, может быть вызвано локальной депассивацией магния в результате химического взаимодействия магния с фторид-ионом. При значительных анодных потенциалах действие фторид-иона аналогично действию его в нейтральных и щелочных средах как иона с малой депассивирующей способностью. С увеличением концентрации фторид-иона положительный дифференц-эффект возрастает.
И
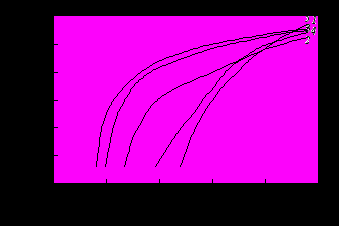
| Рис. 7. Анодные поляризационные кривые на магний-литиевом сплаве в растворах (рН 2,7): 1 – 0,34 М H3PO4 + NaOH; 2 – 0,34 М H3PO4 + 0,17 M HNO3 + NaOH; 3 – 0,34 М H3PO4 + 0,05 M F‾ + NaOH; 4 – 0,17 M HNO3 + 0,05 M F‾ + NaOH; 5 – 0,34 М H3PO4 + 0,17 M HNO3 + 0,05 M F‾ + NaOH |
з сопоставления полученных результатов для электрохимического растворения магния с соответствующими данными для магний-литиевых сплавов типа МА 21 (рис. 7) следует, что в целом для этих сплавов были отмечены те же закономерности, что и для чистого магния: торможение процесса анодного растворения исследуемых объектов уже в первые секунды соприкосновения их с растворами; увеличение скорости анодного процесса с ростом концентрации фосфатов; сдвиг стационарного потенциала магний-литиевых сплавов в область положительных значений при введении фторид- и нитрат-ионов в фосфорнокислый раствор; существенное усиление торможения электрохимического растворения сплавов при увеличение концентрации фторидной добавки более 0,02 моль/л (на магнии более 0,05 моль/л).
Следовательно, в целом наибольшее влияние на кинетику растворения сплавов в исследованной области потенциалов оказывает его магниевая составляющая. Однако кинетика растворения слава не определяется полностью наиболее коррозионностойкой составляющей.
Следует также отметить, что стационарные потенциалы магния и сплава в присутствии фторид-ионов существенно смещались в область положительных значений. Причем стационарный потенциал магний-литиевого сплава МА 21 в нитрат-фосфатных растворах, содержащих фториды, по сравнению с чистым магнием облагораживается, особенно на начальной стадии (τ = 30 с), в значительно большей степени. Очевидно, в результате избирательного растворения β-фазы сплава, богатой литием, происходит защелачивание приэлектродного слоя, что сказывается в дальнейшем на изменении условий образования пассивирующей пленки. Анализ раствора на содержание продуктов анодного растворения сплава МА 21 атомно-абсорбционным методом (Mg) и методом пламенной фотометрии (Li) при малых поляризациях (Е=-0,5 В, τ = 30 с) показал, что скорость растворения лития, в частности, в нитрат-фосфат-фторидном растворе, более чем в 10 раз превышает скорость, которую следовало бы ожидать, исходя из соотношения содержания лития и магния в сплаве.
Таким образом, особенности электрохимического поведения магний-литиевых сплавов в растворах умеренно кислых фосфатов обусловлены изменением состояния поверхности исследуемых объектов, являющейся результатом сложного адсорбционно-химического взаимодействия с компонентами раствора.
Взаимосвязь электрохимического поведения магний-литиевых сплавов с процессами, протекающими при их фосфатировании
Результаты электрохимических исследований согласуются с результатами фосфатирования магний-литиевых сплавов. Так, в присутствии фторидной добавки наблюдается снижение скорости растворения основы и проявляется замедление скорости образования пленки по сравнению с фосфатирующим раствором без нее. В последнем случае образуются более толстые ФП (Р = 54,8 г/м2 против Р = 24,7 г/м2). Увеличение концентрации фторид-иона в фосфатирующем растворе выше 0,3 моль/л для сплава МА 21 приводило к значительному сдвигу потенциала в положительную область. В этих условиях процесс пленкообразования прекращался, что свидетельствует о сильной пассивации поверхности сплавов. Возможно, фторид-ионы адсорбируются на зародышах или растущих кристаллах, блокируя активные центры кристаллизации, тем самым замедляя или подавляя рост кристаллов фосфатной пленки при такой концентрации фторидной добавки.
Согласно данным масс-спектрометрии вторичных ионов в фосфатном покрытии были обнаружены на начальной стадии его формирования наряду с цинком и фосфором ионы солевых добавок. Полученные результаты подтверждают выдвинутое предположение об участие частиц в пассивации поверхности сплавов при фосфатировании. Изменения в формировании ФП на сплавах в присутствии выявленных добавок, возможно, связаны и с особенностями контактного осаждения цинка в их присутствии, что сказывается на структуре и защитной способности ФП.
Отсутствие нитрат-ионов в фосфатирующем растворе, а также замена нитрата цинка эквимолярным количеством сульфата или дигидрофосфата цинка приводило к повышенному газовыделению и образованию фосфатных пленок толстых, рыхлых, с плохой адгезией к основе. Стационарный потенциал сплава в данных растворах на начальном этапе фосфатирования был на 250-300 мВ отрицательнее, чем в растворе с нитратами. Нитрат влияет на изменение состояния поверхности магний-литиевых сплавов, приводя к ее пассивации. О торможении электрохимических процессов, протекающих на магний-литиевом сплаве в цинк-фосфатном растворе в присутствии нитратов, свидетельствуют и более низкие токи взаимодействия (j = 2,57·10‾3 А/см2), по сравнению с токами взаимодействия с растворами, не содержащими нитрат цинка (j = 1,02·10‾2 А/см2).
На условия образования ФП на исследуемых объектах существенное влияние оказывает состав сплава. На более электрохимически активном сплаве ИМВ 12 использование щелочно-активационной обработки поверхности по сравнению со стандартной подготовкой также способствовало получению достаточно тонких (Р = 14,7 г/м2 против Р = 55 г/м2), коррозионностойких (γ = 130 с против γ = 75 с) мелкокристаллических ФП в цинк-фосфатном растворе, но при большей концентрации солевой фторидной добавки Ф3 (0,05 моль/л против 0,02 моль/л для сплава МА 21) и формирование ФП заканчивается за более короткий промежуток времени (5-10 мин против 10-15 мин на сплаве МА 21).
Таким образом, на основании проведенных исследований выявлена взаимосвязь электрохимического поведения магний-литиевых сплавов с особенностями их фосфатирования. Скорость стационарного электрохимического процесса определяет скорость формирования фосфатных пленок.
В пятой главе рассматриваются вопросы, касающиеся изучения закономерностей процесса кристаллизации фосфатных пленок на магний-литиевом сплаве при различных видах предварительной подготовки поверхности.
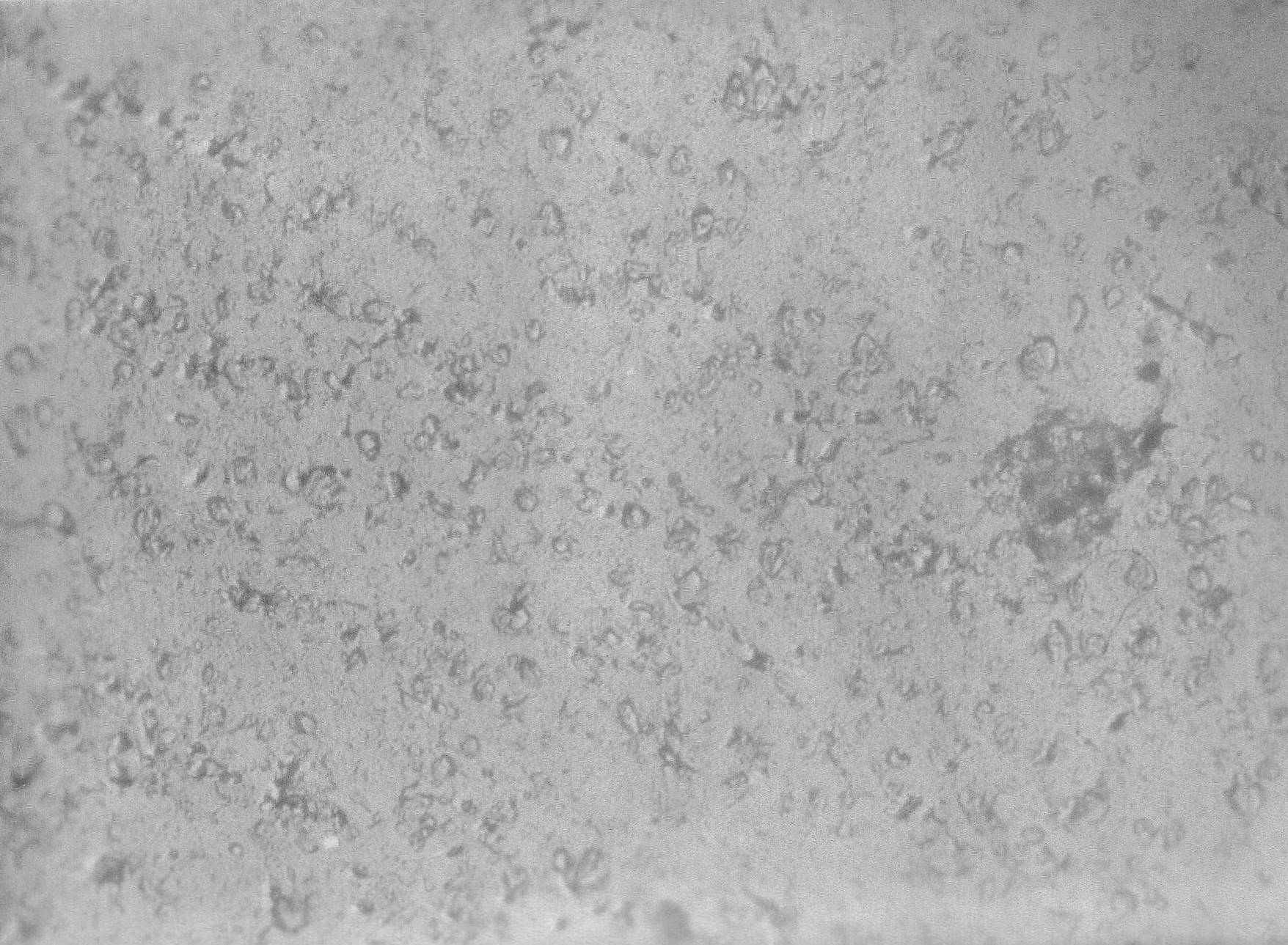
На фотографиях микроструктуры покрытий, полученных на магний-литиевом сплаве при предварительном активировании поверхности, уже в первые секунды фосфатирования наблюдалось большее число первоначальных зародышей кристаллизации по сравнению со стандартной подготовкой (рис. 8 а, в).
Увеличение скорости протекания электрохимических процессов и процесса кристаллизации при использовании щелочно-активационной обработки поверхности на начальной стадии, о чем отмечалось ранее, способствуют впоследствии быстрому экранированию поверхности мелкокристаллическим фосфатным слоем (рис. 8 г).
-
а

б

в

г
Рис. 8. Микрофотографии ФП, полученных на сплаве МА 21 в цинк-фосфатном растворе при стандартной (а, б) и щелочно-активационной (в, г) подготовках поверхности на различных стадиях их формирования: а, в – 5 с; б – 30 мин; г – 10 мин. Tesla BS-500, 5200.
Д

| Рис. 9. Зависимость ln[-ln(1-α)] от lnτ при стандартной (1) и щелочно-активационной (2) подготовках поверхности |
ля более детального изучения процесса кристаллизации ФП на начальных стадиях на магний-литиевых сплавах полученные кинетические данные были обработаны в координатах уравнения Ерофеева (рис. 9), выведенного для такого механизма топохимической реакции, когда лимитирующей стадией является образование и рост зародышей, причем зародышеобразование подчиняется степенному закону.
Результаты обработки экспериментальных данных методом линейной регрессии (у = а + bx, x = ln, y = ln[-ln(1-)], а = lnk, b = n) показали, что указанные зависимости действительно являются линейными как для щелочно-активационной, так и для стандартной подготовок поверхности. В обоих случаях коэффициент корреляции близок к единице. Сравнивая значения параметра n при стандартной и щелочно-активационной обработках поверхности, можно сделать вывод, что в случае последней необходимо меньшее число атомов для образования зародышей и, соответственно, скорость процесса зародышеобразования выше. Сорбированные частицы титансодержащего активатора изменяют условия контактного осаждения цинка, а также приводят к увеличению плотности центров кристаллизации и уменьшению размера кристаллов. При этом активатор способствует формированию фосфатов цинка с первых секунд обработки в фосфатирующем растворе без кумулятивной стадии процесса образования зародышей. Можно высказать предположение, что в случае стандартной подготовки значение параметра n, равное 1,5, говорит о том, что ядра любой формы растут из малого начального объема при нулевой скорости образования, а при щелочно-активационной обработке ядра любой формы растут из заметного начального объема.
Различие в скорости зародышеобразования, обусловленное видом предварительной подготовки поверхности, как отмечалось ранее, приводит к формированию на начальном этапе фосфатирования первичных пассивирующих слоев различной сплошности. Это способствует тому, что дальнейший рост толщины фосфатной пленки происходит по разным законам. В случае стандартной подготовки поверхности, когда в начальный момент времени образуется пористая несплошная пленка, ее рост подчиняется параболическому закону (yn = kt, где у – толщина пленки). Плотный, мелкокристаллический первичный пассивирующий слой, образованный при щелочно-активационной подготовке, создает условия для еще более сильного торможения роста ФП. При этом увеличение толщины пленки происходит по логарифмическому закону y = ln(k).
При допущении, что процесс роста фосфатной пленки лимитируется только скоростью транспорта реагентов, отмеченное выше первоначальное изменение ее сплошности впоследствии по-разному сказываются на диффузии компонентов фосфатирующего раствора через пористую пленку гопеита.
Таким образом, определяющая роль в создании условий для ускоренного получения в цинк-фосфатном растворе коррозионностойких, тонкослойных ФП с улучшенной структурой принадлежит предварительной щелочно-активационной подготовке поверхности, т. к. именно она определяет состояние поверхности магний-литиевых сплавов, а, следовательно, скорость протекания электрохимических процессов и условия кристаллизации.
