Описторхозе у населения среднего приобья
| Вид материала | Документы |
СодержаниеОтносительная площадь гранул и конгломератов метаболита Практические рекомендации Список работ, опубликованных по теме диссертации |
- Хронобиологические аспекты работоспособности спортсменов в условиях Среднего Приобья, 79.46kb.
- Сборник статей и материалов, посвящённых традиционной культуре Новосибирского Приобья, 3550.79kb.
- Середовских Б. А., Рянский Ф. Н., Чибиряк, 149.44kb.
- Вопрос 1: Современное состояние страхового рынка России: проблемы, перспективы развития, 70.75kb.
- Авлена на создание эффективной конкурентной экономики, обеспечивающей повышение уровня, 79.39kb.
- Кредитование малого и среднего бизнеса в Украине, 87.31kb.
- Родов Среднего Урала раскрыто в литературе с точки зрения особенностей формирования, 255.03kb.
- Утвердить генеральный план сельского поселения Ваховск с расчетной численностью населения, 699.45kb.
- Экологические функции четвертичных покровных отложений верхнего приобья 25. 00., 2531.63kb.
- Патогенные микромицеты и оптимизация фитосанитарного состояния лука в лесостепи приобья, 536.05kb.
*к
*к
Рис. 5. Респираторный отдел легкого пациента Ф-ва. Деструкция и сморщивание альвеолоцита 2-го типа (Ал2), уменьшение в цитоплазме Ал2 количества ламеллярных телец, разрушение сурфактанта на внутренней поверхности альвеолы (пунктирная стрелка), увеличение количества коллагеновых волокон (стрелка) в интерстициального пространства (ИП). Относительная сохранность ультраструктуры альвеолоцита 1-го типа (Ал1). * – базальная мембрана, АМ – альвеолярный макрофаг с высоким содержанием вакуолей и различных типов лизосом (первичные, вторичные, остаточные тельца), ПА – просвет альвеолы, Фб – фибробласт. Ув. х 10400.
В более поздних стадиях эксперимента (120 суток) при микроскопическом исследовании выявляется склероз интерстиция респираторных отделов легких и плоскоклеточная метаплазия эпителия. Особого внимания заслуживает осложнения МО в виде скоплений и формирование вокруг этого субстрата гранулем, которые локализуются в межуточной ткани, в начале своей эволюции они характеризируются многоклеточным составом: лейкоциты, макрофаги, плазматические клетки, фибробласты, в период хронической фазы СО - представляют склеротические фокусы или целые поля с незначительным числом макрофагов.
Описанные морфологические проявления укладывается в картину фиброзирующего альвеолита, в пато- и морфогенезе которого ведущая роль принадлежит лейкоцитам, прежде всего эозинофильной популяции, а инициаторным, этиологическим, фактором – паразитарный пигмент-метаболиты описторхисов. Описторхозная инвазия независимо от стадии течения у лабораторных животных вследствие биологических свойств паразита несет в себе мембранодестабилизирущие потенции, заключенные в фосфолипидном составе описторхисов: в клетках гельминта выявлена большая часть (до 24,5%) лизофосфодитилхолина- существенного фактора агрессии на цитомембраны, т.к лизоформы нарушают ориентацию мембранных структур, формируют дополнительные ионные каналы (В.И. Крылов и др., 1984; В.Г. Бычков, 1988).
С целью выявления механизмов повреждений клеток и фибробластических процессов проведены биохимические исследования плазмы крови, тканей легких и печени, лабораторных животных при СО. Паразиты способны вызывать повышение активности фосфолипаз и депрессию антиоксидантной защиты. Наиболее выраженная фосфолипазная активность (р< 0,01) по сравнению с нормативными показателями проявляется к 10 сут инвазии. Однако независимо от длительности вегетирования гельминтов закономерно отмечается повышение уровня пероксидации липидов мембран клеток печени и снижение показателей антиоксидантной системы. Следует отметить, что аналогичное состояние пероксидации липидов и антиоксидантной системы наблюдается вне органов вегерирования описторхисов – в легких (табл. 6).
Таблица 6
Динамика пероксидации липидов, активности эндогенных фосфолипаз и антиоксидантов в гомогенатах легочной ткани сирийских хомяков в зависимости от длительности описторхозной инвазии
| Показатели | Длительность инвазии (сут) | |||||
| 0 (n= 5 | 9 (n = 15) | 60 (n=15) | 90 (n =18) | 120 (n = 14) | 160 (n = 12) | |
| Диеновые коньюгаты (нМоль/г) Малоновый диальдегид (нМоль/г) Фосфолипазная активность (нМоль/мг Β-каротин (мкМоль/л) СОД/ед.активности | 192,4±12,6 0,018±0,003 6,18±2,8 1,4±0,33 0,14±0,08 | 218,2±9,8 0,16±0,04 22,4±2,8 0,7±0,08 0,34±0,09 | 290,8±14,2 0,24±0,03 25,6±6,1 0,15±0,09 0,28±0,09 | 196,4±9,8 0,21±0,07 28,5±7,3 0,12±0,07 0,18±0,02 | 190,6±8,4 0,2±0,04 23,3±4,8 0,62±0,07 0,11±0,01 | 194,4±10,6 0,092±0,006 20,4±3,5 0,72±0,04 0,09±0,03 |
Диффузно отмечается картина фиброзирующего альвеолита с сидерофагами в просвете, бронхиолита с пролиферацией и дисплазией эпителия; в мелких бронхах – хронический бронхит с метапластической перестройкой элементов выстилки.
По данным электронно-микроскопического исследования установлено, что патоморфологические изменения при ХОБЛ на фоне СО сводятся к следующему. В трахее и бронхах с внутренним диаметром > 2 мм преимущественно увеличивается количество макрофагов и лимфоцитов, в эпителиальном пласте – бокаловидных клеток, отмечается плоскоклеточная метаплазия эпителия. В бронхах с внутренним диаметром < 2 мм и бронхиолах повышается число макрофагов, лимфоцитов, эозинофилов, фибробластов и в меньшей степени - нейтрофилов. Происходит утолщение стенки бронхиол, отмечается перибронхиальный фиброз, воспалительный экссудат в просвете бронха, сужение бронхиол, усиливаются проявления воспалительных реакций. В паренхиме легких (респираторные бронхиолы и альвеолы) также повышается количество макрофагов и лимфоцитов. Происходит разрушение альвеолярной стенки, деструкция всех типов альвеолоцитов и эндотелиальных клеток микрососудов.
В просвете легочных сосудов повышается число макрофагов и лимфоцитов, происходит утолщение интимы, выявляются структурные признаки дисфункции эндотелиальных клеток и гипертрофии гладкомышечных клеток сосудов мышечного типа (мелкие артерии, артериолы), ремоделирование легочных сосудов, происходит коллагенизация бронхиол и альвеол. На этом фоне выявляются признаки неоваскулогенеза и значительное усложнение пространственной организации микрососудов. Все это неизбежно приводит к структурно-функциональной реорганизации воздухоносных путей и респираторного отдела легких, нарушается секреция мокроты и ее пассаж, уменьшается проницаемость аэрогематического барьера. Повреждение альвеолоцитов второго типа приводит к нарушению функции сурфактантной оболочки, уменьшение клеток Клара - к нарушению дренажно-детоксикационной функции бронхиол и активации фибробластов с последующей коллагенизацией бронхиол и альвеол.
При сравнении результатов гистологической картины секционного материала и легких лабораторных животных были обнаружены в интерстициальной ткани респираторного отдела отложения пигментированного субстрата – метаболитов гельминта (табл. 7).
Таблица 7.
Относительная площадь гранул и конгломератов метаболита
описторха в тканях легких (%)
| Поле зрения микроскопа | Общая площадь занимаемая отложениями метаболита на срезе | Гранулы размером 1,9-3 мкм | Конгломераты размером 3-8 мкм | Конгломераты размером 8-16 мкм | Конгломераты размером 16-32 мкм | Конгломераты размером свыше 32мкм |
| Площадь среза | 5,4 | 0,6 | 0,97 | 1,07 | 2,08 | 0,68 |
| Площадь метаболитов в срезе | - | 11,1 | 17,95 | 19,85 | 38,6 | 12,5 |
Если применительно к пациентам данные включения можно было бы принять за вещества грубого экологического прессинга (неорганические пыли), то выявление отложений с аналогичными тинкториальными свойствами в легких сирийских хомяков с воздействием факторов окружающей среды связать невозможно. Метаболиты описторхисов являются агентом, обладающим свойствами фактора, инициирующего миграцию клеток гемопоэтического ряда и механоцитов. При крупнодисперсном состоянии метаболитов вокруг них в интерстиции легких формируются клеточные инфильтраты с четко выраженными границами и формированием гранулем с последующим их склерозом.
При диффузном варианте локализации метаболитов (мелкодисперсные фрагменты), выделяющихся через шипики тегумента, инициируется диффузный медленно текущий процесс перестройки соединительнотканного компонента бронхиоло-альвеолярной пограничной зоны. Ремоделирование бронхиоло-альвеолярной пограничной зоны вызывает снижение функций газообмена на больших территориях респираторного отдела легких. Течение продуктивного воспаления приводит к перестройке соединительной ткани и вовлечению в патологический процесс эпителиальных компонентов ацинусов легкого. Коллагенизация интерстиция отрицательно сказывается на состоянии трофики альвеолоцитов, замедляется продукция компонентов сурфактанта, меняется газотранспортная система пневмоцит-базальная пластинка пневмоцита-интерстиций - стенка капилляра.
Эндотелий кровеносных капилляров респираторного отдела легких, проявляя свойства клеток-ловушек, продолжает кумулировать метаболиты гельминта, создавая их повышенную концентрацию и активную перестройку межальвеолярной соединительной ткани.
При развитии заболеваний легких по данному сценарию патогенетически оправданным будет назначение пациентам кортикостероидных препаратов, которые с одной стороны купируют миграцию эозинофилов, а с другой стороны купируют миграцию эозинофилов, а с другой стороны замедляют фибриллогенез в соединительной ткани интерстиция легкого. Оба эти процесса могут оптимизировать клинику течения болезни. Нарушение трофики альвеолоцитов 2 типа (секреторные) приводит к угнетению продукции сурфактанта, и, как следствие, формированию ателектатических очагов. Разрыхление базальной пластинки альвеолоцитов создает условия для проникновения клеток крови в полость альвеол. Полнокровие, состояние эндотелия сосудов и диапедез форменных элементов, напоминает картину легкого при шоке и ДВС-синдроме. Однако следует отметить, что гормонотерапия депрессирует синтез ИЛ – 5 и катионных белков лейкоцитов, что может послужить причиной обострения банального воспаления. Поэтому лечение больных должно быть строго индивидуальным с оценкой всех последствий назначения лекарственных средств.
При воздействии паразитарного пигмента происходят ускоренные процессы биосинтеза и биодеградации коллагена, манифестирующие склеротические изменения в легких при наличии гранулематозного воспаления.
Уровень пролина характеризует скорость биосинтеза и деградации коллагена в мезенхимальных образованиях, наибольшее содержание его отмечается к 90 сут описторхозной инвазии(44,13 ± 2,3 мк Моль/л), что в 8,5 раза больше по сравнению с нормативными показателями (5,20± 0,11 мкМоль/л). Динамика концентрации суммарной фракции гликозаминогликанов, катепсина Д и пролина у сирийских хомяков в зависимости от длительности инвазии представлена на рис. 6.
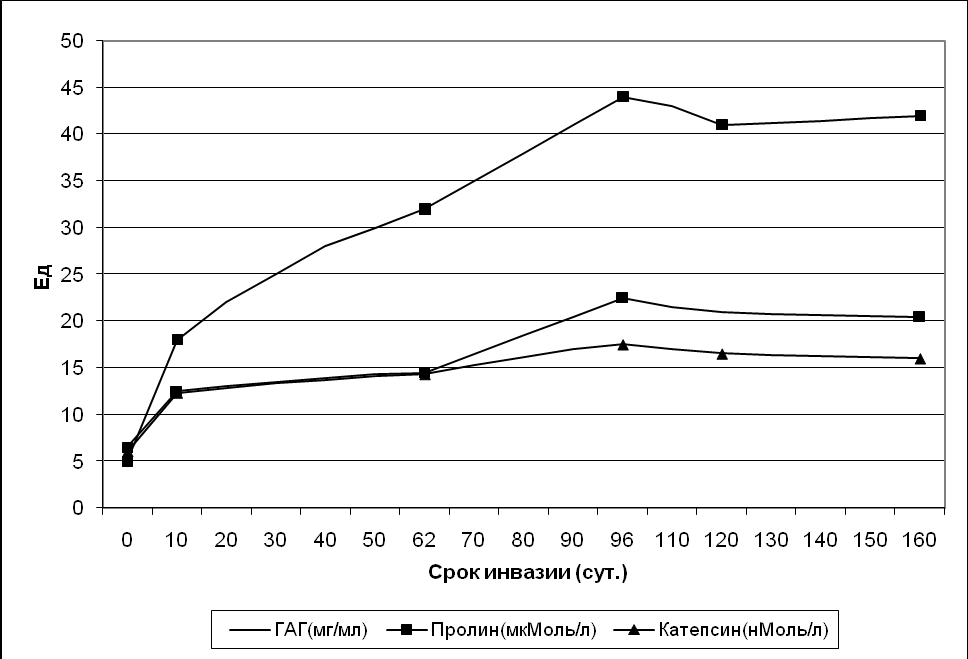
Рис. 6. Динамика концентраций гликозаминогликанов, пролина и катепсина Д при описторхозе в зависимости от длительности инвазии хомяков.
При проведении молекулярно-генетических исследований оказалось, что СО сопровождается экспрессией гена регулятора VEGFR (фактор роста эндотелия и клеток механоцитарных дифферонов) и мутацией гена EGFR (фактор эпидермального роста). Экспрессия VEGFR создает условия для ремоделирования микроциркуляторного русла, а мутация EGFR – для репарации эпителия бронхолегочной системы.
Таким образом, при суперинвазионном описторхозе в экспериментах и клинике развивается полиморфная патология: в острой фазе – шоковое легкое с предпосылками возникновения ДВС – синдрома. В поздней, хронической стадии СО является фоном, при котором могут развиваться хронический бронхит, бронхиолит, бронхиальная астма и диффузные интерстициальные заболевания: пневмониты, синдром Леффлера, вторичная хроническая легочная эозинофилия и легочные геморрагические синдромы (с. Чердж-Стросса, с. Гудпасчера). Суперинвазионный описторхоз является основным или фоновым заболеванием для перечисленных нозологических форм и реактивных состояний, развивающихся не без участия других экзогенных факторов.
Выводы
- Клинические проявления и тяжесть течения заболеваний легких у больных с СО обусловлены формированием сочетанной патологии бронхиальной астмы и ХОБЛ, характеризуются волнообразностью и неустойчивостью клинической симптоматики, стойкостью нарушениий проходимости дыхательных путей и прогрессированием дыхательной недостаточности.
- Структурно-функциональные изменения эритроцитов и тромбоцитов у больных с заболеваниями легких при СО характеризуются дезорганизацией биомембран эритроцитов и тромбоцитов, снижением уровня деформируемости эритроцитов, усилением агрегационной активности, способности тромбоцитов к тромбообразованию и отражают тяжесть течения заболевания, тесно ассоциированы с выраженностью вентиляционных и газообменных нарушений, что подтверждает клинико-патогенетическую роль мембранопатологических процессов в формировании и прогрессировании бронхообструктивного синдрома, интерстициальных заболеваний легких и легочных эозинофилий.
- При описторхозной инвазии активируется перекисная модификация липидов на фоне снижения активности антиоксидантного потенциала в тканях легких и крови, повышается скорость биосинтеза и деградации коллагена, синтеза глюкозаминогликанов и катепсина Д в сыворотке крови.
- Включение в базисную терапию фенспирида в дозе 160 мг/сутки в течение 8 недель больным с бронхиальной астмой легкой и средней степени тяжести, сочетанием бронхиальной астмой и ХОБЛ без ХДН и альмитрина в дозе 50 мг\сутки в течение 12 недель пациентам с сочетанием бронхиальной астмой и ХОБЛ, осложненным ХДН I и II степени, при СО уменьшает выраженность клинических симптомов, восстанавливает дисбаланс системы оксиданты-антиоксиданты и стабильное состояние липидной фазы мембран эритроцитов и тромбоцитов, увеличивает деформируемость эритроцитов и снижает функциональную активность тромбоцитов.
- Лекарственная терапия пациентов при СО с использованием препаратов кортикостероидов, должна быть строго индивидуальна, однако в остром периоде или обострении заболеваний легких является необходимой с целью купирования эозинофильной инфильтрации интерстиция и фиброза.
- Инициирующим агентом патоморфологических процессов в легких при СО являются пигментсодержащие метаболиты гельминта, приобретающие статус доминантного фактора, выполняющего функции локального и дистантного регулятора активности деструктивных и регенераторных процессов в организме больного человека или в организме экспериментального животного при моделировании паразитоза с повторными заражениями.
- При СО диффузия метаболитов в интерстициальную соединительную ткань обеспечивает регуляцию процессов гисто- и органотипического уровней, протекающих в легком.
- При крупнодисперсном фазовом состоянии метаболитов вокруг них в интерстиции легких образуются клеточные инфильтраты с выраженными границами и формированием гранулем с последующим их склерозом. При мелкодисперсном варианте фазового состояния метаболитов инициируется диффузный медленно текущий процесс перестройки соединительнотканного компонента бронхо-альвеолярной пограничной зоны. Ремоделирование структурных компонентов ацинуса вызывает снижение функций газообмена в респираторном отделе легких.
- При СО патоморфологические процессы в легких инициируются на молекулярно-генетическом уровне, что связано с экспрессией гена-регулятора VEGFR( фактор роста сосудистого эндотелия и клеток механоцитарных дифферонов), а также мутацией гена EGFR- эпидермального фактора роста.
- При СО происходит коллагенизация интерстиция, нарушение трофики и ослабление секреторной активности альвеолоцитов II порядка, что приводит к снижению продукции сурфактанта, создавая условия для развития ателектатических очагов в ацинусах легких.
Практические рекомендации:
- Стратегия комплексной терапии заболеваний легких у пациентов в гиперэндемичном очаге наряду с лечебными мероприятиями должна предусматривать диагностику описторхоза, дегельминтизацию и мероприятия профилактического характера по предупреждению повторных заражений гельминтозом.
- У больных СО с бронхообстуктивным синдромом, легочными эозинофилиями и интерстициальными болезнями легких показано исследование морфо-функциональных свойств эритроцитов и тромбоцитов для решения вопроса об использовании препаратов, обладающих антиагрегатным и мембаностабилизирующим действием.
- В период ремиссии легочных заболеваний у больных СО показаны исследования параметров газового состава крови, функции внешнего дыхания, бодиплетизмографии.
- Пациентам с бронхообструктивным синдромом, осложненным ХДН, показана респираторная поддержка в виде неинвазивной вентеляции легких в режиме ВiРаР без интубации трахеи.
- При лечении больных СО с бронхиальной астмой в сочетании с ХОБЛ показано применение альмитрина, как средство патогенетической терапии ХДН.
- Применение фенспирида рекомендуется как эффективный способ контроля клинических проявлений бронхиальной астмы и ХОБЛ без ХДН, структурно-функциональных свойств цитомембран эритроцитов и тромбоцитов.
- При лечении больных СО с заболеваниями легких патогенетически целесообразно назначение кортикостероидных препаратов, обладающих способностью вызывать эозинопению и замедлять фибриллогенез в интерстиции легкого.
Список работ, опубликованных по теме диссертации
- О.Г. Контарева. Особенности состояния клеточных мембран и агрегационной активности тромбоцитов у больных бронхитом (коррекция фенспиридом). / Материалы XXXII Всероссийской научной конференции молодых ученых, Тюмень, 2003, с.94-95.
- О.Г. Контарева. Клинико-метаболическая эффективность фенспирида у больных хроническим обструктивным бронхитом, осложненным легочной гипертензией и хроническим легочным сердцем./ Омский научный вестник, Всероссийская научная конференция, посвященная памяти профессора А.А. Никифоровой (100 лет со дня рождения), март 2004, Омск, с.145-147.
- О.Г. Контарева. Защитные механизмы и регенераторные свойства биомембран тромбоцитов у больных хроническим обструктивным бронхитом./ О.Г. Контарева, А.В. Ковалева, А.Ю. Кохно./ Материалы Международной научной конференции, Медико-биологические и экологические проблемы здоровья человека на севере, г. Сургут, 11-13 ноября изд. «Дефис», Сургут, 204, с.109-110.
- О.Г. Контарева. Компенсаторные механизмы репаративной регенерации биомембран при хроническом обструктивном бронхите и коррекции мембранопротекторами./ О.Г. Контарева, В.Г. Соловьев, А.Ю. Кохно./ Медицинская наука и образование Урала, Тюмень, №2, 2005, с.31.
- О.Г. Контарева. Клинико-морфологические параллели при комплексном лечении больных хроническим обструктивным бронхитом с применением препарата арманор (альмитрин)./ О.Г. Контарева, А.Ю. Кохно./ Медицинская наука и образование Урала, Тюмень №5/2005, с.31.
- О.Г. Контарева. Эффективность терапии больных хронической обструктивной болезни легких с дыхательной недостаточностью альмитрином бесмисилатом (арманор) в Ханты-Мансийском автономном округе./ О.Г. Контарева, А.Ю. Кохно, В.Г. Соловьев, И.В. Медведева./Юбилейная Российская научная конференция, 29-31 мая 2007, Санкт-Петербург, с.133.
- О.Г. Контарева. Исследование деформабильности эритроцитов у больных хронической обструктивной болезнью легких при лечении альмитрином бисмесилатом (арманор)./ О.Г. Контарева, А.Ю. Кохно, В.Г. Соловьев, И.В. Медведева./Юбилейная Российская научная конференция, 29-31 мая 2007, Санкт-Петербург, с.133-134.
- О.Г. Контарева. Результаты клинико-инструментальных и современных физико-химических методов исследования больных ХОБЛ при комплексной терапии с использованием препарата альмитрина./ В.Г. Соловьев, О.Г. Контарева, А.Ю. Кохно./ Медицинская наука и образование Урала, Тюмень №4/2007, с.60-61.
- О.Г. Контарева. Динамика структурно-функциональных показателей клеток эритроидного ряда у больных хронической обструктивной болезнью легких при лечении альмитрином ./О.Г. Контарева, А.Ю.Кохно./ Материал 41-й Всероссийской научной конференции студентов и молодых ученых «Актуальные проблемы теоретической, экспериментальной и клинической медицины », Тюмень 2007, с.69
- О.Г. Контарева. Реорганизация цитоархитектоники эпителиального пласта бронхов у пациентов с хроническим обструктивным бронхитом./ О.Г. Контарева, А.Ю.Кохно./ Морфология, 2008, №2, с.66.
- О.Г. Контарева. Ультраструктурные изменения клеток Клара и каемчатых клеток слизистой оболочки бронхов у больных с хроническим обструктивным бронхитом./ Морфология, 2008, №3,с.54.
- О.Г. Контарева. Морфофункциональная характеристика слизистой оболочки бронхов у больных хроническим обструктивным бронхитом при лечении фенспиридоном./ О.Г. Контарева, А.Ю.Кохно./ Морфология, 2008, №3, с.54.
- О.Г. Контарева. Состояние мембран эритроцитов больных до и после лечения армонормом / О.Г. Контарева, А.Ю. Кохно и В.Г. Соловьев / Морфология, 2008, №5, с.75.
- О.Г. Соловьева, В.Г. Бычков, И.В. Медведева и др. /Синдром Черджа-Стросса в резидуальном периоде описторхоза./ Медицинская наука и образование Урала, Тюмень №1, 2010, с.118-121.
- А.Ю. Кохно, О.Г. Соловьева, И.В. Медведева./ Опыт применения неинвазивной вентиляции легких у больного хронической обструктивной болезнью легких с острой дыхательной недостаточностью./ Медицинская наука и образование Урала, Тюмень №1, 2010, с.141-142.
- О.Г. Соловьева, В.Г. Бычков, И.В. Медведева и др./Легочно-почечный синдром (с. Гудпасчера) в гиперэндемичном очаге описторхоза./ Медицинская наука и образование Урала, Тюмень №1, 2010, с.145-148.
- О.Г. Соловьева./ Морфофункциональные свойства эритроцитов при обострении хронической обструктивной болезни легких./ Медицинская наука и образование Урала, Тюмень №2, 2010, с.75-79.
- О.Г. Соловьева, В.Г. Бычков, И.В. Медведева и др. /Экзогенный аллергический альвеолит (гиперчувствительный пневмонит) в сочетании с бронхиальной астмой на фоне суперинвазионного описторхоза./ Медицинская наука и образование Урала, Тюмень №2, 2010, с.110-113.
- Cоловьева О.Г. Морфофункциональные особенности тромбоцитов при сочетании бронхиальной астмы и хронической обструктивной болезни легких на фоне описторхозной суперинвазии. «Медицинская наука и образование Урала», Тюмень, №1, 2011, с. 43-45.
- Соловьева О.Г., Бычков В.Г., Хадиева Е.Д., Баранов С.В. Легочная патология при суперинвазионном описторхозе (клинико-экспериментальное исследование). «Медицинская наука и образование Урала», 2010, №3, С.66-70.
- Соловьева О.Г., Хадиева Е.Д., Бычков В.Г., Соловьев Г.С. Деструкция и ремоделирование компонентов аэрогематического барьера на фоне суперинвазионного описторхоза. «Медицинская наука и образование Урала», 2010, №4, С.57-59.
- Соловьева О.Г., Кохно А.Ю., Бекетов Б.Н., Истомина О.Ф., Соловьев В.Г. Состав биомембран тромбоцитов и эритроцитов у больных хронической обструктивной болезнью легких на фоне комплексной терапии./ Морфология, 2010, №4, с. 178.
- Соловьева О.Г., Хадиева Е.Д., Бычков В.Г. Роль метаболитов паразита в патогенезе легких при суперинвазионном описторхозе.//Пермский медицинский журнал, 2011. №2, Т.28. с.11-114.
- Соловьева О.Г. Динамика газового состава крови больных с заболеваниями легких при суперинвазионном описторхозе и на фоне комплексной терапии.//Пермский медицинский журнал, 2011, №2, Т.28.с.82-87.
- Соловьева О.Г., Медведева И.В. Влияние комплексной терапии на морфофункциональные свойства эритроцитов у больных с хронической обструктивной болезнью легких.// Медицинская наука и образование Урала, 2011, №1, с. 149-151.
- С.В. Куликова, Е.Д. Хадиева, С.А. Орлов, О.Г. Соловьева, В.М. Золотухин, А.Х. Сабиров, В.Г. Бычков. Поражение сердца при суперинвазионном описторхозе.// Медицинская наука и образование Урала, 2011, №1, с. 66-68.
- О.Г. Соловьева, М.И. Беляева, Е.Д. Хадиева, С.В. Куликова, И.В. Гарчук, А.Х. Сабиров, В.Г. Бычков. Патогенетические аспекты осложненных форм суперинвазионного описторхоза.// Инфекционные болезни, 2011, №2, с. 28-32.
- Гарчук И.В., Зиновьева А.В., Соловьева О.Г. Метаболиты описторхисов как локальный и дистантный фактор регуляции патологических процессов при суперинвазионном описторхозе (экспериментальное исследование)// Материалы всероссийской научной конференции «Актуальные проблемы теоретической, экспериментальной, клинической медицины и фармации». Тюмень, 2011. С. 112-113.
- Соловьева О.Г. Динамика морфологических проявлений поражения воздухоносных путей при суперинвазионнном описторхозе)// Материалы всероссийской научной конференции «Актуальные проблемы теоретической, экспериментальной, клинической медицины и фармации». Тюмень, 2011. С. 95-97.
- М.И. Беляева, В.Г. Бычков, Н.В. Кравец, В.В. Мефодьев, Л.А. Прилукова, О.Г. Соловьева, Е.Д. Хадиева, С.В. Куликова, В.К. Зырянов, Л.В. Андронова. Экспериментальные данные о токсическом и ростостимулирующем эффектах Opistorhis felineus./Rivolta, 1884. //Медицинская паразитология, 2011, №2, с. 51-54.
- Соловьева О.Г., Соловьев В.Г., Зиновьева А.В., Золотухина Е.В., Хадиева Е.Д. Состояние микроциркуляторного русла и интерстиция респираторного отдела легкого при суперинвазионном описторхозе (СО).// Морфология. 2011.№3. С.99.
- Соловьева О.Г. Состояние эпителиального и сурфактантного компонентов аэрогематического барьера при суперинвазионном описторхозе// Морфология. 2011.№3. С.103.
Список сокращений
БА-бронхиальная астма
БОС – бронхообструктивный синдром
ДК-диеновые конъюгаты
ЖЕЛ – жизненная емкость легких
ИЗЛ - интерстициальные заболевания легких
ИКЧ – индекс курящего человека
ИФА – идиопатический фиброзирующмй альвеолит
ЛЭ – легочные эозинофилии
ЛФХ – лизофосфатидтлхолин
МА – максимальная агрегация
МД – максимальная дезагрегация
МДА – малоновый диальдегид
ОЕЛ – общая емкость легких
ОДН – острая дыхательная недостаточность
ОО – остаточный объем легких
ОФВ1 - объем форсированного выдоха за 1 секунду
ОФЛ – общие фосфолипиды
ПОС – пиковая объемная скорость
СО – суперинвазионный описторхоз
СФМ – сфингомиелин
ФС – фосфатидилсерин
ФЭА – фосфатидилэтаноламин
ФХ – фосфатидилхолин
ХДН – хроническая дыхательная недостаточность
ХОБЛ – хроническая обструктивная болезнь легких
ФВД – функция внешнего дыхания
ФГ - фибриноген
ЭАА – экзогенный аллергический альвеолит
I/Io – коэффициент деформируемости эритроцитов
CPБ – С-реактивный белок
Hb - гемлглобин
Ht - гематокрит
MCH - среднее содержание гемоглобина в эритроцитах
MCV - средний объем эритроцита
RDW - степень анизоцитоза эритроцитов
tg α - начальная скорость агрегации
СОЛОВЬЕВА
ОЛЬГА ГЕОРГИЕВНА
КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ ЗАБОЛЕВАНИЙ
ЛЕГКИХ ПРИ СУПЕРИНВАЗИОННОМ ОПИСТОРХОЗЕ
У НАСЕЛЕНИЯ СРЕДНЕГО ПРИОБЬЯ
14.01.04 – внутренние болезни
14.01.09 - инфекционные болезни
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
