Описторхозе у населения среднего приобья
| Вид материала | Документы |
- Хронобиологические аспекты работоспособности спортсменов в условиях Среднего Приобья, 79.46kb.
- Сборник статей и материалов, посвящённых традиционной культуре Новосибирского Приобья, 3550.79kb.
- Середовских Б. А., Рянский Ф. Н., Чибиряк, 149.44kb.
- Вопрос 1: Современное состояние страхового рынка России: проблемы, перспективы развития, 70.75kb.
- Авлена на создание эффективной конкурентной экономики, обеспечивающей повышение уровня, 79.39kb.
- Кредитование малого и среднего бизнеса в Украине, 87.31kb.
- Родов Среднего Урала раскрыто в литературе с точки зрения особенностей формирования, 255.03kb.
- Утвердить генеральный план сельского поселения Ваховск с расчетной численностью населения, 699.45kb.
- Экологические функции четвертичных покровных отложений верхнего приобья 25. 00., 2531.63kb.
- Патогенные микромицеты и оптимизация фитосанитарного состояния лука в лесостепи приобья, 536.05kb.
Р
Оценка клинико-анамнестических, инструментальных и лабораторных параметров у жителей Приобья
Кашель, одышка, дневные и ночные симптомы, ограничение активности, употребление в пищу рыбы семейства карповых, стаж курения, эозинофилия крови, мокроты, рентген ОГК, ФВД (ОФВ1 с бронходилатационным тестом, ЖЕЛ, ТТ), пикфлоуметрия, бодиплетизмография, Эхо-КГ, газы крови, кал на яйца Оpisthorchis felineus, Ig E, СРБ, антитела к Оpisthorchis felineus, билирубин, АЛТ, АСТ, УЗИ ОБП.
ис. 1. Дизайн исследования

Исключение по противопоказаниям
Критерии включения (GINA,2007; GOLD,2007)

Здоровые (n=60)


Основной контингент обследуемых пациентов с СО (n=264)




БА+ХОБЛ с ХДН 1 ст (n=62)
ЛЭ и ИЗЛ (n=17)
БА+ХОБЛ без ХДН (n=85)
БА (n=50)
БА+ХОБЛ с ХДН 2 ст (n=50)




 он
онНеконтролируемый и контролируемый периоды
Контролируемый период
Неконтролируемый период и контролируемый период-1



Клинико-инструментальное и специализированное исследование Кашель, одышка, мокрота, ФВД, бодиплетизмография, пикфлоуметрия, газы крови, продукты пероксидации (ДК, МДА), α-токоферол, фосфолипиды (ЛФХ, ФС, СФМ, ФЭА, ФХ, ОФЛ) в мембранах эритроцитов и тромбоцитов, морфофункциональные характеристики эритроцитов (MCV, MCH, RDW, деформируемость), тромбоцитарное звено гемостаза (агрегационная активность и морфологические формы)






БА (n=50)
БА+ХОБЛ с ХДН 2 ст (n=50)


БА+ХОБЛ без ХДН (n=85)
БА+ХОБЛ с ХДН 1 ст (n=62)
ЛЭ и ИЗЛ (n=17)




Фенспирид (8- недельный курс лечения)
СГКС и Вит. Е (4- недели терапии)
Контролируемый период-2


Альмитрин бисмесилат (12-недельный курс лечения)



Контрольное клинико-инструментальное и специализированное исследование. Итоговая оценка результатов лечения.



Экспериментальная часть
- Оценка деформируемости эритроцитов осуществлялась по методу Corry, Meiselman, 1978 г., базирующемся на принципе воздействия центробежной силы на эритроцит при центрифугировании. Количественно способность эритроцитов к деформации выражали через соотношение I/Io, где I - размеры клеток после центробежного воздействия, Io - до центробежного воздействия. Морфологические характеристики эритроцитов: количество эритроцитов, уровень гемоглобина (Нв), гематокрита (Ht), средний объем эритроцита (MCV), среднее содержание гемоглобина в эритроцитах (МСН), степень анизоцитоза эритроцитов (RDW) проводилось на гематологическом анализаторе Act diff 2 (Beckman, США), основанного на кондуктометрическом методе с измерением амплитуды электрического сигнала при прохождении клетки через измерительный канал.
- Подсчет количества тромбоцитов осуществлялось в камере Горяева с использованием фазово-контрастной микроскопии (В.В.Меньшиков и соавт., 1987), а исследование морфологических форм тромбоцитов: дискоциты (%), активированные формы (%), из них сфероциты (%), число малых и больших агрегатов согласно методике Шитиковой А.С. с соавт. (1996). Для оценки агрегации тромбоцитов фотометрическим методом использовался индуктор агрегации АДФ в концентрации 2х10-5 моль/л с графической регистрацией на агрегометре «БиохимМак». Изучали максимальную степень агрегации (МА), максимальную степень дезагрегации (МД), время достижения максимальной агрегации (Т), время достижения ½ от МА (½ Т), начальную скорость агрегации (tg α), выражающуюся через тангенс угла наклона агрегатограммы в первые секунды агрегации (А.Ш. Бышевский и соавт., 1996).
- Характеристика экспериментального и клинического материала при гистологическом и электронно-микроскопическом исследовании, молекулярно-генетические исследования.
Модель описторхоза создавали у сирийских хомяков (160) массой 95±4,8 г - самцов, животные содержались в стандартных условиях вивария (З.Ф.Лоскутова, 1990). Метацеркарии из язей (Leuciscus idus) одного биотопа выделяли путем ферментативного переваривания по методике Г.А.Глазкова (1977). При выполнении экспериментов соблюдались все правила работы с лабораторными животными (приказ МЗ РФ № 755 от 12.08.77; Федеральный закон РФ «О защите животных от жесткого обращения» от 01.12.1999). Лабораторные животные разделены на II группы; 1 - контрольная (44 животных), II - модель суперинвазионного описторхоза - заражение 50 метацеркариями (192), повторное заражение через 14 суток 50 личинками паразита. После 3, 6, 9, 16, 24, 29, 41, 60, 90, 120, 160 суток хомяков забивали под эфирным наркозом. Кусочки легких экспериментальных животных фиксировали в жидкости Карнуа, заливали в парафин.
Препараты окрашивали гематоксилином Майера и эозином, по Ван Гизон, альциановым синим, реактивом Шиффа по Мак-Манусу, железо выявляли по Перлсу (Пирс Э., 1962).
Степень воспалительных и склеротических процессов регистрировалась посредством определения индекса площади воспалительных инфильтратов (%), занимаемой клеточным и волокнистым элементами, а также доля (%) последних в составе инфильтратов. Методы биохимического раздела работы представлены в табл. 1.
Биохимические исследования проведены на кафедре биохимии (зав. д.м.н. В.Г.Соловьев) Ханты-Мансийской государственной медицинской академии и клинико-диагностическом отделении (зав. Е.И. Ситник) МУЗ Нефтеюганской городской больницы. Часть биохимических исследований проведена на кафедре фармацевтической технологии ГОУ ВПО ТюмГМА (проф. Б.Н. Бекетов). Методами световой и электронной микроскопии исследовали секционный и операционный материалы: кусочки ткани легких лиц с СО, умерших от случайных причин (50), больных с очаговыми поражениями легких, оперированных по поводу основного заболевания с сопутствующей описторхозной инвазией (6).
Таблица 1
Биохимические реакции для изучения структуры и функции мембран клеток
| Выявляемые соединения | Единицы измерения | Автор метода |
| Диеновые коньюгаты | нМоль / г ткани | И.Д.Стальная(1977) |
| Малоновый диальдегид | нМоль / г ткани | И.Д.Стальная, Т.Г.Гаришвили (1977) |
| Фосфолипазная активность | нМоль / мг липидов | Х.Брюкерхов, Р.Дженсен(1978) |
| Супероксиддисмутаза | ед.активности | В.Н.Чумаков, Л.Ф.Осинская(1977) |
| В - каротин | мМоль / л | А.А.Покровский (1969) |
| ГАГ | мг/л | Е.В.Корякина с соавт. (1982) |
| Катепсин Д | нМоль/мл | А.Баррет, М.Хинт(1980) |
| Пролин | мМоль / л | В.И.Крылов с соавт. (1984) |
Статистическая обработка полученных количественных характеристик проводилась на ЭВМ с применением специальных программ. В работе использованы корректированные показатели, в сводных таблицах приведены критерии вероятности различия, определяемые по Стьюденту.
Трансмиссионная электронная микроскопия выполнялась на микроскопе LEO - 912 АВ (Zeiss) в патологоанатомическом отделении (зав. Е.Д. Хадиева) Ханты-Мансийской окружной клинической больницы; часть материалов изучалась в лабораториях электронной микроскопии РОНЦ РАМН им. Н.Н. Блохина (г.Москва), РКЦ «Восстановительная травматология и ортопедия им. Г.А.Илизарова» (г. Курган). Молекулярно-генетические исследования проводили в «ООО Центр молекулярно-генетической диагностики А.Х.Сабирова» (г.Тюмень). Сосудистый эндотелиальный ростовой фактор (VEGFR) выявляли в сыворотке крови сирийских хомяков (10) с описторхозной инвазией (38 сут) посредством иммуносорбентного анализа в модификации ELISA на микропланшетном ридере Anthos 2020 с тест-системой Biosource фирмы Invitrogen. Состояние эпидермального фактора роста выявляли с использованием праймеров для 18, 19,20 21 экзонов гена EGFR при помощи полимеразной цепной реакции (ПЦР) на генетическом анализаторе 3130 XL Applera фирмы Applied Biosistems (США). Результаты анализов проконсультированы д.м.н. А.Х.Сабировым.
Статистическая обработка данных. Анализ данных проводился с использованием статистического пакета “Statistica 6.0”. Для определения статистической значимости различий непрерывных величин использовался непараметрический анализ с определением u-критерия Mann-Whitney. Сравнение показателей в динамике базисной терапии и лечения фенспиридом, альмитрином и СГКС определялось с помощью непараметрического критерия Wilcoxon для парных величин. Для определения зависимостей между переменными использовался непараметрический корреляционный анализ с определением коэффициента ранговой корреляции Спирмена. Различия считались статистически достоверными при р<0,05.
Результаты собственных исследований и их обсуждение
Среднее значение возраста обследуемых пациентов составило 55,8 (22-82) лет у мужчин и 58,1 (21-79) лет у женщин. В целом, БА диагностирована у 248 больных с СО, из них у одной пациентки с синдромом Черджа-Стросса. Сочетание БА и ХОБЛ при СО наблюдалось у 198 пациентов, в состав которых вошел больной с ХДН I степени, в последствие перенесший ЭАА на фоне данных нозологий. Количество курящих больных составило 185 человек, из них 169 мужчин со средним индексом курящего человека (ИКЧ) 21,3 пачко/лет и 16 женщин со средним ИКЧ 15,6 пачко-лет. Наибольший показатель среднего ИКЧ наблюдался в группе больных с сочетанием БА и ХОБЛ, осложненным ХДН II степени (40,4 пачко/лет). В группах больных с сочетанием БА и ХОБЛ на фоне СО среднее значение длительности клинического течения БА и ХОБЛ у мужчин составило 6,9 и 7,6 лет, а у женщин 20,2 и 3,8 лет соответственно. Таким образом, табачная зависимость у обследуемых мужчин обусловило более раннее возникновение ХОБЛ, чем БА, в то время как отсутствие факта курения у большинства обследуемых женщин предрасполагало к более длительному течению БА и позднему присоединению клинической симптоматики ХОБЛ. В группе больных с сочетанием БА и ХОБЛ без ХДН на фоне СО, как у мужчин, так и у женщин, наблюдалось присоединение ХОБЛ к БА, а в группах заболеваний легких с осложнением в виде ХДН I и II степени – тенденция присоединения БА к ХОБЛ у мужчин и ХОБЛ к БА у женщин, при этом форма БА имела преимущественно экзогенный характер у больных 2-й группы и инфекционно-зависимый (эндогенный) у больных 3-й и 4-й групп. Смешанная форма БА, имеющая признаки эндогенной и аллергической форм, отмечалась у всех пациентов в исследуемых группах. У пациентов с сочетанием БА и ХОБЛ без ХДН и осложненным ХДН I степени, при поступлении в стационар во время обострения наблюдалось неконтролируемое течение БА, а в группе больных с БА без ХОБЛ неконтролируемое течение отмечалось у 27 больных со средней степенью тяжести и частично контролируемое - у 23-х пациентов с легким персистирующим течением (оценка уровня контроля БА проводилась с использованием валидизированного АСТ-теста, содержащего 5 вопросов).
Анализируя лабораторные данные при исследовании биомаркеров системного воспаления у больных с заболеваними легких на фоне СО отмечались наиболее высокие показатели С-реактивного белка (СРБ) до 94,69 мг/л, фибриногена (ФГ) у пациентов с тяжелым бронхообструктивным синдромом (БОС) в неконтролируемый период. Проводимые ранее исследования, изучающие общий системный уровень воспаления как при стабильном течении ХОБЛ, так и при обострении, показали увеличение концентрации СРБ по мере прогрессирования заболевания и снижения ОФВ1 (С.Н. Авдеев, Г.Е.Баймаканова, 2007). Уровень фибриногена отмечался выше нормальных значений у пациентов 3-й и 4-й групп. Показатели общего анализа крови свидетельствовали о повышении содержания лейкоцитов во всех группах в неконтролируемый период. Следовательно, полученные значения биомаркеров воспаления при заболеваниях легких отражают выраженность протекания патофизиологических процессов в воздухоносных путях и паренхиме легких в зависимости от природы и стадии прогрессирования заболевания.
При исследовании показателей содержания эозинофилов в крови и Ig E (рис. 2) в неконтролируемый период наибольшие значения изучаемых показателей отмечались у пациентов с ЛЭ и ИЗЛ, по сравнению с другими группами. Полученные изменения сопровождались эозинофилией мокроты в группах больных с ЛЭ, ИЗЛ и БА (самое высокое содержание в мокроте наблюдалось у пациентов с БА). У пациентов с сочетанием БА и ХОБЛ показатель наличия эозинофилов в мокроте был менее значимым. Таким образом, при анализе исследуемых параметров у больных с заболеваниями легких при СО, повторные многократные поступления описторхисов дестабилизируют иммунную систему организма хозяина. В ранее проводимых исследованиях (Кондинский Г.В., 1984; Крылов Г.Г., 2005) выявлено, что суперинвазии развиваются на фоне иммуносупрессирующего влияния предшествующих описторхисов.
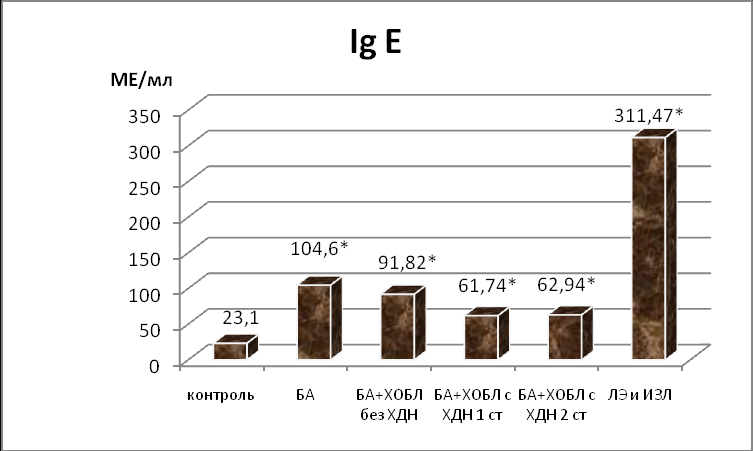


Рисунок 2. Показатели содержания Ig E в сыворотке крови, эозинофилов в общем анализе крови и мокроте у больных с заболеваниями легких на фоне СО
Примечание: *- р<0,001 по сравнению с контрольной группой и **- р<0,001 по сравнению с группой больных БА (критерий Mann-Whitney, U-тест).
Так, суперинвазия приводит к накоплению Ig E в сыворотке крови, при этом блокируется рецепторный аппарат тканевых базофилов и интенсивность аллергических реакций уменьшается уже в начальной фазе (А.А.Шайн, 1991). По закону реинокуляции, выведенного Мошковским Ш.Д, исход супер- и реинвазии определяется вторичным иммунологическим состоянием, обусловленным предшествующем взаимодействием макроорганизма и паразитов. Возбудитель, повторно введенный в организм уже инвазированного хозяина приживается там, но развивается в той мере, как предыдущий возбудитель, уже присутствующий в организме в момент реинокуляции (В.Г. Бычков, 2007). Таким образом, данный механизм обусловливает формирование иммунитета у больных с тяжелым БОС, особенностью которого является тенденция к отсутствию тесных взаимоотношений между паразитом и клеточным составом крови компонентами, приводящая в конечном итоге к СО. По полученным данным исследования у большинства пациентов с БА, сочетанием БА и ХОБЛ без ХДН, ЛЭ и ИЗЛ обнаружена обратная зависимость между уровнем содержания эозинофилов в мокроте и гиперэозинофилией крови: чем меньше эозинофилов в мокроте, тем больше показатель содержания эозинофилов в крови. При тяжелом нарушении бронхопроводимости с развитием ХДН, среди большего количества обследуемых, за исключением единичных случаев, содержание эозинофилов в крови и мокроте параллельно друг другу снижалось.
В некоторых литературных источниках (Н.Н.Озерецковская, 1982., Д.Д. Яблоков, 1979) описано возникновение редукции сосудистого русла за счет появления склероза и аллергического васкулита на фоне суперинвазии описторхоза. У пациентки с синдромом Черджа-Стросса на фоне СО, относящегося к группе узелковых периартериитов, за 2 года до появления развернутой клиники системного васкулита с поражением сосудов легких, диагностированы БА с эозинофилией мокроты до 48% и аллергический ринит. В 1951 году J.Ghurg и L.Strauss описали альтерацию сосудистой стенки с возникновением некроза сосудистой стенки и экстраваскулярные системные изменения. Дефектом иммунной системы при описторхозе является дефицит Т-супрессоров, при этом активируются Т-хелперы с последующей активацией В-клеток, обеспечивающих продукцию антител, которые могут взаимодействовать с антителами мембран, цитоплазмы, ядрами клеток, фиксируясь на клетка-мишенях, или в составе иммунных комплексов с формированием гранулем (Е.Ф.Чернушенко и соавт., 1985). Возможно, иммунологическая перестройка организма при описторхозе в виде появления циркулирующих иммунных комплексов обусловливает появление альтеративных и деструктивных процессов в сосудистом русле с поражением сосудов мелкого калибра при синдроме Черджа-Стросса. Следовательно, эозинофилия крови и тканевая эозинофилия – характерные спутники заболеваний легких при описторхозной суперинвазии.
Во врачебной практике нередко встречаются пациенты, страдающие ХОБЛ, клиническая картина которой имеет черты БА. Считается, что присоединение ХОБЛ к БА встречается чаще, а не наоборот (Е.И.Шмелев, 2008). При присоединении БА к ХОБЛ появляется ранее отсутствующая волнообразность симптоматики, возникают эпизоды ночных приступов респираторных симптомов. С течением времени к наступлению пожилого возраста отличительные особенности БА и ХОБЛ стираются (Г.Б.Федосеев и соавт, 2009). Воспаление дыхательных путей играет важную роль в развитии и прогрессировании БА и ХОБЛ (А.Г.Чучалин, 2009). Основной причиной обострения БА и ХОБЛ является инфекционный фактор: респираторные вирусы, бактерии: хроническая колонизация микроорганизмов способствует появлению частых обострений с дальнейшим утяжелением течения заболевания (С.Н.Авдеев, 2009). По данным многочисленных исследований, основными клеточными элементами воспаления при БА являются эозинофилы, при ХОБЛ – нейтрофилы, Т-лимфоциты, макрофаги. Продуцируя цитокины, клеточные элементы вступают в сложные патогенетические взаимоотношения, в конечном итоге, формируя субэпителиальный фиброз бронхов, ремоделирование дыхательных путей, нарастание степени обструкции, приводя к ХДН и ЛГ. Особенно, это является актуальным для пациентов с заболеваниями легких при паразитарных инвазиях, в частности описторхозе.
При изучении показателей ФВД сочетание БА и ХОБЛ (БА+ХОБЛ) характеризовалось снижением ОФВ1 <80% от должных значений и ОФВ1/ФЖЕЛ<70% от должных значений при возможном общем приросте ОФВ1 более 12% от должных значений после проведения бронходилатационных тестов с сальбутамолом и ипратропиумом бромидом в амбулаторных условиях за 3-12 месяцев до поступления в стационар при клинике контролируемых симптомов БА (при отсутствии обострения). Для пациентов со средней степенью тяжести БА и ХОБЛ в 63,52% случаев наблюдалось увеличение общего прироста более 12% от должных значений, в отличие от пациентов с тяжелыми бронхообструктивными нарушениями, осложненными ХДН, у которых отмечалась тенденция к снижению прироста менее 12% от должных значений. В группе больных с сочетанием БА и ХОБЛ со средней и тяжелой степенью заболеваний в период обострения клиническая симптоматика имела более выраженный характер, особенно у пациентов с тяжелыми бронхообструктивными нарушениями, осложненными острой дыхательной недостаточностью на фоне ХДН. По полученным данным, интенсивность кашля, одышки (диспноэ), изменение цвета и реологии мокроты при обострении состоит в прямой зависимости от степени тяжести БОС. Легочные симптомы в группе больных с сочетанием БА и ХОБЛ средней степени тяжести протекали менее остро (кашель –3,42±0,66 балла, одышка – 3,31±0,58 балла, мокрота – 2,47±0,62 баллов), чем в группе больных с тяжелыми нарушениями бронхопроводимости, осложненными ХДН I степени (кашель – 3,51±0,59 балла, одышка – 3,96±0,17 баллов, мокрота – 2,85±0,35 баллов). При сравнительной оценке выраженности клинических симптомов БА и заболеваний легких в неконтролируемый период, у больных с ЛЭ и ИЗЛ на фоне СО одышка имела более выраженный характер (2,87±0,5 баллов), чем при обострении БА (2,2±1,3 балла) (значения статистически не достоверны), при этом между группами больных с сочетанием БА и ХОБЛ средней степени тяжести и БА наблюдается достоверная разница при сравнении всех клинических симптомов (р<0,001). Следовательно, дуэт двух взаимоотягощяющих нозологий при СО, обусловливает более тяжелую клиническую симптоматику вследствие формирования стойких обструктивных нарушений.
Таким образом, при сочетании БА и ХОБЛ на фоне СО, снижение функции мукоцилиарного клиренса, длительный стаз мокроты в бронхах с отсутствием должного дренажа, хроническая колонизация инфекции способствуют дальнейшему прогрессированию воспаления, бронхообструкции, гиперинфляции легких с формированием эмфиземы, вентиляционно-перфузионных нарушений и гипоксемии с ХДН. Влияние описторхозной инвазии на комплекс клинических проявлений связан с аллергической перестройкой организма, определяющей предрасположенность организма к частым бронхоспазмам и сохранению эозинофильного воспаления в дыхательных путях. При исследовании механики дыхания, прирост ОФВ1 кривой «поток-объем» рассчитывался по следующей формуле: ∆ ОФВ1= ОФВ1 (% от должной величины после пробы) — ОФВ1 (% от должной величины до пробы). Увеличение прироста более 12% от должного значения после пробы с бронхолитиком расценивалось как положительный бронходилатационный тест (БДТ). При получении такого прироста обструкция считалась обратимой. Между всеми значениями ОФВ1, ОФВ1/ФЖЕЛ и ПОС, характеризующих функциональное состояние воздухопроводящих путей при БА и других заболеваний легких, отмечалась достоверная разница. Постбронходилатационные показатели ФВД между группами больных с заболеваниями легких представлены на рис. 3.
У больных с сочетанием БА и ХОБЛ, помимо нарушения бронхопроводимости, важной патофизиологической особенностью является легочная гиперинфляция (гипервоздушность), отражением которой является увеличение легочных объемов. Так, у больных с сочетанием БА тяжелой степени и ХОБЛ III-IV стадии, осложненной ХДН I степени, уровни ОО легких и Raw составили 173,49% и 268,78% от должных значений, а у больных с сочетанием БА средней степени и ХОБЛ II стадии – 147,26% и 179,03% от должных значений соответственно (умеренная гиперинфляция). У пациентов в группе с БА легкой и средней степенью тяжести гиперинфляция наблюдалась незначительная (ОО легких составил 106,058%, ОО/ОЕЛ 105,95% от должных значений).




