Исследование роли gstp1, mdr1 и mrp1 в предрасположенности к хроническим лимфопролиферативным заболеваниям и в формировании устойчивости к химиотерапии 03. 00. 04 биохимия
| Вид материала | Исследование |
- Методика «Удовлетворенность браком» 14 3 Методика «Исследование личностной предрасположенности, 252.33kb.
- Хронические в оспалительные заболевания кишечника у детей (лекция), 306.18kb.
- Инструкция по химиотерапии больных туберкулезом проект изменений «Инструкции по химиотерапии, 634.43kb.
- Динамика Солнечной системы, 11.55kb.
- Использование комбинированного действия химиотерапии и эми при лечении злокачественных, 52.5kb.
- Причины возникновения основных болезней современного человека с позиций западной медицины, 504.57kb.
- Программа кандидатского экзамена «Биохимия», 166.06kb.
- Тема: «Методика организации и проведения прогулки», 77.28kb.
- Практических: 0 Лабораторных, 20.71kb.
- Исследование роли тубулинового кофактора Dмитозе у делящихся дрожжей Schizosaccharomyces, 496.35kb.
На правах рукописи
Горева Ольга Борисовна
исследование роли GSTP1, MDR1 и MRP1 в предрасположенности к хроническим лимфопролиферативным заболеваниям и в формировании устойчивости к химиотерапии
03.00.04 - биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск – 2007
Работа выполнена в ГУ Научно-исследовательском институте молекулярной биологии и биофизики СО РАМН (Новосибирск, Россия)
Научный руководитель:
кандидат биологических наук, доцент Гришанова А.Ю.
Научный консультант:
академик РАМН, доктор биологических наук, профессор Ляхович В.В.
Официальные оппоненты:
доктор медицинских наук, профессор Поспелова Т.И.
доктор медицинских наук, Душкин М.И.
Ведущая организация:
ГУ Научно-исследовательский институт цитологии и генетики СО РАН (Новосибирск)
Защита состоится "___" _______ 2007 г. в ____ часов на заседании диссертационного совета Д 001.034.01 в ГУ Научно-исследовательском институте биохимии СО РАМН (630117, г. Новосибирск, ул. академика Тимакова, 2; тел.: 8-(383)333-54-81).
С диссертацией можно ознакомиться в библиотеке ГУ Научно-исследовательского института биохимии СО РАМН
Автореферат разослан "___" ____________ 2007 г.
Ученый секретарь диссертационного совета
кандидат биологических наук,
старший научный сотрудник Русских Г.С.
Актуальность темы. В последние десятилетия проблема онкологических заболеваний становится все более актуальной. В структуре смертности населения Земного шара смертность от злокачественных новообразований занимает 2-4-ое место, в высокоразвитых странах этот показатель выходит на 1-2-ое место (Якубовская, 2000), а по данным Госкомстата за 2005 год в России – 2-ое место, уступая только заболеваниям системы кровообращения (u/free_doc/2006/b06_13/04-27.htm) Число людей с впервые выявленными злокачественными новообразованиями неуклонно растет (Чиссов и соавт., 1995; Заридзе и соавт, 1998). Новосибирская область и г. Новосибирск входят в число административных территорий, неблагоприятных по заболеваемости злокачественными новообразованиями, в том числе опухолями клеток крови (ссылка скрыта, 2006). Опережая по темпам общую онкологическую заболеваемость, заболеваемость опухолями клеток крови с 1987 года по 2005 год увеличивалась примерно в 4,5 раза (с 3,2 до 14,2 на 100 тысяч населения), преимущественно за счет лейкозов и лимфом. (Ковынев и соавт., 2006).
Такой рост связывают с всевозрастающим загрязнением окружающей среды чужеродными для организма веществами (ксенобиотиками), и, как следствие, увеличением их поступления в организм человека (Карпенко, 1999; Гуляева и соавт., 2000). Исследование причин повышения заболеваемостью опухолями клеток крови показало, что оно обусловлено неблагоприятной экологической ситуацией в г. Новосибирске и Сибирском федеральном округе в целом и совпадает с пиками промышленных выбросов с отсрочкой эффекта на 7-10 лет (Ковынев и соавт., 2006).
Разная предрасположенность к заболеванию может быть обусловлена генетическими факторами, в том числе межиндивидуальными различиями в биоактивации проканцерогенов и выведении канцерогенных веществ из организма. Установление взаимосвязи между определенным генотипом и формой заболевания может приблизить к пониманию механизмов развития различных форм рака, а с учетом предрасполагающих факторов (курение, загрязнители окружающей среды) позволит выявить группы риска, обладающие повышенной чувствительностью к данным заболеваниям.
Рост случаев онкологических заболеваний выводит на передний план проблему их лечения. Основным методом лечения онкогематологических заболеваний является интенсивная полихимиотерапия. Однако, несмотря на высокий процент ремиссий (до 80%) после начальной терапии, рецидив бывает очень часто, и только 20% пациентов достигают долгосрочного выживания (Поддубная, 2001; Thomas, 2003). Кроме того, интенсивная химиотерапия является причиной тяжёлых побочных эффектов, особенно у пожилых пациентов (Robak, 2004). То есть недолгосрочная эффективность химиотерапии и токсичность лечения являются главными проблемами, которые необходимо решать. Одним из препятствий для успешной химиотерапии опухолей является множественная лекарственная устойчивость (МЛУ) – невосприимчивость популяции клеток опухоли одновременно к целому ряду химиотерапевтических препаратов разного химического строения и с разным механизмом действия на клетку. Феномен МЛУ может быть обусловлен различными механизмами, в частности, снижением накопления лекарственного препарата в клетке, связанным с функционированием Р-гликопротеина, белка множественной лекарственной устойчивости и обезвреживанием препаратов в клетке, обусловленным функционированием систем ферментов метаболизма ксенобиотиков, в частности фермента глутатион-S-трансферазы (Ставровская, 2000).
Основными механизмами в метаболизме и распределении ксенобиотиков является функционирование ферментов первой и второй фазы биотрансформации ксенобиотиков, а также АТФ-зависимых транспортных. Фермент второй фазы глутатион S-трансфераза класса Р участвует в процессах детоксикации широкого спектра электрофильных соединений, включая мутагены и канцерогены окружающей среды (Salinas, 1999, Tsuchida, 1992). Многие цитостатики, такие как алкилирующие агенты, антрациклины, препараты платины, стероидные гормоны также являются субстратами глутатион S-трансфераз (Сlandinin, 1994; Pemble, 1994; Ставровская, 2000; Hayes, 2000). Ген GSTP1 является полиморфным: в кодирующем регионе обнаружено две мутации. Известно, что различные полиморфные варианты гена GSTP1 могут обладать различной субстрат-специфичной каталитической активностью (Coles et al., 2000, Allan et al., 2001). Полиморфизм в 5 экзоне гена GSTP1 приводит к замене аминокислоты в активном участке Н-сайта, который отвечает за субстратную специфичность фермента. В связи с этим, межиндивидуальные различия в ферментативной активности GST, опосредуемые полиморфными вариантами генами, могут лежать в основе различной предрасположенности к онкологическим заболеваниям, связанным с влиянием окружающей среды. Нет данных, связан ли полиморфизм гена GSTP1 с предрасположенностью к хроническим лимфопролиферативным заболеваниям и устойчивостью к химиопрепаратам.
АТФ-зависимые транспортные белки Р-гликопротеин и MRP1 (белок ассоциированный с множественной лекарственной устойчивостью) –продукты генов MDR1 и MRP1 осуществляют транспорт веществ из клетки. Их физиологическая роль заключается в защите клеток от токсических соединений. Гены MDR1 и MRP1 являются высокополиморфными, но несмотря на то, что Р-гликопротеин и MRP широко изучаются, пока непонятна функциональная и клиническая значимость открываемых вариантов полиморфизмов этих генов для биодоступности и распределения лекарств в организме человека и, как следствие, формирования лекарственной устойчивости опухолей. Функциональная активность MRP изучена мало и нет сведений о его активности у больных онкологическими заболеваниями.
Целью настоящей работы было исследование полиморфных вариантов генов GSTP1, MDR1, MRP1 и анализа взаимосвязи полиморфизмов этих генов с предрасположенностью к хроническим лимфопролиферативным заболеваниям и устойчивостью к химиотерапии у больных с такими заболеваниями, а также исследование связи полиморфизмов генов MDR1 и MRP1 с функциональной активностью кодируемых ими белков P-гликопротеина и MRP.
Для достижения данной цели были поставлены следующие задачи:
- Исследовать распределение полиморфных вариантов гена GSTP1 в 5 (A313G) и 6 (C341T) экзонах у здоровых европеоидов Западной Сибири и больных хроническими лимфопролиферативными заболеваниями.
- Исследовать распределение полиморфных вариантов гена MDR1 в 6 интроне (Ex6+139C/T), 12 (C1236T), 21 (G2677T), 26 (C3435T) экзонах у здоровых европеоидов Западной Сибири и больных хроническими лимфопролиферативными заболеваниями.
- Исследовать распределение полимофрных вариантов гена MRP1 в 13 экзоне (T1684C), 9 (A1218+8G), 18 (C2461-30G) интронах у здоровых европеоидов Западной Сибири и больных хроническими лимфопролиферативными заболеваниями.
- Проанализировать взаимосвязь полиморфизмов исследуемых генов с предрасположенностью к хроническим лимфопролиферативным заболеваниям у европеоидов западной Сибири в исследованиях «случай-контроль».
- Провести анализ взаимосвязи полиморфизмов исследуемых генов с риском развития лекарственной устойчивости у больных хроническими лимфопролиферативными заболеваниями.
- Определить функциональную активность Р–гликопротеина и MRP в лимфоцитах здоровых европеоидов Западной Сибири и больных хроническими лимфопролиферативными заболеваниями и оценить связь с результатами химиотерапии.
- Исследовать роль полиморфизмов генов MDR1 и MRP1 в функциональной активности P-гликопротеина и MRP соответственно.
Научная новизна
Впервые охарактеризована частота встречаемости полиморфизмов A313G и C341T гена GSTP1, С6+139T, C1236T, G2677T, C3435T гена MDR1, T1684C, A1218+8G и C2461-30G гена MRP1 в популяции европеоидов Западной Сибири. Показано, что распределение частот генотипов и аллелей полиморфных вариантов генов GSTP1, MDR1 и MRP1 у европеоидов Западной Сибири соответствуют частотам в других европеоидных популяциях.
Впервые показано, что полиморфные варианты 341СС гена GSTP1 и 3435ТТ гена MDR1 ассоциированы с устойчивостью к хроническим лимфопролиферативным заболеваниям, а 341СТ и 3435СС генотипы – с предрасположенностью.
Впервые показано, что полиморфные варианты 313AG гена GSTP1 и 2677ТТ, 3435ТТ гена MDR1 ассоциированы с устойчивостью, а генотипы 313АА, 3435СТ – с чувствительностью к химиотерапии у больных хроническими лимфопролиферативными заболеваниями. Комбинация генотипов 2677ТТ/3435ТТ в 21 и 26 экзонах гена MDR1 у больных хроническими лимфопролиферативными заболеваниями увеличивает в 17 раз риск возникновения лекарственной устойчивости к проводимой химиотерапии в сравнении с больными, имеющими другие генотипы.
При исследовании полиморфизмов T1684C, A1218+8G и C2461-30G гена MRP1 не выявлено достоверно значимых ассоциаций полиморфных вариантов гена с риском возникновения лимфопролиферативных заболеваний и развитием устойчивости к химиотерапии у больных с этими заболеваниями.
Впервые показано, что функциональная активность Р-гликопротеина у больных неходжкинскими лимфомами ассоциирована со степенью злокачественности опухоли: достоверно более высокий уровень активности показан для больных с высокой степенью злокачественности. Показано также, что уровень функциональной активности Р-гликопротеина в лимфоцитах периферической крови не зависит от применяемых химиопрепаратов и не является показателем для прогноза устойчивости к химиотерапии у больных неходжкинскими лимфомами.
Показано, что уровни функциональной активности Р-гликопротеина и MRP1 не связаны с полиморфизмами С6+139T, С1236T, G2677T, C3435T гена MDR1 и T1684C, A1218+8G, C2461-30G гена MRP1 ни у здоровых европеоидов Западной Сибири, ни у больных хроническими лимфопролиферативными заболеваниями.
Научная и практическая значимость работы
Настоящая работа вносит вклад в развитие фундаментальных знаний о роли полиморфизмов генов MDR1, MRP1, GSTP1 и функциональной активности транспортных белков Р-гликопротеина и MRP1 в предрасположенности к хроническим лимфопролиферативным заболеваниям и в формировании лекарственной устойчивости у больных с такими заболеваниями.
Полученные данные могут быть использованы для оценки как индивидуального, так и популяционного риска развития онкогематологических заболеваний, а так же разработки дифференцированных программ их первичной профилактики.
Выявление полиморфных вариантов генов, ассоциированных с устойчивостью к химиотерапии позволит выработать рекомендации по оптимизации химиотерапии
Основные положения выносимые на защиту:
- С предрасположенностью к хроническим лимфопролиферативным заболеваниям связаны полиморфизмы C341T в 6 экзоне гена GSTP1 и C3435T в 26 экзоне гена MDR1.
- С формированием устойчивости к химиотерапии у больных хроническими лимфопролиферативными заболеваниями связаны полиморфизмы A313G в 5 экзоне гена GSTP1, G2677T в 21 экзоне и C3435T 26 экзонах гена MDR1.
- Уровень функциональной активности Р-гликопротеина в лимфоцитах периферической крови у больных неходжкинскими лимфомами связан со степенью злокачественности опухоли.
- Эффективность химиотерапии у больных лимфопролиферативными заболеваниями не зависит от уровня функциональной активности Р-гликопротеина.
- Уровни функциональной активности P-гликопротеина и MRP1 у здоровых европеоидов Западной Сибири и у больных хроническими лимфопролиферативными заболеваниями не связаны с полиморфными вариантами генов MDR1 (С6+139T, C1236T, G2677T и C3435T) и MRP1 (T1684C, A1218+8G и C2461-30G) соответственно.
Апробация работы. Результаты работы были представлены на следующих конференциях: 17th Meeting of Europe Association for Cancer Research, Granada, Spain, 2002; 1 Международный симпозиум «Стресс и экстремальные состояния», Феодосия, Украина, 2002; 18th International Cancer Congress, Oslo, Norway, 2002; European Scientific Conference: Understanding the Genome: Scientific Progress and Microarray Technology, Genova, Italy, 2002; 37thAnnual Scientific Meeting: European society for clinical investigation. The pathophysiology of diseases: from bench to bedside, Verona, Italy, 2003; 8th Congress of the European Hematology Association, Lyon, France, 2003; Российско-Норвежская конференция по вопросам гематологии, Санкт-Петербург, 2003; III Конференция молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины», Москва, 2004; 8-ая Международная Пущинская школа-конференция молодых ученых «Биология – наука XXI века», Пущино, 2004; 9th Congress of the European Hematology Association, Geneva, Switzerland, 2004; 15th European Students' Conference for future doctors and young scientists, Berlin, Germany, 2004; XII Международной научной конференции студентов, аспирантов и молодых ученых «Ломоносов», Москва, 2005; Региональная конференция молодых ученых-окологов «Актуальные вопросы экспериментальной и клинической онкологии», Томск, 2006; 13th International Student Congress of Medical Sciences, Groningen, the Netherlands, 2006; Совместная российско-американская конференция по проблемам гематологии и трансплантации костного мозга, 2006.
Публикации. По материалам диссертации имеется 18 печатных работ (из них 3 в рецензируемой печати).
Структура и объем диссертации. Диссертационная работа изложена на 157 страницах машинописного текста с полуторным интервалом, содержит 22 таблицы и 28 рисунков и состоит из шести разделов: введения, обзора литературы, материалов и методов, результатов собственных исследований, обсуждения результатов, выводов, а также списка цитируемой литературы, включающего 206 ссылок.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Описание клинического материала. Работа выполнена на образцах периферической крови пациентов, которые наблюдались в гематологическом кабинете Новосибирской областной консультативной поликлиники и проходили лечение в отделении гематологии Государственной Новосибирской областной клинической больницы с 1998 по 2006 гг. Исследовано 240 больных, из них 79 хроническим лимфолейкозом (ХЛЛ), 161 больной неходжкинскими лимфомами (НХЛ). Группа больных включала 135 мужчин (56,0%) и 105 женщин (44,0%) в возрасте от 17 до 86 лет (средний возраст 56,64) Лечение больных проводилось по протоколам, которые включали следующие препараты: циклофосфамид, лейкеран, адриамицин, онковин, винкристин, преднизолон. Эффективность химиотерапии оценивалась врачами ГНОКБ через 6 месяцев после установления диагноза и начала лечения. Наличие ответа на лечение определялось при полной или частичной клинико-гематологической ремиссии у больных НХЛ и ХЛЛ и в случае стабилизации у больных ХЛЛ. Отсутствие ответа на лечение определялось при прогрессировании заболевания или в случае смерти больного.
Контрольную группу составили пациенты травматологического отделения 3-й Муниципальной клинической больницы скорой помощи в период проведения контрольных анализов перед выпиской. Она включала 100 человек, из них 54 мужчины (54,0%) и 46 женщин (46,0%) в возрасте от 17 до 86 лет (средний возраст 53,47). Основным критерием отбора в контрольную группу было отсутствие каких бы то ни было онкологических заболеваний.
Методы исследования. Выделение ДНК из цельной крови проводили с помощью стандартного набора производства ООО «Лаборатория Медиген» (г. Новосибирск). Анализ полиморфных вариантов специфических участков генома проводился с использованием методов полимеразной цепной реакции и анализа полиморфизма длин рестрикционных фрагментов, используя структуру праймеров и соответствующие ферменты рестрикции, которые были описаны в литературе (Harries et al.., 1997; Harris et al., 1998; Cascorbi et al., 2001; Ito et al., 2001). Подбор эндонуклеаз рестрикции для гена MRP1 проводился с спользованием программы Vector NTI 8.0. Для обнаружения полиморфных вариантов MRP1 использовали следующие эндонуклеазы рестрикции: T1684C – AspS9I, A1218+8G – AspLEI, C2461-30G – BtrI («СибЭнзим», Россия). Продукты ферментативного гидролиза разделяли разделяли вертикальным электрофорезом в 7% полиакриламидном геле в трис-боратном буфере. Визуализацию бандов и сканирование геля проводили в проходящем УФ свете с помощью видеосистемы «DNA Analyzer» (Москва).
Функциональная активность Р-гликопротеина была определена на проточном цитофлюориметре FACS Calibur фирмы «Becton Dickinson» с использованием субстрата родамина 123 и ингибитора верапамила в лимфоцитах в контрольной группе, которая включала здоровых европеоидов (n=49), и у больных НХЛ (n=76). Активность Р-гликопротеина (E Rh123, отн.ед.) оценивали по выбросу родамина 123, определяемому как отношение геометрических средних флюоресценции родамина 123 в присутствии верапамила и без него (Huet et al., 1998). Исследование функциональной активности MRP проводилось у здоровых (n=29) и больных НХЛ (n=31) с использованием 5(6)-диацетат карбоксифлюоресцеина в присутствии ингибитора циклоспорина А (Dogan et al., 2003). Активность MRP1 (ECFDA, отн.ед.) оценивали по выбросу карбоксифлуоресцеина, определяемому как отношение геометрических средних флюоресценции карбоксифлуоресцеина в присутствии циклоспорина А и без него.
Статистическую обработку данных проводили с использованием пакета прикладных статистических программ «Statistica v.6» (StatSoft Inc., 1995) и программы EpiInfo 6 (1993). Распределение генотипов исследованных полиморфных локусов проверяли на соответствие равновесию Харди-Вайнберга с помощью точного теста Фишера (Вейр, 1995). Об ассоциации аллелей, генотипов и комбинаций генотипов с лимфопролиферативными заболеваниями и устойчивостью к лечению судили по величине отношения шансов (ОШ) (Флетчер и др., 1998). Достоверность различий в частотах встречаемости изучаемых признаков между анализируемыми группами оценивали по критерию χ2 с поправкой Йетса на непрерывность или двухстороннему точному критерию Фишера, когда в группе сравнения было менее 5 наблюдений.
Для оценки достоверности различий между выборками с различными физиологическими и клиническими параметрами по уровню, функциональной активности P-гликопротеина и MRP использовались непараметрический критерии Манна-Уитни. В случае сравнения более чем двух групп, для оценки использовали критерий Крускалля-Уоллиса с последующим попарным сравнением по критерию Манна-Уитни, в случае, если уровень значимости различий р≤0,05. Корреляцию между возрастом и уровнем функциональной активности оценивали по критерию Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Распределение частот генотипов и аллелей генов GSTP1, MDR1 и MRP1 у здоровых европеоидов Западной Сибири и у больных хроническими лимфопролиферативными заболеваниями
Полиморфизм A313G в 5 экзоне гена GSTP1, приводящий к замене Ile105Val, был исследован в контрольной группе (n=57) и у больных ХЛПЗ (n=163). Анализ распределения частот полиморфных вариантов гена и аллелей GSTP1 в 5 экзоне в группе контроля и у больных хроническими лимфопролиферативными заболеваниями показал отсутствие статистически значимых различий. В группе без онкопатологии частота мутантного аллеля (0,30) была сопоставима с описанными частотами для других европеоидов 0,28-0,36 (Harries et al., 1997; Landi, 1998), ниже, чем у афроамериканцев 0,42-0,45, но выше, чем у африканцев (χ2=8,89, р=0,003), азиатов 0,14-0,27 (Harries et al., 1997).
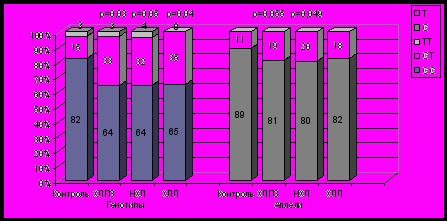
Полиморфизм C341T в 6 экзоне гена GSTP1, приводящий к замене Ala114Val, был исследован у 60 индивидуумов контрольной группы и 146 больных ХЛПЗ. Анализ распределения частот полиморфных вариантов гена GSTP1 в 6 экзоне в контрольной группе и у больных ХЛПЗ показал статистически значимые различия: χ2=6,79, р=0,03 для ХЛПЗ, χ2=6,00, р=0,05 для НХЛ и χ2=6,40, р=0,04 для ХЛЛ (рис. 1). Частота встречаемости Т341T генотипа не отличалась у больных ХЛПЗ и НХЛ от контрольной группы, а в группе больных ХЛЛ этот генотип отсутствовал.