Исследование роли gstp1, mdr1 и mrp1 в предрасположенности к хроническим лимфопролиферативным заболеваниям и в формировании устойчивости к химиотерапии 03. 00. 04 биохимия
| Вид материала | Исследование |
- Методика «Удовлетворенность браком» 14 3 Методика «Исследование личностной предрасположенности, 252.33kb.
- Хронические в оспалительные заболевания кишечника у детей (лекция), 306.18kb.
- Инструкция по химиотерапии больных туберкулезом проект изменений «Инструкции по химиотерапии, 634.43kb.
- Динамика Солнечной системы, 11.55kb.
- Использование комбинированного действия химиотерапии и эми при лечении злокачественных, 52.5kb.
- Причины возникновения основных болезней современного человека с позиций западной медицины, 504.57kb.
- Программа кандидатского экзамена «Биохимия», 166.06kb.
- Тема: «Методика организации и проведения прогулки», 77.28kb.
- Практических: 0 Лабораторных, 20.71kb.
- Исследование роли тубулинового кофактора Dмитозе у делящихся дрожжей Schizosaccharomyces, 496.35kb.
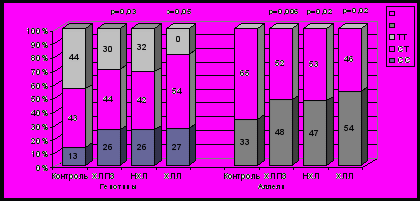
Рис. 1. Распределение генотипов и частот аллелей полиморфного варианта C341T гена GSTP1 у больных ХЛПЗ и в контрольной группе.
Частота встречаемости мутантного T аллеля была выше в общей группе больных ХЛПЗ по сравнению с группой контроля (р=0,055) и статистически достоверно выше у больных НХЛ (р=0,049). В группе ХЛЛ также наблюдалось более высокая частота валинового аллеля, но эти различия не являлись статистически достоверными (рис. 1).
Сравнение частот генотипов C341T гена GSTP1 в нашей контрольной выборке с описанными в различных популяциях и этнических группах не выявило достоверных отличий от австралийских европеоидов и индийской популяции (Harris et al., 1998). Частота мутантного аллеля в контрольной группе (0,11) была сопоставима с таковой у австралийских европеоидов (0,07) и индийцев (0,05), но достоверно выше, чем у других среди азиатов (0,0-0,01) (Ishii et al., 1999; Harris et al., 1998).
К настоящему времени открыты и охарактеризованы более 50 однонуклеотидных замен в гене MDR1, большинство из которых является молчащими мутациями или расположены в интронных областях (Mickley et al., 1998; Ito et al., 2001; Kerb et al., 2001; Saito et al., 2002; Marzolini, 2004). Мы исследовали наиболее часто встречающиеся полиморфизмы в гене MDR1: в 6 интроне (Ex06+139C/T), 12 (C1236T), 21 (G2677T) и 26 (C3435T) экзонах. Полиморфизм G2677T приводит к замене Ala893Ser, а мутации C1236T и C3435T, являются синонимичными.
Анализ распределения полиморфных вариантов гена MDR1 в 6 интроне, 12 и 21 экзонах в группе контроля и у больных ХЛПЗ не выявил статистически достоверных различий в частотах встречаемости генотипов и аллелей. В группе без онкопатологии частоты мутантных аллелей в 6 интроне (0,44), 12 экзоне (0,47) и 21 экзоне (0,43) значимо не отличались от описанных в литературе для европеоидов Германии и России (Cascorbi et al. 2001; Hoffmeyer et al., 2000; Siegmund et al., 2002; Gaikovitch et al 2003).
Анализ распределения полиморфных вариантов гена MDR1 в 26 экзоне показал, что частоты распределения генотипов статистически значимо отличаются от контрольных в группе ХЛПЗ (χ2=7,15, р=0,03) и ХЛЛ (χ2=5,93, р=0,05), в группе ХНЛ эти отличия не достигают значимого уровня (рис. 2). Частота встречаемости мутантного аллеля в группах больных ниже по сравнению со здоровыми, причем эти различия являются статистически достоверными для всех групп (p=0,02 для ХЛЛ и НХЛ и р=0,006 для ХЛПЗ).
Частоты встречаемости мутантного аллеля в группе без онкопатологии (0,65) в 26 экзоне близки к частотам генотипов в популяции России (0.54) (Gaikovitch et al., 2003), европеоидов Англии (0.52), Португалии (0,57) (Ameyaw et al., 2001), но значительно превышают частоты мутантного аллеля у европеоидов Польши (0.38) (Jamroziak et al., 2002), Германии (0.48) (Hoffmeyer et al., 2000).
Р
 ис. 2. Распределение генотипов и частот аллелей полиморфного варианта C3435T гена MDR1 у больных ХЛПЗ и в контрольной группе.
ис. 2. Распределение генотипов и частот аллелей полиморфного варианта C3435T гена MDR1 у больных ХЛПЗ и в контрольной группе.При исследовании частот генотипов и аллелей MRP1 в 13 экзоне (T1684C), а также в 9 (A1218+8G) и 18 (C2461-30G) интронах в контрольной группе и у больных ХЛПЗ не было выявлено статистически значимых отличий. Частота встречаемости мутантного аллеля 1684С в 13 экзоне в группе без онкопатологии (0,83) была достоверно выше частоты этого аллеля в японской популяции 0.19 (Ito S. et al., 2001) и незначительно выше частоты 1684С аллеля европеоидов Германии 0.80 (Oselin K. Et al., 2003). Частоты встречаемости мутантного аллеля в группе без онкопатологии в 9 интроне (0,33) совпали с частотой данного аллеля в японской популяции (0.34) (Ito S. et al., 2001) и европеоидов Германии (0.35) (Oselin K. et al., 2003). Частота встречаемости мутантного аллеля в контрольной группе в 18 интроне (0,78) была достоверно выше частоты данного аллеля в японской популяции 0.30 (Ito S. et al., 2001).
Роль полиморфизмов генов GSTP1, MDR1 и MRP1 в предрасположенности к хроническим лимфопролиферативным заболеваниям
При анализе полиморфизма A313G гена GSTP1 у здоровых и больных ХЛПЗ не выявлено статистически значимых ассоциаций различных генотипов с риском развития ХЛПЗ (табл. 1). Это свидетельствует о том, что ни один из генотипов A313G не является фактором предрасположенности к ХЛПЗ. Наши данные согласуются с опубликованными ранее исследованиями больных с НХЛ и ХЛЛ, где не было выявлено ассоциаций полиморфных вариантов A313G гена GSTP1 с риском развития заболеваний (Sarmanova et al., 2001).
При анализе ассоциации разных генотипов C341T GSTP1 с риском развития ХЛПЗ выявлено, что носители «дикого» генотипа 341СС 2,44 раза более устойчивы к возникновению ХЛПЗ (ОШ=0,41, р=0,02), в частности к НХЛ носители данного генотипа будут устойчивее других индивидуумов в 2,5 раза (ОШ=2,5, р=0,03) (табл. 1). Для ХЛЛ также показана ассоциация дикого генотипа с вероятностью устойчивости к заболеванию в 2,38 раза, однако необходимая статистическая достоверность не показана (р=0,09). Это можно объяснить малой выборкой исследованных больных с ХЛЛ. Генотип 341CT ассоциирован с предрасположенностью к лимфопролиферативным заболеваниям: риск заболеть ХЛПЗ у носителей этого генотипа по сравнению с остальными индивидуумами повышен в 2,78 раза (р=0,014), риск заболеть НХЛ – в 2,68 раза (р=0,026), а ХЛЛ – в 3,05 раза (р=0,037) (табл. 1). Это свидетельствует о том, что генотип 341СТ является фактором предрасположенности к хроническим лимфопролиферативным заболеваниям, а «дикий» генотип – фактором устойчивости к ХЛПЗ, в частности к НХЛ.
Анализ ассоциаций генетических вариантов MDR1 с предрасположенностью к лимфопролиферативным заболеваниям показал, что в 6 интроне, 12 и 21 экзонах статистически значимых ассоциаций наличия мутантного аллеля с риском развития ХЛПЗ не выявлено, т.е. полиморфизмы C6+139T, C1236T и G2677T в 6 интроне не являются предрасполагающими факторами к развитию этих заболеваний (табл. 1).
При анализе ассоциаций полиморфных вариантов гена MDR1 с риском развития ХЛПЗ для мутации в 26 экзоне С3435T было установлено, что индивидуумы с 2 аллелями «дикого» типа в 26 экзоне в 2,26 раза более чувствительны к ХЛПЗ (р=0,035), а носители 2 мутантных аллелей более устойчивы к развитию ХЛПЗ по сравнению с другими индивидами (р=0,04), а по сравнению с гомозиготами дикого типа в 2,86 раза (р=0,01). Для НХЛ и ХЛЛ прослеживается аналогичная связь (табл. 1). Гомозиготные по «дикому» аллелю индивиды в 2,24 раза более чувствительны к НХЛ (р=0,046) и в 3,36 раза – к ХЛЛ по сравнению с другими индивидами. Однако для ХЛЛ этот риск не является достоверным (р=0,13), вероятнее всего это обусловлено маленькой выборкой. Статистическая достоверность ассоциации мутантного генотипа с НХЛ достигается только по сравнению с «дикими» гомозиготами (ОШ=0,38, р=0,03). Для ХЛЛ устойчивость к заболеванию в 3,23 раза выше у индивидов с мутантным генотипом по сравнению с остальными (р=0,04) и в 4,55 раза выше по сравнению с индивидами с диким генотипом (р=0,03). Таким образом, полиморфизм С3435Т гена MDR1 является значимым фактором, предрасполагающим к лимфопролиферативным заболеваниям.
При анализе ассоциаций разных генотипов MRP1 в 13 экзоне, 9 и 18 интронах с риском развития ХЛПЗ было показано отсутствие статистически значимых ассоциаций. Следовательно, полиморфизмы T1684C, A1218+8G и C2461-30G гена MRP1 не являются факторами предрасположенности к развитию этих заболеваний (табл. 1).
Таблица 1
Ассоциация полиморфных вариантов GSTP1, MDR1 и MRP1
с предрасположенностью к ХЛПЗ
| Гено- тип | К | Общая группа ХЛПЗ | НХЛ | ХЛЛ | ||||||
| n | n | ОШ | p | n | ОШ | p | n | ОШ | p | |
| A313G (экзон 5 гена GSTP1) | ||||||||||
| AA | 26 | 77 | 1,07 | 0,95 | 59 | 1,07 | 0,97 | 18 | 1,07 | 0,97 |
| AG | 28 | 71 | 0,8 | 0,57 | 52 | 0,56 | 0,16 | 19 | 1,04 | 0,89 |
| GG | 3 | 15 | 1,82 | 0,41 | 14 | 2,27 | 0,32 | 1 | 0,49 | 0,65 |
| C341T (экзон 6 GSTP1 ) | ||||||||||
| CC | 49 | 94 | 0,41 | 0,02 | 68 | 0,4 | 0,03 | 26 | 0,42 | 0,09 |
| CT | 9 | 48 | 2,78 | 0,014 | 34 | 2,68 | 0,026 | 14 | 3,05 | 0,037 |
| TT | 2 | 4 | 0,2 | 0,21 | 4 | 1,14 | 1 | 0 | 0,73 | 0,73 |
| C6+139T (интрон 6 MDR1 ) | ||||||||||
| CC | 28 | 47 | 1,15 | 0,74 | 33 | 0,95 | 0,98 | 14 | 2,35 | 0,09 |
| CT | 43 | 71 | 1,17 | 0,66 | 62 | 1,41 | 0,29 | 9 | 0,53 | 0,25 |
| TT | 18 | 18 | 0,6 | 0,23 | 14 | 0,58 | 0,23 | 4 | 0,69 | 0,73 |
| С1236T (экзон 12 MDR1 ) | ||||||||||
| CC | 23 | 35 | 1,05 | 0,99 | 25 | 0,9 | 0,87 | 10 | 1,79 | 0,31 |
| CT | 49 | 76 | 1,13 | 0,77 | 64 | 1,27 | 0,49 | 12 | 0,7 | 0,56 |
| TT | 17 | 20 | 0,76 | 0,57 | 16 | 0,76 | 0,6 | 4 | 0,77 | 0,78 |
| G2677T (экзон 21 MDR1 ) | ||||||||||
| GG | 28 | 42 | 0,88 | 0,77 | 32 | 0,82 | 0,63 | 10 | 1,15 | 0,94 |
| GT | 45 | 82 | 1,25 | 0,48 | 67 | 1,31 | 0,41 | 15 | 1,05 | 0,92 |
| ТТ | 16 | 22 | 0,81 | 0,69 | 18 | 0,83 | 0,76 | 4 | 0,73 | 0,78 |
| C3435T (экзон 26 MDR1 ) | ||||||||||
| CC | 12 | 36 | 2,26 | 0,035 | 29 | 2,24 | 0,046 | 7 | 3,36 | 0,13 |
| CT | 38 | 61 | 1,06 | 0,93 | 47 | 0,97 | 0,97 | 14 | 1,15 | 0,93 |
| TT | 39 | 41 | 0,54 | 0,04 | 36 | 0,61 | 0,12 | 5 | 0,31 | 0,04 |
| TT/CC | 0,35 | 0,01 | | 0,38 | 0,03 | | 0,22 | 0,03 | ||
| A1218+8G (интрон 9 MRP1) | ||||||||||
| AA | 39 | 43 | 0,63 | 0,14 | 34 | 0,6 | 0,13 | 9 | 0,77 | 0,77 |
| AG | 37 | 68 | 1,58 | 0,14 | 56 | 1,61 | 0,14 | 12 | 1,44 | 0,58 |
| GG | 10 | 14 | 0,96 | 0,9 | 12 | 1,01 | 0,84 | 2 | 0,72 | 1 |
| T1684C (экзон 13 MRP1) | ||||||||||
| TT | 0 | 0 | | | 0 | | | 0 | | |
| TC | 30 | 38 | 0,75 | 0,4 | 30 | 0,81 | 0,61 | 8 | 0,57 | 0,35 |
| CC | 56 | 95 | 1,34 | 0,4 | 69 | 1,23 | 0,61 | 26 | 1,74 | 0,32 |
| C2461-30G (интрон 18 MRP1 ) | ||||||||||
| CC | 2 | 0 | 0,34* | 0,56 | 0* | 0,39 | 0,58 | 0* | 2,47 | 0,98 |
| CG | 34 | 49 | 0,99 | 0,92 | 44 | 1,05 | 0,98 | 5 | 0,64 | 0,62 |
| GG | 50 | 76 | 1,12 | 0,81 | 64 | 1,05 | 0,99 | 12 | 1,73 | 0,49 |
К – контрольная группа, n – число наблюдений, *– ОШ при допущении единицы в ячейке «дикой» гомозиготы
Роль полиморфизмов генов GSTP1, MDR1, MRP1 в формировании устойчивости к химиотерапии у больных хроническими лимфопролиферативными заболеваниями
Об ассоциации разных генотипов с устойчивостью к химиотерапии судили по величине отношения шансов, показывающей во сколько раз выше вероятность быть устойчивым к химиотерапии (ОШ>1), чем чувствительным (ОШ<1) для индивида с данным генотипом. Данные по ассоциации различных генотипов GSTP1, MDR1 и MRP1 с устойчивостью к химиотерапии представлены в таблице 2.
При анализе взаимосвязи между полиморфным вариантом гена GSTP1 в 5 экзоне и эффектом от лечения в общей группе больных ХЛПЗ было выявлено, что дикий генотип 313АА ассоциирован с чувствительностью к проводимому лечению. Вероятность не иметь эффекта от лечения у больных с этим генотипом ниже по сравнению с другими больными (ОШ=0.43, р=0,04) (табл. 2). Для генотипа 313AG выявлена обратная ассоциация: наличие данного генотипа приводит к увеличению шанса в 2,39 раза не отвечать на химиотерапию (р=0,04) (табл. 2). Поэтому A313G генотип можно считать фактором устойчивости к лечению.
Для полиморфизма в 6 экзоне гена GSTP1 не было выявлено достоверных ассоциаций различных полиморфных вариантов с устойчивостью к химиотерапии (таблица 2).
Анализ ассоциаций генетических вариантов MDR1 с ответом на химиотерапию представлен в таблице 2. Для полиморфизмов в интроне 6 и экзоне 12 у больных ХЛПЗ не было выявлено достоверных ассоциаций полиморфных вариантов С6+139T и C1236T с эффектом от химиотерапии (табл. 2). Больные ХЛПЗ с генотипом 2677ТT в 21 экзоне имеют вероятность формирования устойчивости к химиотерапии в 6.8 раза выше по сравнению с больными, имеющими один или оба аллеля 2677G (р=0,008). Аналогичная связь прослеживается для больных с генотипом 3435ТT: вероятность устойчивости к химиотерапии у них в 6.3 раза выше (р=0,02), чем у больных с генотипом 3435СC и еще более высокая по сравнению с больными, имеющими один или оба аллеля 3435С в генотипе (ОШ=10,08, р=0,002). Кроме того, если больной имеет гаплотип 2677TТ/3435ТT, то риск быть устойчивым к лечению у него в 10.5 раз выше (р=0,007), чем у больных с комбинацией генотипов 2677GG/3435CC, а по отношению к больным с другими комбинациями генотипов – в 17 раз (ОШ=17,73, р=0,00045).
Известно, что полиморфизм С3435Т в 26 экзоне находится в неравновесии по сцеплению с полиморфизмами 21 экзонах, который в свою очередь приводит к аминокислотной замене (Kim et al., 2001). Поэтому выявленные различия в формировании устойчивости к химиотерапии у больных ХЛПЗ с разными генотипами в 26 экзоне могут быть результатом сцепления с полиморфизмами, приводящими к изменению структуры и функции белка.
Таблица 2
Ассоциация полиморфных вариантов GSTP1, MDR1 и MRP1 с эффектом от лечения у больных ХЛПЗ
| Полимор-физм | Гено-тип | НО* на ХТ, n | ЕО* на ХТ, n | ОШ | p |
| A313G (экзон 5) | AA | 19 | 36 | 0,43 | 0,04 |
| AG | 26 | 19 | 2,39 | 0,04 | |
| GG | 5 | 6 | 1,02 | 1 | |
| C341T (экзон 6) | CC | 18 | 32 | 0,88 | 0,95 |
| CT | 6 | 11 | 0,92 | 0,88 | |
| TT | 1 | 0 | 1,79* | 1 | |
| C6+139T (интрон 6) | CC | 4 | 5 | 3,6 | 0,18 |
| CT | 5 | 14 | 1,38 | 0,74 | |
| TT | 3 | 22 | 0,29 | 0,16 | |
| С1236T (экзон 12) | CC | 4 | 5 | 3,6 | 0,18 |
| CT | 5 | 14 | 1,38 | 0,74 | |
| TT | 3 | 22 | 0,29 | 0,16 | |
| G2677T (экзон 21) | GG | 4 | 18 | 0,64 | 0,74 |
| GT | 1 | 16 | 0,14 | 0,08 | |
| ТТ | 7 | 7 | 6,8 | 0,0084 | |
| TT/GG | | | 0,92 | 0,99 | |
| C3435T (экзон 26) | CC | 4 | 18 | 0,64 | 0,74 |
| CT | 1 | 18 | 0,12 | 0,04 | |
| TT | 7 | 5 | 10,08 | 0,002 | |
| TT/CC | | | 6,3 | 0,02 | |
| A1218+8G (интрон 9) | AA | 5 | 5 | 2,4 | 0,42 |
| AG | 5 | 11 | 0,55 | 0,68 | |
| GG | 0** | 1 | 1,6 | 1 | |
| T1684C (экзон 13) | TT | 0 | 0 | | |
| TC | 1 | 6 | 0,26 | 0,37 | |
| CC | 9 | 14 | 3,86 | 0,37 | |
| C2461-30G (интрон 18) | CC | 0 | 0 | | |
| CG | 2 | 6 | 0,58 | 0,68 | |
| GG | 8 | 14 | 1,71 | 0,68 |
* НО на ХТ – нет ответа на химиотерапию, ЕО на ХТ – есть ответ на химиотерапию; **– ОШ при допущении единицы в ячейке мутантной гомозиготы в группе чувствительных к химиотерапии
Частоты исследованных аллелей гена MRP1 достоверно не отличались в группе с наличием ответа на лечение и в группе больных, устойчивых к лечению. При анализе ассоциации различных генотипов с формирование устойчивости к лечению у больных ХЛПЗ не было выявлено каких-либо достоверно значимых ассоциаций (табл.2).
На сегодняшний день существуют лишь предположения о том, каким образом однонуклеотидные замены могут влиять на развитие предрасположенности к онкологическим заболеваниям. Одной из гипотез является предположение о том, что аллель - специфические различия в укладке РНК могут влиять на экспрессию генов, участвуя, например, в транскрипции, сплайсинге или процессинге (Le Hir H., et al., 2003). Возможно, также, что некоторые однонуклеотидные замены повышают стабильность мРНК, что в последствие приводит к повышенной экспрессии белка. Но, тем не менее, молекулярные механизмы влияния однонуклеотидных замен на функцию Р-ликопротеина и MRP до сих пор остаются неизвестными.
Однако, полиморфизм в индивидуальных генах незначительно увеличивает риск развития заболевания или формирования устойчивости к химиотерапии. Комбинация вариантов аллелей, в том числе и с аллелями других генов, учавствующих в детоксификации ксенобиотиков, вероятно, увеличит эффективность оценки риска. Такой пример увеличения риска не ответить на лечение был продемонстрирован для комбинации генотипов 21 и 26 экзона гена MDR1. Кроме того, неправильно было бы рассматривать полиморфизм гена как единственный механизм формирования различной чувствительности к заболеваниям. Также нужно исследовать экспрессию генов и функциональную активность изучаемых белков, таким образом формируя системный подход к проблеме.
