Научные основы прогноза токсичности и опасности химических веществ с учетом механизма токсического действия. 14. 02. 01 Гигиена
| Вид материала | Автореферат |
- Отравление аварийными химически опасными веществами, 33.95kb.
- Токсикомания шаг в сторону наркомании, 29.31kb.
- Показатели безопасности изделий регламентируются с учетом функционального назначения,, 184.97kb.
- Вопрос Параметры звука, 183.33kb.
- Волощенко О. И., Медяник, 2522.04kb.
- Программа спецкурса «методы расчета физико-химических свойств веществ» для студентов, 40.47kb.
- Т е м ылекций по гигиене для студентов IV курса медицинского факультета по специальностям, 21.78kb.
- Технология переработки отходов производств, использующих высокочистый кремний 05. 17., 277.13kb.
- О государственной регистрации потенциально опасных химических и биологических веществ, 360.85kb.
- «О пользе молока», 74.05kb.
результаты исследований.
Научное обоснование прогноза токсичности веществ в воде на основе соотношений структура-биотрансформация-активность и сравнительная оценка этого подхода и стандартных методов КССА
Первый этап включал анализ литературных данных о биохимических процессах взаимодействия веществ с ферментными системами и теоретических работ, посвященных моделированию процессов биотрансформации и их связи с токсичностью; реакции биоактивации систематизированы в соответствии с их механизмом. Проведенный анализ свидетельствует, что как реакции первой фазы биотрансформации, так и реакции второй фазы могут приводить не только к детоксикации, но и к биоактивации (токсификации) чужеродных химических веществ. Сделано заключение, что возможные пути биотрансформации и механизмы токсического действия определяются структурой вещества, т.е. наличием определенных структурных фрагментов, а степень выраженности эффекта - вероятностью осуществления реакций биотрансформации, которая обусловлена их энергетическими характеристиками.
В соответствии с развитой ранее ( З.И. Жолдакова, 1987) патогенетической моделью интоксикации выделены ведущие стадии взаимодействия вещества с организмом – стадия всасывания и транспорта к активному центру фермента или к макромолекулярному рецептору, стадия трансформации на активном центре фермента, стадия взаимодействия образовавшихся метаболитов с макромолекулами-рецепторами, стадия выведения.
Вторая стадия — это высокоспецифичная реакция, протекающая с участием ферментов и приводящая к биотрансформации вещества. На третьей стадии осуществляется взаимодействие образовавшихся в ходе биотрансформации продуктов или интермедиатов (короткоживущих промежуточных соединений) с биомолекулами. На этой же стадии возможно взаимодействие с биомолекулой-мишенью самого вещества, обуславливающее его токсическое действие. Таким образом, интоксикация организма может быть вызвана взаимодействием как с самим веществом, так и с продуктами его биотрансформации. Токсичность на второй и третьей стадиях может быть описана с помощью параметров, характеризующих реакционную способность ксенобиотиков.
Взаимодействие веществ или продуктов их биотрансформации с биомолекулами-рецепторами вызывает целый ряд биохимических и феноменологических изменений, приводящих к наблюдаемому токсическому эффекту, поэтому во многих случаях именно эта стадия является определяющей.
Интенсивное развитие экспериментальных исследований механизма взаимодействия вещества с организмом на молекулярном уровне, с изучением токсикокинетики, установлением структуры и количества образовавшихся метаболитов и их токсичности позволяет сделать обоснованные предположения о том, какая стадия является определяющей для механизма токсического действия соединений данного структурного ряда и данного токсического эффекта.
На основе классификации механизмов токсического действия на молекулярном уровне и гипотезы о природе определяющей стадии взаимодействия вещества или продуктов его биотрансформации с биомолекулами, включающей гипотезу о природе реакций биотрансформации, разработан метод определения параметров для построения зависимостей структура-биотрансформация-активность.
При анализе токсичности неизвестного вещества проводили;
- отнесение его к определенному структурному ряду;
- поиск и анализ данных о биохимических механизмах действия веществ этого ряда на организм и процессов биотрансформации;
- поиск данных о предполагаемых метаболитах и их токсичности.
Выбор независимых переменных соотношений структура-биотрансформация-токсичность осуществляли исходя из гипотезы об определяющей стадии взаимодействия вещества с биомолекулами:
- в случае, когда согласно гипотезе действие вещества на организм связано с взаимодействием самого вещества с биомолекулой-рецептором – в качестве независимых переменных использовали параметры, характеризующие электронное строение и реакционную способность самого вещества (энергии высшей заполненной и нижней свободной молекулярных орбиталей, заряды атомов и т.д.);
- в случае, когда согласно гипотезе действие вещества на организм связано с образованием в ходе биотрансформации метаболитов более реакционноспособных и следовательно более активных, чем исходные вещества, проводили расчет параметра, характеризующего энергию активации модельной реакции биотрансформации - разности теплот образования (энергий) продуктов и исходных соединений;
- если для данного соединения имеется несколько реакционных центров (атомов), с участием которых может проходить реакция - по результатам расчета параметра, характеризующего энергию активации, определяли, какая именно реакция биотрансформации из всех возможных на данном пути реализуется для данного соединения, т.е. определяли наиболее энергетически выгодную, ключевую реакцию биотрансформации;
- если определяющая стадия механизма токсического действия связана с образованием в ходе биотрансформации короткоживущих интермедиатов, в качестве независимой переменной использовали параметр, характеризующий энергию активации ключевой реакции биотрансформации;
- в случае, если определяющая стадия механизма токсического действия связана с образованием в ходе биотрансформации стабильных высокотоксичных метаболитов, в качестве независимых переменных использовали характеристики реакционноспособности этих метаболитов – продуктов ключевой реакции биотрансформации или их производных.
Далее с использованием регрессионного анализа получали уравнение зависимости показателей токсикометрии от определенных таким образом независимых переменных – модель структура-токсичность. После построения достоверной модели структура-токсичность проводили ретроспективную верификацию и расчет показателей токсикометрии для неизученных веществ (прогноз).
Так, для соединений ряда замещенных бензолов гипотеза, выдвинутая П.Н. Дьячковым, И.П.Улановой и А.В. Кузнецовым и развитая в настоящей работе (Харчевникова Н.В., Дьячков П.Н. и соавт., 2004; Dyachkov P.N., Kharchevnikova N.V., et al., 2007, 2010), состояла в том, что стадией механизма токсического действия, определяющей острую токсичность, является взаимодействие с биомолекулами метаболитов, образующихся в ходе биотрансформации ароматического гидроксилирования. Реакция биотрансформации идет через стадию образования ареноксидного интермедиата с тетраэдрически координированным атомом углерода бензольного кольца (рис. 1).
 Рисунок 1. Биотрансформация замещенных бензолов под действием цитохрома Р450 (оксеноидная модель).
Рисунок 1. Биотрансформация замещенных бензолов под действием цитохрома Р450 (оксеноидная модель).Согласно выдвинутой гипотезе, острая токсичность замещенных бензолов определяется легкостью осуществления (скоростью) ключевой реакции биотрансформации – наиболее энергетически выгодной реакции образования ареноксидного инетрмедиата IV (рисунок 1). Прогноз токсичности включал определение ключевой реакции биотрансформации – т.е. прогноз положения присоединения кислорода. Параметром, определяющим это положение, является минимальная для данного соединения разность энергий интермедиатов, различающихся положением присоединения кислорода, и исходного производного бензола Еmin.
Адекватность метода прогноза ключевой реакции биотрансформации была проверена нами с использованием выборки субстратов ароматического гидроксилирования из коммерческой базы данных Metabolite 2001.1. Для 24 сложных соединений, которые можно рассматривать как замещенные бензолы, для всех возможных путей биотрансформации ароматического гидроксилирования были рассчитаны значения параметра, характеризующего устойчивость интермедиата Е. Согласно гипотезе о ключевой реакции биотрансформации, экспериментально наблюдаемый метаболит должен соответствовать наименьшему значению параметра. Точность прогноза положения ароматического гидроксилирования составила 92%. В таблице 2 приведены примеры прогноза в сопоставлении с экспериментальными данными.
Наши расчеты подтвердили, что и для сложных соединений существует прямая зависимость острой токсичности в этом ряду от параметра, характеризующего ключевую реакцию (минимальной разности энергий. ареноксидных интермедиатов и исходного соединения, Еmin).
Получена достоверная зависимость острой токсичности для ароматических соединений, которые могут рассматриваться как бензолы с простыми и сложными заместителями (хлорированных бифенилов, бифениловых эфиров, соединений типа дифенилметана), от параметра Еmin.
Таблица 2. Сравнение теоретических и экспериментальных данных по ключевой реакции биотрансформации ароматического гидроксилирования
| Соединение | Возможные положения гидроксилирования | Е (ккал/моль) | Эксперимент |
 | 4 | 0,32 | + |
| 5 | 4,53 | - | |
| 6 | 1,32 | - | |
 | 16 | -0,83 | + |
| 4 | 0,27 | + | |
| 18 | 0,67 | - | |
| 17 | 0,87 | - | |
| 8 | 7,17 | - | |
| 9 | 1,17 | - | |
 | 4 | 2,15 | + |
| 5 | 7,65 | - | |
| 2 | 5,8 | - |
Зависимость описывает острую токсичность около 70 соединений с использованием одного параметра.
Из-за включения замещенных бензолов со сложными заместителями соединения в этом ряду довольно сильно различаются по размерам молекул, поэтому показатели токсикометрии, для которых строятся соотношения структура-активность (например ЛД50 ), были пересчитаны в миллимоли на килограмм.
Для всего ряда изученных производных бензола, включая бифенил, хлорированные бифенилы, бифениловые эфиры и соединения типа дифенилэтана получены следующая зависимость ЛД50 для мышей от параметра Еmin (рис.2):
lgЛД50 (ммоль/кг) = 1,408 + 1,066 Еmin;
r = 0,793 n = 67 s = 0,262 F = 110,27 р < 0,0001
Зависимость острой токсичности для крыс в этом ряду имеет вид:
lgЛД50 (ммоль/кг) = 1,511 + 1,03 Еmin;
r = 0,734 n = 67 s = 0,29 F = 81,7 р < 0,0001
При высокой достоверности зависимостей коэффициенты корреляции не очень высоки, что определяется природой экспериментальных данных. Типичные лабораторные различия в определении ЛД50 составляют 2-3 раза (Каспаров А.А., Саноцкий И.В., 1986).
Был сделан ретроспективный прогноз показателей острой токсичности для замещенных бензолов, не вошедших в обучающую выборку. Расхождения значений показателей острой токсичности, взятых из баз данных, с рассчитанными по уравнению (1), не превышали 3 раз, что подтверждает надежность прогноза на основании данного уравнения.
Для всего ряда замещенных бензолов выявить достоверную линейную связь хронической токсичности с параметром Еmin не удалось. Такая зависимость выявлена для 13 соединений этого ряда.
Линейная зависимость между lgМНД и параметром Еmin, аналогична полученной для показателя острой токсичности.
lgМНД (ммоль/кг) = -2,76 + 1,95 Еmin
r = 0,82 n = 13 p < 0,01
Вещества, которые укладываются в зависимость, включают алкил и гидрокси замещенные бензолы, тогда как амино- и нитрозамещенные производные выпадают из зависимости. Необходимо отметить, что для ряда соединений, выпадающих из зависимости, сопоставление МНД и референтной дозы RfD при поступлении per os свидетельствует, что зарубежный норматив вносит коррекцию в сторону сближения с зависимостью, полученной для других членов ряда. Так, для бифенила МНД на три порядка ниже, чем RfD, для ацетофенона – на порядок, хлорбензола и о-дихлорбензола – на 2 порядка. Очевидно, требуется гармонизация отечественных и зарубежных нормативов этих веществ.
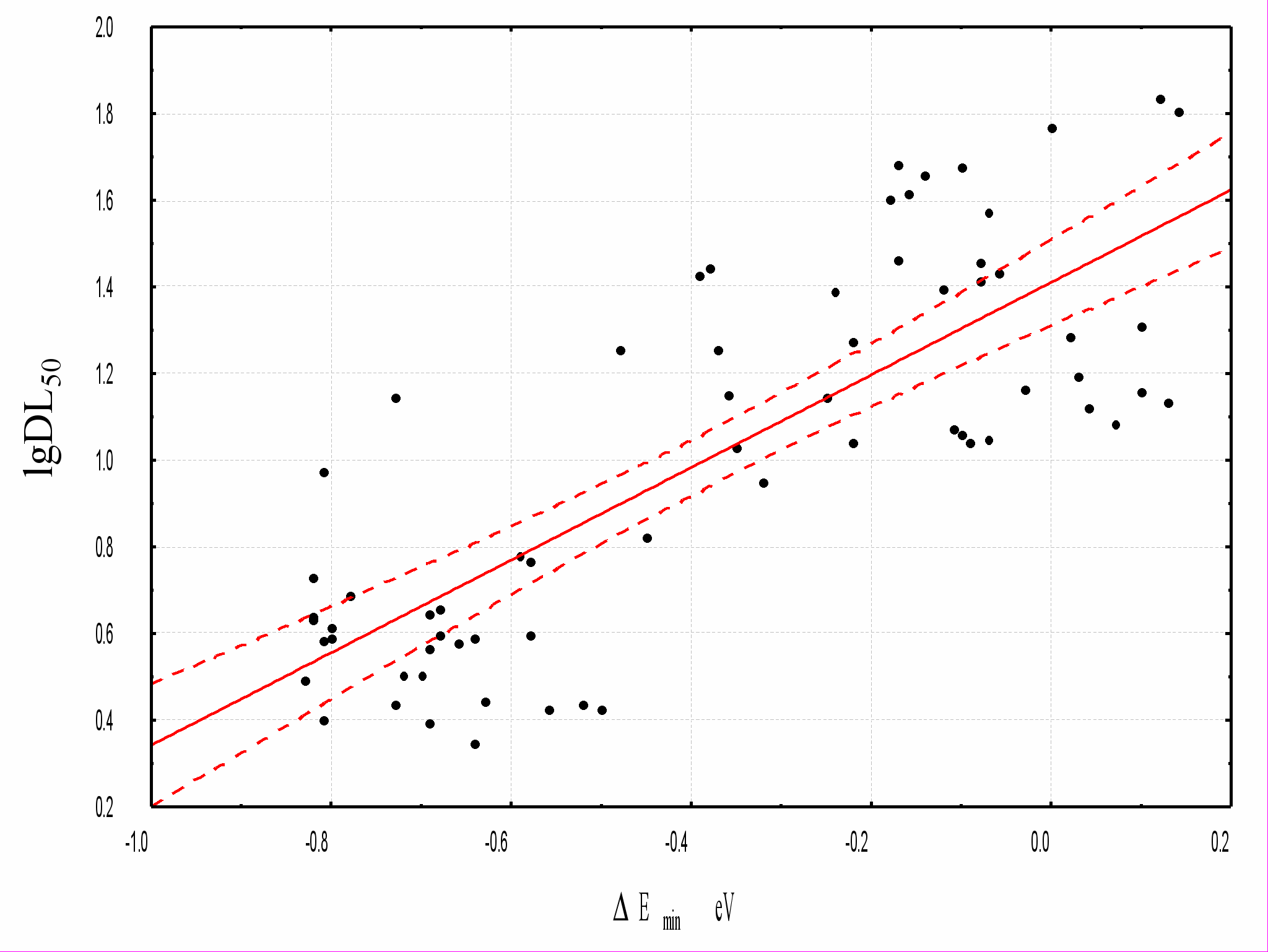
Рисунок 2. Зависимость острой токсичности замещенных бензолов для мышей при внутрижелудочном введении от параметра Еmin.
С использованием того же параметра Еmin создана модель, позволяющая отделять канцерогенные одно- и двукратно замещенные бензолы от не канцерогенных. Гипотеза состояла в том, что ареноксидные интермедиаты, образование которых определяет острую токсичность бензолов, не являются конечными канцерогенами, а процесс гидроксилирования, энергия активации которого характеризуется параметром Еmin, приводящий к образованию соединений более гидрофильных, чем исходные, в общем случае является процессом детоксикации по канцерогенному эффекту. Показано, что соединения, для которых Еmin < -0,17 эВ, т.е. для которых гидроксилирование проходит легко, не обладают канцерогенностью, тогда как соединения с Еmin > -0,17 эВ являются канцерогенами. Исключение составляет случай, когда вещества, легко подвергающиеся гидроксилированию, как, например, гидрохинон, обладают собственной канцерогенной активностью, связанной с альтернативными путями метаболической трансформации. С использованием дополнительного параметра, характеризующего легкость образования фенилгидроксиламинов и нитрениевых ионов на пути N-окисления амино группы и восстановления нитрогруппы получена дискриминантаная функция, позволяющая отделить канцерогенные нитро и амино двукратно замещенные бензолы от не канцерогенных.
Параметр Еmin использован при создании модели для прогноза пути и интенсивности биодеградации полихлорированных бифенилов под действием бактерий.
Достоверные соотношения структура-биотрансформация-токсичность для различных видов эффектов – нефротоксичности, гонадотоксичности, мутагенной активности получены в ряду галогенсодержащих алифатических соединений. Гипотеза состояла в том, что различные виды токсичности галогенированных алифатических соединений определяются способностью соединений вступать в одну и ту же химическую реакцию с биомолекулами и могут быть предсказаны с использованием одного параметра, характеризующего эту реакцию. Выбор параметра определялся тем, что в ряду веществ, подвергающихся одному типу трансформации, разность энергий граничных орбиталей характеризует легкость прохождения реакции. С использованием этого параметра получены достоверные зависимости нефротоксичности, гонадотоксичности и генотоксичности в ряду галогенированных пропанов и мутагенности в ряду галогенированных алканов и спиртов с короткой цепью. В том же ряду получена достоверная зависимость мутагенности от параметра, характеризующего реакционную способность метаболитов, образующихся в ходе окислительного дегалогенирования под действием цитохрома Р450.
При прогнозе токсичности и опасности соединений ряда ароматических аминов исходили из представления о том, что как общая токсичность, так и избирательная (метгемоглобинобразующая), и специфическая (мутагенность и канцерогенность) активности определяются биоактивацией в ходе N-окисления аминогрупп.

Рисунок 3. Схема биотрансформации ароматических аминов
Установлено, что ответственными за образование метгемоглобина при действии ароматических аминов являются не сами соединения, а их промежуточные метаболиты - продукты N-окисления. Первый метаболит - N-фенилгидроксиламин окисляется оксигемоглобином до нитрозобензола. Нитрозобензол восстанавливается в N-фенилгидроксиламин. Прогноз выполнен на основании схемы биоактивации (рис. 3), построенной по результатам данных биохимических исследований (McLean,1968, Kadbular, 1990). N-фенилгидроксиламины и особенно нитрозобензол производные выделены как промежуточные продукты биотрансформации анилина, алкиланилинов, п-фенетидина, 2-аминофлюорена и других ариламинов.
Таблица 3. Метгемоглобинобразование под действием ариламинов
| № п/п | Название | ЕНСМО нитро- зобен- золов | крысы в/ж 1/2ЛД50 | крысы в /ж / 1/5ЛД50 | кошки в/в 0,25 м/кг | кошки в/ж 0,25 м/кг |
| %Mt Hb | %Mt Hb | |||||
| 1 | Анилин | -0,85 | 32 | 4,8 | 61,6 | 48,1 |
| 2 | пара-толуидин | -0,89 | 24,9 | 5,0 | 50,5 | - |
| 3 | мета-толуидин | -0,85 | 32,6 | 7,0 | 61,3 | - |
| 4 | орто-толуидин | -0,86 | 19,9 | 5,0 | 32,1 | - |
| 5 | 2,4-диметиланилин | -0,85 | - | - | 6,3 | - |
| 6 | 2,5-диметиланилин | -0,89 | - | - | 29,1 | - |
| 7 | 2,6-диметиланилин | -0,81 | - | - | 7,2 | - |
| 8 | 3,4-диметиланилин | -0,82 | - | - | 14,1 | - |
| 9 | 3,5-диметиланилин | -0,84 | - | - | 38,3 | - |
| 10 | п-фторанилин | -1,184 | - | - | 66 | - |
| 11 | м-фторанилин | -1,06 | - | - | 60,8 | - |
| 12 | о-фторанилин | -1,07 | - | - | 45,5 | - |
| 13 | 2,4-дифторанилин | -1,27 | - | - | 62,5 | - |
| 14 | п-аминобензойная кислота | -0,7 | - | - | 0 | - |
| 15 | 2-аминобензиловый спирт | -0,79 | - | - | 6,9 | |
| 16 | 3-аминобензиловый спирт | -0,79 | - | - | 0,6 | |
| 17 | пара-хлоранилин | -1,25 | 60 | 30 | - | - |
| 18 | орто-хлоранилин | -1,18 | - | - | - | 53,1 |
| 19 | мета-хлоранилин | -1,167 | 42 | 20 | - | 47,3 |
| 20 | пара-анизидин | -0,987 | 29,9 | 8,4 | - | - |
| 21 | орто-анизидин | -0,925 | 16 | 6,5 | - | - |
| 22 | 2,4,6-трихлоранилин | -1,22 | 7,2 | - | - | 38,8 |
| 23 | 2,6-дихлоранилин | -1,02 | - | - | - | 17 |
| 24 | 2,4-дихлоранилин | -1,23 | - | - | - | 31,7 |
| 25 | пара-фенетидин | -0,765 | 35,3 | 9,9 | - | - |
| 26 | Пентафторанилин | -2,02 | - | - | - | 1,4 |
| 27 | 2,3,4,5-тетрафторанилин | -2,12 | - | - | - | 3,3 |
| 28 | 2-броманилин | -1,05 | - | - | - | 56,4 |
| 29 | 3-броманилин | -1,03 | - | - | - | 46,6 |
| 30 | 2,6-диброманилин | -0,98 | - | - | - | 2,6 |
| 31 | 2,4,6-диброманилин | -0,91 | - | - | - | 19,1 |
Сделано предположение, что метгемоглобинобразующая активность ароматических аминов может коррелировать с параметрами, характеризующими легкость окислительно-восстановительного процесса, протекающего в эритроцитах при действии на организм ариламинов. В таблице 3 представлены данные по метгемоглобинобразованию под действием ариламинов в острых и подострых опытах на белых крысах (в/ж введение, % метгемоглобина), данные работы по метгемоглобинобразованию под действием ариламинов у кошек (в/в и в/ж введениие, % метгемоглобина) (McLean et al., 1967), а также результаты расчетов ЕНСМО нитрозосоединений, образующихся в результате метаболизма исходных замещенных ариламинов.
Гипотеза состояла в том, что, что метгемоглобинобразующая активность ариламинов определяется не только легкостью образования первого метаболита, но и его способностью вступать в следующую реакцию метаболизма - окисления в эритроцитах. Активным окислительным агентом в реакциях превращения оксигемоглобина в метгемоглобин является свободный радикал, образующийся в процессе восстановления нитрозогруппы в гидроксиламиногруппу. Известно, что способность соединения к восстановлению, т.е. сродство к электрону, характеризуется энергией нижней свободной молекулярной орбитали ЕНСМО. Первой стадией окисления N-фенилгидроксиламинов в эритроцитах является образование катион-радикалов с переносом одного электрона на связанный с гемоглобином кислород. Перенос второго электрона с железа(II) приводит к образованию метгемоглобина и перекиси водорода.
Зависимости содержания метгемоглобина в крови крыс, получавших ариламины в остром опыте в дозе 1/2ЛД50 (%МtHb (ac)) и подостром эксперименте в дозе 1/5ЛД50 (%МtHb (subac)), от ЕНСМО нитрозосоединений, имеют вид:
%МtHb (ac) = -33,7 ЕНСМО- 68,9 ; r=0,88, n=12, p<0,01
%МtHb (subac) = -30,925 EНСМО - 19,36; r=0,81, n=9, p<0,01
Показано, что метгемоглобинобразующая активность соединений коррелирует с ЕНСМО. Снижение ЕНСМО (рост сродства к электрону) сопровождается ростом метгемоглобинобразующей активности. Зависимости хорошо передают и объясняют известную качественную закономерность об увеличении метгемоглобинобразующей активности анилина при введении в качестве заместителе атомов хлора.
Таким образом, метгемоглобинобразующая активность ариламинов обусловлена активностью их метаболитов в процессах окисления-восстановления. Зависимость метгемоглобинобразующей активности от структуры ариламинов удалось описать с использованием параметров, характеризующих окислительно-восстановительные свойства не самих ариламинов, а их метаболитов.
Предлагаемый подход позволяет не только получить достоверные и теоретически обоснованные зависимости структура-токсичность, но и предсказать вид токсического эффекта. Так, гипотеза состояла в том, что существует обратная зависимость между метгемоглобинобразующей и мутагенной активностью ариламинов, и эти виды активности должны коррелировать с относительной устойчивостью N-фенилгидроксиламинов и нитрениевых ионов - двух последовательных метаболитов ариламинов, т.е. с энтальпией реакции перегруппировки:
ArNHOH + H+ ArNH+ +H2O , где Ar – арил, ароматическая система.
Высказанное предположение подтверждено с использованием рассчитанного методом АМ1 параметра (Hf) - разности энергий образования нитрениевых ионов и соответствующих N-фенилгидроксиламинов (таблица 4).
Таблица 4. Мутагенная и метгемоглобинобразующая активности ариламинов
| Соединение | % MtHb | Логарифм удваивающей дозы в тесте Эймса (мкм/чашку) | (Hf) (ккал/моль) |
| Анилин | 61,6 | 2 | 0 |
| п-Толуидин | 50,5 | 0,86 | -3,8 |
| о-Толуидин | 32,1 | 0,58 | -5,7 |
| 2,4-диметиланилин | 6,3 | -0,65 | -11,2 |
| 2,6-диметиланилин | 7,2 | 0,44 | -10,8 |
| 2,5-диметиланилин | 29,1 | 0,34 | -10,5 |
| 2,3-диметиланилин | 24,3 | 0,46 | -5,5 |
| 3,4-диметиланилин | 14,1 | -0,12 | -7,9 |
| 3,5-диметиланилин | 38,3 | 0,55 | -5,4 |
За нуль принято значение параметра для анилина. Данные по метгемоглобинобразующей активности ариламинов взяты из работы (McLean et al., 1967), в которой активность соединений определена на кошках как наиболее чувствительных к этому виду активности животных. Исследования проведены при введении соединений внутривенно и внутрижелудочно на двух дозах - 0,25 моль/кг и 0,065 моль/кг. Выбраны данные для метгемоглобинобразующей активности соединений при в/в введении в дозе 0,25 моль/кг, т.к. при этих условиях изучено больше соединений, для которых известна также мутагенная активность в тесте Эймса. Использованы данные для случая метаболической активации микросомальной фракцией клеток печени хомяка (Zeiger E. et al., 1988, 1992).
Видно (рис. 4), что зависимости представляют из себя "ножницы”, т.е. с ростом (Hf), соответствующим затруднению образования нитрениевого иона, растет метгемоглобинобразующая активность и падает мутагенность (растет удваивающая доза).
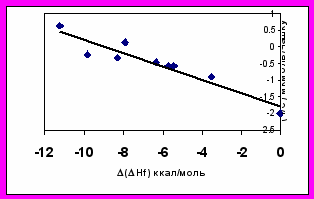
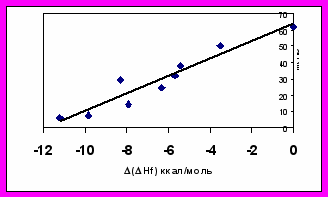
Рисунок 4. Зависимости метгемоглобинобразующей активности (%MHb) и мутагенной активности в тесте Эймса (удваивающие дозы) от относительной устойчивости метаболитов в ряду ароматических аминов.
Таким образом, по крайней мере, в изученном ряду соединений существует обратная зависимость этих двух видов активности, и они связаны с относительной устойчивостью двух последовательных метаболитов ариламинов – N- фенилгидроксиламинов и нитрениевых ионов. Можно сделать вывод, что общетоксический эффект и мутагенный эффект соединений определяются различными метаболитами исходных веществ - ароматических аминов. Эта зависимость может быть использована при выборе показателей при обосновании безвредных доз ароматических аминов. Таким образом, предлагаемый подход позволяет осуществлять прогноз вида токсического эффекта.
В таблице 5 представлены полученные уравнения зависимостей структура биотрансформация-токсичность.
Таблица 5. Соотношения структура-биотрансформация-токсичность
| Структурный ряд | Эффект | Регрессионное уравнение |
| Замещенные Бензолы | Общая токсичность | lgЛД50 = 1,64 + 1,23 Еmin r = 0,793 n = 67 р < 0,001 lgМНД =-2,76 + 1,95 Еmin r = 0,82 n = 13 p < 0,01 |
| Ароматические Амины | Мутагенная активность в тесте Эймса Метгемоглобин- образующая актив- ность на млекопи-тающих Токсичность для млекопитающих | lg(1/С ) = - 1,65 - 0,15 (Hf) r=0,91 n= 10 p < 0,001 %MtHb = 66,9 + 5,03 (Hf) r=0,92 n=10 p < 0,001 lgЛД50 =-33,17-4.05 (Hf)int r=0,82 n=22 p<0,01 |
| Галогензаме-щенные пропаны | Некроз почек Генотоксичность in vivo | lgC = -16,69 + 1,71 Егр r=0,99 n=6 p < 0,001 lgC = -18,07 + 1,73 Егр r=0,99 n=6 p < 0,001 |
| Галогензаме-щенные углево- дороды и спир- ты с короткой цепью | Мутагенная актив- ность на бактериях (вариант без акти-вации) Мутагенная актив- ность на бактериях (вариант с актива- цией) | lgDmut= - 17,62+1,55Егр -0,79lgP r=0,76 n=25 p < 0,001 lgDmut= - 26,24+2,54Егр.м r=0,76 n=21 p < 0,001 lgDmut= - 2,69-5,7 4С2 r=0,72 n=21 p < 0,001 |
| Алифатические спирты | Хроническая токсичность | lgМНД = -21,02-1,56 ЕHOMO –0,77 lgP n=28 r=0,86 p<0,001 |
| Алифатические амины | Острая токсичность Хроническая тоскичность | lgЛД50 = 2,42 - 0,21 lgP -0,029 (lgP)2-0,142 pKa n = 40 r = 0,84 p < 0,001 lgПД = -5,68 + 0,17(Hf)r n = 9 r=0,80 p < 0,01 |
| Замещенные пиридины | Острая токсичность Хроническая токсичность | lgЛД50 = -2,40 + 0,33 Егр n = 17 r = 0,86 p < 0,001 lgМНД = -24,7 + 2,04 Егр n = 7 r = 0,75 p < 0,05 |
