Вирусные болезни и современные методы оздоровления плодовых и ягодных культур специальность 06. 01. 07 защита растений
| Вид материала | Документы |
- Комплекс мероприятий по защите сада от вредителей. Литература, 648.1kb.
- Научное обоснование создания сырьевых садов на основе генетического потенциала плодовых, 1284.76kb.
- Общая характеристика работы Актуальность темы, 398.26kb.
- Примерная программа наименование дисциплины фитопатология и энтомология рекомендуется, 313.88kb.
- Реферат по дисциплине «Биотехнология в пищевой проышленности»: Особенности производства, 313.46kb.
- Тобольский архиерейский дом в XVII 60-е гг. XVIII в. Специальность 07. 00. 02 Отечественная, 448.98kb.
- Технологии закладки и выращивания плодовых и ягодных культур Технология закладки, 657.63kb.
- Министерство образования и науки Российской Федерации Учебно-методическое, 3299.35kb.
- Министерство образования и науки Российской Федерации Учебно-методическое, 5418.2kb.
- С. Х. Аль-Шукри, Д. Н. Солихов // нефрология. 2009. Т. 13, № С. 86-91. Библиогр.:, 347.38kb.
ВИРУСОВ САДОВЫХ КУЛЬТУР
5.1. Повышение эффективности индикаторного метода
Тестирование на травянистых индикаторах. Для улучшения переноса вирусов на травянистые индикаторы требуется совершенствование состава буфера путем введения в него антиоксидантов.
Включение в состав буфера салициловой кислоты улучшало передачу вируса PDV с рябины сорта Бусинка на индикатор Chenopodium quinoa. При использовании контрольного буфера (с никотин-основанием) симптомы инфекции отсутствовали (таблица 7).
Таблица 7 – Эффективность выявления вируса PDV на рябине сорта Бусинка при тестировании на индикаторе Chenopodium quinoa в зависимости от препарата в составе буфера для заражения
| Препарат | Концен-трация, М | Число растений с вирусными симпто-мами, в % | Число дней от инокуляции до появления симптомов | Наличие и вид симптомов |
| Контроль (никотин-основание) | 0,1 | 0 | – | – |
| Диэтилдитио- карбамат натрия | 0,015 | 20,0 | 10 | Хлоротические пятна |
| Салициловая кислота | 0,0001 | 25,0 | 6-7 | Хлоротические пятна, скручивание краёв молодых листьев |
При передаче вирусов АrМV, RpRSV, TBRV и SLRSV с ежевики сорта Смутстем на индикатор Chenopodium quinoa включение в состав буфера гидроксипроизводного бензойной кислоты (ГПБК) приводило к появлению симптомов инфекции на листьях индикатора. В варианте с никотин-основанием (10-1 М) симптомы отсутствовали. По мере снижения концентрации ГПБК с 10-3 до 10-5 М имелась тенденция к увеличению числа растений с симптомами вирусной инфекции от 40 до 80 % (патент РФ № 2147173). Разработанный способ позволяет повысить накопление вирусов в тканях индикаторов и ускорить процесс тестирования.
Тестирование на древесных индикаторах. При тестировании рябины на древесных индикаторах симптомы вирусных заболеваний отсутствовали, а по результатам ИФА высокие значения индексов зараженности вирусами ACLSV и ApMV отмечены для рябины сортов Красавица, Рубиновая и вида моравская (таблица 8).
Таблица 8 – Зараженность древесных индикаторов вирусами ACLSV и ApMV при тестировании рябины (по результатам ИФА)
| Сорт рябины | Вид индикатора | ACLSV | ApMV | ||
| Ао/Ак * | НВ | Ао/Ак | НВ | ||
| Моравская | Spy-227 | 3,3 | + | 4,2 | + |
| Красавица | Spy-227 | 3,9 | + | 4,4 | + |
| Malus platycarpa | 1,2 | − | 6,0 | + | |
| Рубиновая | Spy-227 | 3,6 | + | 3,5 | + |
| Форма № 3 | Jay Darling | 2,5 | + | 3,8 | + |
* Ао/Ак – индекс зараженности (экстинкция образца/экстинкция контроля); НВ – наличие вируса.
При тестировании ежевики сорта Смутстем у индикатора Malling Exploit отмечали отставание в росте и хлороз листовой пластинки. Накопление вирусов в тканях индикатора Malling Exploit проходило интенсивнее, чем у R. occidentalis. Поэтому для тестирования ежевики на неповирусы предпочтительнее использовать сорта красной малины по сравнению с черной.
5.2. Оптимизация метода иммуноферментного анализа
5.2.1. Влияние распределения вирусов в органах растений и подбора
оптимального вида образца на результаты диагностики
Вирусы в тканях растений распределены неравномерно, поэтому при выполнении ИФА важное значение имеет выбор оптимального вида образца. В фазу начала цветения для выявления вирусов ASPV, ASGV и ApMV на груше предпочтительней оказалось использование в качестве образцов для ИФА лепестков цветков по сравнению с листьями, а при диагностике вируса ACLSV оба вида образцов давали близкие результаты (таблица 9).
Таблица 9 – Концентрация вирусов в различных органах и заражённость деревьев груши латентными вирусами в зависимости от фазы цветения и вида тестируемого органа в открытом грунте (в среднем за 2003-2004 гг.)
| Тести- руемый орган | Показа- тель зара- жённости вирусом | ASPV | ASGV | ApMV | ACLSV | ||||
| НЦ* | КЦ | НЦ | КЦ | НЦ | КЦ | НЦ | КЦ | ||
| Листья | Ао/Ак | 1,3 а | 2,1 б | 1,5 а | 2,1 б | 1,4 а | 1,6 а | 1,7 а | 1,5 а |
| % зара-женности | 28,6 а | 61,5 б | 21,4 а | 46,2 б | 21,4 а | 23,0 а | 71,5 б | 25,0 а | |
| Лепестки цветков | Ао/Ак | 1,7 а | 1,4 а | 1,4 а | 1,8 а | 1,6 а | 1,2 а | 1,6 б | 1,1 а |
| % зара-женности | 71,4 б | 15,4 а | 25,7 а | 38,5 б | 78,6 б | 0,0 а | 64,3 б | 0,0 а |
*НЦ – начало цветения, КЦ – конец цветения.
В фазу окончания цветения вирусы лучше выявлялись в листьях, чем в лепестках цветков. Для идентификации вируса ASGV следует отбирать листья или лепестки цветков в фазу окончания цветения, вируса ASPV – лепестки цветков в фазу начала цветения или листья в фазу окончания цветения. Диагностику вируса ApMV лучше осуществлять путем тестирования лепестков цветков, а вируса ACLSV – листьев и лепестков цветков в фазу начала цветения.
При выявлении вируса ACLSV в условиях зимней теплицы использование лепестков цветков оказалось предпочтительней, чем листьев. Вирус ASPV выявлялся в листьях лучше (концентрация в 2,6 раза выше), чем в цветках. В завязях груши концентрация вирусов была ниже, чем в листьях. Наибольшая концентрация вирусов ASPV, ASGV, ACLSV и ApMV отмечена в листьях груши у основания побега, а вируса PNRSV – в средней части и у основания побега.
На рябине вирус ASGV успешно диагностировался в древесине побега и листьях. Концентрация вирусов в верхушечных листьях рябины была выше, чем в нижних (таблица 10).
Таблица 10 – Индекс зараженности растений рябины различными вирусами в зависимости от расположения листьев на побеге (в среднем по 4 срокам тестирования)
| Сорт | PNRSV | PDV | PPV | |||
| В* | О | В | О | В | О | |
| Невежинская желтая | 2,8 а | 2,4 а | 2,2 а | 3,0 а | 1,8 а | 1,8 а |
| Невежинская крупноплодная | 2,7 б | 1,9 а | 2,8 б | 1,3 а | 2,2 б | 1,3 а |
| Невежинская красная | 2,4 б | 1,6 а | 3,2 б | 1,8 а | 1,3 а | 1,6 а |
| Алая крупная | 2,5 а | 1,9 а | 2,1 а | 4,1 б | 1,8 а | 2,2 а |
| Розина | 3,3 б | 2,3 а | 2,0 а | 2,2 а | 1,8 а | 1,4 а |
| Бусинка | 2,8 б | 1,5 а | 3,0 б | 2,1 а | 2,3 б | 1,5 а |
| Среднее по сорту | 2, 8б | 1,9 а | 2,6 а | 2,4 а | 1,9 а | 1,6 а |
*В – верхушечные листья, О – листья у основания побега.
В условиях защищенного грунта для рябины оптимальным периодом диагностики являлся срок тестирования с февраля по май.
У большинства ягодных культур вирусы более интенсивно накапливались в молодых листьях верхушечной части побега (таблица 11).
Таблица 11 – Распределение вирусов по побегу у ягодных культур, индекс зараженности Ао/Ак (в среднем за 2003 и 2005 г.г.)
| Культура | Сорт | ArMV | RpRSV | SLRSV | TBRV | ||||
| В | О | В | О | В | О | В | О | ||
| Ежевика | Торн- фри | 2,1 б | 1,0 а | 1,2 а | 1,0 а | 1,3 а | 1,4 а | 1,3 а | 1,5 а |
| Смут- стем | 2,6 а | 2,6 а | 1,3 а | 1,3 а | 1,0 а | 1,5 б | 1,8 а | 2,8 б | |
| Малино- ежевичный гибрид | Логан- берри | 1,7 а | 1,5 а | 1,6 а | 1,3 а | 1,9 б | 0,8 а | 2,1 б | 1,4 а |
| Малина чёрная | Кумбер- ленд | 1,3 а | 1,0 а | 1,1 а | 1,0 а | 1,6 а | 1,4 а | 1,8 а | 1,6 а |
| Жимолость | Салют | 1,5 а | 1,3 а | 2,0 б | 1,5 а | 1,8 б | 1,2 а | 1,9 б | 1,1 а |
У ежевики сорта Смутстем вирус ArMV равномерно распределялся по побегу, а вирус TBRV интенсивнее накапливался в листьях у основания побега.
Вирус ArMV на ежевике лучше выявлялся в листьях и завязях, а в лепестках цветков он отсутствовал. Вирус TBRV присутствовал в листьях и бутонах ежевики, а в завязях не обнаруживался.
На актинидии не выявлено преимущество использования почек, бутонов и коры побегов для диагностики вирусов по сравнению с листьями. У форм актинидии с пестролистностью вирусы чаще обнаруживались в бесхлорофилльных сегментах листьев.
5.2.2. Выявление оптимальных сроков тестирования
Выбор оптимального срока диагностики тесно связан с условиями выращивания тестируемых растений. В условиях зимней теплицы вирус ASPV на груше выявлялся при тестировании в весенний период (март и май) – 35-40 %, тогда как в июле он не диагностировался. Вирус ASGV примерно на одном уровне (26-27 %) диагностировался во все изученные сроки, что связано с его термостабильностью. Диагностику вирусов ApMV и ACLSV на груше предпочтительней оказалось осуществлять в марте, тогда как в более поздние сроки процент достоверно зараженных растений существенно снижался.
В условиях открытого грунта вирусы на груше лучше диагностировалось в начале июня, чем в мае и июле (таблица 12). В мае процессы репликации и распространения вирусов по побегу отстают от процессов пролиферации. К июню концентрация вирусов достигает максимума, и диагностика в этот срок наиболее эффективна.
Таблица 12 – Результаты тестирования растений груши на вирусы в зависимости от срока в условиях открытого грунта, % зараженных растений (в среднем за 2000-2004 гг.)
| Месяц | ASPV | ASGV | ACLSV | ApMV |
| Май | 31,3 б | 18,8 а | 50,0 б | 12,5 а |
| Июнь | 62,2 в | 35,1 б | 62,2 б | 48,6 б |
| Июль | 17,4 а | 14,2 а | 18,8 а | 15,2 а |
При диагностике вируса ACLSV он не обнаруживался в мае только у 7 %, тогда как в июле – уже у 80 % растений груши (рисунок 2).
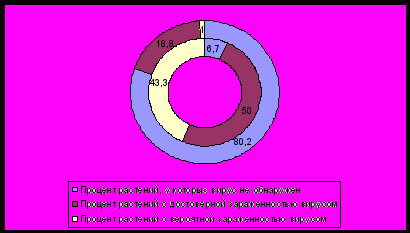
Рисунок 2 – Результаты диагностики груши на вирус ACLSV методом ИФА в зависимости от срока: внутренний круг – май, внешний – июль (открытый грунт).
При тестировании рябины в феврале – апреле в условиях защищённого грунта показатели индекса зараженности вирусами PDV и PNRSV были в 2,4 и 3,7 раза выше, чем в июне. У сорта Титан вирус PNRSV успешно диагностировался в феврале и июле, а в период с марта по июнь его концентрация снижалась ниже достоверных значений (рисунок 3). На сортах Алая крупная и Розина отмечали подъём концентрации PNRSV в феврале и апреле. По вирусу PDV наиболее высокие индексы зараженности были с марта по май. Максимальная концентрация вируса PPV у пяти сортов приходилась на март, у сорта Розина – на апрель.
А Б
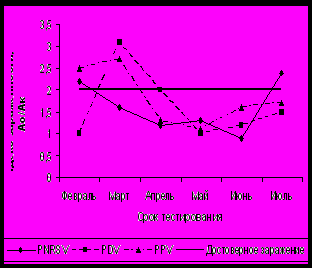
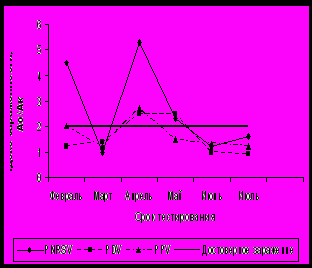
Рисунок 3 – Индекс зараженности рябины вирусами в зависимости от сортовых особенностей и срока тестирования в условиях зимней теплицы: А. Титан; Б. Розина.
На ягодных культурах оптимальные сроки анализа приходились на май – начало июня для условий открытого грунта, на февраль – апрель – для теплиц. На ежевике отмечена высокая эффективность ИФА и в сентябре.
В условиях зимней теплицы максимальная концентрация вирусов в листьях ежевики и малины черной отмечалась с февраля по апрель. Летом концентрация вирусов снижалась: индексы зараженности к июню уменьшались в 1,5-3 раза (таблица 13).
Таблица 13 – Зараженность растений ежевики и малины черной вирусами в зависимости от срока тестирования в условиях зимней теплицы, индекс зараженности
| Срок тестирования | Ежевика | Малина черная | ||||||
| ArMV | RpRSV | SLRSV | TBRV | ArMV | RpRSV | SLRSV | TBRV | |
| Февраль | 2,7 | 2,2 | 3,1 | 2,7 | 2,1 | 1,9 | 2,6 | 2,1 |
| Апрель | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Июнь | 1,5 | 2,3 | 1,0 | 1,0 | 1,4 | 1,0 | 1,0 | 1,0 |
| НСР05 | 0,5 | 0,4 | 0,8 | 0,7 | 0,5 | 0,4 | 0,6 | 0,5 |
На актинидии вирусы успешно выявлялись при тестировании в июне.
Следовательно, репликация вирусов на плодовых и ягодных культурах на протяжении вегетационного сезона подвержена значительным колебаниям и находится в прямой зависимости от погодных условий и степени старения листового аппарата.
5.2.3. Повышение чувствительности ИФА путем подбора экстрагирующего буфера
Для повышения чувствительности ИФА в экстрагирующий буфер добавляли ГПБК в концентрации 0,01 М, что повысило выявляемость вирусов ACLSV и ASGV в образцах груши по сравнению с использованием диэтилдитиокарбамата натрия (таблица 14).
Таблица 14 – Эффективность выявления вирусов на груше при использовании ГПБК в составе экстрагирующего буфера при выполнении ИФА (индекс зараженности)
| Сорт (клон) | ACLSV | ASGV | ||
| Контроль (DIEKA*, 0,015 М) | ГПБК, 0,01 М | Контроль (DIEKA, 0,015 М) | ГПБК, 0,01 М | |
| Кафедральная (1) | 1,9 а | 6,0 б | 0,9 а | 2,0 б |
| Москвичка (1) | 1,3 а | 6,0 б | 0,7 а | 0,7 а |
| Москвичка (3) | 1,8 а | 4,2 б | 1,8 а | 5,6 б |
| Румяная (1) | 1,4 а | 6,2 б | 1,0 а | 0,9 а |
| Башкирская крупная | 1,5 а | 2,5 б | 1,0 а | 1,0 а |
| Велеса | 0,9 а | 5,3 б | 0,7 а | 1,2 б |
| Память Жегалова | 1,2 а | 8,9 б | 1,4 а | 1,1 а |
| Чижовская | 1,3 а | 9,0 б | 1,7 б | 0,8 а |
| Берри Харди | 2,3 а | 16,4 б | 1,0 а | 6,4 б |
| Берри Харди (1) | 1,0 а | 2,3 б | 1,0 а | 1,1 а |
| В среднем по сортам | 1,5 а | 6,7 б | 1,1 а | 2,1 б |
| Выявлено вирусов, % | 10,0 | 100 | 0 | 30,0 |
*DIEKA – диэтилдитиокарбамат натрия.
Использование стандартного буфера не позволило обнаружить вирус ASGV, тогда как буфер с ГПБК обеспечил его выявление у 3-х сортов груши. Вирус ACLSV в контроле был идентифицирован лишь у одного сорта, а на буфере с ГПБК – у всех сортов груши.
На образцах рябины эффективность выявления вирусов ACLSV и ASGV при использовании экстрагирующего буфера с ГПБК также возрастала.
При тестировании ежевики сорта Торнфри на вирусы АrМV, TBRV, RpRSV и SLRSV применение салициловой и галловой кислот в концентрациях 0,001 и 0,01 М в составе экстрагирующего буфера повышало выявляемость вирусов.
Испытанные соединения выступают как активные антиоксиданты, препятствующие разрушению вирусных частиц при гомогенизации растительных образцов. Фенольные соединения могут формировать комплексы с таннинами, снижая их реакционную способность, что оказывает благоприятное действие на сохранность вирусных частиц.
5.3. Применение метода полимеразной цепной реакции
Для корректной и надежной оценки наличия вирусов в растительном материале необходима отработка метода ПЦР применительно к биологическим особенностям культуры, поскольку на результат выделения вирусной РНК большое влияние оказывают вещества вторичного происхождения, в том числе фенольной природы. Это особенно актуально для плодовых культур, ткани которых содержат большие количества такого рода соединений.
Груша. Экстракция РНК вирусов на груше в силу особенностей биохимического состава её тканей протекает недостаточно эффективно (хуже по сравнению с яблоней), поэтому данный этап ПЦР нуждался в совершенствовании. При выполнении ОТ-ПЦР добавление ГПБК к лизирующему буферу улучшало экстракцию РНК и позволило успешно диагностировать вирусы ACLSV, ASGV и ASPV в образцах груши.
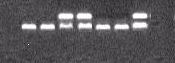
При тестировании на вирус ACLSV оптимальными навесками препарата ГПБК являлись 20 и 30 мг, которые обеспечивали успешную экстракцию РНК из листьев груши сорта Чижовская, зараженной указанным вирусом (рисунок 4).
1 2 3 4 5 6 7
Рисунок 4 – Электрофореграмма продуктов амплификации при тестировании груши сорта Чижовская методом ОТ-ПЦР на наличие вируса ACLSV с применением
гидроксипроизводного бензойной кислоты:
1 – без ГПБК; 2 – ГПБК 10 мг; 3 – ГПБК 20 мг; 4 – ГПБК 30 мг; 5 – ГПБК 40 мг/образец; 6 – отрицательный контроль; 7 – положительный контроль.
При диагностике груши на другие вирусы методом ОТ-ПЦР использовали выявленные оптимальные концентрации ГПБК. Оптимизация этапа экстракции РНК способствовала успешной диагностике вируса ASGV на груше сорта Beurre Hardy. Ранее на данном образце вирус также был диагностирован методом ИФА. При диагностике 6 сортов груши на вирус ASPV зараженным оказался сорт Велеса. На разработанный способ экстракции РНК получен патент РФ № 2389795.
Сравнительная оценка ИФА и ОТ-ПЦР при тестировании груши на вирусы подтвердила более высокую чувствительность и специфичность ПЦР. У сорта Москвичка (клон 1) методом ИФА не удалось диагностировать все исследованные вирусы, тогда как метод ПЦР успешно их выявлял. На клоне 3 сорта Москвичка ИФА показал вероятное заражение вирусами ACLSV и ASPV, в то время как ПЦР – достоверное заражение.
Рябина. На сортах рябины Алая крупная и Красавица методом ПЦР в реальном времени был диагностирован вирус PPV: интенсивность флуоресценции превышала отрицательный контроль соответственно в 3,9 и 3,4 раза (рисунок 5). На сорте Алая крупная экстремум флуоресценции почти достиг уровня положительного контроля. Вместе с тем наработка продуктов амплификации у положительного контроля началась раньше (с 19 цикла) по сравнению с образцами рябины (с 24 цикла), что связано как с концентрацией вируса, так и с эффективностью экстракции нуклеиновой кислоты.
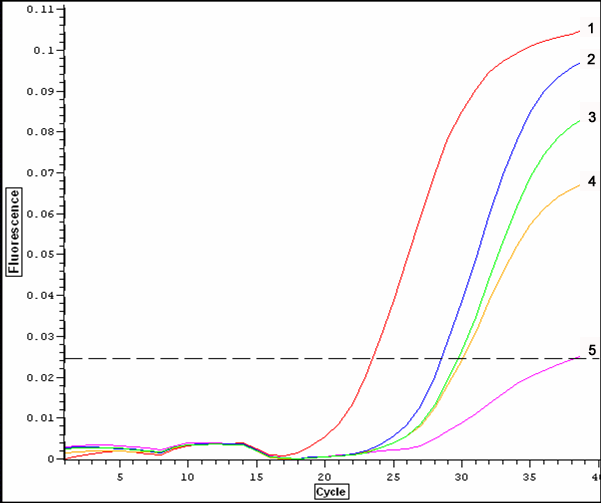
Рисунок 5 – Интенсивность флуоресценции при тестировании образцов рябины
методом ПЦР в реальном времени на вирус PPV:
1 – положительный контроль; 2 – Алая крупная; 3 – Красавица; 4 – рябина,
инокулированная вирусом PPV; 5 – отрицательный контроль.
Косточковые культуры. При диагностике некоторых косточковых культур так же, как и на груше, существует проблема выделения РНК. Если на вишне экстракция РНК протекает успешно, то на многих сортах сливы возникают трудности с получением высококачественных препаратов нуклеиновых кислот. При диагностике вируса шарки сливы в буфер добавляли ГПБК. Анализ продуктов амплификации вируса шарки сливы показал, что оптимальная навеска ГПБК составила 20 мг на один образец (рисунок 6).
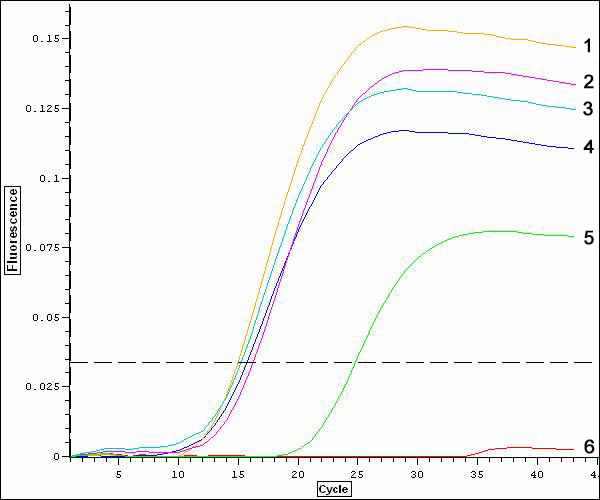
Рисунок 6 – Влияние концентрации антиоксиданта ГПБК на интенсивность флуоресценции при тестировании сливы на вирус PPV: 1 – ГПБК 20 мг/образец, 2 – ГПБК 30 мг, 3 – без ГПБК, 4 – ГПБК 10 мг, 5 – положительный контроль,
6 – отрицательный контроль.
Увеличение количества ГПБК до 30 мг/образец приводило к снижению интенсивности флуоресценции на 9,5 % по сравнению с навеской 20 мг. Повышение интенсивности флуоресценции конечного продукта в оптимальных вариантах свидетельствует о лучшем выделении вирусной РНК вследствие предположительной оптимизации солюбилизации клеточного дебриса и усиления денатурации нуклеаз.
Повышение выявляемости вирусов в разработанной технологии диагностики до 90-100 % достигается за счет использования ГПБК в качестве эффективного антиоксиданта, учета биологических особенностей культур и условий окружающей среды (рисунок 7). ГПБК в низкой концентрации (10-4 – 10-5 М), введенное в состав буфера для инокуляции, повышает сохранность вирусов и улучшает их передачу, позволяя получать более достоверные результаты по зараженности тестируемых растений вирусами. В более высокой концентрации ГПБК повышает эффективность выявления вирусов при тестировании методом ИФА. Добавление в лизирующий буфер ГПБК значительно улучшает экстракцию РНК, особенно в образцах груши и сливы, при выполнении ПЦР. Подобраны оптимальные виды образцов и сроки анализа.
