Билет Вещества, состоящие из атомов одного вида, называются простыми
| Вид материала | Документы |
- Реферат Ученицы 10-б сошенко Надежды Тема: Психоактивные вещества, 60.77kb.
- Реферат по органической химии тема: получение алканов,алкенов,алкинов, 194.91kb.
- 1. Три формы существования мира. Какие процессы называются информационными?, 1454.9kb.
- Тест по теме: «Строение и классификация органических соединений» Задания уровня, 1355.16kb.
- Строение вещества, 360.6kb.
- Ткани растений, 275.54kb.
- Молекулярно-кинетическая теория, 37.31kb.
- Молекулярно-кинетическая теория газов, 97.72kb.
- Молекулярная физика и термодинамика. Лекция №1 Молекулярно-кинетическая теория Основные, 10053.18kb.
- Элементы квантовой механики и физики атомов, молекул, твердых тел, 156.85kb.
Билеты 9 класс
Билет 2.
Вещества, состоящие из атомов одного вида, называются простыми. К ним относятся металлы и неметаллы. Например, Н2,О2, С, S8,О3, К.
Вещества, состоящие из атомов разного вида, называются сложными. Например, Н2О, КОН и др.
Сложные вещества делятся на: оксиды, основания, кислоты и соли.
Оксиды – это сложные вещества, состоящие из 2 элементов, один из которых кислород со степенью окисления -2.
Общая формула оксидов ЭmOn, где m - число атомов элемента, а n - число атомов кислорода.
Оксиды, не образующие кислот, оснований и солей при обычных условиях, называются несолеобразующими. К ним относят такие соединения, как N2O, NO, CO, SiO..
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойственными свойствами).
Солеобразующие бывают:
- основные – оксиды металлов со степенью окисления +1,+2 , кроме ZnO, ВеО.
- амфотерные - оксиды металлов со степенью окисления +3,+4, а также ZnO, ВеО.
- кислотные - оксиды металлов со степенью окисления +5,+6,+7, а также оксиды неметаллов со степенью окисления +3,+4,+5,+6,+7.
При комнатной температуре большинство оксидов - твердые вещества (CuO, Fe2O3 и др.), некоторые - жидкости (H2O, Cl2O7 и др.) и газы (NO, SO2 и др.). Химическая связь в оксидах - ионная, либо ковалентная.
Основания - сложные вещества, молекулы которых состоят из атома металла (или иона
 ) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме(ОН)x, где x равно степени окисления металла.
) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме(ОН)x, где x равно степени окисления металла.Классифицировать основания можно следующим образом:
1) по растворимости в воде основания делятся на растворимые (щелочи и NH4OH) и нерастворимые (все остальные основания);
2) по степени диссоциации основания подразделяют на сильные (щелочи) и слабые (все остальные).
3) по кислотности, т.е. по числу гидроксогрупп, способных замещаться на кислотные остатки: на однокислотные (NaOH), двухкислотные [Ca(OH)2], трехкислотные [Al(OH)3].
- По структурной теории кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
- По теории электролитической диссоциации, кислоты – это электролиты, образующие при диссоциации в качестве катионов только катионы водорода .
Кислоты классифицируют:
a) по содержанию атомов кислорода в молекуле - на бескислородные (Нcl) и кислородсодержащие (H2SO4);
б) по основности, т.е. числу атомов водорода, способных замещаться на металл - на одноосновные (HCN), двухосновные (H2S) и т.д.;
в) по электролитической силе - на сильные и слабые. Наиболее употребляемыми сильными кислотами являются разбавленные водные растворы HCl, HBr, HI, HNO3, H2SO4, HClO4.
Соли – это сложные вещества, состоящие из атомов металла и кислотного остатка.
Соли делят на:
- средние или нормальные
- кислые
- основные
- комплексные
- двойные – содержат два разных катиона и один анион
6. смешанные – содержат один катион и два разных аниона
Средние соли - это продукты полного замещения атомов водорода кислоты атомами металла или гидроксо-групп основания кислотными остатками. Средние соли образуют все кислоты и основания, независимо от их основности или кислотности.
Билет 11.
Кислоты.
1. По структурной теории кислоты – это сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
2. По теории электролитической диссоциации, кислоты – это электролиты, образующие при диссоциации в качестве катионов только катионы водорода .
Общие свойства кислот
Общие свойства кислот в водных растворах обусловлены присутствием ионов Н, образующихся при диссоциации молекул кислоты, таким образом, кислоты - это доноры протонов: НxAn D xH+ An.
- Д
 иссоциация и изменение окраски индикаторов НCl Н+ +Cl-
иссоциация и изменение окраски индикаторов НCl Н+ +Cl-
- С металлами, стоящими в ряду активности до водорода
Характер продуктов реакций зависит от природы и концентрации кислот и от активности металлов. Разбавленные кислоты (кроме HNO3) взаимодействуют с металлами, находящимися в ряду напряжений металлов левее водорода, образуя соль и вытесняя водород из кислоты.
Zn+ 2HCl ZnCl2 + H2
3.Взаимодействие с основными и амфотерными оксидами.
2HCl + CaO CaCl2 + H2O ; 6HCl + Al2O3 2AlCl3 + 3H2O
- С солями (если в результате реакции образуется газ или осадок)
Возможно только в том случае, если образуется: а) более слабая кислота (в растворе); б) нерастворимая соль; в) выделяется газ (часто реакция идет без воды, при нагревании).
HCl + AgNO3 AgCl +HNO3
- С основаниями (реакция нейтрализации)
HCl+ KOH KCl + H2O
Кислоты классифицируют:
a) по содержанию атомов кислорода в молекуле - на бескислородные (Нcl) и кислородсодержащие (H2SO4);
б) по основности, т.е. числу атомов водорода, способных замещаться на металл - на одноосновные (HCN), двухосновные (H2S) и т.д.;
в) по электролитической силе - на сильные и слабые. Наиболее употребляемыми сильными кислотами являются разбавленные водные растворы HCl, HBr, HI, HNO3, H2SO4, HClO4.
В медицине при недостаточной кислотности желудочного сока используют разбавленные растворы хлороводородной (соляной) кислоты. Находит применение и борная кислота (H3BO3) в качестве противовоспалительного и противомикробного средства.
Билет 12.
Амфотерные гидроксиды - сложные вещества, имеющие свойства и кислот, и оснований.
Все амфотерные гидроксиды плохо растворяются в воде, хорошо - в кислотах и щелочах. Диссоциацию амфотерных гидроксидов в кислой и основной средах, например, гидроксида цинка, можно выразить следующим уравнением:
Zn2 + 2OH → Zn(OH)2 H2ZnO2 → 2H +
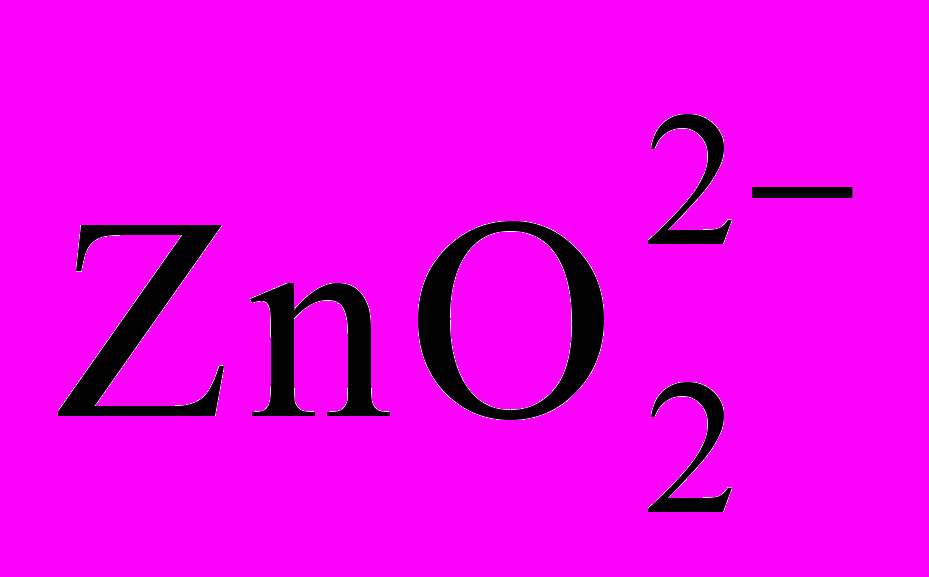
в кислой среде в основной среде
Химические свойства амфотерных гидрооксидов
1) Взаимодействие с кислотами:
Zn(OH)2 + 2HBr ZnBr2 + 2H2O
2) Взаимодействие со щелочами:
а) сплавление с твердой щелочью:
Zn(OH)2 + 2NaOH Na2ZnO2 +2H2O
б) взаимодействие с растворами щелочей:
Zn(OH)2 + 2NaOH Na2[Zn(OH)4] (тетрагидроксоцинкат натрия)
Билет 13.
Основания - сложные вещества, молекулы которых состоят из атома металла (или иона
 ) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме(ОН)x, где x равно степени окисления металла. Все основные гидроксиды находятся в орто-форме. При наименовании оснований для элементов, проявляющих переменную cтепень окисления, следует указать ее величину: Fe(OH)3 - гидроксид железа(III).
) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме(ОН)x, где x равно степени окисления металла. Все основные гидроксиды находятся в орто-форме. При наименовании оснований для элементов, проявляющих переменную cтепень окисления, следует указать ее величину: Fe(OH)3 - гидроксид железа(III).Классифицировать основания можно следующим образом:
1) по растворимости в воде основания делятся на растворимые (щелочи и NH4OH) и нерастворимые (все остальные основания);
2) по степени диссоциации основания подразделяют на сильные (ще-лочи) и слабые (все остальные).
3) по кислотности, т.е. по числу гидроксогрупп, способных замещаться на кислотные остатки: на однокислотные (NaOH), двухкислотные [Ca(OH)2], трехкислотные [Al(OH)3].
Химические свойства оснований
Общие свойства оснований обусловлены наличием в их растворах иона ОН, создающего в растворе щелочную среду.
1) Взаимодействие с кислотными оксидами:
2NaОН + СО2 Na2СО3 + Н2О
2) Реакция с кислотами (реакция нейтрализации):
H2SO4 + 2NaOH Na2SO4 + 2H2O
3) Взаимодействие с солями (только в том случае, если при действии растворимого основания на соль выпадает осадок или выделяется газ):
СuSO4 + 2NaOH Cu(OH)2 + Na2SO4
NH4Cl (крист.) + NaOH(конц)
 NH3 + NaCl+ H2O
NH3 + NaCl+ H2OБилет 17.
Оксиды – это сложные вещества, состоящие из 2 элементов, один из которых кислород со степенью окисления -2.
Общая формула оксидов ЭmOn, где m - число атомов элемента, а n - число атомов кислорода.
Оксиды, не образующие кислот, оснований и солей при обычных условиях, называются несолеобразующими. К ним относят такие соединения, как N2O, NO, CO, SiO..
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойственными свойствами).
Солеобразующие бывают:
- основные – оксиды металлов со степенью окисления +1,+2 , кроме ZnO, ВеО.
- амфотерные - оксиды металлов со степенью окисления +3,+4, а также ZnO, ВеО.
- кислотные - оксиды металлов со степенью окисления +5,+6,+7, а также оксиды неметаллов со степенью окисления +3,+4,+5,+6,+7.
При комнатной температуре большинство оксидов - твердые вещества (CuO, Fe2O3 и др.), некоторые - жидкости (H2O, Cl2O7 и др.) и газы (NO, SO2 и др.). Химическая связь в оксидах - ионная, либо ковалентная.
Номенклатура оксидов
Если элемент, образующий оксид, имеет единственную валентность, то ее в названии оксида можно не указывать: Na2O - оксид натрия. Если же элемент образует несколько оксидов, то это необходимо: Mn2O7 - оксид марганца(VII). По систематической номенклатуре, требующей полного отражения состава соединения, оксиды называют так: CrO - хром оксид, Cr2O3 - дихром триоксид.
Химические свойства оксидов
Кислотным оксидам соответствуют кислоты, которые могут быть получены из оксидов прямо или косвенно.
Основные оксиды реагируют с:
- водой, если образуется растворимое основание(щелочь) К2O + H2O 2KOH ;
BaO + H2O Ba(OH)2
2. кислотными оксидами CO2 + CaO CaCO3 ;
3. амфотерными оксидами Na2O + ZnO
 Na2ZnO2
Na2ZnO24.кислотами MgO + 2Hcl MgCl2 + H2O
Кислотные оксиды реагируют с:
1. водой, если образуется растворимая кислота
SO3 + H2O H2SO4 ; N2O5 + H2O 2HNO3
2. основными оксидами CO2 + CaO CaCO3 ;
3. амфотерными оксидами ZnO + SO3
 ZnSO4 ;
ZnSO4 ; 4. щелочами SO2 + 2NaOH Na2SO3 + H2O
Билет 9.
Правила вычисления степени окисления:
- Степень окисления атомов в простом веществе равна нулю.
- В нейтральных молекулах алгебраическая сумма степеней окисления всех атомов равна нулю, для сложных ионов эта сумма равна заряду иона.
- Степень окисления водорода во всех соединениях, кроме гидридов металлов (NaH, CaH2), равна +1, в гидридах металлов степень окисления водорода равна -1.
- Кислород в большинстве соединений имеет степень окисления -2, исключения фторид кислорода F2O+2 ,и пероксиды, содержащие группу –О – О– , в которой степень окисления кислорода -1.
- Степень окисления у металлов всегда положительна, и для металлов главных подгрупп равна номеру группы.
Основные положения теории окислительно – восстановительных реакций.(ОВР)
- Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. При этом степень окисления понижается.
- Атомы, молекулы или ионы, принимающие электроны называются окислителями. Во время реакции они восстанавливаются.
- Окислением называется процесс отдачи электронов атомом, молекулой или ионом. При этом степень окисления повышается.
- Атомы, молекулы или ионы, отдающие электроны называются восстановителями. Во время реакции они окисляются.
- Окисление всегда сопровождается восстановлением и наоборот. В ОВР число электронов, отданных восстановителем, равно числу электронов, принятых окислителем, то есть соблюдается электронный баланс.
1)8 Na0 +10HN+5O3 8Na+1NO3 + N+12O + 5H2O

восстановитель Na0 – 1e Na+1 8 окисляется
окислитель 2N+5 +8e 2N+1 1 восстанавливается
2) 4K2Fe+6O-24 + 10H2SO4 2Fe+32(SO4)3 + 4K2SO4 + 10H2O + 3O02
в
 осстановитель 2O-2 – 4e O02 3 окисляется
осстановитель 2O-2 – 4e O02 3 окисляется окислитель 2Fe+6 +6e 2Fe+3 2 восстанавливается

Билет 1.
Современная формулировка периодического закона: Свойства химических элементов, а также образуемых ими простых веществ, находятся в периодической зависимости от заряда ядра атома.
Периодическая система состоит из периодов и групп.
Период - это ряд элементов, расположенных в порядке возрастания атомной массы, который начинается щелочным металлом и заканчивается инертным газом. Периодов всего 7.
1,2,3 – малые, так как состоят из одного ряда, 4,5,6 – большие, так как состоят из двух рядов, 7 – незавершенный, так как пока нет инертного газа, указавшего на завершение этого периода.
Группа – это вертикальный столбец системы. Групп всего 8. Каждая группа делится на главную и побочную подгруппы. Главная подгруппа содержит элементы малых и больших периодов, а побочная – только больших.
Порядковый номер элемента показывает заряд ядра, число электронов, протонов.
Число нейтронов равно атомная масса минус порядковый номер.
Номер периода показывает число энергетических уровней.
Номер группы (для элементов главных подгрупп) показывает число электронов на последнем уровне.
Изотопы – атомы с одинаковым зарядом ядра, но разными массами.
Изобары – атомы с одинаковой массой, но разными зарядами ядра.
В пределах периода с ростом порядкового номера металлические свойства уменьшаются, а неметаллические усиливаются, так как:
1. увеличиваются заряды атомных ядер,
2. увеличивается число электронов на внешнем уровне,
3. радиус атома уменьшается.
В пределах главной подгруппы с ростом порядкового номера металлические свойства усиливаются, а неметаллические ослабевают, так как:
1. увеличиваются заряды атомных ядер,
2. увеличивается число энергетических уровней,
3. увеличивается радиус атома.
Билет 6.
Виды химической связи.
Химическая связь – взаимодействие между атомами, приводящее к образованию устойчивой многоатомной системы.
Причины образования связи: стремление системы к минимуму энергии и стремление атомов к завершению внешнего энергетического уровня (он содержит 8 электронов).
Ионная связь – это электростатическое притяжение между ионами. Она возникает между атомами металлов ( а также NH4 +) и неметаллов.
При образовании ионной связи атом металла отдает свои валентные электроны (электроны с внешнего уровня) атому неметалла, при этом каждый атом завершает свой внешний уровень.

К веществам с ионной связью относятся: щелочи, соли, некоторые оксиды и гидриды металлов.
Вещества с ионной связью образуют кристаллы с ионной кристаллической решеткой. Физические свойства: тугоплавкие, нелетучие, твердые, но хрупкие, растворимы в воде, растворы и расплавы проводят ток.
Ковалентная связь – это связь между атомами, возникающая за счет образования общих электронных пар. Она возникает между атомами неметаллов. Если они одинаковые, то связь ковалентная неполярная, а если разные, то ковалентная полярная.
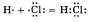
При кристаллизации веществ с ковалентной связью образуются два типа кристаллических решеток:
- Атомная по физическим свойствам это твердые, тугоплавкие, нелетучие, нерастворимые вещества. Например, алмаз, графит(С), кремний, бор, карборунд(SiC), кварц (SiO2), карбиды, силициды.
- Молекулярная по физическим свойствам это летучие, хрупкие вещества с низкой температурой плавления и кипения. Например, углекислый газ (СО2), лед, хлор, кислород, азот, нафталин, глюкоза, сахароза и другие органические вещества.
Металлическая связь возникает между атомами металлов. Для них характерна металлическая кристаллическая решетка. По физическим свойствам это тепло- и электропроводные вещества, пластичные, с металлическим блеском.
Билет 4.
Металлы в Периодической системе расположены в левой нижней части от диагонали бор – астат., а также в четных рядах больших периодов. На последнем уровне атомы металлов содержат от 1 до 3 электронов. При химических реакциях они отдают эти электроны при этом окисляются и являются восстановителями.
Строение атома натрия:
Na(11р+ ,12n0 )11e
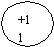
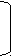
2e 8e 1e
1s22s22p63s1
В связи с тем что электроны внешнего слоя атомов металлов слабо связаны с ядром, они могут быть «отданы» другим частицам, что и происходит при химических реакциях:
Me0 –ne =Men+
При характеристике физических свойств металлов следует отметить их общие свойства: электрическую проводимость, теплопроводность, металлический блеск, пластичность, которые обусловлены единым видом химической связи — металлической, и металлической кристаллической решетки. Их особенностью является наличие свободноперемещающихся обобществленных электронов между ион-атомами, находящимися в узлах кристаллической решетки.
К металлам относятся элементы, имеющие на внешнем электронном уровне от одного до трех электронов, за исключением некоторых р-элементов, имеющих большее количество электронов на внешнем уровне: германий, олово, свинец, сурьма, висмут, полоний. Для них характерна низкая электроотрицательность и небольшая энергия ионизации.
Физические свойства
Все металлы, за исключением ртути - твердые вещества, обладают металлическим блеском, являются хорошими проводниками электрического тока, обладают пластичностью, упругостью, прочностью, высокой теплопроводностью. Большинство этих свойств обусловлено металлической связью.
Примеры взаимодействия металлов с простыми веществами (неметаллами):
1.Взаимодействие с кислородом:
2Сu +O2 =2CuO
2.
I. Взаимодействие с неметаллами.
1) 2Ме +
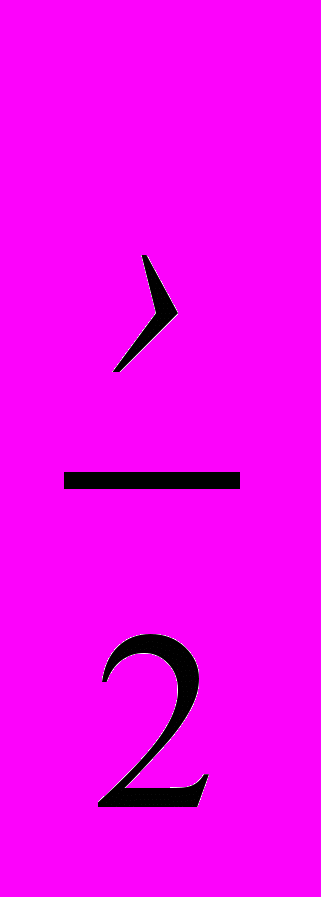 О2 Ме2Ох оксиды (основные или амфотерные)
О2 Ме2Ох оксиды (основные или амфотерные)2) Ме +
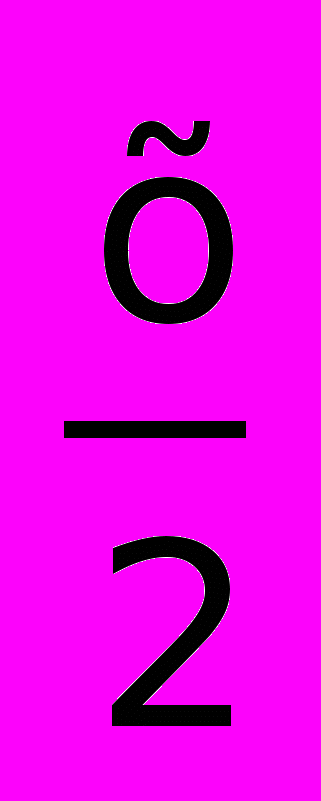 Hal2 МеHalx галогениды (например, Bа +F2 BaF2)
Hal2 МеHalx галогениды (например, Bа +F2 BaF2)3) 3Ме +
 N2 Me3Nx нитриды (например, щелочные и щелочноземельные металлы, алюминий, железо)
N2 Me3Nx нитриды (например, щелочные и щелочноземельные металлы, алюминий, железо)4) 2Ме + хS Me2Sx сульфиды (например, щелочные и щелочноземельные металлы, железо, хром, алюминий, цинк)
5) 3Ме + хР Ме3Рх фосфиды (например, щелочные и щелочноземельные металлы, алюминий)
6) 2Me + xH2 2MeHx гидриды (например, щелочные и щелочноземельные металлы)
7) с углеродом - карбиды (см. тему “Углерод”).
