Молекулярно-кинетическая теория газов
| Вид материала | Лекция |
Содержание1.2. Массы атомов и молекул. Количество вещества. Моль. Молярная масса. Основные формулы расчета количества вещества |
- Занятие №16 Основные положения мкт. Масса и размеры молекул. Мкт- молекулярно- кинетическая, 138.45kb.
- Контрольная работа №5 10 класс По теме: «Молекулярно-кинетическая теория. Свойства, 99.75kb.
- Молекулярно-кинетическая теория, 37.31kb.
- 2. Молекулярно-кинетическая теория идеальных газов, 52.42kb.
- Молекулярная физика и термодинамика. Лекция №1 Молекулярно-кинетическая теория Основные, 10053.18kb.
- Программа учебной дисциплины «Кинетическая теория неравновесных смесей газов» специальность, 118.5kb.
- Контрольная работа "Молекулярно-кинетическая теория идеального газа. Газовые законы., 9.92kb.
- Молекулярно-кинетическая теория. Термодинамика. Задания с выбором ответа, 110.39kb.
- Тема: Молекулярно-кинетическая теория, 131.48kb.
- Элективный курс «Решение задач» Тема: «Молекулярно-кинетическая теория идеального газа», 63.54kb.
Тема: Молекулярно-кинетическая теория газов
Лекция 1
1.1. Основные представления молекулярно-кинетической теории вещества.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества.
В основе молекулярно-кинетической теории лежат три основных положения:
- Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
- Атомы и молекулы находятся в непрерывном хаотическом движении.
- Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
 1 |
| Рис. Траектория броуновской частицы. |
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном (1827 г.). Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис. 3.1.1). Теория броуновского движения была создана А. Эйнштейном (1905 г.). Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена (1908–1911 гг.).
Приведем некоторые из доказательств беспорядочного (хаотического) движения молекул:
а) стремление газа занять весь предоставленный ему объем (распространение пахучего газа по всему помещению);
б) броуновское движение - беспорядочное движение мельчайших видимых в микроскоп частиц вещества, находящихся во взвешенном состоянии и нерастворимых в ней. Это движение происходит под действием беспорядочных ударов молекул, окружающей жидкости, находящихся в постоянном хаотическом движении;
в) диффузия - взаимное проникновение молекул соприкасающихся веществ. При диффузии молекулы одного тела, находясь в непрерывном движении, проникают в промежутки между молекулами другого соприкасающегося с ним тела и распространяются между ними. Диффузия проявляется во всех телах - в газах, жидкостях и твердых телах, - но в разной степени.
Диффузию в газах можно наблюдать если сосуд с пахучим газом открыть в помещении. Через некоторое время газ распространится по всему помещению.
Диффузия в жидкостях происходит значительно медленнее, чем в газах. Например, в стакан нальем раствор медного купороса, а затем, очень осторожно добавим слой воды и оставим стакан в помещении с постоянной температурой и где он не подвергается сотрясениям. Через некоторое время будем наблюдать исчезновение резкой границы между купоросом и водой, а через несколько дней жидкости перемешаются, несмотря на то, что плотность купороса больше плотности воды. Так же диффундирует вода со спиртом и прочие жидкости.
Диффузия в твердых телах происходит еще медленнее, чем в жикостях (от нескольких часов до нескольких лет). Она может наблюдаться только в хорошо пришлифованных телах когда расстояния между поверхностями пришлифованных тел близки к расстояниям между молекулами (10-8 см). При этом скорость диффузии увеличивается при повышении температуры и давления.
Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
Молекулы обладают кинетической энергией Wкин и одновременно потенциальной энергией взаимодействия Wпот. В газообразном состоянии Wкин >> Wпот. В жидком и твердом состояниях кинетическая энергия частиц сравнима с энергией их взаимодействия (Wкин Wпот).
Наличие промежутков между молекулами следует, например из опытов смещения различных жидкостей: объем смеси всегда меньше суммы объемов смешанных жидкостей.
Доказательства силового взаимодействия молекул:
а) деформация тел под влиянием силового воздействия;
б) сохранение формы твердыми телами;
в) поверхностное натяжение жидкостей и, как следствие, явление смачивания и капиллярности.
Между молекулами существуют одновременно силы притяжения и силы отталкивания (рис. 1). При малых расстояниях между молекулами преобладают силы отталкивания. По мере увеличения расстояния r между молекулами как силы притяжения, так и силы отталкивания убывают, причем силы отталкивания убывают быстрее. Поэтому при некотором значении r0 (расстояние между молекулами) силы притяжения и силы отталкивания взаимно уравновешиваются.
1.2. Массы атомов и молекул. Количество вещества. Моль. Молярная масса. Основные формулы расчета количества вещества
Молекула - наименьшая частица вещества, обладающая его химическими свойствами. Молекулы состоят из более простых частиц - атомов химически элементов. Молекулы различных веществ имеют различный атомный состав.
Атом - наименьшая частица химического элемента, входящая в состав молекул и сохраняющая химические свойства данного элемента. Молекулы могут содержать различное число атомов. Так, молекулы благородных газов одноатомны, простых газов - двухатомны. воды - трёхатомны и т. д., а молекулы белков построены из сотен тысяч атомов.
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше. При увеличении в миллион раз молекулы были бы величиной с точку типографского шрифта этой книжки.
Одной из важнейших характеристик атома является его масса. Абсолютная масса атома (т. е. масса выращенная в граммах) величина очень малая. Так атом водорода имеет массой 1,67·10-24 г. Поэтому для практических целей удобнее пользоваться атомной единицей массы (а.е.м.). В качестве 1 а.е.м. принята точно 1/12 часть массы атома изотопа углерода 12С. Атомной массой элемента называется масса его атома выраженная в атомных единицах массы. Иными словами, атомная масса показывает, во сколько раз масса данного атома больше 1/12 массы атома 12С. Так атом азота в 14/12 раза тяжелее атома углерода. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Например М(СО2) = 44 а.е.м.
Плотность молекулы всегда значительно больше, чем для твёрдого вещества, так как в каждом веществе при любом агрегатном состоянии между молекулами всегда есть свободное пространство..
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц, сколько содержится атомов углерода в 0,012 кг углерода. Молекула углерода состоит из одного атома.
Мы имеем 12 г углерода. Углерод в химии обозначается символом C. Представьте себе один атом углерода – черный шарик. Вот теперь поверьте мне на слово: в 12 г черного порошка находится 6,02x1023 атомов углерода. Вот такое число частиц называют одним молем. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА:
| NА = 6,02·1023 моль–1. |
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА:
|
Большое или маленькое это число Авогадро? Нужен простой и понятный всем пример. Представьте себе зернышко пшеницы. В обычном пакетике (весом 1 кг) нет такого числа зерен. Даже в мешке нет такого числа зерен. И даже в вагоне нет еще такого числа зерен. Более того, человечество еще не съело столько зерен пшеницы за всю свою историю. Вот так.
Или. Чтобы почувствовать его колоссальность, представьте себе, что в Черное море высыпали число булавочных головок (диаметр каждой около 1 мм), равное числу Авогадро. При этом оказалось бы, что в Черном море уже не остается места для воды: оно не только до краев, но и большим избытком оказалось бы заполненным этими булавочными головками. Авогадровым числом булавочных головок можно было бы засыпать площадь, равную, например, территории Франции, слоем толщиной около 1 км. И такое огромное число отдельных молекул содержится всего лишь в 18 г воды; в 2 г водорода и т.д.
Чтобы представить себе, как велико число Авогадро, допустим, что нам удалось пометить все молекулы, содержащиеся в одном моле воды (18 г). Если эту воду вылить в океан и дождаться, когда воды Мирового океана перемешаются, то набрав в любом месте стакан воды, мы найдём в нём примерно 100 меченых молекул
Если взять число кирпичей, равное этому числу, то, будучи плотно уложенными эти кирпичи покрыли бы поверхность всей суши Земного шара слоем высотой 120 м.
Установлено, что в 1 см3 любого газа при нормальных условиях (т.е. при 00С и давлении 760 мм. рт. ст.) содержится 2,71019 молекул.
Итак, строго говоря, число Авогадро это есть:

Обязательно обратите внимание на размерность числа Авогадро - 1/моль.
Введем ряд обозначений:

Моль любого вещества содержит одно и тоже число структурных элементов независимо от его химических свойств и агрегатного состояния. Из этого следует, что моль молекул различных газов при одних и тех же условиях занимает одинаковый объём. Этот вывод был подтверждён опытными данными. Объём, занимаемый одним молем газа при нормальных условиях (температура 0 °С, давление 760 мм рт. ст. или 101325 Па) называют мольным объёмом. Он равен 22,4 литра.
Возникает закономерный вопрос: какова масса одного моля вещества. Это уже зависит от самого вещества. Например, массы одного моль свинца и одного моль меди сильно различаются. Для первого это 207г, а для второго это всего лишь 63,5 г. Формула для вычисления массы вещества следующая:

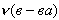 - количество вещества (моль)
- количество вещества (моль) 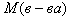 - молярная масса вещества (г/моль)
- молярная масса вещества (г/моль) Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
| M = NA · m0. |
m = moN = N / NamoNa = vM,
откуда количество вещества ( в молях ) равно:
v = m / M.
Молярную массу определяют из таблицы Менделеева, которая есть на форзаце каждого второго учебника по химии. Для водорода она равна 1, для углерода 12, для кальция 40 и т.д. Я надеюсь, что вы поняли, где брать значение молярной массы - массы одного моль вещества.
Молярная масса выражается в килограммах на моль (кг/моль).
Пример:
Вычислить массы метана CH4 и этана С2H6, взятых в количестве
= 2 моль каждого.
Решение:
Молярная масса метана равна 16 г/моль, а этана С2Н6 – 30 г/моль. Отсюда:
m(CH4) = 2 моль 16 г/моль = 32 г;
m(С2Н6) = 2 моль 30 г/моль = 60 г.
Таким образом, моль - это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
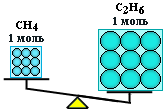
(CH4) = (С2Н6), но m(CH4) < m(С2Н6)
Вычисление используется практически в каждой расчетной задаче.
Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12C (с массовым числом 12) (m одного атома 12С равна 1,99310-26кг).. Она называется атомной единицей массы (а. е. м.):
| 1 а. е. м. = 1,66·10–27 кг. |
Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой. – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С.
Абсолютная масса атома (m) равна относительной атомной массе, умноженной на 1 а.е.м. Например, для атома водорода абсолютная масса определяется следующим образом:
m (H) = 1,0081,66110-27 кг = 1,67410-27 кг
Относительная молекулярная масса соединения (M r) – это безразмерная величина, равная отношению массы m молекулы вещества к 1/12 массы атома 12С:
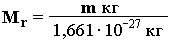
Относительная молекулярная масса равна сумме относительных масс атомов, входящих в состав молекулы. Например:
М r (C2H6) = 2 A r (C) + 6A r (H) = 212 + 6 = 30.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а.е.м.

