Билет Вещества, состоящие из атомов одного вида, называются простыми
| Вид материала | Документы |
- Реферат Ученицы 10-б сошенко Надежды Тема: Психоактивные вещества, 60.77kb.
- Реферат по органической химии тема: получение алканов,алкенов,алкинов, 194.91kb.
- 1. Три формы существования мира. Какие процессы называются информационными?, 1454.9kb.
- Тест по теме: «Строение и классификация органических соединений» Задания уровня, 1355.16kb.
- Строение вещества, 360.6kb.
- Ткани растений, 275.54kb.
- Молекулярно-кинетическая теория, 37.31kb.
- Молекулярно-кинетическая теория газов, 97.72kb.
- Молекулярная физика и термодинамика. Лекция №1 Молекулярно-кинетическая теория Основные, 10053.18kb.
- Элементы квантовой механики и физики атомов, молекул, твердых тел, 156.85kb.
I. Промышленные способы.
1) Взаимодействие водяного пара с раскаленным коксом и далее с оксидом углерода(II) (нагревание, катализатор):
H2O + C CO + H2 (синтез-газ)
Н2O + CO → CO2 + H2 (конверсия при избытке воды)
2) Конверсия метана с водяным паром (катализатор Ni, MgO, Al2O3):
H2O + CH4 →CO + 3H2
H2O + CO + 3H2 → CO2 + 4H2
3) Железо-паровой метод:
4H2O + 3Fe Fe3O4 + 4H2 (t0 570 0С )
H2O + Fe FeO + H2 ( t0 570 0C)
4) Электролиз воды (обычно раствора щелочи):
2H2O
 2H2 + O2
2H2 + O2 II. Лабораторные способы:
1) Восстановление воды активными металлами:
а) 2H2O + Ca Ca(OH)2 + H2 (щелочные и щелочноземельные);
б) Н2O + Mg MgO + H2 (нагревание, другие активные металлы);
в) 6H2О + 2Al + 6NaOH 2Na3[Al(OH)6] + 3H2
2) Восстановление разбавленных кислот металлами (кроме HNO3):
H2SO4 + Zn ZnSO4 + H2
3) восстановление воды гидридами активных металлов:
2H2O + CaH2 Ca(OH)2 + 2H2
Химические свойства
В обычных условиях малоактивен, реагирует только со фтором. При нагревании вступает во взаимодействие практически со всеми элементами основных подгрупп (кроме благородных газов), проявляя свойства восстановителя при реакции с неметаллами и окислителя - с активными металлами.

1) Взаимодействие с неметаллами:
H2 + Cl2 2HCl ; 3H2 + N2 → 2NH3
H2 + S → H2S ; 2H2 + O2 → 2H2O
2) Взаимодействие со щелочными и щелочноземельными металлами:
2Na + H2 2NaH; Ca + H2 CaH2 (гидриды)
3) Взаимодействие с оксидами неметаллов и малоактивных металлов:
CO2 + H2 → CO + H2O; СuO + H2 Cu + H2O
Билет 15.
ВОДА
Строение и физические свойства
Вода - единственное вещество, у которого плотность жидкой фазы (1 г/см3 при 4 0С) больше, чем твердой, благодаря чему большие водоемы не промерзают до дна. Исключительно высока теплоемкость воды - она является важным регулятором климата, стабилизируя температуру поверхности планеты. Ту же термостатирующую роль играет вода в животных организмах. Благодаря высоким диэлектрической проницаемости и дипольному моменту вода - хороший растворитель.
Организмы животных и растений содержат от 50 до 90 % воды. Вода составляет 61 % от массы тела человека.
Химические свойства
I. Кислотно-основные свойства.
Вода является идеальным амфотерным соединением, т.к. при ее дисссоциации образуются ионы Н и ОН:
Н2О → H + OH

Более правильно изображать диссоциацию воды иначе:
2H2O → H3O + OH
ибо протон (Н) вступает в донорно-акцепторное взаимодействие с молекулой воды, образуя ион гидроксония [Н3О].
Вода очень слабый электролит ( < 1010). При взаимодействии с кислотными оксидами проявляет основные свойства:
SO3 + H2O H2SO4
а с основными кислотные:
BaO + H2O Ba(OH)2
II. Окислительно-восстановительные свойства.
Поскольку оба составляющих воду элемента находятся в очень устойчивых степенях окисления, такие реакции возможны только при участии сильных окислителей или восстановителей.
1) Окислительные свойства (за счет Н):
а) с активными металлами (см. “Получение водорода”);
б) с малоактивными неметаллами:
C + H2O CO + H2 (при высокой температуре)
Si + H2O + 2NaOH Na2SiO3 + 2H2
в) с гидридами активных металлов:
СаН2 + 2Н2О Са(ОН)2 + 2Н2
2) Восстановительные свойства (за счет О2):
При взаимодействии со фтором происходит окисление кислорода:
2Н2О +2F2 →4HF +O2
Билет 21.
Серная кислота
Физические свойства и медико-биологическое значение
Тяжелая маслянистая жидкость без цвета и запаха, гигроскопична. Хорошо растворяется в воде.
Соли серной кислоты широко используются в медицине: Na2SO4.10H2O (глауберова соль) и MgSO4.7H2O (горькая соль) как слабительное, CaSO4.2H2O (гипс) гипсовые повязки, CuSO4.5H2O (медный купорос) вяжущее и антисептическое средство.
Получение (контактный способ)
1) Обжиг пирита:
4FeS2 + 11O2 8SO2 + 2Fe2O3
2) Окисление сернистого газа в контактном аппарате:
2SO2 + O2
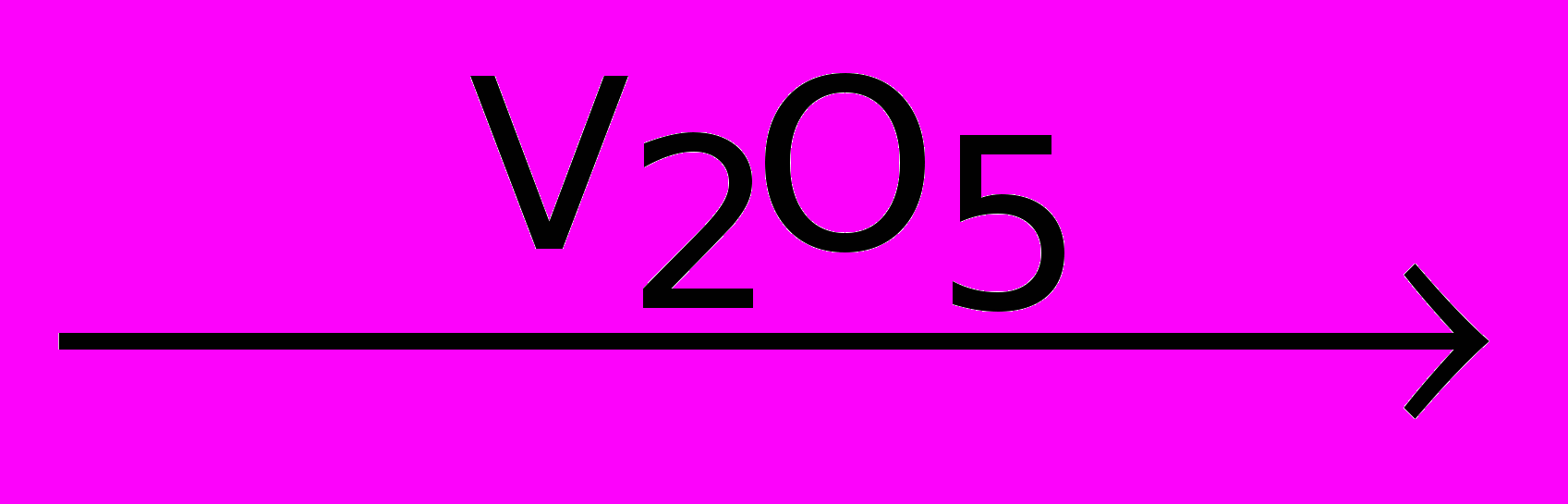 2SO3
2SO33) Получение серной кислоты и олеума (раствор серного газа в концентрированной серной кислоте):
SO3 + H2O H2SO4; SO3 + H2SO4(конц.) H2S2O7 (олеум)
Химические свойства
I. Кислотно-основные свойства - сильная двухосновная кислота.
Дает кислые соли гидросульфаты и средние сульфаты.
2H2SO4 + CaO Ca(HSO4)2 + H2O
H2SO4 + CaO CaSO4 + H2O
H2SO4 + Mg(OH)2 MgSO4 + 2H2O
H2SO4 + BaCl2 BaSO4 + 2НСl
(последняя реакция является качественной реакцией на сульфат-ион)
II. Окислительно-восстановительные свойства.
1) В разбавленной серной кислоте окислителем является ион водорода, поэтому она взаимодействует только с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода:
2Al + 3H2SO4(разб.) 3H2 + Al2(SO4)3
2) В концентрированной кислоте окислителем является сера со степенью окисления +6. Неактивные металлы и неметаллы восстанавливают ее до SO2, активные металлы - до H2S (SO2, S).
Металлы Fe, Al, Cr при обычной температуре пассивируются.
Cu + 2H2SO4(конц.) SO2 + CuSO4 +2H2O
4Zn + 5H2SO4(конц.) H2S + 4ZnSO4 + 4H2O
C + 2H2SO4(конц.) 2SO2 + CO2 + 2H2O
S + 2H2SO4(конц.) 3SO2 + 2H2O
2P + 5H2SO4(конц.) 5SO2 + 2H3PO4 + 2H2O
Концентрированная кислота обугливает органические соединения, например, сахарозу:
C12H22O11 + H2SO4 12C + H2SO4. nH2O
Билет 24.
Аммиак
Бесцветный газ с резким запахом, хорошо растворим в воде. Раствор аммиака в воде с концентрацией 310 % называется нашатырным спиртом, 1825 % - аммиачной водой.
В медицине используются и раствор аммиака, и его соли. Аммиак как местнораздражающее средство, для возбуждения сердечной деятельности и центра дыхания (нашатырный спирт). Хлорид аммония диуретик и отхаркивающее средство. При взаимодействии с хлором аммиак образует монохлорамин (дезинфицирующее средство):
NH3 + Cl2 NH2Cl + HCl
Получение
I. Промышленный способ (синтез Габера-Боша).
N2 + 3H2 → 2NH3 H = 52 кДж/моль
Условия: t0 450 500 0C, наиболее выгодное давление 350 атм, катализатор пористое железо, активированное K2O, Al2O3 и др.
II. Лабораторные способы.
1) Взаимодействие солей аммония с сильными основаниями (качественная реакция на ион
 обнаружение запаха аммиака):
обнаружение запаха аммиака):NH4Cl + KOH NH3 + H2O + KCl
2) Взаимодействие нитридов с водой:
Mg3N2 + 6H2O 3Mg(OH)2 + 2NH3
III. В природе аммиак выделяется при гниении веществ белковой природы.
Химические свойства
I. Кислотно-основные свойства.
1) Слабое основание:
NH3 + H2O →NH3 . H2O →
 + OH
+ OH NH3 + HCl NH4Cl, NH3 + H3PO4 NH4H2PO4
2NH4OH + CO2 (NH4)2CO3 + H2O
2) Очень слабая кислота:
2NH3(жидк.) + 2Na 2NaNH2 + H2
3) Лиганд (донор электронной пары) в комплексных соединениях:
4NH3 + CuSO4 [Cu(NH3)4]SO4
II. Окислительно-восстановительные свойства.
Аммиак хороший восстановитель:
4NH3 + 5O2
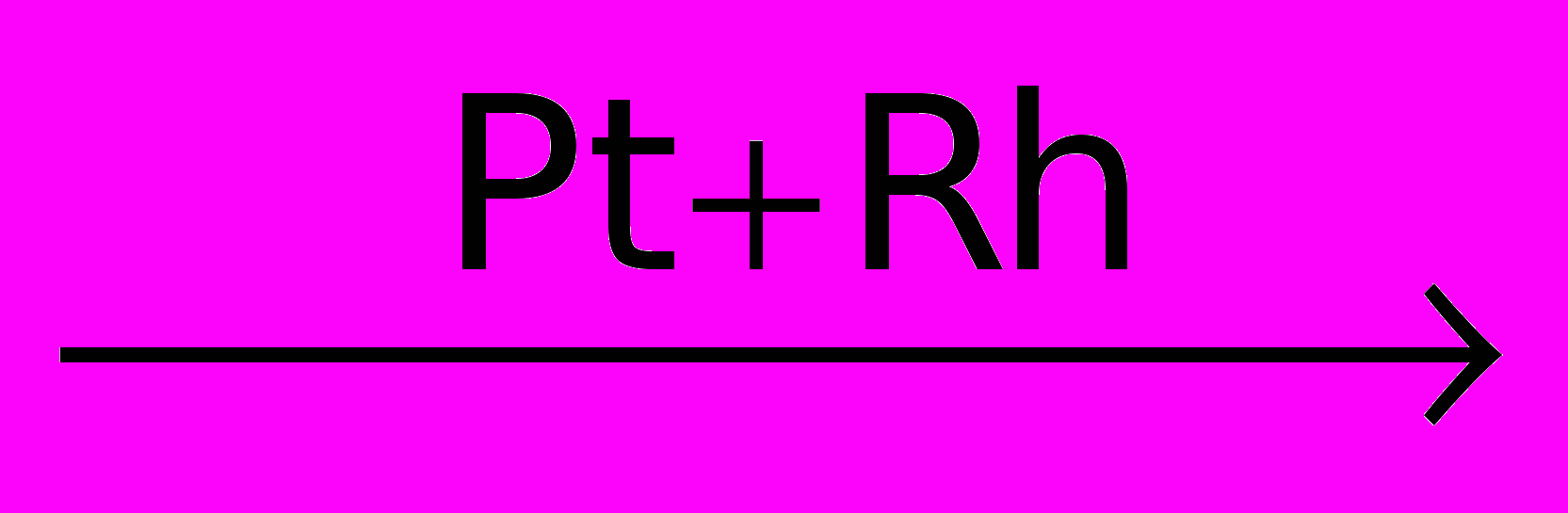 4NO + 6H2O
4NO + 6H2O4NH3 + 3O2 →2N2 + 6H2O
Билет 18.
УГЛЕРОД
Изотопы: 12С, 13С, 14С (радиоактивен, получается только искусственным путем).
Электронное строение: 1s22s22p2.
Валентность: II, III, IV.
Степени окисления: 4, 3, 2, 1, 0, +1, +2, +3, +4.
В природе встречается как в свободном (алмаз, графит), так и в связанном состоянии (нефть, газ, каменный уголь, углекислый газ, карбонаты металлов). Главная составная часть органических веществ животных и растительных организмов.
Простое вещество
Имеет несколько аллотропных модификаций: две природные алмаз, графит, и две, полученные искусственным путем: карбин СССС, поликумулен СССС.
Получение
В промышленности нагреванием каменного угля, либо термическим разложением метана:
CH4
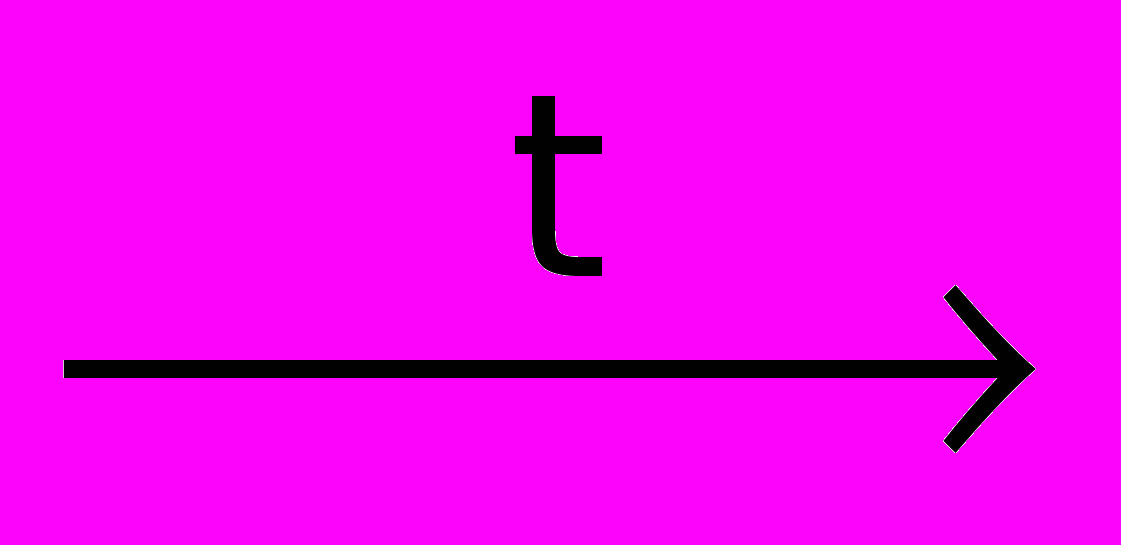 С + 2Н2
С + 2Н2Активированный уголь, используемый в медицине и военном деле в качестве адсорбента, получают нагреванием древесины без доступа воздуха.
Химические свойства
В обычных условиях инертен. При нагревании проявляет как окислительные, так и восстановительные свойства (более характерны).
1) Окислительные свойства:
а) взаимодействие с водородом:
С + 2H2 CH4
б) взаимодействие с металлами с образованием карбидов:
3C + 4Al Al4C3; 2C + Ca CaC2
2) Восстановительные свойства:
а) горение:
C + O2 CO2
б) восстановление металлов из их оксидов:
C + FeO Fe + CO
в) восстанавление некоторых неметаллов:
Ca3(PO4)2 + 5C + 3SiO2
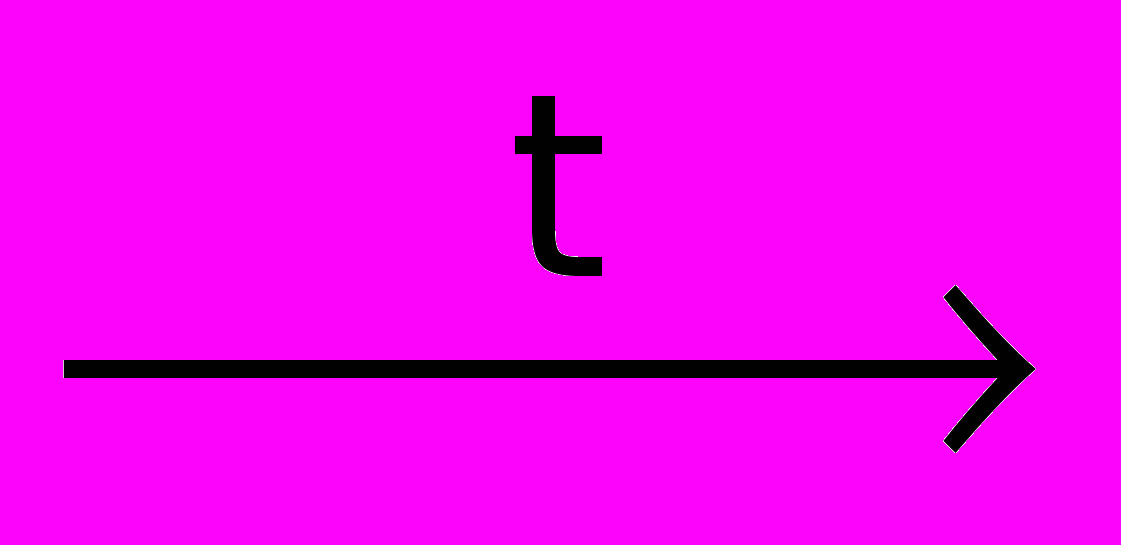 2P + 5CO + 3CaSiO3
2P + 5CO + 3CaSiO3г) восстановление оксида углерода(IV) до угарного газа:
C + CO2 2CO
д) реакция с концентрированными серной и азотной кислотами:
С + 2Н2SO4(к) CO2 + 2SO2 + 2H2O
С + 4HNO3(к) CO2 + 4NO2 + 2H2O
3) Диспропорционирование: 3C + CaO CaC2 + CO
Оксид углерода(II) –несолеобразующий оксид.
Бесцветный газ без запаха. Может взаимодействовать с гемоглобином крови, образуя карбоксигемоглобин, неспособный переносить кислород.
Получение
I. Промышленные способы.
2C + O2 (недостаток) 2СО ; СO2 + C 2CO
СH4 + H2O
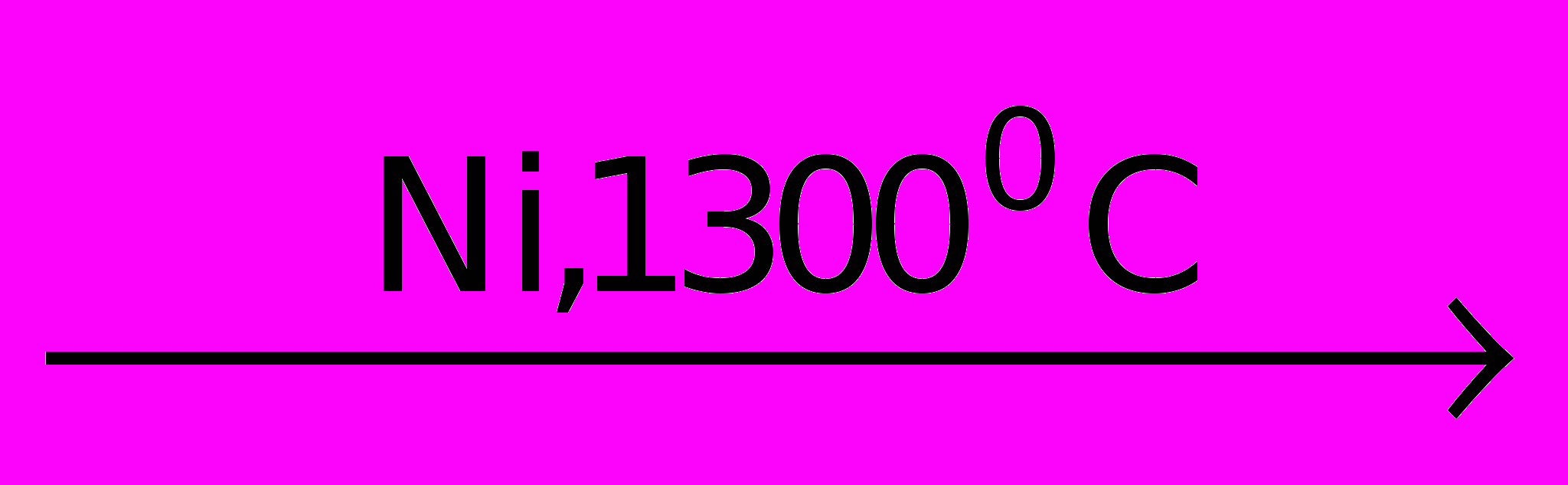 CO + 3H2
CO + 3H2 Химические свойства
I. Окислительно-восстановительные свойства.
1) Восстановительные свойства (наиболее характерны):
а) восстанавливает металлы из их оксидов (см. получение железа).
б) горение:
2СО + О2 2СО2
в) при взаимодействии с хлором образует ядовитый газ фосген:
CO + Cl2 COCl2
2) Окислительные свойства:
CO + H2 → C + H2O
II. Кислотно-основные свойства.
Иногда относят к несолеобразующим оксидам, поскольку при обычных условиях с водой и щелочами не реагирует. Однако, в жестких условиях реагирует со щелочью, давая соль муравьиной кислоты формиат натрия:
CO + NaOH
 HCOONa
HCOONaТаким образом, СО можно считать ангидридом муравьиной кислоты.
Оксид углерода(IV)
Бесцветный газ, тяжелее воздуха, относительно мало растворим в воде, не поддерживает горения и дыхания.
Смесь СО2 (5 %) с кислородом или воздухом (карбоген) является средством для возбуждения дыхательного центра, применяется в медицине в случаях резкого угнетения дыхания. Используется также как охлаждающий агент (“сухой лед”).
Получение
I. Промышленные способы.
C + O2
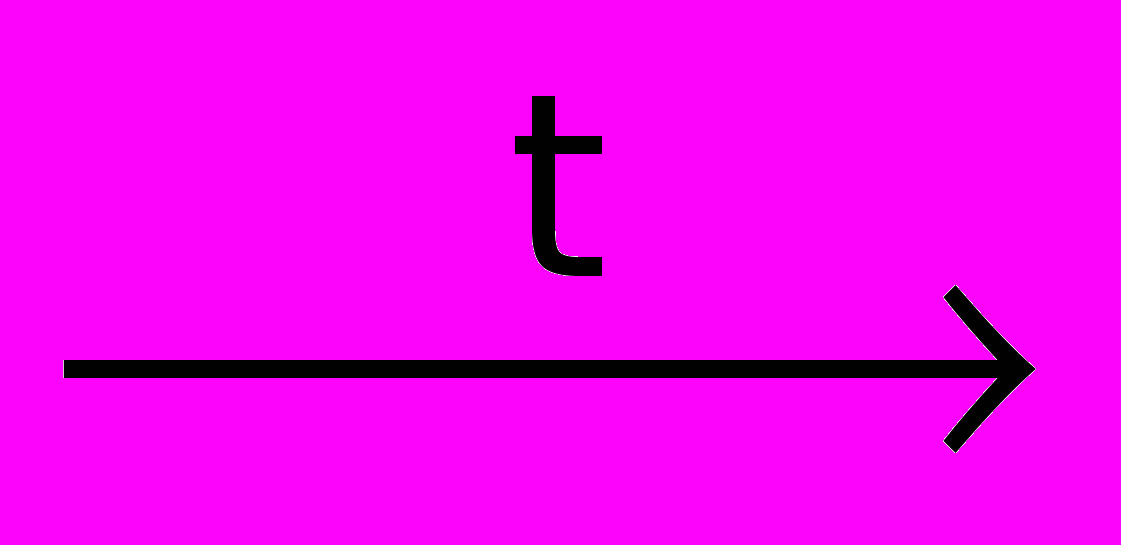 CO2 ; CaCO3
CO2 ; CaCO3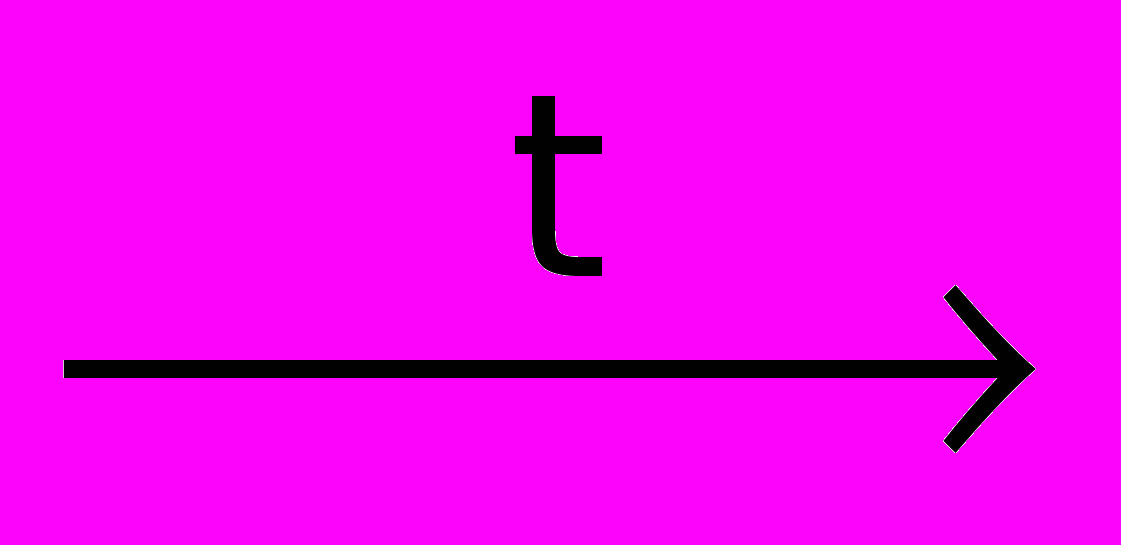 СaO + CO2
СaO + CO2CnH2n+2 +
 O2
O2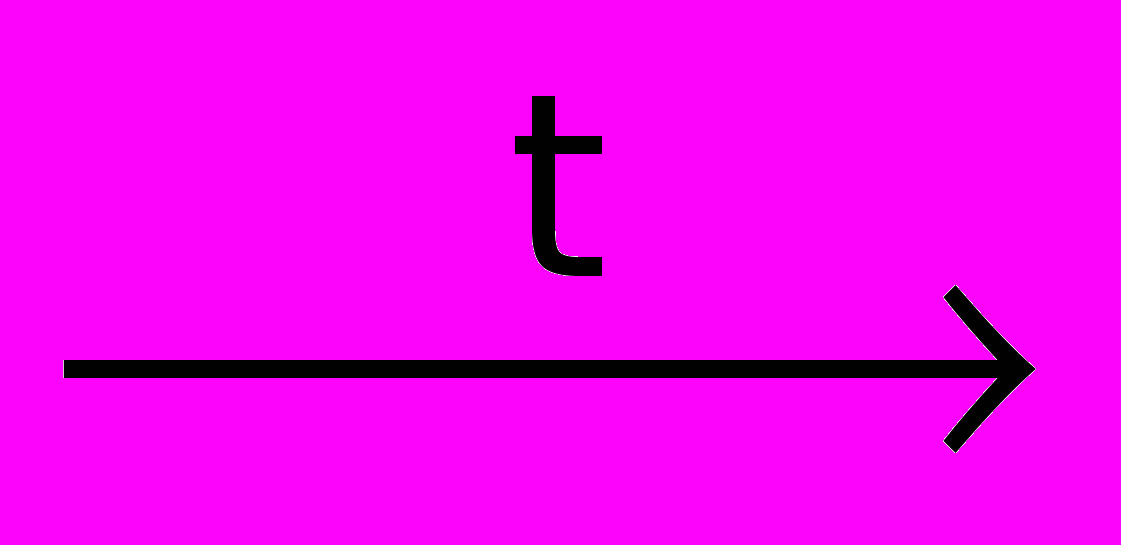 nCO2 + (n+1)H2O
nCO2 + (n+1)H2OII. Лабораторные способы.
Действием кислот на карбонаты и гидрокарбонаты:
CaCO3+2HCl CaCl2 + CO2+ H2O
NaHCO3 + HClNaCl+CO2+H2O
III. Образование в природе.
1) Биологическое окисление (ферментативная реакция):
C6H12O6 + 6O2 6CO2 + 6H2O
2) Спиртовое брожение (ферментативная реакция):
C6H12O6 2CO2 + 2C2H5OH
Химические свойства
I. Кислотный оксид.
CO2 + H2O → CO2 . H2O → H2CO3
CO2 + Na2O Na2CO3; CO2 + 2NaOH Na2CO3 + H2O
Качественная реакция обнаружения (помутнение известковой воды):
Ca(OH)2 + CO2 CaCO3 + H2O
При пропускании избытка СО2 осадок растворяется, и раствор снова становится прозрачным:
CaCO3 + CO2 + H2O Ca(HCO3)2
II. Окислитель.
CO2 + C 2CO ; CO2 + H2 →CO + H2O ; СO2 +2Mg 2MgO + C
6CO2 + 6H2O
 C6H12O6 + 6O2
C6H12O6 + 6O2 (ферментативная реакция фотосинтеза)
Угольная кислота
Слабая двухосновная кислота, по второй ступени диссоциирует незначительно. Проявляет все свойства кислот. Неустойчива, существует только в разбавленных водных растворах:
H2CO3 CO2 + H2O
Соли угольной кислоты
Угольная кислота образует два ряда солей: средние (карбонаты) и кислые (гидрокарбонаты). Из карбонатов в воде растворимы только карбонаты щелочных металлов и аммония.
Питьевая сода - NaHCO3 - применяется в медицине при болезнях, связанных с нарушением кислотно-основного равновесия; CaCO3 (мел, известняк, мрамор) используется в зубных порошках, пастах.
Получение
1) Получение гидрокарбонатов:
NaOH + CO2 NaHCO3 ; Na2CO3 + H2O + CO2 2NaHCO3
2) Получение карбонатов:
CO2 + 2NaOH Na2CO3 + H2O
Химические свойства
1) Разложение сильными или нелетучими кислотами:
BaCO3 + 2HCl BaCl2 + CO2 + H2O
Очень слабые кислоты (борная, кремниевая) разлагают карбонаты только при прокаливании.
2) Термическое разложение:
а) карбонаты всех металлов, кроме щелочных:

б) карбонаты щелочных металлов разлагаются только при добавлении термостойкой кислоты или ее ангидрида (см. получение стекла).
в) гидрокарбонаты:

Билет 16.
СЕРА
Изотопы серы: 32S (95 %), 33S, 34S, 36S.
Электронное строение атома: 1s22s22p63s23p4.
Валентность: II, IV, VI.
Степени окисления: 2, 1, 0, (+2), +4, +6.
Входит в состав белков (аминокислоты цистеин и цистин образуют дисульфидные мостики, определяющие пространственное строение белков).
Простое вещество
Аллотропные модификации серы: ромбическая (), моноклинная (), пластическая. Сера - желтое твердое вещество, нерастворимое в воде. Образует зигзагообразные цепи Sn (n1000). Наиболее устойчивое состояние серы S8 (циклическое соединение).
В природе встречается в виде самородной серы S и соединений: FeS2 (пирит), ZnS, PbS, HgS, CaSO4.2H2O (гипс), Na2SO4.10H2O (глауберова соль), MgSO4.7H2O (горькая соль).
Химические свойства
Образует соединения со многими элементами, проявляя свойства как окислителя, так и восстановителя.
1) Взаимодействие с простыми веществами:
S + O2
 SO2 ; S + H2
SO2 ; S + H2 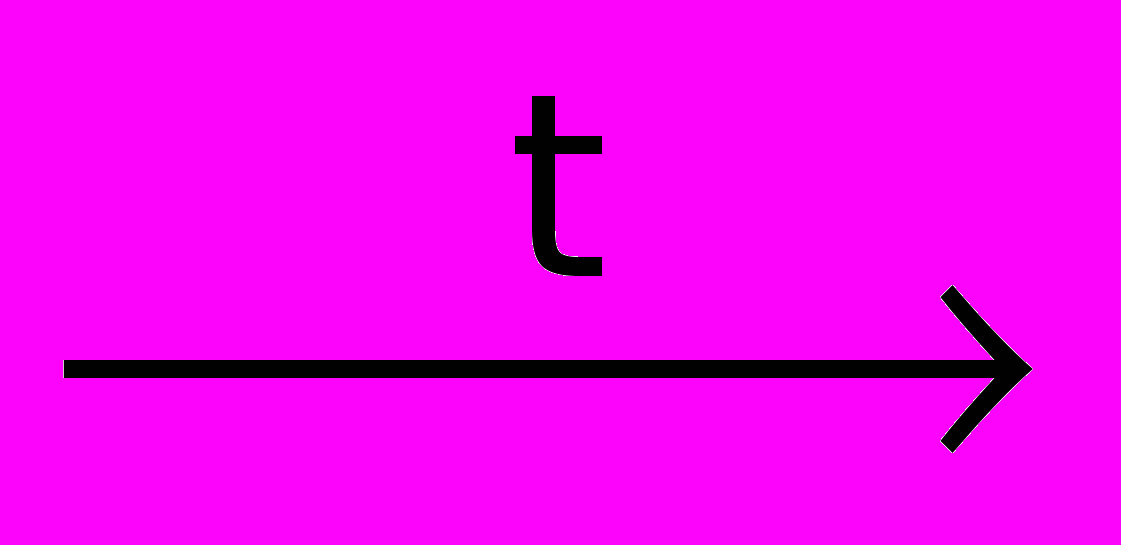 H2S ; S + Fe
H2S ; S + Fe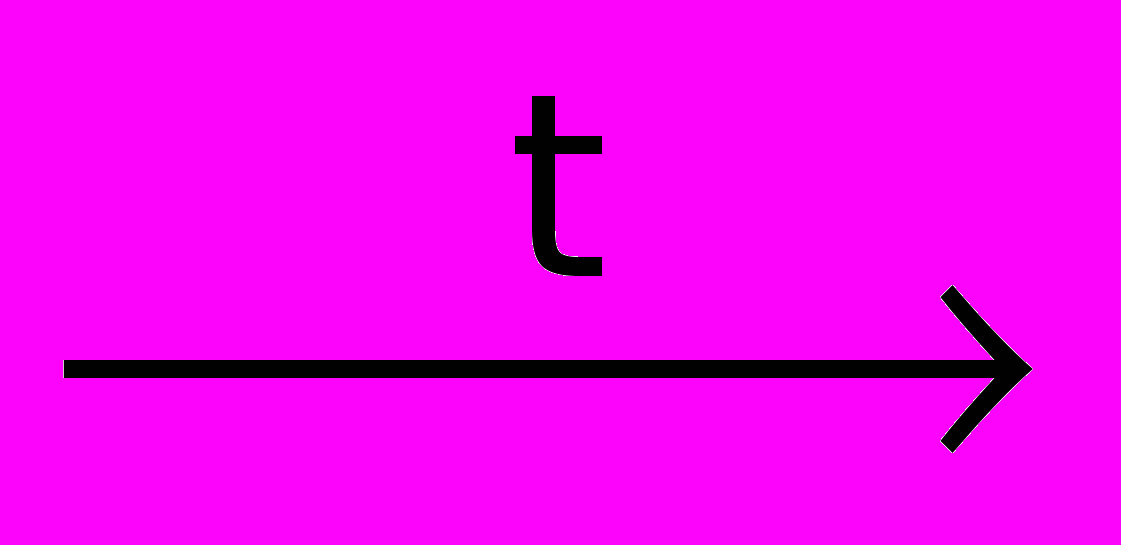 FeS
FeS3S + 2P
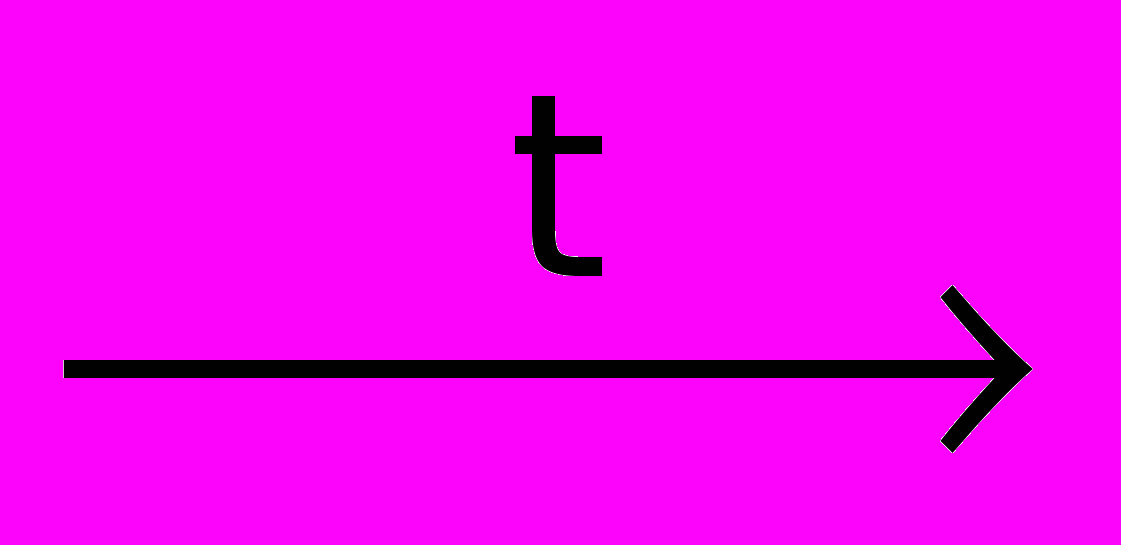 P2S3; 2S + C
P2S3; 2S + C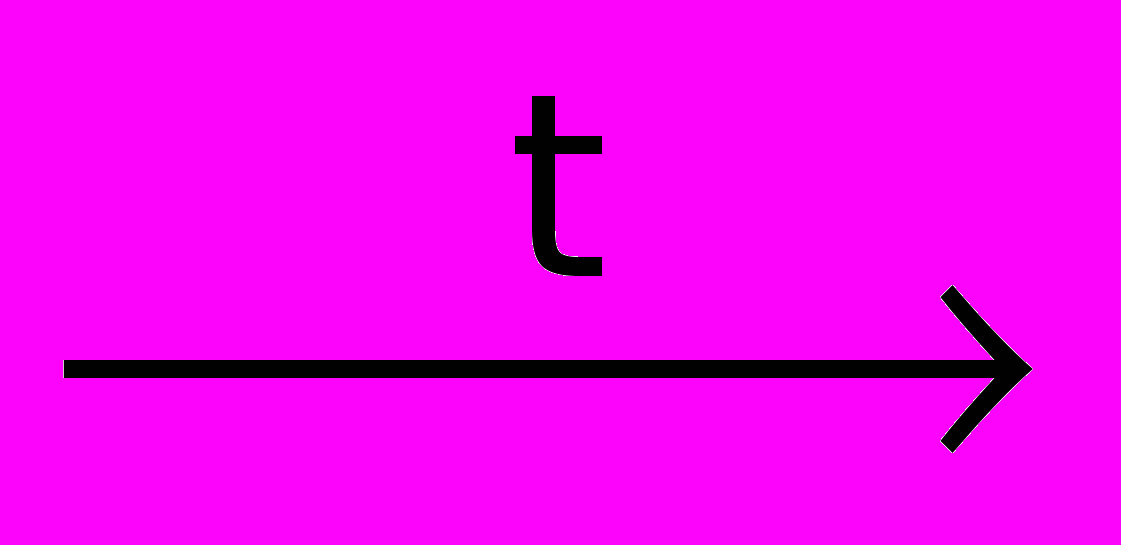 CS2; 2S + Cl2
CS2; 2S + Cl2 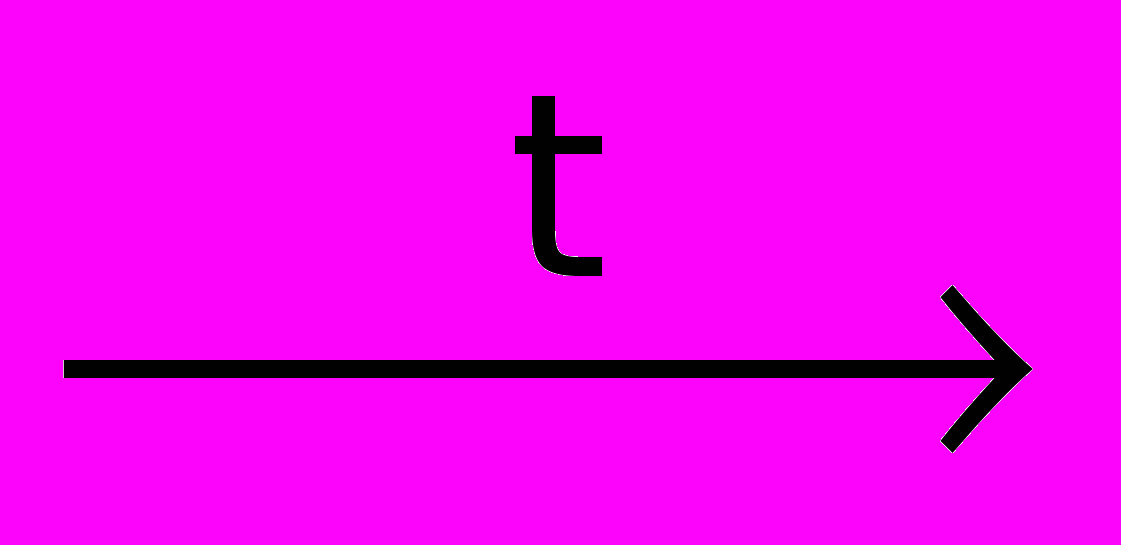 S2Cl2
S2Cl22) Взаимодействие с кислотами:
S + 2H2SO4 (конц.)
 3SO2 + 2H2O
3SO2 + 2H2OS + 2HNO3 (pазб.)
 2NO + H2SO4
2NO + H2SO4S + 6HNO3 (конц.)
 6NO2 + H2SO4 + 2H2O
6NO2 + H2SO4 + 2H2O 3) Взаимодействие со щелочами (диспропорционирование):
3S + 6KOH
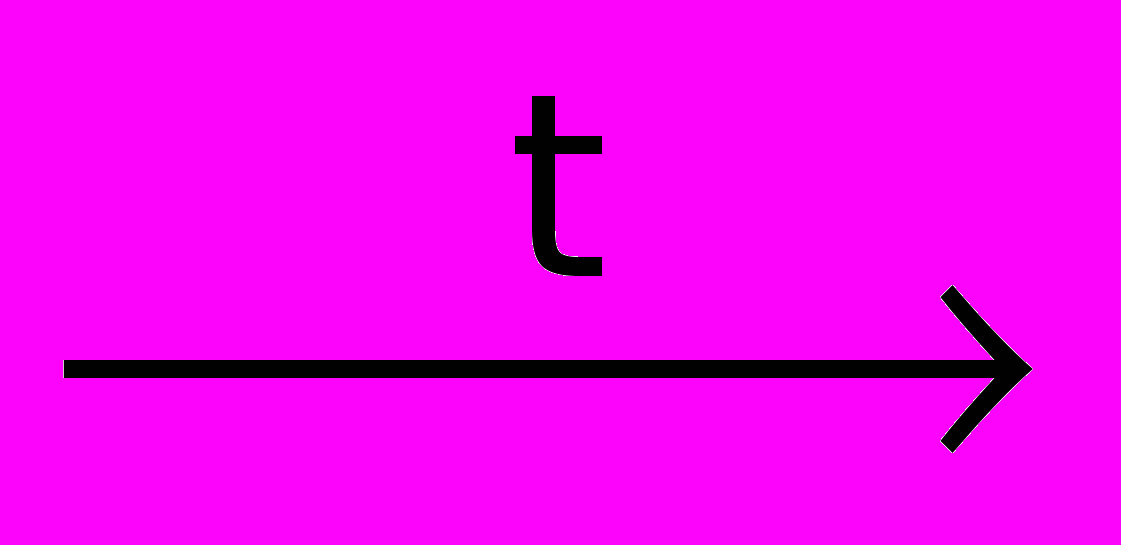 2K2S + K2SO3 + 3H2O
2K2S + K2SO3 + 3H2OOксид серы(IV), cернистый газ
Физические свойства
Бесцветный газ с резким запахом, ядовит.
Химические свойства
I. Кислотно-основные свойства ангидрид сернистой кислоты.
SO2 + H2O →H2SO3
SO2 + CaO CaSO3
SO2 + NaOH NaHSO3
SO2 + 2NaOH Na2SO3 + H2O
II. Окислительно-восстановительные свойства: окислитель (а) и восстановитель (б, в): S0 S4 S6
а) SO2 + 2H2S 3S0 + 2H2O
б) 2SO2 + O2
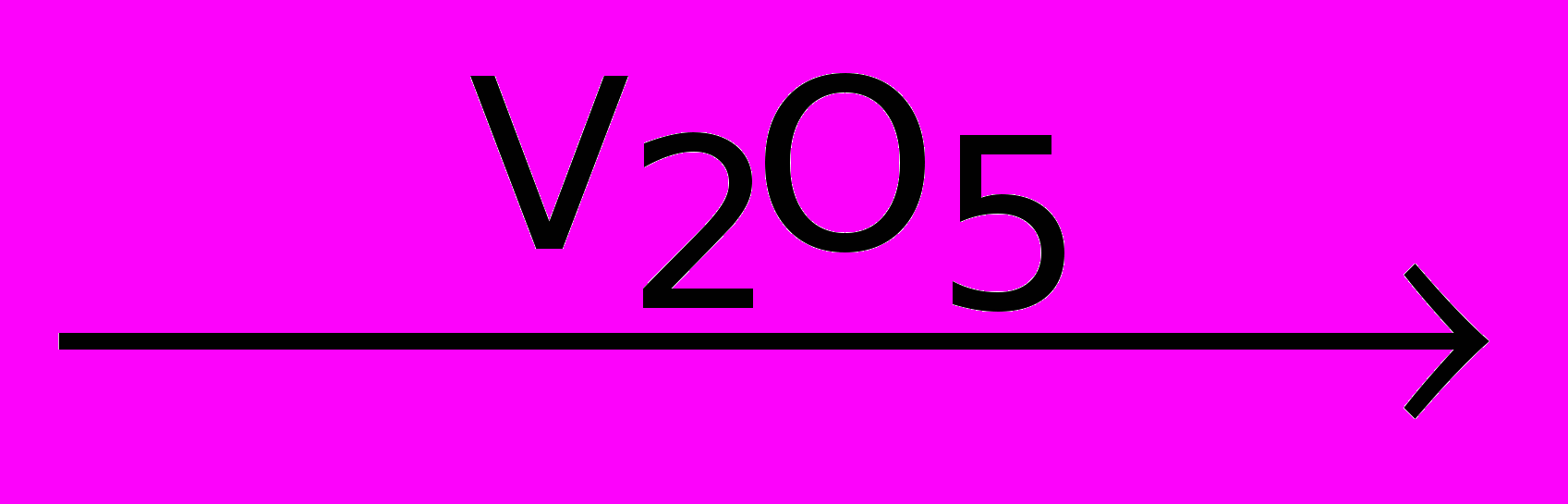 2SO3
2SO3в) 5SO2 + 2KMnO4 + 2H2O K2SO4 + 2MnSO4 + 2H2SO4
Оксид серы(VI), cерный газ
Физические свойства
Бесцветная жидкость, хорошо поглощает влагу.
Получение
Каталитическое окисление сернистого газа (см. выше).
Химические свойства
Кислотный оксид, ангидрид серной кислоты:
SO3 + H2O H2SO4 ; SO3 + CaO CaSO4
SO3 + KOH KHSO4
SO3 + 2KOH K2SO4 + H2O
