Билет Вещества, состоящие из атомов одного вида, называются простыми
| Вид материала | Документы |
- Реферат Ученицы 10-б сошенко Надежды Тема: Психоактивные вещества, 60.77kb.
- Реферат по органической химии тема: получение алканов,алкенов,алкинов, 194.91kb.
- 1. Три формы существования мира. Какие процессы называются информационными?, 1454.9kb.
- Тест по теме: «Строение и классификация органических соединений» Задания уровня, 1355.16kb.
- Строение вещества, 360.6kb.
- Ткани растений, 275.54kb.
- Молекулярно-кинетическая теория, 37.31kb.
- Молекулярно-кинетическая теория газов, 97.72kb.
- Молекулярная физика и термодинамика. Лекция №1 Молекулярно-кинетическая теория Основные, 10053.18kb.
- Элементы квантовой механики и физики атомов, молекул, твердых тел, 156.85kb.
II. Взаимодействие со сложными веществами.
1) С водой при комнатной температуре взаимодействуют только щелочные и щелочноземельные металлы, при нагревании - некоторые другие металлы (см. также темы “Алюминий” и “Железо”):
2Na + 2H2O 2NaOH + H2
Mg + 2H2O
 Mg(OH)2 + H2
Mg(OH)2 + H22) С кислотами:
а) Кислоты - “неокислители” (все кислоты, кроме концентрированной Н2SO4 и HNO3 любой концентрации) окисляют металлы, стоящие в ряду напряжений до водорода:
Zn + H2SO4(разб.) ZnSO4 + H2; 2Al + 6hcl 2AlCl3 + 3H2
б) Продукты взаимодействия металлов с азотной кислотой и с концентрированной серной кислотой определяются типом металла и концентрацией кислоты (см. главы “Азот” и “Сера”).
3) C оксидами (при нагревании):
2Al + Cr2O3 Al2O3 +2Cr
4) С растворами солей:
Fe + Cu(NO3)2 Cu + Fe(NO3)2
5) Металлы, которым соответствуют амфотерные оксиды и гидроксиды, реагируют со щелочами (например, цинк, алюминий):
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
2Al + 6NaOH + 6H2O 2Na3[Al(OH)6] + 3H2
Таким образом, несмотря на большое многообразие металлов, все они обладают общими физическими и химическими свойствами, что объясняется сходством в строении атомов и строении простых веществ.
Билет 7.
Взаимосвязь между различными классами неорганических веществ называется генетической связью.
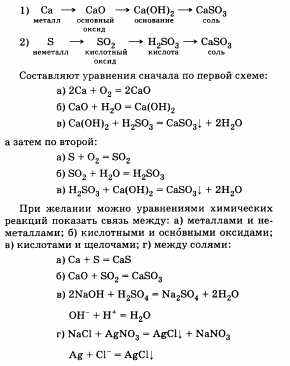
Билет 10.
Все реакции в водных растворах электролитов происходят между ионами и называются реакциями ионного обмена. Они идут до конца, если образуется газ, вода или осадок.
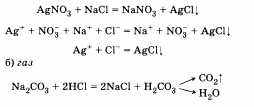

Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
Билет 8.
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Химическая реакция - такое взаимодействие реальных частиц (молекул, ионов, атомов), которое приводит к изменению их физико-химических свойств без изменения природы химических элементов.
В ходе химической реакции одни вещества (исходные, реагенты) превращаются в другие (продукты реакции).
По признаку - природа соединений - реакции делят на реакции неорганической и органической химии.
К общим признакам, применимым к органическим и неорганическим реакциям, относятся следующие:
- степень завершенности процесса,
- характер теплового эффекта,
- степень однородности реакционной смеси.
По первому из них реакции делят на:
- необратимые, когда исходные вещества полностью превращаются в продукты (если реагенты взяты в стехиометрических отношенях):
K2S + 2HCl
 2KCl + H2S
2KCl + H2S- обратимые, в ходе которых устанавливается динамическое равновесие между реагентами и продуктами:
N2 +3H2
 2NH3
2NH3По второму признаку реакции делят на:
- экзотермические, идущие с выделением тепла:
Na + 2H2O 2NaOH + H2 + Q
- эндотермические, в ходе которых происходит поглощение энергии:
CaCO3
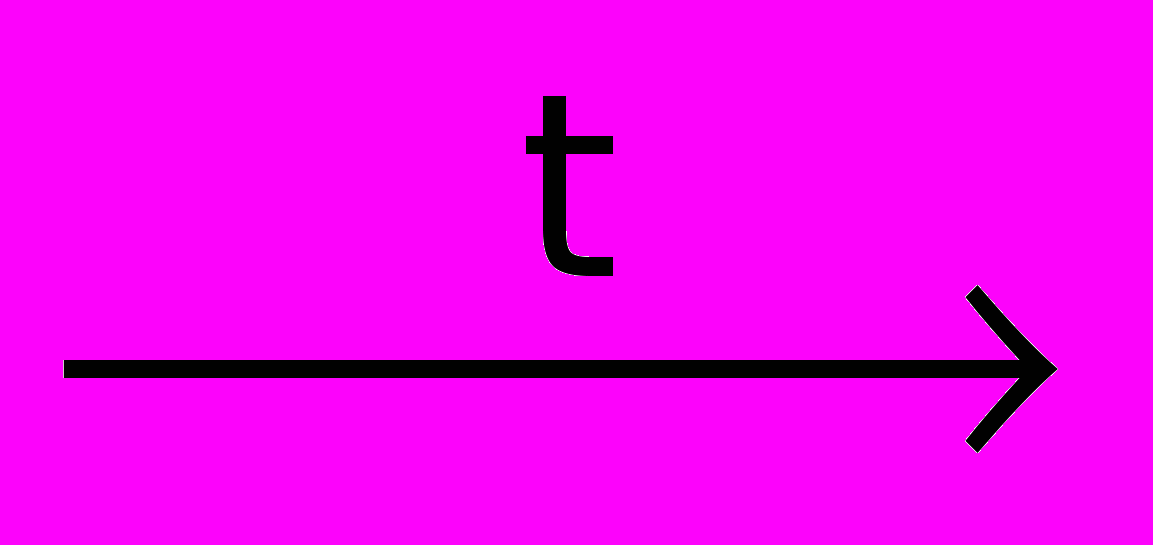 CaO + CO2 - Q
CaO + CO2 - QПо третьему признаку реакции делятся на:
- гомогенные, протекающие в объеме одной фазы (реакции между газами или веществами в истинных растворах):
2CO(г) + O2(г) 2CO2, HCl(р-р) + NaOH(р-р) H2O + NaCl
- гетерогенные, протекающие на поверхности раздела двух фаз (реагенты находятся в разных агрегатных состояниях):
2Al(тв.) + 3Сl2(г) 2AlCl3
Кроме предложенных общих способов классификации можно также подразделять реакции по признаку наличия катализатора на каталитические и некаталитические.
Реакции неорганической химии классифицируются по признаку изменения числа реагентов и продуктов:
- реакции разложения, в которых из одного исходного вещества образуется несколько продуктов:
Mg(OH)2
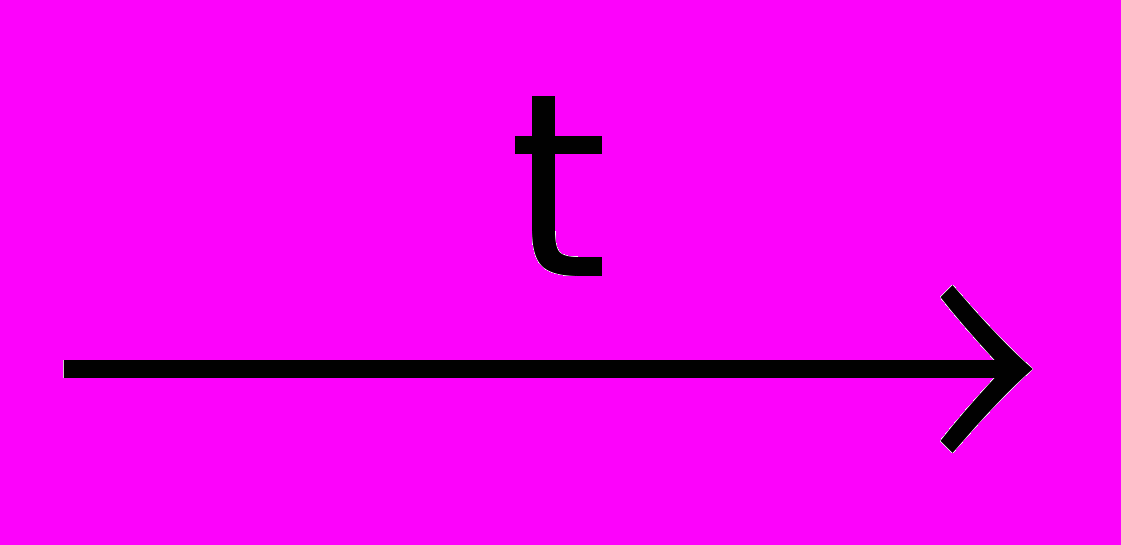 MgO + H2O
MgO + H2O- реакции соединения, в которых из нескольких реагентов образуется один продукт:
2Fe + 3Cl2
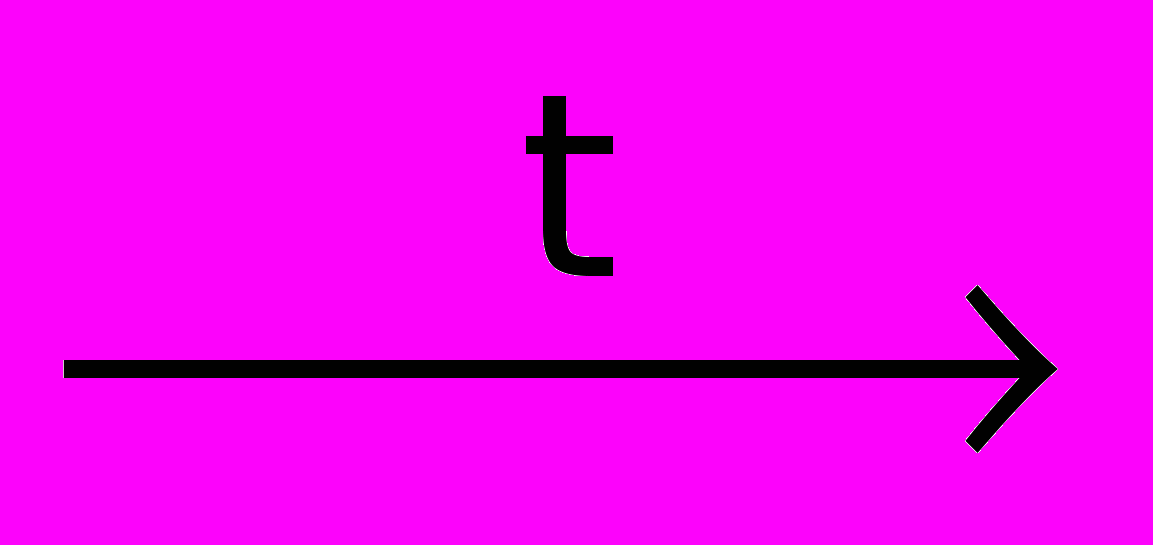 2FeCl3
2FeCl3Реакции замещения - реакции, в которых часть сложного вещества замещается простым веществом:
CuSO4 + Fe FeSO4 + Cu ; 2KBr + Cl2 2КСl +Br2
Реакции обмена - реакции, в которых реагенты обмениваются своими составными частями:
AgNO3 + NaBr NaNO3 + AgBr
Реакции обмена являются необратимыми в тех случаях, когда один из продуктов уходит из сферы реакции
Химические реакции классифицируют также по признаку возможного переноса электронов в ходе процесса.
В отдельный класс выделяют окислительно-восстановительные реакции, сопровождающиеся переносом электронов и приводящие к изменению степеней окисления атомов, входящих в состав реагентов:
2HCl + Zn ZnCl2 + H2; Сl2 + H2O HСl + HOCl
Очевидно, что одна и та же реакция может относиться одновременно к разным типам, в зависимости от признака, по которому проводят классификацию.
Например:
NaOH + HCl NaCl + H2O
реакция необратимая, экзотермическая, гомогенная, обмена (кислотно-основная, нейтрализации), не окислительно-восстановительная.
Билет 19.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ГЛАВНОЙ
ПОДГРУППЫ II ГРУППЫ
В главную подгруппу второй группы входят берилий Be, магний Mg, кальций Сa, барий Ba, стронций Sr, радий Ra. Это - s-элементы, т.к. их валентные электроны находятся на s-подуровне.
Наиболее распространенные минералы кальция и магния: кальцит CaCO3 (основная часть мрамора, известняка, мела), гипс CaSO4.2H2O, доломит MgCO3. CaCO3, магнезит MgCO3. В качестве фосфата Ca3(PO4)2 кальций входит в состав апатитов и фосфоритов.
Электронное строение внешнего слоя - ns2.
Валентность всегда постоянна и равна II.
Степени окисления: 0, +2.

Щелочноземельные металлы - хорошие восстановители. На воздухе легко окисляются, давая основные оксиды МеО, которым соответствуют основания Ме(ОН)2.

Медико-биологическое значение
Кальций входит в состав костей. При его недостатке происходит нарушение роста, искривление костей скелета. Кальций улучшает свертываемость крови, снимает спазмы сосудов. Хлорид кальция применяется для лечения неврозов, а также как противоаллергический, противоотечный, противовоспалительный препарат. Хлорная известь - CaOCl2 - дезинфицирующее средство. Сульфат кальция применяется в гипсовых повязках. Магний входит в состав хлорофилла, активирует ферменты. Сульфат магния уменьшает спазмы сосудов, применяется как слабительное. Растворимые соли бария токсичны, однако, сульфат бария используется в рентгеноскопии.
13.2. КАЛЬЦИЙ
Электронное строение атома: 1s22s22p63s23р64s2.
Валентность II.
Степени окисления: 0, +2.
Простое вещество
Физические свойства
Серебристо-белый, довольно твердый, легкий металл.
Получение
Электролизом расплавов солей (6 ч. CaCl2 и 1 ч. CaF2, последний добавляется для понижения температуры плавления хлорида кальция):

Химические свойства
Сильный восстановитель. Во всех реакциях легко отдает валентные электроны и превращается в положительно заряженный катион.
I. Взаимодействие с простыми веществами.
1) При обычных условиях - с хлором, кислородом:
Ca + Cl2 CaCl2 ; 2Ca + O2 2CaO
2) При нагревании - с некоторыми неметаллами:
Ca + S CaS ; 3Ca +N2 Ca3N2
Ca + 2C CaC2 ; Ca + H2 CaH2
II. Взаимодействие со сложными веществами.
1) С водой:
Ca + 2H2O Ca(OH)2 + H2
2) С кислотами (при взаимодействии с кислотами-”неокислителями” вытесняет водород из кислот, а с кислотами-”окислителями” - образуются продукты восстановления серы и азота):
Ca+H2SO4(pазб.) CaSO4 + H2
4Ca + 5H2SO4(конц.) 4СaSO4 + H2S + 4H2O
4Ca + 10HNO3(разб) 4Ca(NO3)2 + NH4NO3 +3H2o
4Са + 10HNO3(конц.) 4Ca(NO3)2 + N2O +5H2O
3) С оксидами (при нагревании):
V2O5 + 5Ca 2V + 5CaO
Билет 22.
ХИМИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ
В главную подгруппу первой группы периодической системы входят литий Li, натрий Na, калий К, рубидий Rb, цезий Сs и франций Fr. Это s-элементы, так как их валентные электроны находятся на s-подуровне.
В природе щелочные металлы в свободном состоянии не встречаются. Наиболее важными минералами натрия и калия являются каменная соль (состоит в основном из хлорида NaCl, иначе именуемого поваренной солью), сильвинит NaCl. KCl и карналлит KCl.MgCl2. 6H2O.
Электронное строение внешнего слоя - ns1, где n - номер периода.
Валентность всегда постоянна и равна I.
Степени окисления: 0, +1.

Все щелочные металлы - очень хорошие востановители, на воздухе легко окисляются, поэтому хранятся под инертным растворителем. Их оксиды имеют общую формулу Me2O, проявляют основные свойства, им соответствуют гидроксиды МеОН (щелочи, кроме LiOH).
Гидроксид лития ограниченно растворим в воде и может разлагаться при нагревании (500 0С) на оксид и воду. Остальные гидроксиды устойчивы к нагреванию, хорошо растворимы в воде, являются сильными электролитами.
Медико-биологическое значение
Ионы натрия и калия играют важнейшую роль в жизнедеятельности организмов. Натрий участвует в передаче нервных импульсов, способствует удержанию воды в тканях, участвует в поддержании кислотно-основного равновесия в крови. Гидрокарбонат натрия применяется при повышенной кислотности желудочного сока, сульфат натрия - при отравлении солями бария и свинца. Калий также участвует в передаче нервных импульсов. Его недостаток вызывает нарушения в работе сердца. Соли лития применяются для лечения психических заболеваний, а также заболеваний, связанных с отложением солей, например, подагры.
Получение
В природе щелочные металлы встречаются только в составе различных минералов. Основной способ их получения - электролиз расплавов солей или щелочей:

Калий получают, вытесняя его избытком натрия из расплавов хлорида или гидроксида (в первом случае используют пары натрия, во втором - жидкий натрий):
KCl + Na NaCl + K; KOH + Na NaOH + K
Химические свойства
Во всех реакциях щелочные металлы являются восстановителями.
I. Взаимодействие с неметаллами.
1) При взаимодействии с кислородом литий образует оксид, остальные металлы пероксиды:
4Li + O2 2Li2O, 2Na + O2 Na2O2
Пероксиды при нагревании с избытком металлов переходят в оксиды:
Na2O2 + 2Na 2Na2O
Пероксиды способны поглощать углекислоту, выделяя кислород:
2Na2O2 + 2CO2 2Na2CO3 + O2
2) C галогенами: 2Me + Cl2 2MeCl (галогениды)
3) С водородом: 2Me + H2 2MeH (гидриды)
4) С серой: 2Me + S Me2S (сульфиды)
5) С азотом: 6Me + N2 2Me3N (нитриды)
II. Взаимодействие со сложными веществами.
1) С водой (литий вступает в реакцию медленно, натрий - бурно, калий - с воспламенением, рубидий и цезий - со взрывом):
2Me + 2H2O 2MeOH + H2
2) С кислотами - сильными окислителями (азотной и концентри-рованной серной) реакции идут с выделением продуктов восстановления азота или серы:
8Na + 10HNO3(конц.) N2O + 8NaNO3 + 5H2O
8Na + 5H2SO4(конц.) H2S + 4Na2SO4 + 4H2O
Билет 20.
Простое вещество
Железо - d-элемент, находится в побочной подгруппе VIII группы периодической системы. Самый распространенный в природе металл после алюминия. Входит в состав многих минералов: бурый железняк Fe2O3.H2O, красный железняк или гематит Fe2O3, магнитный железняк или магнетит Fe3O4, пирит FeS2.
Электронное строение: 1s22s22p63s23p64s23d6.
Валентность: II, III, (VI).
Cтепени окисления: 0, +2, +3, +6 (только в ферратах К2FeO4).
Физические свойства
Железо - блестящий, серебристо-белый металл, т. пл. - 1539 0С.
Получение
Чистое железо можно получить восстановлением оксидов водородом при нагревании, а также электролизом растворов его солей. Доменный процесс получение железа в виде сплавов с углеродом (чугун и сталь):
1) 3Fe2O3 + CO 2Fe3O4 + CO2
2) Fe3O4 + CO 3FeO + CO2 ; 3) FeO + CO Fe + CO2
Химические свойства
I. Взаимодействие с простыми веществами неметаллами.
1) С хлором и серой (при нагревании). Более сильным окислителем хлором железо окисляется до Fe3, более слабым - серой - до Fe2:
2Fe + 3Cl2 2FeCl3 ; Fe + S FeS
2) С углем, кремнием и фосфором (при высокой температуре).
3) В сухом воздухе окисляется кислородом, образуя окалину смесь оксидов железа(II) и (III):
3Fe + 2O2 Fe3O4 (FeO. Fe2O3)
II. Взаимодействие со сложными веществами.
1) Во влажном воздухе протекает коррозия (ржавление) железа:
4Fe + 3O2 + 6H2O 4Fe(OH)3
При высокой температуре (700900 0С) в отсутствие кислорода железо реагирует с парами воды, вытесняя из нее водород:
3Fe + 4H2O Fe3O4 + 4H2
2) Вытесняет водород из разбавленной соляной и серной кислот:
Fe + 2HCl FeCl2 + H2; Fe + H2SO4(разб.) FeSO4 + H2
Высококонцентрированные серная и азотная кислоты при обычной температуре с железом не реагируют вследствие его пассивации.
Разбавленной азотной кислотой железо окисляется до Fe3, продукты восстановления HNO3 зависят от ее концентрации и температуры:
8Fe + 30HNO3(оч. разб.) 8Fe(NO3)3 + 3NH4NO3 + 9H2O
Fe + 4HNO3(разб.) Fe(NO3)3 + NO + 2H2O
Fe + 6HNO3(конц.)
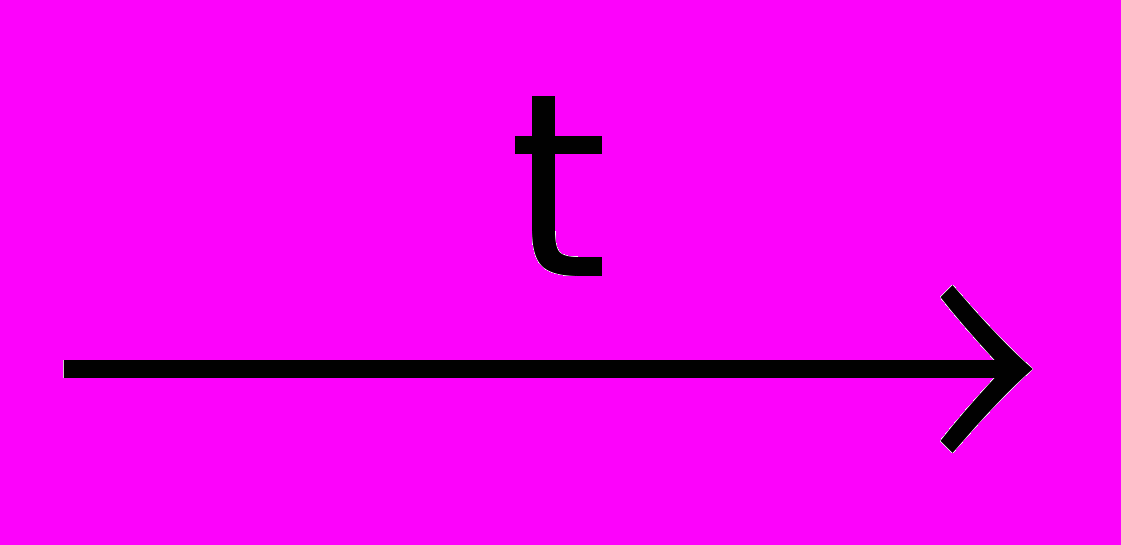 Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O3) Реакция с растворами солей металлов, стоящих правее железа в электрохимическом ряду напряжений металлов:
Fe + CuSO4 FeSO4 + Cu
Медико-биологическое значение
Железо - составная часть жизненно важных биологических комплексов, таких как гемоглобин (транспорт кислорода и углекислого газа), миоглобин (запасание кислорода в мышцах), цитохромы (ферменты). В организме взрослого человека содержится 4-5 г железа. Недостаток железа в организме приводит к таким заболеваниям, как анемия, малокровие.
Соединения железа(II)
Оксид железа(II)
Оксид FeO - черный порошок, нерастворим в воде.
Получение
Восстановление из оксида железа(III) при 500 0С действием оксида углерода(II):
Fe2O3 + CO 2FeO + CO2
Химические свойства
Основной оксид, ему соответствует гидроксид Fe(OH)2; растворяется в кислотах, образуя соли железа(II):
FeO + 2HCl FeCl2 + H2О
Гидроксид железа(II)
Гидроксид Fe(OH)2 - нерастворимое в воде основание.
Получение
Действиe щелочей на соли железа(II) без доступа воздуха:
FeSO4 + 2NaOH Fe(OH)2 + Na2SO4
Химические свойства
Гидроксид Fe(OH)2 проявляет основные свойства, хорошо растворяется в минеральных кислотах, образуя соли.
Fe(OH)2 + H2SO4 FeSO4 + 2H2O
При нагревании разлагается:
Fe(OH)2
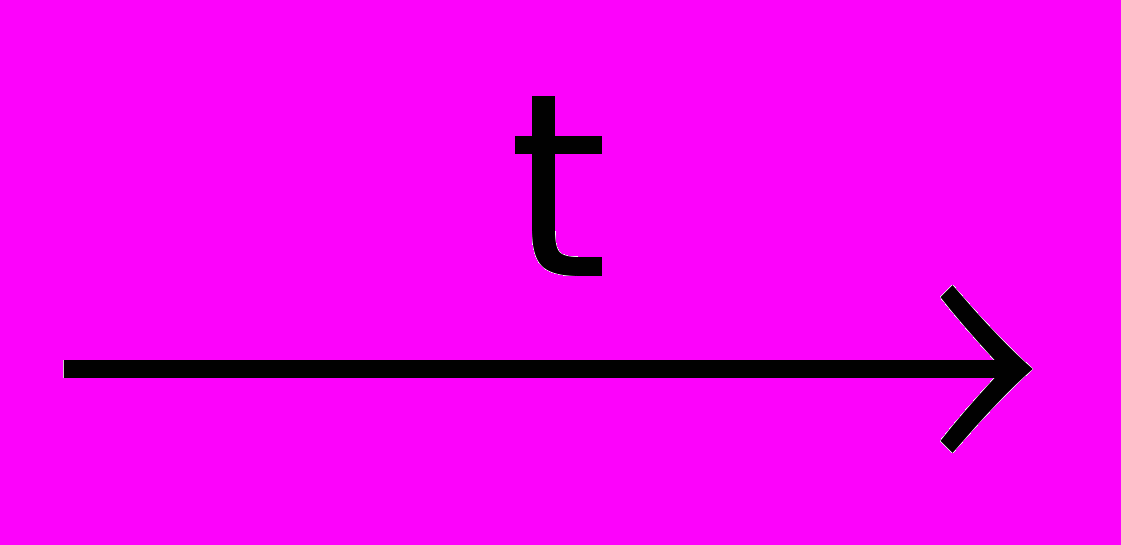 FeO + H2O
FeO + H2OОкислительно-восстановительные свойства
Соединения железа(II) проявляют достаточно сильные восстановительные свойства, устойчивы только в инертной атмосфере; на воздухе (медленно) или в водном растворе при действии окислителей (быстро) переходят в соединения железа (III):
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
2FeCl2 + Cl2 2FeCl3
10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Соединения железа(II) могут выступать и в роли окислителей:
FeO + CO
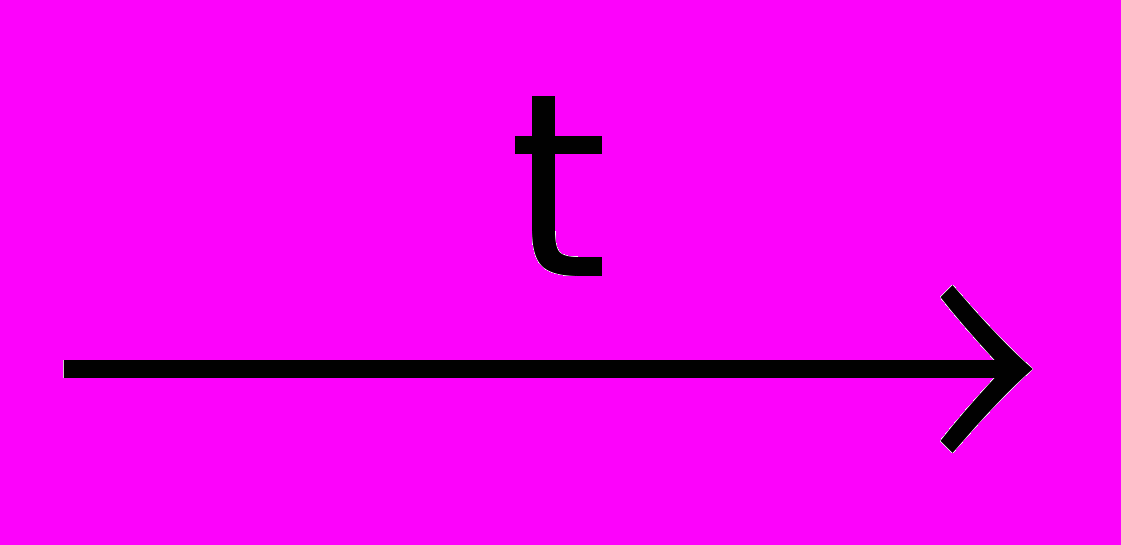 Fe + CO2
Fe + CO2Соединения железа(III)
Оксид железа(III)
Оксид Fe2O3 - самое устойчивое природное кислородсодержащее соединение железа. Это амфотерный оксид, нерастворимый в воде. Образуется при обжиге пирита FeS2 (cм. 20.4 “Получение SO2”).
Химические свойства
1) Растворяясь в кислотах, образует соли железа(III):
Fe2O3 + 6HCl 2FeCl3 + 3H2O
2) При сплавлении с карбонатом калия образует феррит калия:
Fe2O3 + K2CO3
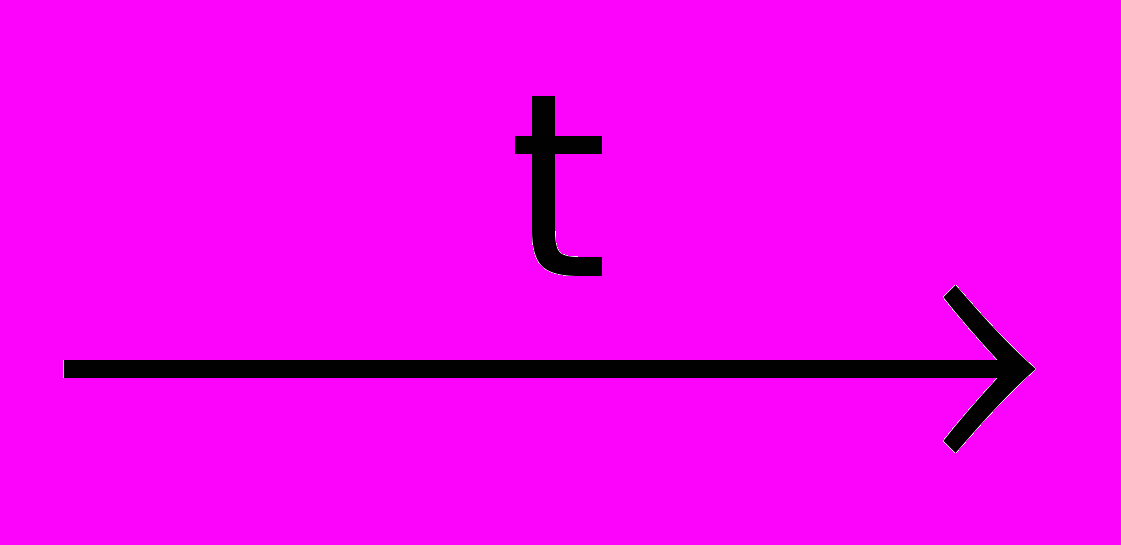 2KFeO2 + CO2
2KFeO2 + CO23) При действии восстановителей выступает как окислитель:
Fe2O3 + 3H2
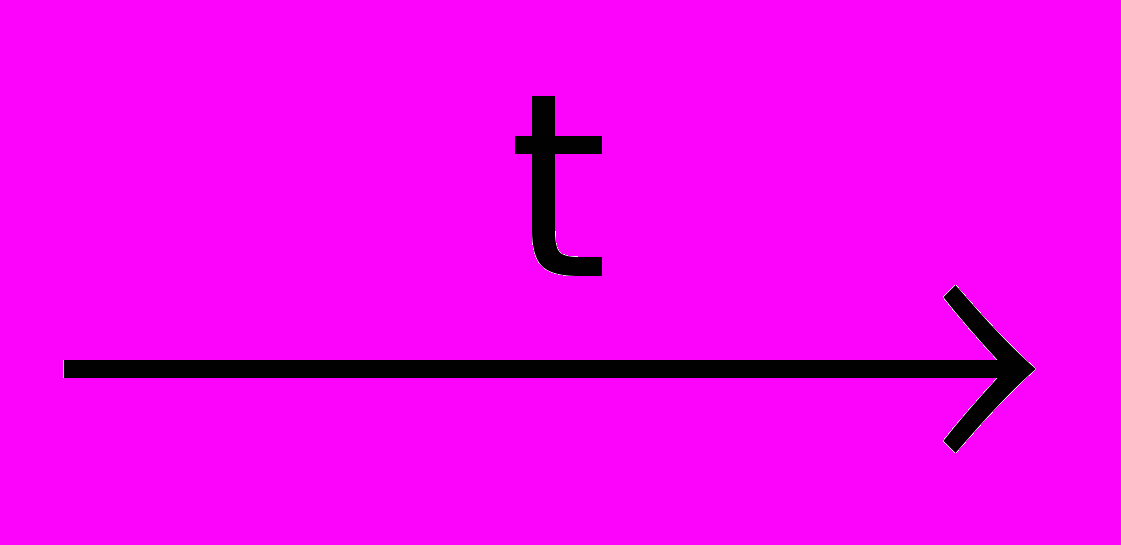 2Fe +3H2O
2Fe +3H2OГидроксид железа(III)
Гидроксид Fe(OH)3 - красно-бурое вещество, нерастворимое в воде.
Получение
Fe2(SO4)3 + 6NaOH 2Fe(OH)3 + 3Na2SO4
Химические свойства
Гидроксид Fe(OH)3 - более слабое основание, чем гидроксид железа(II), обладает слабо выраженной амфотерностью.
1) Pастворяется в разбавленных кислотах:
Fe(OH)3 + 3H2SO4 Fe2(SO4)3 + 3H2O
2) При кипячении в 50 % растворе NaOH образует гидроксокомплекс:
Fe(OH)3 + 3NaOH Na3[Fe(OH)6]
Билет 14.
ХИМИЯ ВОДОРОДА
Водород Н элемент I (и VII) группы I периода периодической системы. Природный водород состоит из двух стабильных изотопов: протия 1Н (99.9 %) и дейтерия 2Н(D) (0.1 %). Искусственным путем получают неустойчивый радиоактивный изотоп тритий 3Н(Т).
Это самый распространенный элемент Вселенной. В свободном виде на Земле встречается редко, в основном в виде соединений с неметаллами (вода, нефть, природный газ).
Электронная структура атома -1s1.
Валентность: I.
Степени окисления: 1, 0, +1.
Медико-биологическое значение
Перенос водорода по биохимической цепочке организма является одним из фундаментальнейших процессов в живой природе. Многие реакции организма протекают лишь при определенной величине концентрации ионов водорода.
Простое вещество
Физические свойства
Легкий бесцветный газ без запаха. Плохо растворяется в воде и органических растворителях. Хорошо растворим во многих металлах: никеле, платине, палладии.
Получение
