Строение вещества
| Вид материала | Курсовая работа |
- Темы рефератов по дисциплине Строение вещества для группы ах-07-1 Твердые системы, 11.09kb.
- Содержание понятия «строение вещества», «структура вещества», «строение молекул». Упорядоченные, 115.53kb.
- Тематическое планирование. 11 класс. Тема: «Строение вещества», 67.77kb.
- Тест по теме: «Строение и классификация органических соединений» Задания уровня, 1355.16kb.
- «Строение вещества» Общая трудоёмкость дисциплины составляет, 21.62kb.
- Занятие 4 химические вещества клетки, 102.78kb.
- Темы рефератов по курсу «Анатомия цнс». Большой (конечный), 14.05kb.
- Т. С. Назарова методические рекомендации к таблицам по химии для общеобразовательной, 476.32kb.
- Н. Г. Чернышевского рабочая программа, 145.62kb.
- Тесты на тему: «нервная система», 102.31kb.
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО
ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
АЛТАЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Химический факультет
Кафедра физической и коллоидной химии
КЛАСТЕРЫ АТОМОВ И МОЛЕКУЛ – ПРОМЕЖУТОЧНОЕ ОБРАЗОВАНИЕ НА ЭТАПЕ АГРЕГИРОВАНИЯ ВЕЩЕСТВА
(Курсовая работа по курсу «Строение вещества»)
Выполнила студентка
IV курса, 682 группы
Паневина Н.В.
________________________
Научный руководитель
к.х.н, доцент Шипунов Б.П.
_________________________
_________________________
Курсовая работа защищена
“____” ____________2002 г.
Оценка _______________
Барнаул 2002
Содержание
| 1. ЧТО ТАКОЕ КЛАСТЕР. ИСТОРИЯ ПОЯВЛЕНИЯ. ОБЩИЕ СВЕДЕНИЯ | 3 |
| 2. ОБРАЗОВАНИЕ КЛАСТЕРОВ | 5 |
| 3. Классификация кластерных соединений металлов | 8 |
| 3.1 Изолированные атомы металлов | 12 |
| 3.2. Двухатомные металлические частицы | 14 |
| 3.3. Металлические частицы с числом атомов от 3 до 12 | 14 |
| 3.4. Частицы с числом атомов металлов от 13 до 150 | 15 |
| 3.5. Частицы с размерами от 2 до 10 нм | 16 |
| 3.6. Частицы с размерами от 10 до 30 нм | 16 |
| 3.7. Частицы с размерами более 30 нм | 17 |
4. Остовная изомерия малых металлических частиц | 17 |
| 5. Лиганды в кластерных соединениях | 19 |
| 6. РАСПРОСТРАНЕННОСТЬ КЛАСТЕРНЫХ СОЕДИНЕНИЙ | 21 |
| 7. Электронное строение кластерных соединений | 22 |
| 8. НОМЕНКЛАТУРА КЛАСТЕРНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ | 24 |
| Литература | 25 |
1. ЧТО ТАКОЕ КЛАСТЕР. ИСТОРИЯ ПОЯВЛЕНИЯ. ОБЩИЕ СВЕДЕНИЯ
Представления о непостоянных агрегатах атомов и молекул восходят ко второй половине 19 века когда в химии утвердилось атомно-молекулярное учение, а в физике-«кинетическая теория материи». Такие представления не раз выдвигались для объяснения поведения жидкостей и жидких растворов, образования осадков и коллоидов, электропроводности жидких электролитов и электрических разрядов в газах. К.М.Гульдберг и П.Вааге, Д.И Менделеев,В.Рамзай в химии, Дж.К.Максвелл, В.К.Рентген, П.Ланжевен в физике и много других ученых, менее знаменитых, так или иначе учавствовали в постепенном становлении понятия, ныне обозначаемого термином «кластер».
Сам этот термин впервые появился в научной литературе в 1937 году в известных работах Дж.Е.Майера по статистической механике неидеальных газов. Первоначально он означал группу атомов и молекул, выделяемую в газе по определенным формально-математическим признакам. Здесь введение кластеров было еще чисто математическим шагом. Однако вскоре благодаря Я.И.Френккелю, стало ясно, что при описании неидеальных газов, и особенно предпереходных состояний, можно опираться на представление о действительном образовании групп или агрегатов, молекул. Строгая теория неидеальных газов, основанная на представлении о физических кластерах, была развита в статистической механике Т.Хиллом в 1955 году.
В течение 50-х годов название и понятие «кластер» стало весьма употребительным в теориях конденсации и вообще образования новой фазы. На конец десятилетия приходится и дальнейшее распространение области применения этого понятия: кластерными соединениями по предложению Ф.Коттона, были названы химические соединения (например, многоядерные карбонилы и их производные), содержащие несколько связанных друг с другом атомов металлов, которые окружены лигандами.
В течение второй половины 60-х годов представления о кластерах делаются все более популярными в разных областях химии, в теории жидкого состояния, в учении о растворах и соединениях непостоянного состава (здесь новым явилось продвижение представления о кластерах из области исследований твердых соединений), в плазмохимии, в элементорганической химии. В конце 60-х начале 70-х годов кластеры становятся объектом теоретических (компьютерных) исследований.
Разные авторы вкладывают в термин «кластер» неодинаковое содержание, хотя во всех случаях сохраняется оттенок первоначального значения этого английского слова (cluster)-груда, скопление, пучок, гроздь, группа.
Одно из определений:
Кластер - это группа из небольшого (счетного) и, вообще говоря, переменного числа взаимодействующих частиц (атомов, молекул, ионов).
Минимальное число членов образующих группу равно двум. Верхняя граница размыта и неотчетлива. Но ясно, что она должна находиться в той же области, где добавление еще одного члена уже не изменит свойств кластера: в этой области заканчивается переход из количества в качество. Ниже мы увидим, что эта граница не вполне однозначна, но практически большая часть изменений, существенных для химика, заканчивается при~103 частицах в группе. Следует различать свободные кластеры и стабилизированные теми или иными факторами в последнем случае кластер имеет более сложный состав и приобретает структуру, в которой целесообразно выделять «тело» кластера (т.е. группу взаимодействующих частиц рассматриваемого типа) и стабилизирующие элементы, например «оболочку» из лигандов, или центральную частицу (часто это ион), или совокупность того и другого.
Наличие или отсутствие стабилизации резко сказывается на поведении кластеров, и прежде всего на продолжительности их жизни: для стабилизированных кластеров она такая же, как для обычных молекул, для нестабилизированных нижней границей времени жизни 10-13-10-12с. С точки зрения химика, кажется правильным считать кластерными только такие образования, которые существуют, достаточно долго, чтоб участвовать в химическом превращении в качестве самостоятельной единицы. При этом остается неясным, при какой же продолжительности жизни кластеров их образование становится кинетически ощутимым. Фактических данных для ответа на этот вопрос мало, но с ростом «разрешающей способности» экспериментальных методов постепенно выясняется важная кинетическая роль даже весьма короткоживущих состояний.
Разнообразие типов кластеров определяется возможностью сочетания различных сред и способов стабилизации с множеством вариантов построения тела кластера из частиц той или иной природы.
Поясним это на примере.
В системах, состоящих из компонента А, образующего тело кластеров Ag, и компонента В, функция последнего может отвечать одному из четырех вариантов 1) ВАg: В - заряд (электрон, позитрон) или центральная частица (ион, молекула); 2)AgBl: В – лиганд; 3)AgB
 : В – матрица; 4) AgBj: В – второй компонент тела кластера. Реализация этих вариантов различна в газовых, жидких, аморфных и кристаллических средах. Так, для варианта «ВАg» примерами являются соответственно: зародыши пара, конденсирующего на молекулярных ядрах; сольваты ионов и молекул в жидких растворах; металлические кластеры в металлсилицидных, металлфосфидных и других стеклах; субоксиды щелочных металлов. Для варианта «AgB
: В – матрица; 4) AgBj: В – второй компонент тела кластера. Реализация этих вариантов различна в газовых, жидких, аморфных и кристаллических средах. Так, для варианта «ВАg» примерами являются соответственно: зародыши пара, конденсирующего на молекулярных ядрах; сольваты ионов и молекул в жидких растворах; металлические кластеры в металлсилицидных, металлфосфидных и других стеклах; субоксиды щелочных металлов. Для варианта «AgB » примерами служат мицеллы ПАВ в жидких средах; кластеры воды в аморфных органических полимерах; кластерные кристаллы (металлы в цеолитах) и, наконец, адсорбаты кластерной дисперсности для сред, представляющих собой межфазные поверхности. Аналогично этому для разных сред легко найти случаи, отвечающие вариантам «AgBl» и «AgBj». При трех компонентах – А,В и С – возможны уже 10 вариантов из функций в построении тела кластера и его стабилизации. И почти для каждой из сред, включая межфазные поверхности, можно узнать примеры реализации этих вариантов.
» примерами служат мицеллы ПАВ в жидких средах; кластеры воды в аморфных органических полимерах; кластерные кристаллы (металлы в цеолитах) и, наконец, адсорбаты кластерной дисперсности для сред, представляющих собой межфазные поверхности. Аналогично этому для разных сред легко найти случаи, отвечающие вариантам «AgBl» и «AgBj». При трех компонентах – А,В и С – возможны уже 10 вариантов из функций в построении тела кластера и его стабилизации. И почти для каждой из сред, включая межфазные поверхности, можно узнать примеры реализации этих вариантов.2. ОБРАЗОВАНИЕ КЛАСТЕРОВ
Конкретные процессы, в которых возникают кластеры, столь же многообразны, как и типы кластеров. Однако это многообразие определяется скорее различиями в природе частиц и особенно в способах стабилизации кластеров. Отвлекаясь от таких «частностей», можно усмотреть лишь два общих пути образования кластеров — агрегация в кластер одиночных («мономерных») частиц или кластеров меньшего размера и дезагрегация до кластеров больших коллективов взаимодействующих частиц.
Самый наглядный и в то же время самый важный пример агрегативного пути образования кластеров — зарождение новой фазы. Это частный случай весьма общей категории процессов качественного изменения структуры; для всех таких процессов характерно первоначальное возникновение зародышей новой структуры в недрах старой.
Кластерообразование и последующий рост новой фазы — интересное средство «усиления», таковы фотография, декорирование поверхностей, наблюдение элементарных частиц с помощью камер Вильсона и пузырьковых камер.
К явлениям образования кластеров в фазовых переходах близки уже упоминавшиеся предпереходные явления; здесь до возникновения новой фазы дело не доходит, и кластеры остаются как бы несостоявшимися фазами. Они-то и были названы гетерофазными флюктуациями, поскольку они находятся в динамическом равновесии с материнской фазой, т. е. непрерывно возникают и распадаются.
Образование кластеров путем агрегации происходит и во многих иных процессах, не связанных с возникновением новых фаз, например при сольватации ионов в газах и жидкостях. (Так, согласно теории И. П. .Стаханова, шаровая молния состоит именно из гидратированных ионов, возникающих в воздухе при «обыкновенной» молнии.) Просто в жидкостях, особенно полярных, молекулы также легко ассоциируются в кластеры. В частности, известны различные кластерные модели строения жидкой воды. Как и в предпереходных состояниях, такие кластеры находятся в динамическом равновесии со средой; разница в том, что они не являются представителями или провозвестниками новой фазы в старой.
Все сказанное относится и к поверхностным кластерам: они могут возникать и при гетерогенном зарождении новой фазы, и просто при адсорбции, образованием новой фазы не сопровождающейся. В качестве примера приведем малоизвестный случай металлических кластеров — продуктов взаимодействия твердых поверхностей с растворами металлов (наиболее известный пример подобных растворов— серебряная вода). В объеме раствора металлические кластеры не обнаруживаются; они возникают и стабилизируются только благодаря адсорбции на поверхности. Весьма интересно, что они способны к обратимой дегидратации (вообще десольватации), что доказано по спектрам поглощения этих систем.
Образование кластеров путем дезагрегации больших коллективов частиц возможно при испарении конденсированных фаз, а также при растворении твердых веществ в жидкостях и плотных газах. Эти процессы также связаны с возникновением новых фаз, но менее плотных, чем исходная. Кластеры и в этом случае могут быть либо промежуточными формами на пути образования новой фазы, либо гетерофазными флюктуациями, характеризующими предпереходное состояние.
Дезагрегация сплошной фазы до кластеров может быть и вовсе не связана с возникновением новых фаз: существует ряд процессов «диспергирования» конденсированных фаз, включая механическое дробление, электроэрозию, ионную бомбардировку, а также воздействие активных сред. Так, окисление сажи озоном сопровождается «откалыванием» от зерен углерода кластеров из нескольких десятков атомов.
Еще один своеобразный случай «химического» диспергирования твердой фазы — образование из нее неравновесных поверхностных кластеров вследствие протекания реакции на поверхности.
Посередине между случаями образования кластеров путем агрегации и путем дезагрегации лежат процессы образования одних кластеров из других без изменения числа частиц в теле кластера. Это главным образом разные реакции стабилизации или дестабилизации кластеров. Важный пример — сольватация электрона, «инжектируемого» в жидкость или возникающего в ней. Кластеры, существующие в ассоциированных жидкостях, таких, как спирты, действуют в качестве ловушек для электрона. Захват электрона и последующая релаксация стабилизированного спиртового кластера протекают за 10-18 с.
Процессы образования кластеров могут быть классифицированы и иначе — по тому, равновесной или неравновесной является система, в которой кластеры возникают и существуют. Такое деление имеет смысл именно при рассмотрении систем в целом; оно позволяет увидеть физико-химические причины, обусловливающие возникновение кластеров в обоих этих случаях.
Образование кластеров, находящихся в равновесии с материнской средой, есть попросту условие - наибольшей устойчивости этой среды: «микрогетерогенность» плотных газов, жидкостей, жидких и твердых растворов, нестехиометрических соединений обеспечивает минимальность свободной энергии данных систем. Разумеется, это возможно благодаря взаимодействию между частицами, из которых состоит кластер, и чем такое взаимодействие сильнее, тем продолжительнее живет каждый одиночный кластер равновесной системы.
Последнее замечание требует, по меньшей мере, двух пояснений. Во-первых, оно подразумевает, что даже в равновесной системе состояние отдельного кластера нельзя считать равновесным; в динамическом равновесии со средой находится множество кластеров, каждый из которых обменивается с нею частицами, меняя размер, положение и форму. Во-вторых, образование кластера и продолжительность его жизни определяются не только «внутрикластерными» взаимодействиями частиц, но и взаимодействием кластеров с частицами среды, а в достаточно плотных средах — и друг с другом. Интересный пример: «мерцающие кластеры» — модель, предложенная для описания жидкой воды. Эти кластеры непрерывно изменяют свой размер, то увеличиваясь, то уменьшаясь вплоть до полного разрушения; среднее время их жизни оценивается в 10-10 - 10-13 с.
Несколько иначе выглядит ситуация в неравновесных системах. Здесь кластеры образуются (и исчезают) в качестве некоторых переходных форм на пути системы из одного состояния в другое, точнее, может быть, кластеры сами представляют собой этот путь эволюции системы. Равновесия множества кластеров со средой уже нет, а ход процесса на определенном этапе обусловливается именно межкластерными взаимодействиями. Капитальную важность имеют вопросы механизма и кинетики образования кластеров, но вопросы эти почти не изучены. Например, совершенно не ясен механизм агрегации мономерных частиц в кластер. Рассматривая реакции поштучного присоединения мономерных частиц к растущему кластеру и особенно соединения двух кластеров в третий, нужно найти ответ на вопрос, как формируются стабильные конфигурации: в частности, при построении кластеров из атомов видны легкие переходы 1-2-3-4-5, поскольку присоединение каждого следующего атома не требует нарушения стабильной конфигурации (треугольник переходит в тетраэдр, а тетраэдр — в тригональную бипирамиду). Однако дальнейший рост невозможен без затрат на перестройку исходной структуры. Как может происходить такая перестройка — вопрос, который пока лишь поставлен. Не исключено и то, что рост идет через неравновесные конфигурации, а равновесные возникают в результате релаксации свободного кластера.
По существу, то же самое относится и к образованию кластеров путем дезагрегации сплошной фазы: эти процессы изучены еще хуже, и механизмы их ждут своих исследователей.
3. Классификация кластерных соединений металлов
Характерным признаком кластерных соединений металлов, отличающим их от других типов соединений, в частности от полиядерных координационных соединений, служат короткие (не более 0,35 нм) расстояния металл—металл и соответственно значительные взаимодействия металл—металл, что на языке структурной химии означает наличие прямых связей металл—металл. Для кластеров низкой нуклеарности это ковалентные связи металл-металл, локализованные в пространстве между атомами, их образующими, топологически аналогичные С—С-связям в органических соединениях. По мере укрупнения кластерных соединений, в особенности в полиэдрических молекулах, характер связей металл-металл все в большей мере начинает приближаться к полностью делокализованным взаимодействиям, существующим в компактном металле. Однако наличие прямых контактов (связей) металл—металл остается неотъемлемым структурным признаком также и крупных кластерных молекул.
Приняв это положение за основу, в дальнейшем при классификации кластерных соединений металлов будем использовать принципы, уже разработанные в структурной химии для других типов соединений со связями элемент—элемент. Хорошо известно топологическое разнообразие остовов органических молекул, состоящих из цепей, циклов и каркасов из атомов углерода и их разнообразных комбинаций; структурная классификация молекул с полиэдрическими остовами наиболее развита на примере кластерных гидридов бора, карборанов и металлоборанов. Здесь в основу классификации положена геометрия выпуклых многогранников, ребра которых принимаются эквивалентными наиболее коротким контактам (связям) между кластерообразующими атомами. В качестве опорных структур рассматриваются правильные и полуправильные выпуклые многогранники, а соединения, имеющие более сложное, часто искаженное строение остова, расчленяются на более простые фрагменты и считаются той или иной комбинацией последних.
Следовательно, при классификации в каждом данном кластерном соединении прежде всего выявляется металлический остов, который затем в соответствии с его строением относят к одному из следующих структурных типов: цепь, цикл, каркас, полиэдр - или к комбинации этих простейших структурных элементов. В дальнейшем при классификации учитывается число атомов металла (нуклеарность кластера), природа металла, тип и число лигандов и т.п.
Термин «кластеры» применяют к трем типам объектов, показанных на рис.1. Преимущественно физическими методами получают металлические частицы с диаметром менее 30нм. Их обычно называют «ультрадисперсные металлические частицы» или «безлигандные металлические кластеры».
Рис.1. Типы металлсодержащих объектов, к которым применяют понятие «кластер»
Ультрадисперсные металлические частицы «безлигандные» металлические кластеры
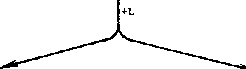
-
кластерные соединения металлов
+L
кластерные материалы
-L
Безлигандные металлические кластеры являются метастабильными, и самый «простой» и естественный путь их стабилизации - покрытие поверхности таких ультра дисперсных металлических частиц лигандами; в качестве последних могут выступать как небольшие летучие молекулы (органические соединения), так и полимеры (органические и неорганические). В результате в зависимости от типа лигандов и способа их взаимодействия получаются или молекулярные кластерные соединения металлов (рис.2), или образуются содержащие металлические кластеры полимерные соединения, обычно называемые кластерными материалами (рис.3). Кластерными называют такие соединения металлов, молекулы которых содержат окруженный лигандами остов из атомов металлов, находящихся на расстояниях, допускающих прямое взаимодействие металл-металл.
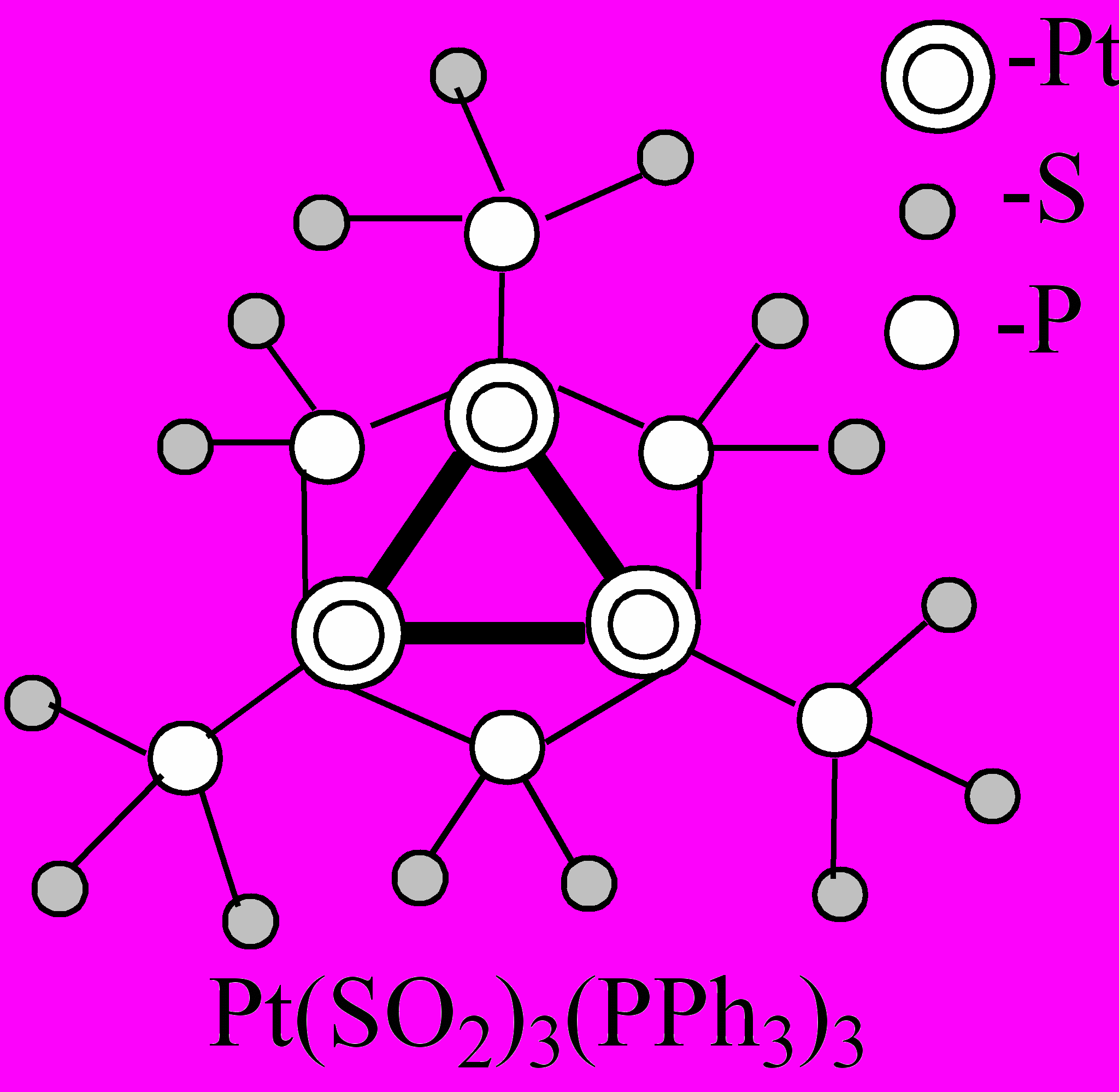

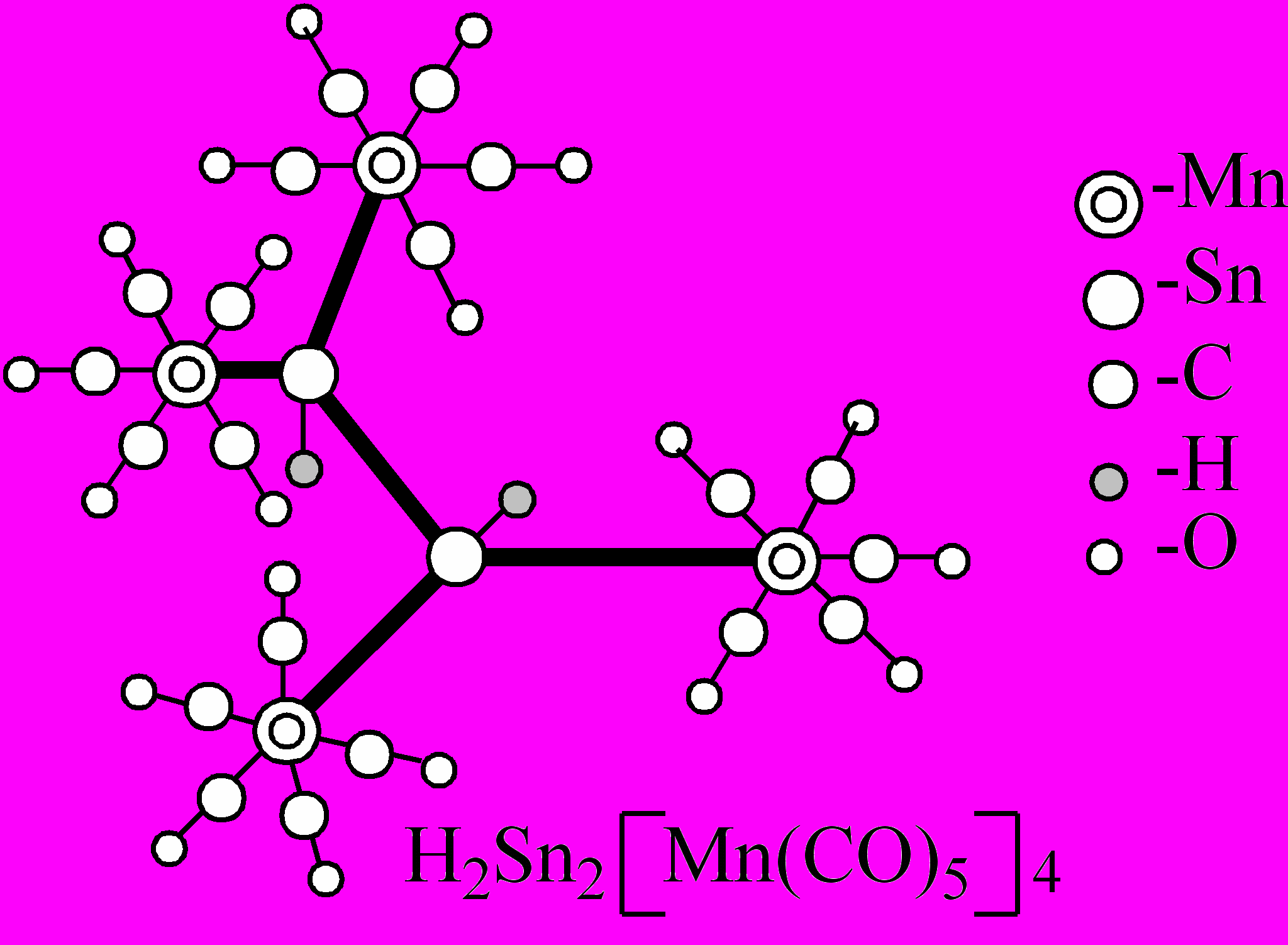
Рис. 2. Типичные примеры молекулярных кластерных соединений металлов, имеющих остов в виде металлоцепей, металлоциклов или металлополиэдров
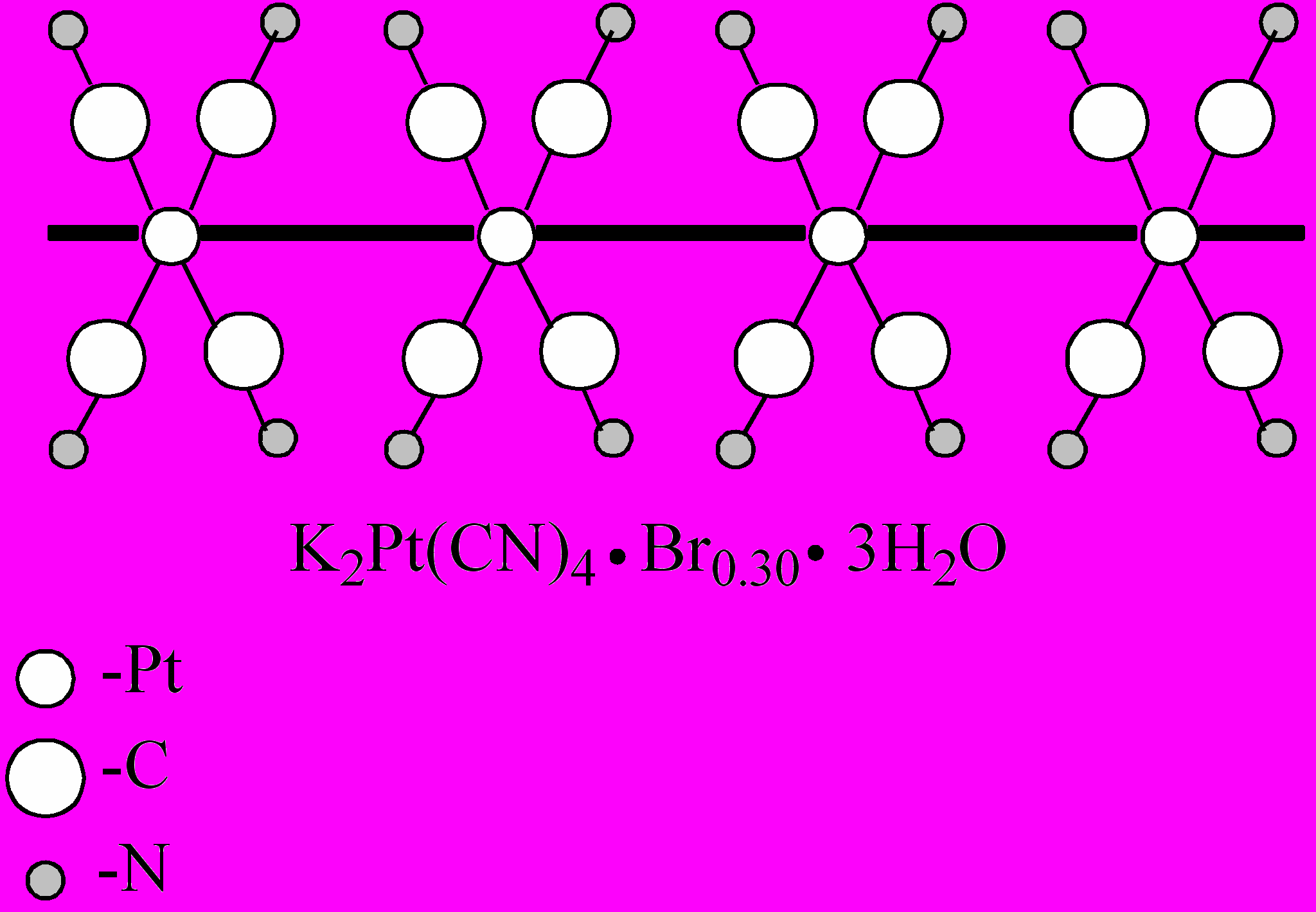
Рис. 3. Типичный пример кластерного материала, имеющего в виде основного структурообразующего элемента металлоцепь
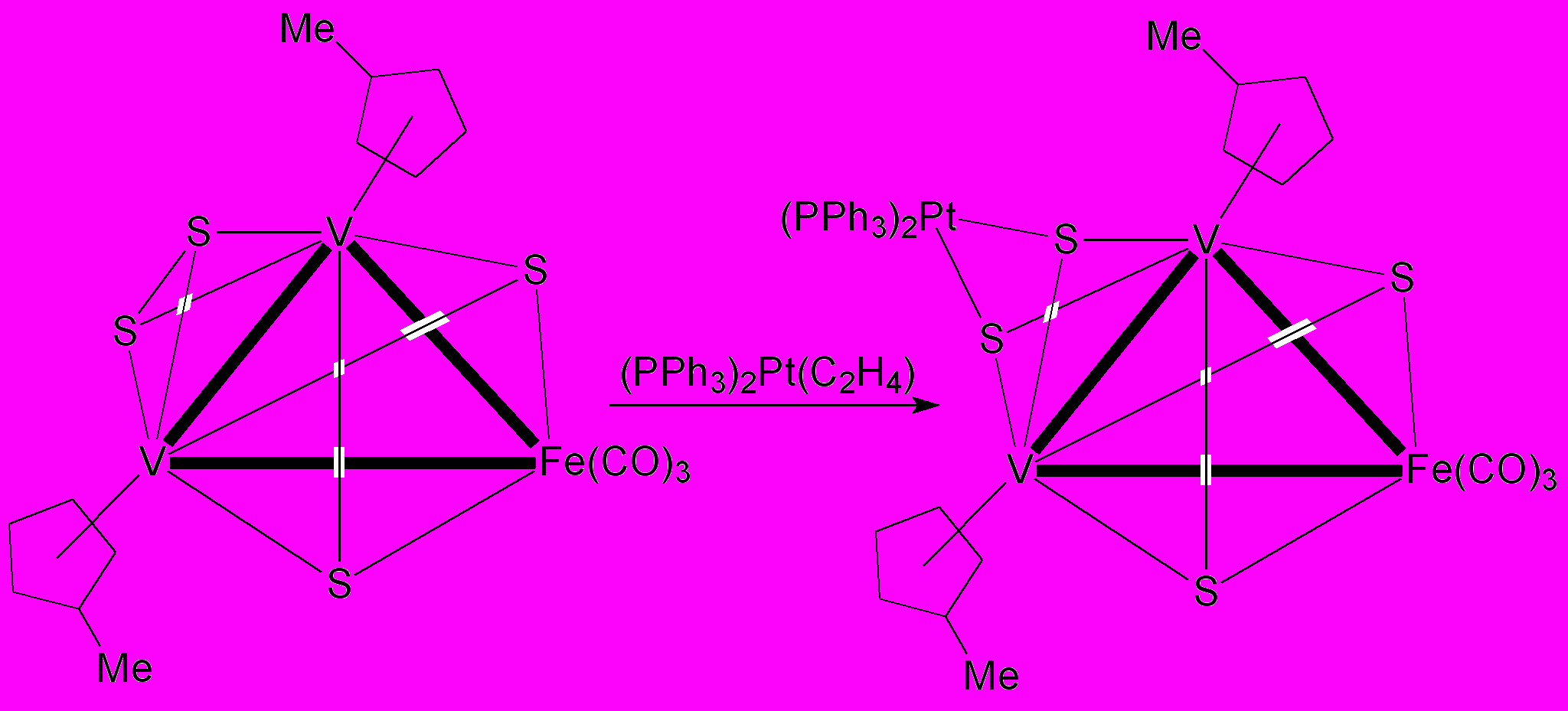
В определенных условиях возможен переход от молекулярных кластерных соединений к кластерным материалам; найдены реакции, позволяющие осуществить обратный переход от кластерных материалов к молекулярным
кластерным соединениям. Например:
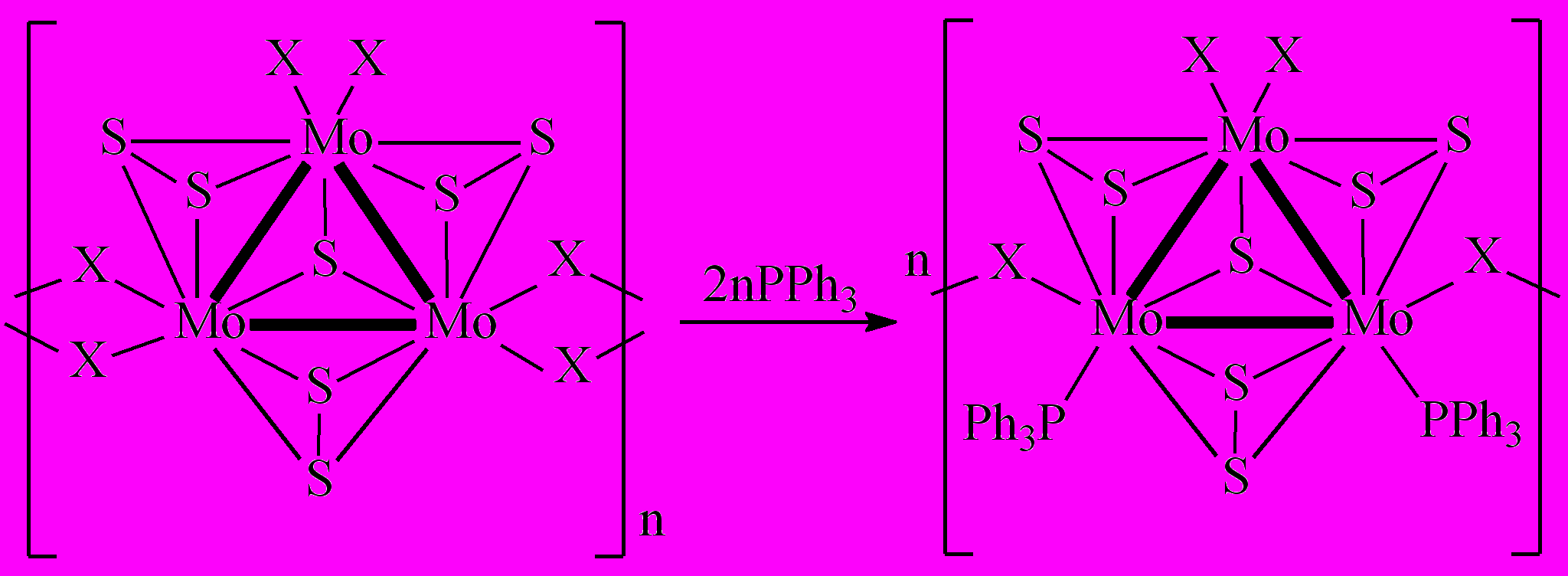
Кластерные материалы мы подробно рассматривать не будем; основное внимание будет уделено молекулярным кластерным соединениям металлов, как переходных, так и непереходных.
Для понимания роли и места молекулярных кластерных соединений металлов в ряду других объектов, исследуемых физиками и химиками, полезно рассмотреть типы и свойства так называемых ультрадисперсных или малых металлических частиц: в таком контексте кластерные соединения металлов можно рассматривать как металлические частицы, обрамленные лигандами, в той или иной степени взаимодействующими с поверхностными атомами.
В течение последних лет интенсивно разрабатывались методы приготовления, изучались структура и свойства высокодисперсных металлов (преимущественно переходных) на поверхности тех или иных носителей. Однако позднее необычные свойства ультрадисперсных металлов, возможности образования таких частиц в различных агрегатных состояниях и их стабилизация привлекли более пристальное внимание. Были освоены методы, позволяющие получать металлические частицы с размерами вплоть до десятков ангстрем; показано на отдельных примерах, что основные физические свойства таких частиц могут существенно отличаться от свойств компактных металлов и в ряде случаев являются уникальными.
Интерес к исследованию таких систем в настоящее время лавинообразно нарастает, что обусловлено (помимо фундаментальных особенностей ультрадисперсного состояния) необычным сочетанием электрических, магнитных, тепловых, сверхпроводящих, механических и других свойств этих частиц, не встречающихся у массивных образцов металлов. Предполагают, что эти свойства способны обеспечить широкое практическое применение таких материалов в ряде специальных областей новой техники.
Ультрадисперсное состояние металлов, охватывающее частицы начиная от изолированных атомов вплоть до металлических порошков, представляет особый интерес не только для физиков, но и для химиков, поскольку все процессы седиментации, образования пленок и покрытий, роста кристаллов проходят через стадии образования таких частиц (слева направо на рис.4), а при растворении металлов идут через эту область в обратном направлении — от компактного металла к мелким частицам и изолированным атомам и ионам.
В рассматриваемой области объектов при переходе от изолированных атомов к массивному металлу выделяют несколько типов металлических частиц, приведенных на рис.4.
3.1. Изолированные атомы металлов
Известно, что пары металлов, например переходных металлов, более чем на 99% состоят из отдельных атомов. При их совместной конденсации с избыточным количеством инертного газа (чаще всего аргона) на подложку, охлаждаемую до очень низких температур (ниже 70 К), происходит так называемая матричная изоляция атомов металлов; ряд металлов был получен в атомарном состоянии в матрицах инертных газов; их физические характеристики были изучены методами ЭПР, -резонансной, видимой и УФ-спектроскопии.
Процессы агрегации атомов металлов, изолированных в инертных матрицах при низких температурах, идут чрезвычайно интенсивно. Так, на примере диффузии атомов ванадия в аргоновой матрице показано, что только при температурах не выше 10-12 К и отношении концентраций V/Ar ~ 1/104 удается получить материал, в котором отсутствуют димеры V2; увеличение концентрации металла и даже небольшое повышение температуры матрицы приводят к возникновению процессов кластерирования атомов металлов; уже при 50 К эти процессы идут достаточно интенсивно. Поскольку агрегация связана с диффузией атомов металлов, то вполне естественно было ожидать, что для одних и тех же атомов скорость агрегации будет разной в различных матрицах. На примере агрегации Ag было показано, что изолированные атомы уже полностью отсутствуют при напылении серебра в матрицы инертных газов при температурах выше 22 К (для Аг), 30 (для Кг), 38 К (для Хе); спектральные характеристики указывали на то, что в этих условиях в матрицах находятся кластеры Ag2-Ag6.
| | I | II | III | IV | V | VI | VII |
| Типы металлических частиц |  | 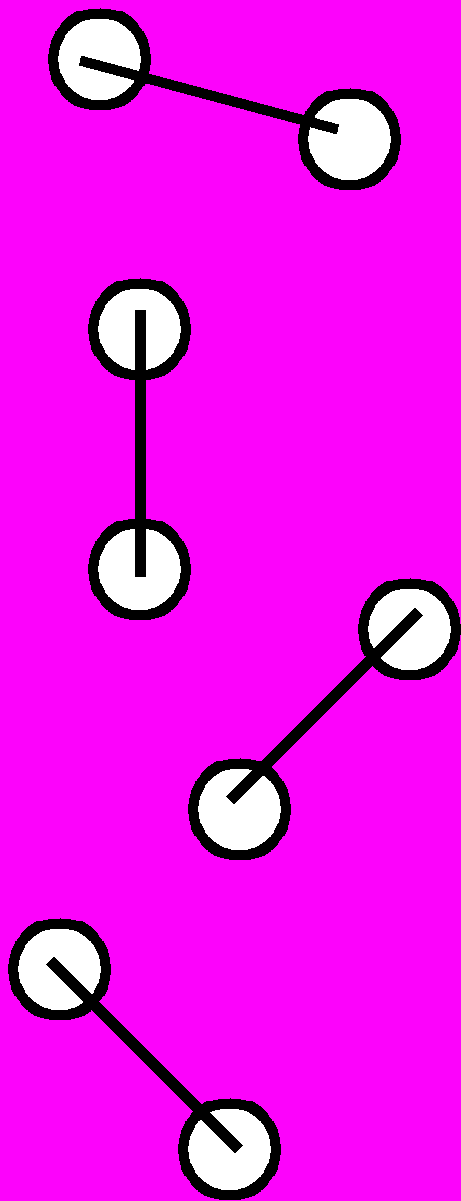 |  |  | 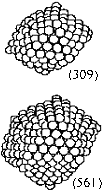 |  | 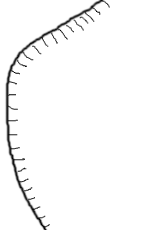 |
| Количество атомов | 1 | 2 | 3-12 | 13 – 150 | 151 – 21100 | 2.2104 - 5105 | > 106 |
| Средний диаметр, А | 2.4 - 3.4 | 4.5 – 6.0 | 5.5 – 8.0 | 8 – 20 | 20 – 100 | 100 – 300 | > 300 |
| % поверхностных атомов | 100 | 100 | 100 | 92 – 63 | 63 –15 | 15 – 2 | < 2 |
| Количество внутренних слоев в частице | 0 | 0 | 0 | 1 – 3 | 4 – 18 | > 18 | много |
| С  оединения, полученные при взаимодействии с лигандами L оединения, полученные при взаимодействии с лигандами L | MLn | LnM - MLn | MqLn | MqLn | MqLn | MqL(ад)n | |
| | | q/n<1 q/n=1 q/n>1 q>1 | q>>1 | ||||
| | | малые средние большие гигантские | | | |||
| | Моноядер-ные соединения металлов | Биядерные соединения со связями металл-металл | Кластерные соединения металлов | Коллоидные металлы, черни | Ультрадисперсные металлические частицы | ||
Рис.4. Связь между ультрадиспесными металлическими частицами и кластерными соединениями металлов | |||||||
3.2. Двухатомные металлические частицы
Как уже указывалось выше, пары металлов, как правило, состоят из атомов, хотя в них всегда присутствуют и двухатомные частицы в небольших концентрациях. Физические свойства двухатомных металлических частиц изучены достаточно подробно, преимущественно масс-спектрометрическими методами; в частности, этим методом определена зависимость соотношения М/М2 в паровой фазе от температуры и рассчитаны энергии диссоциации связи металл-металл в димерах
| М2 | V | Cr | Fe | Co | Ni | Nb | Mo | Rh | Pd | Pt |
| D0, кДж/моль | 238 | 151 | 100 | 167 | 230 | 503 | 404 | 281 | 105 | 358 |
| М2 | AuV | AuCr | AuFe | AuCo | AuNi | CuNi | MoNb | AuRh | AuPd | PtTi |
| D0, кДж/моль | 238 | 209 | 188 | 218 | 251 | 201 | 488 | 228 | 151 | 394 |
Металлические димеры М2 в конденсированной фазе впервые получены методом матричной изоляции. Найдено, что при напылении паров металлов в твердые матрицы инертных газов, изменяя условия проведения эксперимента (температуру, скорость подачи металла, соотношение металл-матрица и т.п.), можно получить димеры М2 в значительных количествах. Димерные частицы также образуются при отжиге матриц, содержащих изолированные металлические атомы. Найдены спектроскопические критерии образования связей металл—металл в димерах М2 и разработаны спектральные методы определения (в видимой и УФ-областях) концентрации димеров; таким путем были получены и идентифицированы димеры V2, Cr2, Мо2, Cu2, Ag2 и др.
3.3. Металлические частицы с числом атомов от 3 до 12 (так называемые малые кластеры или малые металлические частицы)
Получить матрицы, содержащие только частицы М3, М4, М5 и т.п., существующими методами криохимии пока не удалось. При нагревании аргоновых матриц, содержащих атомы металлов, до температур 50-140 К идет агрегация с образованием частиц с широким распределением по размерам.
Для определения оптимальной структуры кластеров, состоящих из небольшого числа взаимодействующих атомов, использовали потенциалы Леннарда-Джонса и Морзе. Находилась конфигурация с минимальной потенциальной энергией. С ростом числа атомов N быстро возрастает не только общее число конфигураций, но и число относительно устойчивых форм. Уже при N>4 поиск пространственного расположения частиц, отвечающего абсолютному минимуму энергии, становится затруднительным. На рис.4 показана последовательность оптимальных конфигураций для кластеров, содержащих до 12 атомов.
Характерная особенность строения таких частиц состоит в том, что при формировании путем последовательного присоединения одиночных атомов наиболее плотными конфигурациями с минимальной энергией, отвечающими различному числу атомов, являются правильный треугольник, тетраэдр, тригональная бипирамида, тетрагональная бипирамида и т.п. Добавляя седьмой атом, можно построить еще один тетраэдр на грани предыдущего; образующаяся неустойчивая конфигурация замыкается в пентагональную бипирамиду. Последующим присоединением «шапочных» атомов на грани семиатомного кластера можно построить различные структуры вплоть до N=12.
Для кластеров с N13 был проведен перебор возможных изомерных конфигураций; при этом задавали модельный потенциал межатомного взаимодействия типа Леннарда-Джонса или Морзе и минимизировали энергию малых металлических частиц.
Расчеты показали, что различие в энергиях «изомеров» не столь велико, чтобы при разумных значениях температур можно было отдать предпочтение тому или иному изомеру.
3.4. Частицы с числом атомов металлов от 13 до 150 (с размерами от 0,8 до 2 нм)
При числе атомов металла в частице меньше 13 реализуется только такая плотная упаковка, когда каждый атом является поверхностным. Начиная с N, равного 13, появляется возможность образования таких плотноупакованных структур, в которых внутрь полиэдра (например, икосаэдра) можно поместить атом металла так, что возникают два сорта атомов - внутренние и поверхностные; следовательно, максимальное отношение числа поверхностных атомов к внутренним равно 12. При N>150 и геометрии частицы, близкой к сферической, это отношение приближается к единице, Следовательно, рассматриваемая группа частиц характеризуется появлением внутренних атомов и первых слоев, но все еще значительным превышением числа поверхностных атомов. Атом в поверхностном слое имеет меньше соседей, чем в объеме, и все они расположены по одну сторону от него. Это нарушает равновесие и симметрию в распределении сил и масс и приводит к изменению равновесных межатомных расстояний по сравнению с их значениями в макрокристаллах, а также к сдвиговым деформациям. Поверхностные атомы имеют меньшие координационные числа (КЧ), чем внутренние, их электронная оболочка сильно поляризована, их связи направлены лишь в одну сторону —внутрь частицы. В соответствии с изложенным выше, для таких частиц становятся более устойчивыми конфигурации атомов, имеющие оси симметрии пятого порядка, как известно недопустимые для макрокристаллов. При такой конфигурации каждый из поверхностных атомов имеет по пять соседей и тем самым повышает свое КЧ, в то время как для гексагональной плотноупакованной- и гранецентрированной кубической - структур число соседей у поверхностных атомов равно только четырем. Расчеты показали, что для 13-атомного кластера икосаэдрическая структура имеет на 17% меньшую энергию, чем ГЦК-структура; последняя для данного числа атомов должна спонтанно переходить в икосаэдрическую. На рис.4 показаны икосаэдрические упаковки атомов, соответствующие минимуму энергии с N = 13 (один внутренний атом), N= 55 (два внутренних слоя) и N= 147 (три внутренних слоя).
3.5. Частицы с размерами от 2 до 10 нм
Здесь количество поверхностных и внутренних атомов сравнимо. Это наиболее интересная и наименее изученная область объектов. Именно в этой области наблюдаются основные аномалии физических свойств. Частицы таких размеров получают методом газофазной нуклеации паров металлов или стабилизацией в полимерных матрицах
3.6. Частицы с размерами от 10 до 30 нм
Это переходная область, где в Центре кластера появляется все большее число внутренних слоев, упаковка которых начинает соответствовать структуре данного компактного металла. По мере роста размеров частиц энергия упругой деформации растет пропорционально объему и в какой-то момент может превысить поверхностную энергию, ответственную за устойчивость икосаэдрических структур. В частицах возникает два типа упаковки атомов — внутренняя кристаллическая и внешняя икосаэдрическая, что неизбежно связано с возникновением внутренних пустот и упругих деформаций. Существует некоторый критический размер частиц, выше которого пентагональные структуры становятся менее стабильными, чем кристаллическая. Считают, что переход от икосаэдрической к кристаллической структуре затруднен кинетически ввиду необходимости перестройки окружения все большего числа атомов, этим объясняют сохранение пентагональных форм для относительно больших (10—30 нм) металлических частиц. Однако теоретически предельный размер кластера со структурой, имеющей устойчивую пентагональную симметрию, до сих пор не определен, так как для этого необходимо рассчитать свободную энергию огромного числа изомеров. Экспериментально наблюдали икосаэдрические частицы с диаметром 40 нм и даже больше.

Увеличение размера кластера сопровождается определенной структурной перестройкой (своеобразным фазовым переходом), в результате которой постепенно стираются различия физических свойств кластера и компактного металла. Эти различия были вызваны высоким значением отношения поверхностной энергии в кластере к объемной; они прежде всего касаются изменения теплофизических свойств кластеров, Температура плавления и температура Дебая у малых частиц ниже, чем у массивного металла. Колебания поверхностных атомов в кластере происходят с большей амплитудой и меньшей частотой, чем вибрация атомов в объеме компактного образца; это обусловливает изменение колебательного спектра и увеличение теплоемкости кластера по сравнению с массивным образцом. Расчеты показывают, что для частиц таких размеров четкая огранка, характерная для кристаллов, все еще нестабильна и имеется тенденция к образованию частиц шарообразной формы, ребра и вершины в которых округляются, а грани становятся выпуклыми.
3.7. Частицы с размерами более 30 нм
Доля поверхностных атомов от общего числа атомов в таких частицах составляет менее 0,01 и соответственно влияние поверхностной энергии невелико. Хотя такие частицы по ряду свойств все еще отличаются от компактного металла, их внутренняя структура, как правило, соответствует строению кристаллов данного металла.
4. Остовная изомерия малых металлических частиц
Определение равновесных форм малых агрегаций атомов обычно проводят путем минимизации потенциальной энергии частиц, получаемых за счет постепенного увеличения числа атомов в кластерах, В процессе минимизации энергии предполагают, что атомы металлов таких частиц имеют плотную упаковку в виде жестких или деформируемых шаров. В модели жестких шаров учитываются связи с ближайшими соседями и минимуму энергии отвечает конфигурация с наименьшим числом насыщенных поверхностных связей. Модель деформируемых шаров учитывает дальнодействующее взаимодействие атомов, описываемое потенциалами Леннарда-Джонса или Морзе, и допускает сокращение длин связей. Установлено, что по мере включения более дальнодействующих взаимодействий количество изомеров уменьшается. Так, для 11-атомной частицы расчеты с использованием модели жестких сфер дают свыше 473 только тетраэдрических конфигураций, тогда как с помощью потенциала Леннарда-Джонса получено 145 изомеров, а с использованием потенциал а Морзе — всего 23 изомера.
В ряде случаев, вопреки ожиданиям, показано, что наиболее стабильными оказываются линейные, а не компактные сферические конфигурации атомов (для N=3 и M = Ag,Au,Cu, Cd, Pd), В других расчетах на примере кластеров Ni показано, что стабильность кластеров возрастает при переходе от линейных к плоским циклическим и
| | N=3 | N=4 | N=5 | N=6 | Рис.5. Типы изомеров для гомоэлементных металлических частиц с N = 36 |
| Полиэдры | | 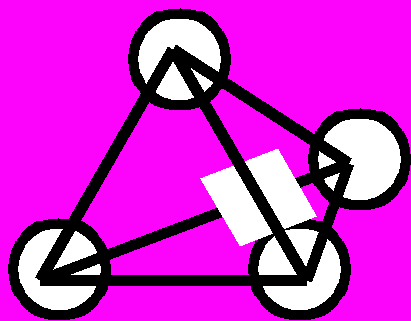 |  |  | |
| | |  |  |  | |
| Циклы | 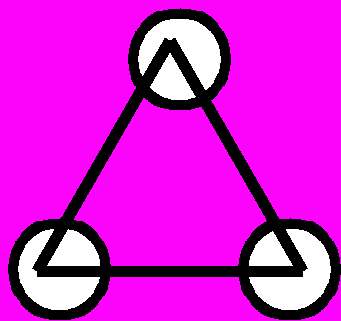 | 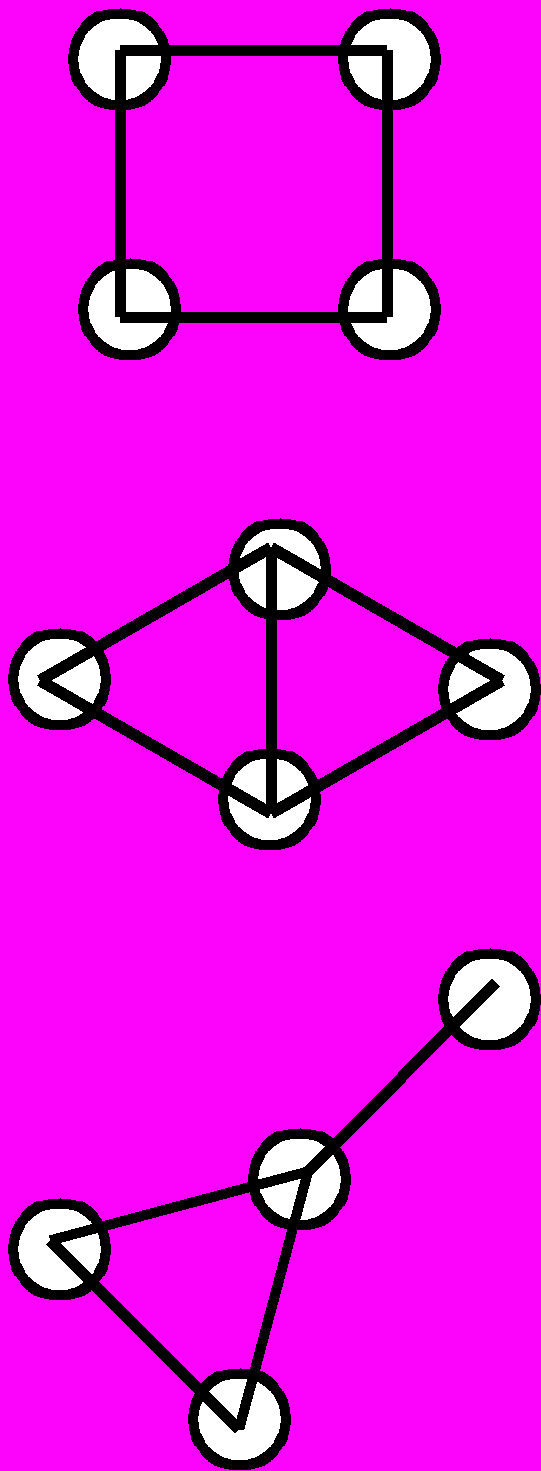 | 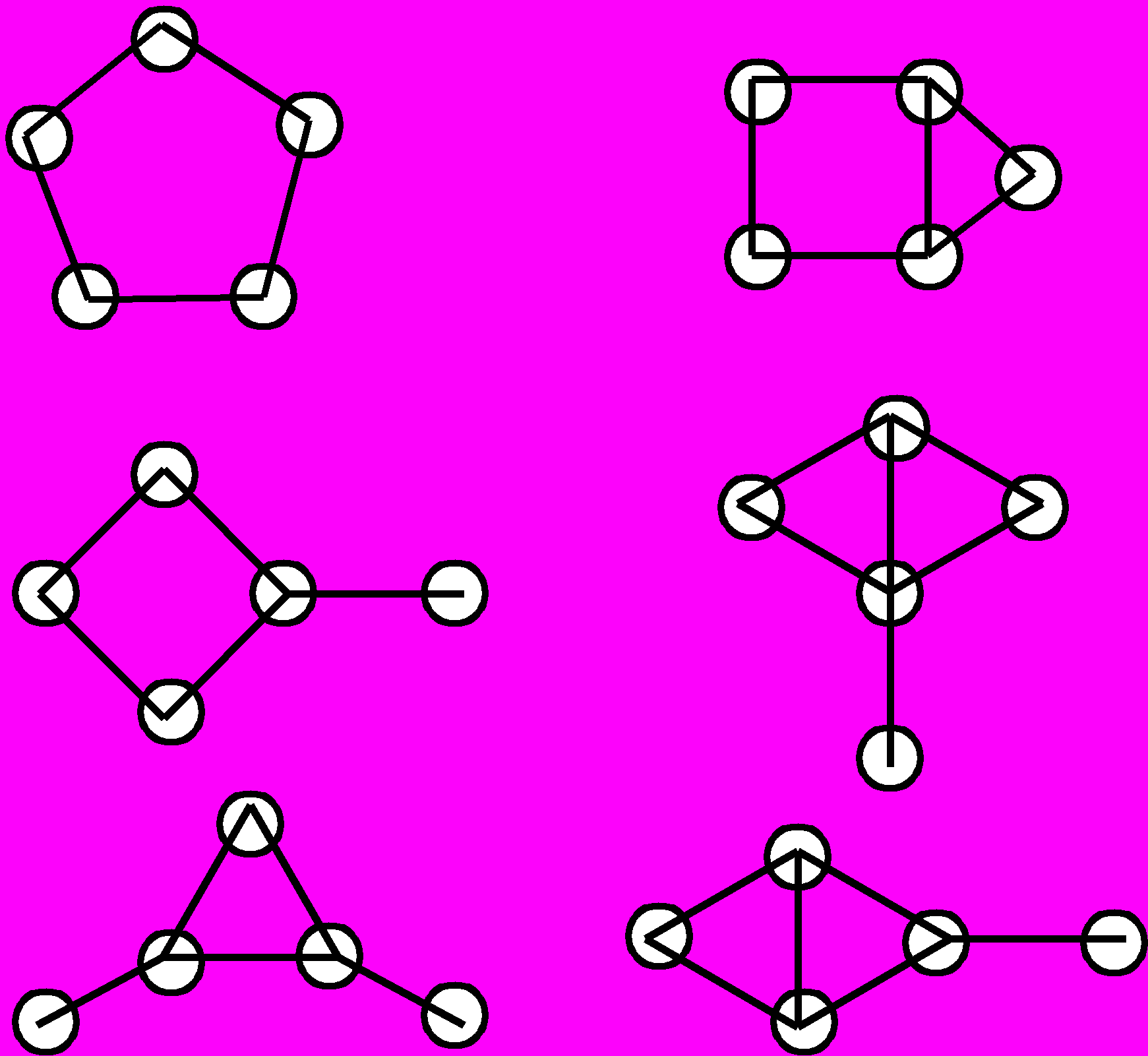 |  | |
| Цепи |  | 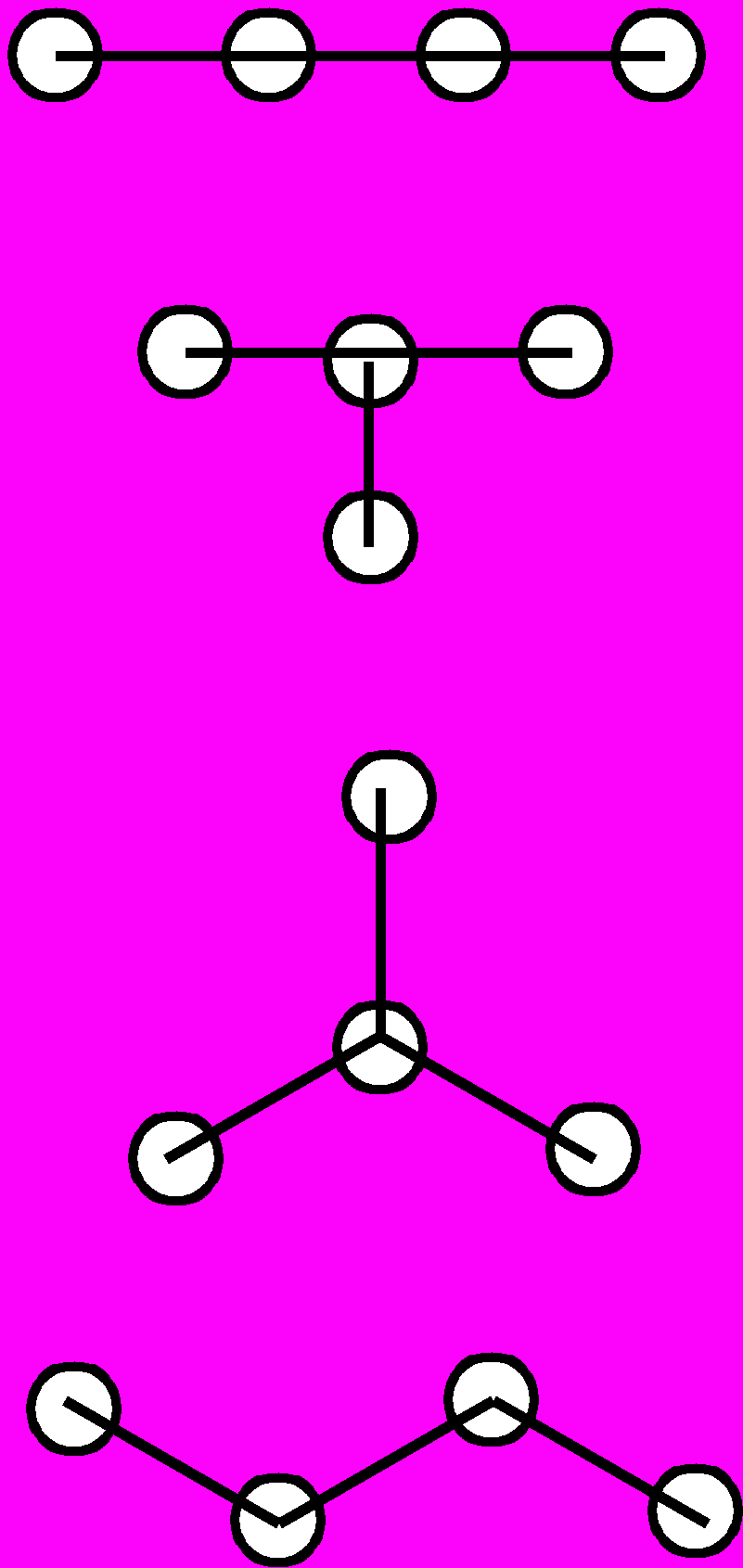 | 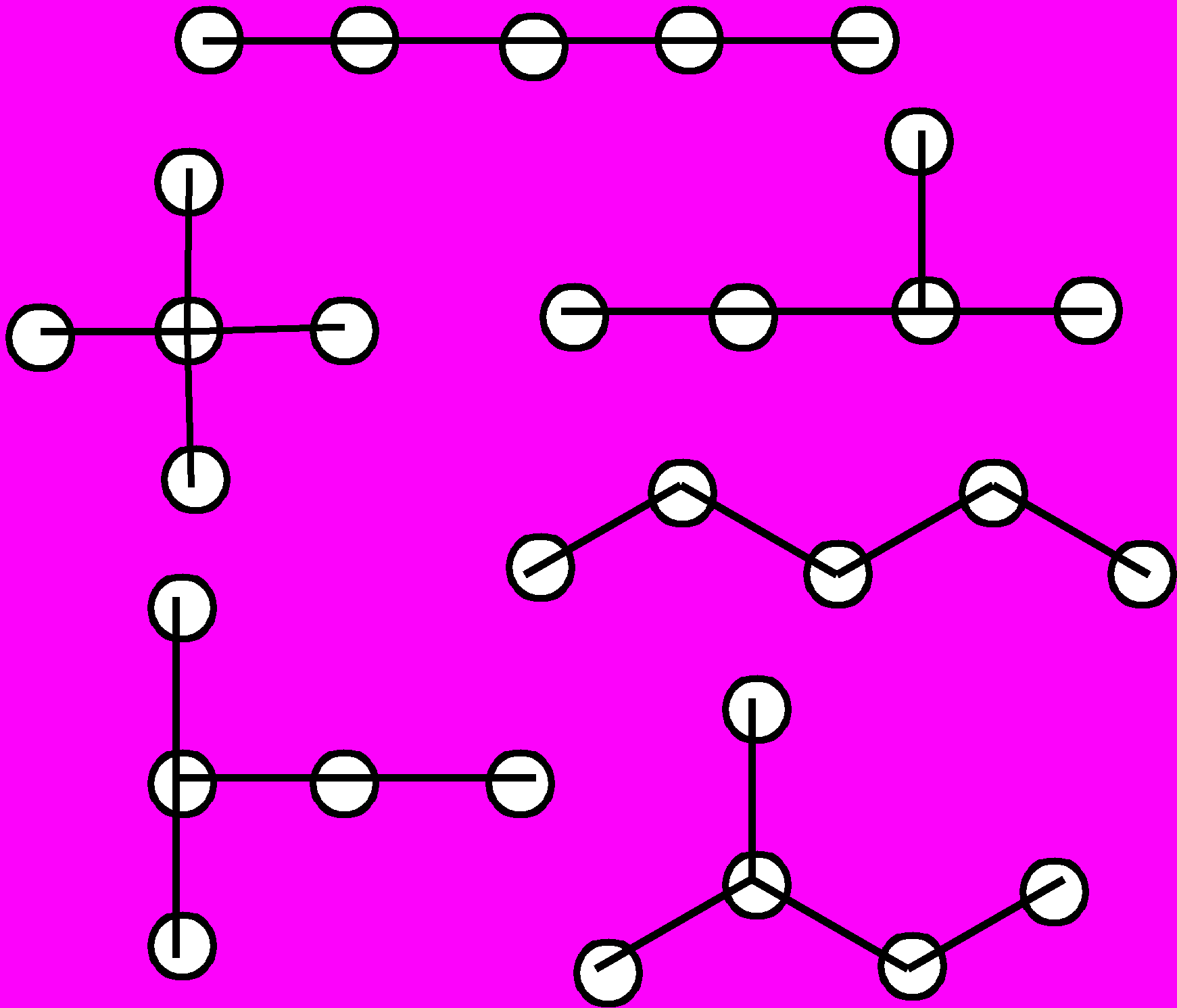 | 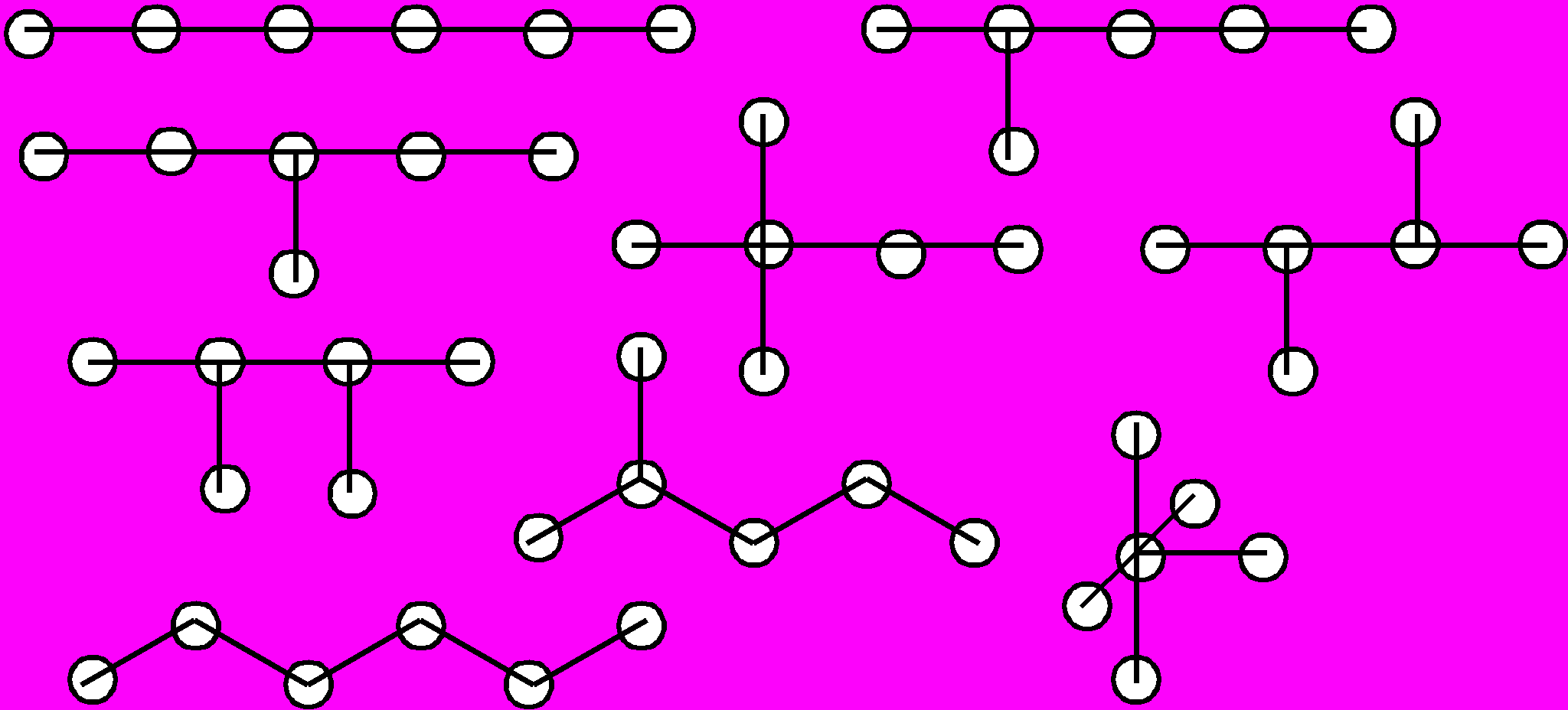 |
от последних к объемным конфигурациям атомов, В дальнейшем оказалось, что эти последовательности различны для разных металлов
На рис.5 показаны возможные изомеры для небольшого числа атомов металлов (N=36). Прежде всего необходимо отметить, что в отличие от соединений углерода, где «жесткость» четырех гибридных sp3-орбиталей диктует выбор возможных изомеров, для атомов металлов, в особенности переходных, геометрические возможности существенно шире, что приводит к значительному увеличению числа возможных изомеров при одном и том же числе атомов. Так, уже при N=3 для металлов имеют самостоятельное значение линейная и изогнутая цепочки. По существу, те же причины приводят к тому, что для металлов нет ограничений, связанных с так называемой энергией напряжения, характерной для малых углеродных циклов; в результате здесь возможны конденсированные трех- и четырехчленные циклы, спирали и т.п.. Все это приводит к существенному увеличению числа возможных изомеров для одного и того же числа атомов.
На рис.5 показаны также возможные сочетания цикл-цикл, цикл-цепь, цикл—полиэдр, цепь—полиэдр и т.п. Ясно, что с ростом числа атомов металла доля таких структур будет стремительно увеличиваться, Кроме того, появятся новые сочетания — полиэдр—полиэдр.
Таким образом, мельчайшие металлические частицы, служащие остовами для кластерных соединений металлов, имеют огромное число изомеров, кроме того, во многих случаях возможно образование энантиоморфных пар изомеров и, наконец, введение гетероатомов может увеличить число изомеров до величин, с трудом поддающихся количественной оценке.
5. Лиганды в кластерных соединениях
Изучение закономерностей расположения различных лигандов на поверхности металлического остова в кластерных соединениях приводило исследователей сначала интуитивно, а затем все более определенно к выводу о том, что процесс кластерообразования состоит в создании на поверхности металлического остова плотноупакованной оболочки из лигандов.
Значение такой оболочки, вероятно, состоит в том, чтобы, во-первых, предотвратить взаимодействие между отдельными металлическими частицами приводящее к их «слипанию» и образованию компактного металла, и во-вторых, оказывать пространственные препятствия подходу реагентов непосредственно к металлическому остову и его разрушению, что необходимо в связи с относительной «слабостью» связей металл—металл, их легкой поляризуемостью и высокой активностью.
В химии кластерных соединений обычная для координационной и металлоорганической химии классификация лигандов по числу донируемых электронов и числу занимаемых координационных мест (дентантности) сохраняет свое значение, однако появляется ряд новых аспектов.
Лиганды в кластерных соединениях могут иметь координацию вершинную, реберную (), граневую (3, n) или внутриполостную (
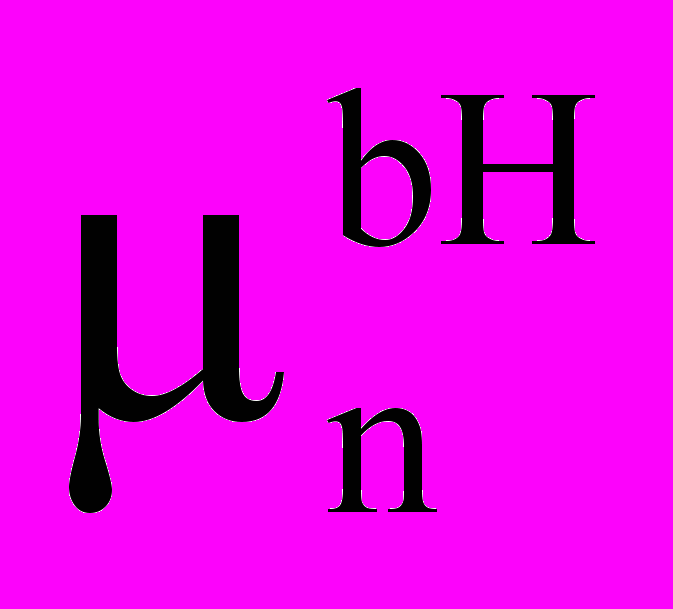 где n — число вершин, с которыми связан внутренний атом или атомы); для сложных многоатомных лигандов возможно одновременно несколько типов координации. Водород принадлежит к числу простейших лигандов, в моноядерных комплексах он может быть лишь монодентатным одноэлектронным лигандом. В кластерных соединениях водород чаще всего бывает мостиковым лигандом, соединяющим два атома металла при различных типах реберной координации или три атома металла при граневой координации. Если для водорода как лиганда электронные возможности исчерпываются единственным имеющимся у него электроном и при любых способах координации число донируемых электронов не меняется, то для других моноатомных лигандов, а также для лигандов, состоящих из нескольких атомов, наблюдается иная картина. Например, атом хлора при вершинной координации дает 1 электрон, при реберной — 3 электрона, при граневой (3) — 5 электронов на образование связи с металлами кластерного остова.
где n — число вершин, с которыми связан внутренний атом или атомы); для сложных многоатомных лигандов возможно одновременно несколько типов координации. Водород принадлежит к числу простейших лигандов, в моноядерных комплексах он может быть лишь монодентатным одноэлектронным лигандом. В кластерных соединениях водород чаще всего бывает мостиковым лигандом, соединяющим два атома металла при различных типах реберной координации или три атома металла при граневой координации. Если для водорода как лиганда электронные возможности исчерпываются единственным имеющимся у него электроном и при любых способах координации число донируемых электронов не меняется, то для других моноатомных лигандов, а также для лигандов, состоящих из нескольких атомов, наблюдается иная картина. Например, атом хлора при вершинной координации дает 1 электрон, при реберной — 3 электрона, при граневой (3) — 5 электронов на образование связи с металлами кластерного остова.

а б
Рис.6. Направленность «свободных» электронных пар у -s-(а) и 3-s-лигандов(б)
Аналогично сера при вершинной и реберной координациях дает 2 электрона, а при граневой (3) — 4 электрона. На рис.6 схематически показано, как происходит последовательное вовлечение в связывание с кластерным остовом свободных электронных пар атома серы с увеличением числа координируемых атомов металлов; все же при 3-координации, как видно из рис.6, у серы остается свободная электронная пара, направленная перпендикулярно плоскости 3-грани. По этой электронной паре может координировать еще один атом металла. Ситуация осложняется, когда лиганд состоит из нескольких атомов. Например, при реберной координации группы S2 связь S—S лежит перпендикулярно связи М—М; молекула S2 в этом случае является донором шести электронов; оставшиеся две электронные пары также способны дополнительно координировать металлические центры.
6. РАСПРОСТРАНЕННОСТЬ КЛАСТЕРНЫХ СОЕДИНЕНИЙ
Эксперименты по получению ультрадисперсных металлических частиц не накладывают каких-либо ограничений на природу диспергируемого металла; для любого металлического элемента могут быть получены тем или иным методом основные типы частиц.
Энтальпии атомизации металлических элементов различаются почти на 800 кДж/моль: от 837 кДж/моль для W до ~60 кДж/моль для Hg. Можно полагать, что поверхностная энергия ультрадисперсных частиц одного типа и размера будет также изменяться в довольно широких пределах для разных металлов параллельно изменению энтальпии атомизации. Однако среди большого разнообразия потенциальных лигандов всегда можно найти такие, энергия взаимодействия которых с данной металлической частицей приведет к образованию кластерного соединения, устойчивого настолько, чтобы его можно было выделить и охарактеризовать с использованием хорошо развитой техники работы с лабильными соединениями. Следовательно, для каждого металлического элемента периодической системы могут быть получены кластерные соединения, содержащие остов в виде цепей, циклов, каркасов или полиэдров, образованных данным элементом.
Кластерные соединения существуют для большинства металлов периодической системы. Для некоторых металлов не получены гомоэлементные кластерные соединения, но они входят в состав гетерометаллических кластерных соединений. Само по себе отсутствие какого-либо типа кластерных соединений для данного металла не может означать ничего другого, кроме того, что пока еще не были затрачены необходимые усилия для получения таких кластерных соединений.
Не существует резкой границы между кластерными соединениями металлов и цепочечными, циклическими или каркасными соединениями неметаллических элементов. Более того, имеется обширная область соединений, где в одном и том же остове сосуществуют металлические и неметаллические элементы.
7. Электронное строение кластерных соединений
(Реконструкционный анализ молекулярных орбиталей кластерных соединений металлов)
Молекулу кластерного соединения MmLn псевдосферической симметрии разбивают на следующие фрагменты: Мт — сферическое металлическое ядро - остов кластера и окружающая его «диэлектрическая» оболочка из Ln-лигандов. При ином типе фрагментации молекулу кластера делят на одинаковые одно-металлические фрагменты MLq, где q = п/т (рис.7).

Рис.7. Два способа разделения модельной октаэдрической кластерной молекулы при реконструкционном анализе МО: на шесть одинаковых фрагментов MLq (А) или на металлический остов Mm и лигандную сферу Ln (Б)
Молекулярные орбитали кластера в первом подходе получают, комбинируя «внешние» МО металлического ядра с подходящими по симметрии МО лигандной сферы, в то время как во втором случае МО кластера строят из граничных орбиталей фрагментов MLq с учетом общей симметрии кластера.
Ясно, что первый подход более универсален и лучше применим к описанию электронного строения средних и крупных кластерных соединений металлов; в то же время для кластеров с низкой нуклеарностью более пригоден второй подход.
Для понимания природы связи в безлигандных металлических кластерах важно знать, какие типы орбиталей атомов металлов и в какой мере взаимодействуют друг с другом, какова «геометрия» электронного облака такого кластера и как эти параметры меняются при увеличении размеров кластеров.
Что касается зарядов на атомах, то они в значительной степени являются условной характеристикой, имеющей смысл только в пределах одного и того же метода расчета и способа вычисления зарядов. Однако об относительном перераспределении (перетекании) заряда между различными частями одного и того же кластера на основании расчетов, вероятно, можно судить достаточно надежно.
Характерно, что все без исключения расчеты дают один и тот же результат: суммарная электронная плотность концентрируется в объеме кластера, а на поверхности в результате такого перетекания электронной плотности в объем кластера реализуется некоторый положительный заряд. Это показано на примере расчетов кластеров Li8, Li13, Ti5, Cu13, Сг6, Pd13 Pt13 и др.
В данной работе речь шла преимущественно о кластерах с N = 213, т.е. входящих в группу малых кластеров (см. рис.4). Об электронном строении более крупных кластеров известно сравнительно мало. Связано это с тем, что вычислительные трудности быстро возрастают с увеличением числа атомов в кластере. В интервале N = 102104 происходят наиболее резкие изменения всех анализируемых свойств безлигандных металлических кластеров. При N>104 все свойства асимптотически приближаются к свойствам соответствующего компактного металла.
Таким образом, из изложенного выше следуют два вывода:
1. на поверхности безлигандного металлического остова имеется некоторый избыточный положительный заряд;
2. этот дефицит электронной плотности создается за счет уменьшения заселенности s- и р-уровней.
8. НОМЕНКЛАТУРА КЛАСТЕРНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ
Принципы построения названий простейших кластерных соединений в соответствии с номенклатурой ИЮПАК видны из приводимых ниже примеров:
[Со6С(СО)14]- - анион карбидогекса--карбонил-октакарбонил-полиэдро-гексакобальтат
Ru4(СО)12(С2Рh2) - 3-дифенилацетилен-клозо-тетракис (трикарбонилрутений) (4Ru—Ru),
Os4(CO)12(Н)3I - тригидридо--иодо-цикло-тетракис(трикарбонилосмий) (4Os—Os),
Os3(CO)12 - додекакарбонил-триангуло-триосмий.
Однако в связи с большой сложностью таких названий и трудностями, возникающими при использовании тех же правил для кластеров с большей нуклеарностью, в обзорах и оригинальных публикациях большинство авторов стараются вообще не называть кластерные соединения, чаще всего используя брутто- и структурные формулы или структуры и цифровые обозначения в тексте. Но необходимость создания компактной и четкой системы названий кластерных соединений остается и по мере развития этой области становится все более актуальной в связи с появлением изомеров, развитием стереохимии кластеров, использованием их в катализе и т.п.
ЛИТЕРАТУРА
- Губин С.П. Химия кластеров.-М.: Наука, 1987 г. 426 c.
- Кипнис А.Я. Кластеры в химии.-М.: Знание, 1981 г. 95 c.
- Калинников В.Т., Ракитин Ю.В. Введение в магнетохимию.-М.: Наука, 1980 г. 383 c.
- Цукерблат Б.С., Белинский М.И. Магнетохимия и радиоспектроскопия обменных кластеров. Кишинев: Штиница, 1983 г. 124 c.
- Федин В.П., Губин С.П., Мищенко А.В., Федоров В.Е. Координационная химия. 1984 г. Т.10. 236 c.
