Хамидулина А., Погорелова Ю., Славкина К. Моу лицей №102 г. Челябинска. /2010г Химия,10Б
| Вид материала | Документы |
СодержаниеХимические свойства Химические свойства алкинов 3.Рекция замещения. |
- Алекберова А., Моу лицей №102 г. Челябинска. /2010г Химия,10Б, 56.81kb.
- Н. А. Попова моу лицей №102 г. Челябинска, 44.04kb.
- «Визитная карточка» проекта, 241.64kb.
- Шумаков Алексей Николаевич 8 моу лицей 102 имени академика М. Ф. Решетнева 25 диплом, 53.97kb.
- Биохимия – химия жизни, 216.85kb.
- Попова Н. А., учитель информатики, моу лицей №102, 102.79kb.
- Самостоятельная работа из 4 вариантов (см. Приложение 3). Структура парного урока, 102.7kb.
- М. В. Моу русско-Акташской СОШ Моу русско-Акташской сош протокол № от Миронова, 357.45kb.
- Положение о поощрениях и взысканиях обучающихся в моу «Лицей №102 имени академика, 63.54kb.
- Собрание трудового коллектива Краткая история лицея, 312.02kb.
Хамидулина А., Погорелова Ю., Славкина К. МОУ лицей № 102 г. Челябинска. /2010г Химия,10Б.
ТХС.
 Зависимость свойств … от строения.
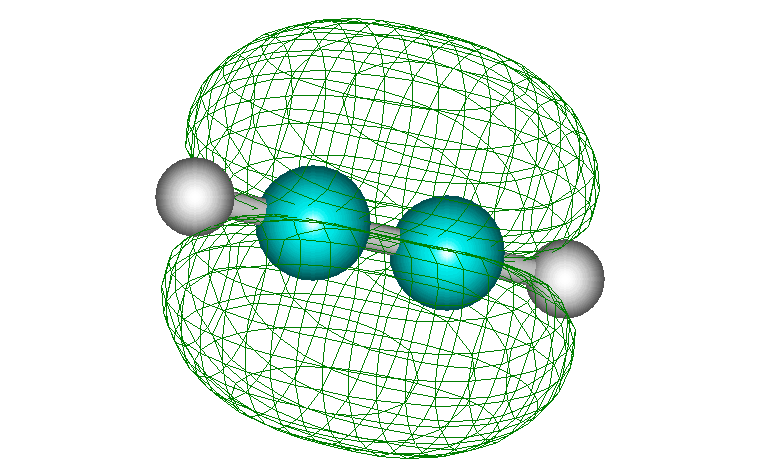
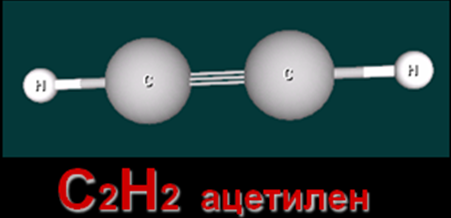
Зависимость свойств … от строения. Алкины. - непредельные углеводороды, в молекулах которых имеется одна тройная связь. В названии используется суффикс – ин. Атомы углерода, связанные тройной связью находятся в состоянии sp- гибридизации. Общая формула CnH2n-2.
Физические свойства:
Углеводороды от С2H2 до C4H6 – газы, С5 по С15 – жидкости, С16 – твёрдые вещества. В воде алкины не растворяются,хорошо растворяются в органических растворителях.
Химические свойства:
Алкины в ещё большей степени являются ненасыщенными углеводородами. Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах тройной связи. Тройная связь в алкинах комбинированная: состоит из двух двойных связей и одной одинарной. Атомы углерода , связанные тройной цепью находятся в состоянии sp- гибридизации. В гибридизации участвуют близкие по энергии атомные орбитали, не занятые электронами (вакантные) или орбитали с неспаренными электронами и неподелёнными электронными парами.




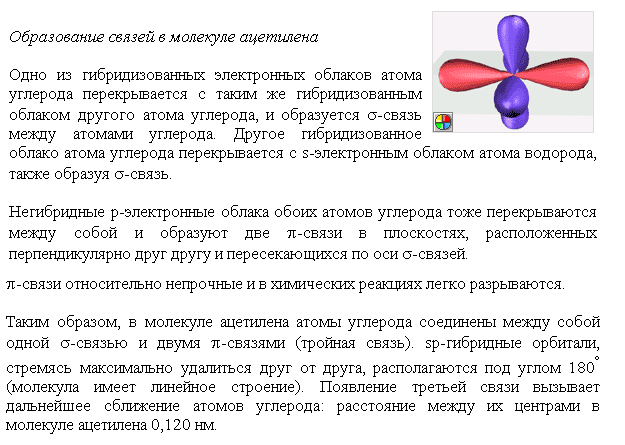
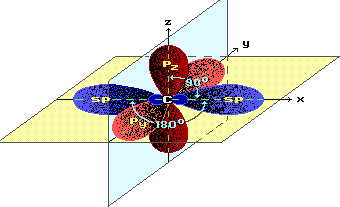
ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью. Некоторые отличия в свойствах алкинов и алканов определяются следующими факторами:
1.p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2.p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения.
3.Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах
Рекции присоединения
- Гидрирование
- Галогенирование
- Гидрогалогенирование
Реакция полимеризации
Рекции замещения
Горение
Реакции присоединения
Алкины легко вступают в такие реакции. Это объяняется тем, что природа трёх связей у алкинов неодинакова. Процесс присоединения идёт в две стадии, вначале разрывается одна двойная связь, затем другая.
Гидрирование
Г
 идрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
идрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.CH
 CH + H2 CH 2 = CH2 пропин ----- пропен
CH + H2 CH 2 = CH2 пропин ----- пропен  CH 2 = CH2 + H2 CH3–CH3 пропен ---- пропан
CH 2 = CH2 + H2 CH3–CH3 пропен ---- пропан Галогенирование
Алкины, как и алкены, обесцвечивают бромную воду. Эта реакция является на алкины качественной. Реакция галогенирования алкинов протекает медленнее, чем алкенов.
Она также идёт в две стадии:

Гидрогалогенирование
Ацетилен используется для получения винилхлорида, а из него получают поливинилхлорид.
1
 . СН
. СН  СН + НCl CH2=CHCl (винилхлорид) /HgCl2; C160-200*C/.
СН + НCl CH2=CHCl (винилхлорид) /HgCl2; C160-200*C/. 2
 . n CH2=CHCI (-CH2-CHCI-)n (поливинилхлорид) / t,p, инициатор/ Поливинилхлорид в сочетании с тонкой нейлоновой тканью служит хорошим покрытием для взлётно-посадочной вертолётной площадки. Из поливинилхлорида изготовляют вентиляционные трубопроводы на подводных лодках, изоляцию для электропроводки и некоторые строительные материалы. К другим алкинам присоединение галогеноводорода идёт по правилу Марковникова.
. n CH2=CHCI (-CH2-CHCI-)n (поливинилхлорид) / t,p, инициатор/ Поливинилхлорид в сочетании с тонкой нейлоновой тканью служит хорошим покрытием для взлётно-посадочной вертолётной площадки. Из поливинилхлорида изготовляют вентиляционные трубопроводы на подводных лодках, изоляцию для электропроводки и некоторые строительные материалы. К другим алкинам присоединение галогеноводорода идёт по правилу Марковникова.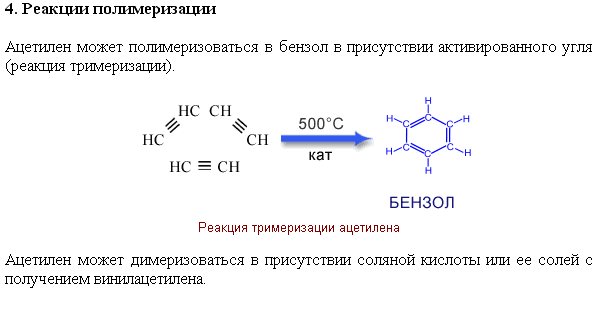 Три молекулы ацетилена при нагревании полимеризуются в циклическую молекулу ароматического углеводорода бензола. Эта рекция называется реакцией тримеризации.
Три молекулы ацетилена при нагревании полимеризуются в циклическую молекулу ароматического углеводорода бензола. Эта рекция называется реакцией тримеризации.3.Рекция замещения.
Вступая в рекцию замещения, алкины проявляют слабые кислотные свойства. Атомы водорода, стоящие у атомов углерода, связанных тройной связью, способны замещаться на металл.
С
 Н
Н  СН + Ag2O AgC
СН + Ag2O AgC  CAg + H2O /ацетиленид серебра/
CAg + H2O /ацетиленид серебра/ (аммиачный р-р оксида серебра)
Это связано с электронной плотностью связи. Электронная плотность связи С-Н смещена в сторону атома углерода, и атом водорода становится более подвижным и способен замещаться на металл:
б+ б- б-
Н – С
 С- Н
С- Н4.Горение
Алкины горят на воздухе сильно коптящим пламенем:
t
 2С2Н2 + 5О2 4СО2 + 2 Н2О + Q
2С2Н2 + 5О2 4СО2 + 2 Н2О + Q
