Биологическая фиксация азота в однолетних агроценозах лесостепной зоны Западной Сибири
| Вид материала | Автореферат |
СодержаниеАзотфиксация, формирование биомассы и потребление азота Динамика фиксации атмосферного азота в однолетних агроценозах Таблица 11 – Математические модели суточной динамики азотфиксации |
- Эволюция культуры лесостепной части западной сибири второй четверти II − середины, 312.04kb.
- Мо Нитрогеназа Azotobacter Фиксация азота Mo,, 74.74kb.
- Перспективы развития рынка кредитования физических лиц Западной Сибири, 75.44kb.
- Программа дисциплины археология западной сибири дпп. Дс. 02 Цели и задачи дисциплины, 431.44kb.
- Программа дисциплины источниковедение и историография западной сибири для аспирантов, 223.01kb.
- История Западной Сибири) реферат (от лат еfеrо «сообщаю») краткое изложение, 69.17kb.
- Ареология флоры Западной Сибири, 22.43kb.
- Ареология флоры Западной Сибири”, 34.99kb.
- Урок 46. Природные ресурсы Западной Сибири. Проблемы их освоения тип урока, 57.84kb.
- Тюменский государственный нефтегазовый университет Гуманитарный институт Лаборатория, 27.71kb.
Эффективным приемом повышения азотфиксирующей способности традиционных зернобобовых культур или основным условием формирования симбиотического аппарата у культур, впервые выращиваемых в данном регионе, является обработка семян активными штаммами клубеньковых бактерий.
По активизации азотфиксирующей деятельности отзывчивость зернобобовых культур группы гороха на инокуляцию возрастает в следующем ряду: кормовые бобы (+ 16 %) – чечевица (+ 33 %) – вика яровая (+ 50 %) – горох (+ 54 %), а уровень усвоения атмосферного азота у нетрадиционных культур возрастает в ряду: нут – фасоль – соя – люпин (рис. 6).
По влиянию биопрепаратов на зерновую продуктивность растений выявлено следующее:
- в подавляющем большинстве опытов у всех изученных культур отмечена положительная реакция на инокуляцию семян активными штаммами клубеньковых бактерий. Хотя в отдельные годы при остром дефиците влаги биопрепараты были неэффективны;
- в абсолютном выражении средний прирост урожая варьирует от 0,3-0,4 (у культур группы гороха) до 0,4-0,6 (у нетрадиционных культур) т/га (рис. 7).
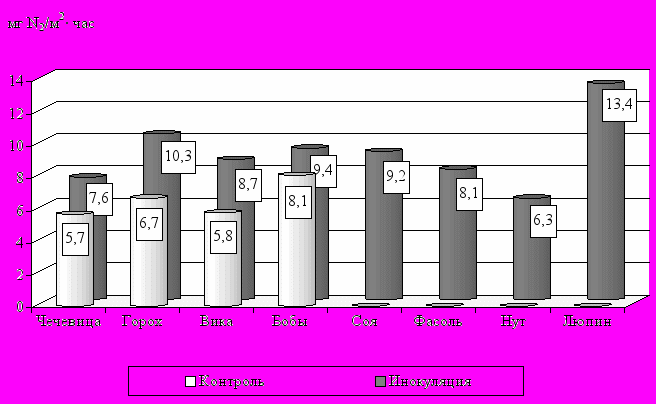
Рис.6. Влияние инокуляции на азотфиксирующую активность зернобобовых культур в период цветения (в среднем за 1996-1998 гг.)
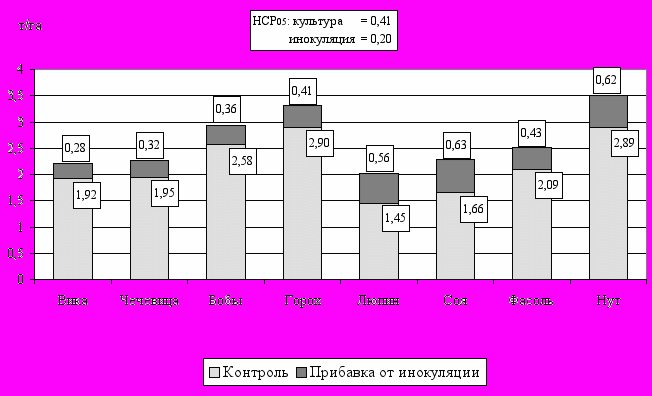
Рис. 7. Влияние ризоторфина на урожайность зернобобовых культур
(в среднем за 1996-1998 гг.)
Эффективность инокуляции зернобобовых культур в значительной степени зависит от применяемого штамма клубеньковых растений. Свидетельством тому являются результаты испытаний 5 различных штаммов на посевах сои. Установлено, что применение всех изученных штаммов обеспечивает формирование симбиотического аппарата на корнях сои.
Но, как по уровню азотфиксации, так и по влиянию на продуктивность растений препараты неравноценны. Так, во все годы исследований максимальная азотфиксирующая активность клубеньков наблюдалась при инокуляции штаммом 645б. Несколько ниже (в среднем на 13 %) были показатели у штамма 634б. И значительно уступали им 3 остальных штамма – в среднем 62-70 % к уровню усвоения азота штаммом 645б (табл. 8).
Таблица 8 – Влияние препаратов клубеньковых бактерий на азотфиксирующую
активность (фаза цветения) и продуктивность растений сои
Вариант | 1994 год | 1995 год | 1996 год | В среднем за 1994-1996 гг. | ||||
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | |
| Контроль | 5 | 260 | 6 | 272 | 4 | 245 | 5 | 259 |
| Штамм 607 д | 78 | 302 | 84 | 371 | 56 | 260 | 73 | 311 |
| Штамм 611 д | 79 | 322 | 97 | 348 | 68 | 272 | 81 | 314 |
| Штамм 626 а | 75 | 310 | 92 | 382 | 79 | 283 | 82 | 325 |
| Штамм 634 б | 97 | 364 | 124 | 464 | 84 | 315 | 102 | 381 |
| Штамм 645 б | 108 | 385 | 136 | 485 | 108 | 348 | 117 | 406 |
| НСР05 | 26,1 | 32,6 | 32,2 | 48,7 | 19,6 | 30,6 | 14,8 | 44,0 |
Примечание: 1- активность нитрогеназы, мкг азота/раст. · час;
2 – урожайность, г/м2
Аналогичная закономерность прослеживалась и при учете продуктивности растений. По влиянию на урожайность сои изученные штаммы бактерий по усредненным данным можно разделить на 2 группы, существенно отличающиеся по эффективности: штаммы 607д, 611д и 626а с эффектом 20-25% и штаммы 634б и 645б с эффектом 47-57%.
Следовательно, для формирования наиболее продуктивного симбиотического аппарата необходимо вести подбор инокулянта для конкретных условий выращивания растений. И в нашем примере для практического применения в условиях лесостепи Алтайского Приобья следует рекомендовать штамм 645б.
Учитывая существенное влияние инокуляции как на размеры усвоения атмосферного азота, так и на урожайность зернобобовых культур, нами оценено последействие бактериального удобрения в севообороте.
После культур, заражающихся почвенными бактериями группы гороха, к посеву пшеницы накапливается в среднем 40-50 кг/га нитратного азота, что вдвое выше, чем после зернового предшественника. В то же время бесклубеньковые посевы зернобобовых культур не в состоянии обеспечить последующую культуру севооборота достаточным азотным питанием и по количеству накапливаемого нитратного азота в почве приравниваются к зерновому предшественнику или даже уступают ему.
Применение ризоторфина значительно усиливает роль зернобобовых культур в севообороте (рис. 8).
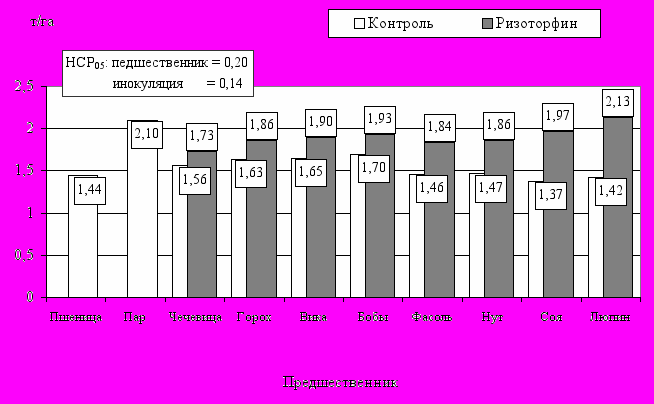
Рис. 8. Последействие инокуляции зернобобовых культур на урожайность яровой пшеницы (в среднем за 1997-1999 гг.)
Так, под воздействием инокуляции обеспеченность пшеницы нитратным азотом возрастает на 8-17 кг/га после традиционных (с минимумом у чечевицы и максимумом у кормовых бобов), и на 34-45 кг/га – после новых для региона культур (с минимумом у фасоли и максимумом у люпина узколистного).
Улучшение условий азотного питания приводит к существенному росту урожайности пшеницы. Показано, что действие зернобобовых культур, заражающихся почвенными бактериями, по сравнению с зерновым предшественником, составляет 0,12-0,26 т/га, с максимумом у кормовых бобов. Последействие инокуляции в этом случае составляет 0,17-0,25 т/га. Эффект последействия бактериального удобрения, внесенного под нетрадиционные зернобобовые культуры, значительно выше и составляет, в зависимости от культуры, 0,38-0,71 т/га. При этом максимальное последействие ризоторфина отмечено при инокуляции сои и люпина.
Таким образом, при использовании биопрепаратов на основе клубеньковых бактерий роль зернобобовых культур в севообороте существенно усиливается. При небольших затратах инокуляция обеспечивает существенный прирост урожая не только зернобобовой, но и следующей за ней зерновой культуры. Суммарный эффект ризоторфина с учетом действия и последействия составляет в среднем 0,5-0,6 т/га зерна при выращивании традиционных и 0,8-1,2 т/га – при возделывании новых для региона зернобобовых культур.
Азотфиксация, формирование биомассы и потребление азота
однолетними бобово-злаковыми смесями
Особенности фиксации азота в смешанных посевах бобовых и злаковых культур представляют как научный, так и практический интерес.
В условиях Сибири подобных исследований проведено крайне мало, и, главным образом, с многолетними травами (Демарчук и др., 1993; Данилов, 1996). Поэтому целью нашей работы было изучение особенностей усвоения биологического азота наиболее распространенной в практике горохоовсяной смесью при инокуляции препаратами ассоциативных и симбиотических бактерий.
В результате проведенных исследований установлено положительное влияние препаратов азотфиксирующих бактерий на уровень азотфиксации в ризосфере овса, формирование симбиотического аппарата и его активность у гороха. Показано, что азотфиксирующая активность овса возрастает при инокуляции всеми изученными препаратами, но максимальный и стабильный по годам исследований эффект (53-97%) наблюдался при использовании ризоэнтерина.
Аналогичные результаты получены в другом опыте, где при инокуляции овса азотфиксирующая активность возросла на 45 % в одновидовом посеве и на 55 % в смеси с горохом (рис. 9).
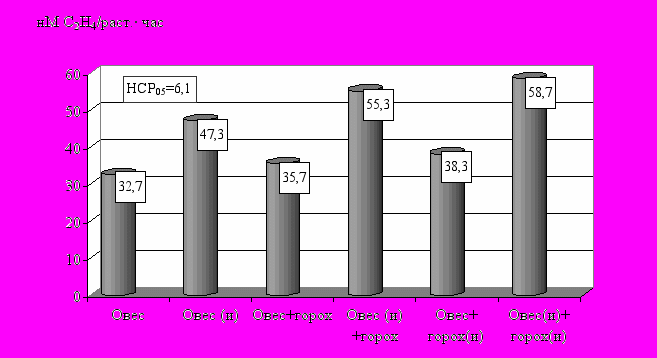
Рис. 9. Влияние биопрепаратов на активность нитрогеназы в ризосфере овса (цветение) в одновидовом и смешанном посеве (в среднем за 1994-1996 гг.)
Следовательно, растения гороха усиливает действие биопрепарата на уровень азотфиксации овса.
Анализ показателей, характеризующих симбиоз гороха с клубеньковыми бактериями, показывает, что при инокуляции семян культуры число клубеньков возрастает в среднем на 62 %, а их сырая масса – на 85 % при несущественных изменениях их размеров. В присутствии растений овса число клубеньков на корнях гороха не меняется, но увеличивается их масса на одном растении на 26-39 % за счет роста средней массы 1 клубенька на 23-35 % (не инокулированный овес) и на 41-59 % (инокулированный овес) (табл. 9).
Таблица 9 – Влияние инокуляции на симбиотический аппарат гороха в одновидовом и смешанном посеве (в среднем за 1994-1996 гг.)
| Вариант | Число клубень-ков, шт./раст. | Масса клубень-ков, мг/раст. | Средняя масса 1 клубенька, мг | Азотфиксирующая активность, мкг N2/час | |
| на 1 растение | на 1 г клубеньков | ||||
| Горох | 11,8 | 77,0 | 6,42 | 29,1 | 383 |
| Горох (и) | 19,1 | 142,2 | 7,34 | 47,2 | 339 |
| Овес + горох | 12,2 | 97,6 | 7,92 | 31,8 | 337 |
| Овес (и) + горох | 11,2 | 102,4 | 9,06 | 34,6 | 344 |
| Овес +горох (и) | 18,4 | 178,8 | 9,89 | 53,0 | 298 |
| Овес (и) + горох (и) | 17,2 | 198,3 | 11,65 | 54,3 | 277 |
| НСР05 | 3,15 | 23,08 | 1,50 | 7,16 | 50,8 |
Инокуляция гороха ризоторфином в смешанном посеве также увеличивает размеры клубеньков на 25-28 %. А при двойной инокуляции отмечено положительное взаимодействие клубеньковых бактерий и корневых диазотрофов по влиянию на размеры клубеньков. Азотфиксирующая активность растений гороха возрастает при внесении ризоторфина как в одновидовом, так и в смешанном посеве на 57-67 %.
Во все годы исследований отмечалось положительное влияние препаратов корневых диазотрофов на урожайность биомассы горохоовсяной смеси, и эффекты инокуляции овса в среднем за три года варьировали от 14 до 23 % в зависимости от применяемого препарата. Биомасса овса возрастала на 23-36 %, а гороха – на 4-14 % в зависимости от условий года, при максимальном эффекте от ризоэнтерина.
При сравнении одновидовых и смешанных посевов установлено, что в чистом посеве урожайность овса в среднем на 24 % выше, чем гороха. Смешанный посев по продуктивности превосходит посев овса в чистом виде на 30 %, а гороха – на 70 % (табл. 10). Инокуляция овса или гороха соответствующим биопрепаратом обеспечивает рост биомассы в среднем на 13 %, а одновременное применение обоих препаратов – на 26 %, то взаимодействие между ассоциативными и симбиотическими азотфиксирующими бактериями не обнаружено.
Таблица 10 – Влияние инокуляции на урожай биомассы (фаза цветения) и потребление азота растениями овса и гороха в чистом и смешанном посеве
(в среднем за 1994-1996 гг.)
| Вариант | Сухая биомасса, кг/м2 | Содержание азота, % | Вынос азота, г/м2 | ||||
| овес | горох | овес + горох | овес | горох | овес | горох | |
| Овес | 0,30 | - | - | 2,09 | - | 6,26 | - |
| Овес (и) | 0,37 | - | - | 2,17 | - | 8,11 | - |
| Горох | - | 0,23 | - | - | 3,35 | - | 7,64 |
| Горох (и) | - | 0,28 | - | - | 3,57 | - | 10,04 |
| Овес + горох | 0,21 | 0,18 | 0,39 | 2,13 | 3,33 | 4,56 | 6,00 |
| Овес (и) + горох | 0,25 | 0,19 | 0,44 | 2,22 | 3,41 | 5,50 | 6,62 |
| Овес + горох (и) | 0,23 | 0,21 | 0,44 | 2,27 | 3,47 | 5,24 | 7,20 |
| Овес (и) + горох (и) | 0,26 | 0,23 | 0,49 | 2,27 | 3,50 | 5,83 | 8,06 |
| НСР05 | 0,024 | 0,032 | 0,029 | 0,099 | 0,083 | 0,53 | 1,23 |
Рассматривая вопрос о взаимовлиянии компонентов смеси на содержание азота в биомассе, следует сказать, что существенное повышение концентрации азота в растениях овса отмечено лишь при совместном действии гороха и препаратов азотфиксирующих бактерий. Содержание азота в растениях гороха возрастает при инокуляции культуры как в одновидовом посеве (+ 0,22 %), так и в смеси с овсом (+ 0,24 %). Действие овса на этот показатель не прослеживается.
Вынос азота овсом (в расчете на одно растение) в чистом и смешанном посевах существенно не различался и составлял в среднем 17,0 и 18,9 мг соответственно (рис. 10). В то же время вынос азота горохом в присутствии овса был на 19,4 % выше, чем в чистых посевах. Это свидетельствует о том, что компоненты бобово-злаковой смеси взаимно стимулируют друг друга.
Основные изменения в выносе азота горохоовсяной смесью при инокуляции связаны с ростом урожайности культур. Так, при внесении ризоторфина 70 % дополнительного выноса элемента связано с нарастанием биомассы гороха и овса. При инокуляции только зерновой культуры эта цифра возрастает до 76 %, а с применением двух препаратов – достигает 78,5 %.
Потребление азота (мг/растение) в значительной степени определяется азотфиксирующей активностью бактерий в ризосфере овса (r = 0,82±0,30) и клубеньках гороха (r = 0,80±0,32).
Таким образом, можно заключить, что смешанный посев овса и гороха положительно реагирует на инокуляцию семян соответствующими препаратами азотфиксирующих бактерий. При этом наблюдается положительное взаимодействие компонентов по азотфиксирующей активности и усвоению азота растениями. Основные изменения в выносе азота горохоовсяной смесью при инокуляции овса связаны с ростом урожайности этой культуры и повышением концентрации элемента в горохе.
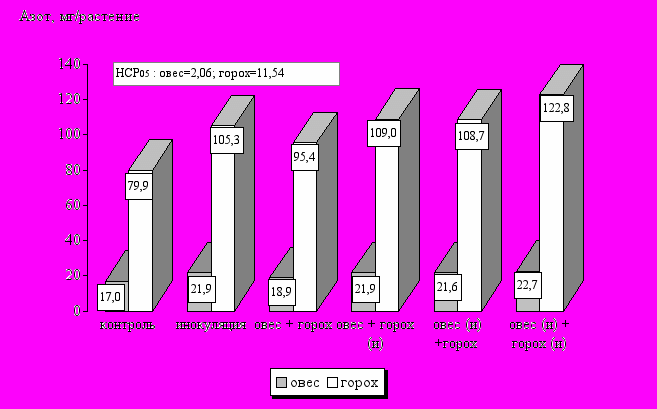
Рис. 10. Влияние инокуляции на содержание азота в растениях овса и гороха (фаза цветения, в среднем за 1994-1996 г.г.)
При внесении ризоторфина вынос азота увеличивается, главным образом, за счет нарастания биомассы гороха и овса. А при двойной инокуляции доли факторов в изменении выноса азота посевом располагаются в следующем порядке (по мере убывания): прирост биомассы гороха (40 %) – прирост биомассы овса (32 %) – повышение концентрации элемента в горохе (22 %) - повышение концентрации элемента в овсе (6 %).
Динамика фиксации атмосферного азота в однолетних агроценозах
Известно, что показатели биологической фиксации атмосферного азота характеризуются большой вариабельностью. При этом многие исследователи отмечают суточную ритмичность азотфиксации, которая обусловлена, главным образом, динамикой поступления в корни растений продуктов фотосинтеза. Например, изучение суточной динамики фиксации азота у различных бобовых культур: гороха (Алисова, Чундерова, 1979), сои и люцерны (Садыков и др., 1982; Садыков, 1989), люпина (Herridge, 1989) – показало, что в большинстве случаев максимум активности клубеньковых бактерий приходится на середину или вторую половину дня, а минимум – на утренние часы.
Аналогичные результаты получены по суточной динамике ассоциативной азотфиксации в ризосфере зерновых культур (Садыков и др., 1982; Косинова, Родынюк, 1985; Умаров и др., 1985).
Однако, конкретные условия местообитания растений могут оказать существенное влияние на суточный ход фотосинтеза, а следовательно, и фиксации азота. В связи с этим нами проведено изучение суточной динамики азотфиксирующей активности в ризосфере зерновых и клубеньках зернобобовых культур в условиях лесостепной зоны.
Экспериментальные данные показывают, что нитрогеназная активность клубеньковых бактерий в течение суток существенно меняется. Так у гороха максимальные и минимальные значения различаются в 5-8 раз, особенно в период бутонизации растений (рис.11).
Независимо от фазы развития растений самая высокая азотфиксирующая активность обнаруживается в 18-19 часов, а самая низкая – в 4-5 часов утра. Но в отличие от ассоциативной азотфиксации, максимальное замедление процесса в клубеньках гороха наступает несколько позднее: в 21-24 часа.
Интенсивность связывания атмосферного азота растениями сои, в отличие от гороха, возрастает от бутонизации к цветению и характеризуется более высокими показателями.
Полученные данные в целом согласуются с результатами других исследователей. В частности, время минимальной и максимальной интенсивности связывания атмосферного азота по гороху совпадает с данными С.М. Алисовой и А.И. Чундеровой (1979), а по сое – с результатами исследований Б.Ф. Садыкова (1989), хотя имеются и некоторые различия. Так, в наших исследованиях по обеим культурам амплитуда колебаний нитрогеназной активности клубеньков примерно в 2 раза выше, чем у упомянутых авторов, и примерно на час раньше наступают периоды ускорения и замедления процесса азотфиксации
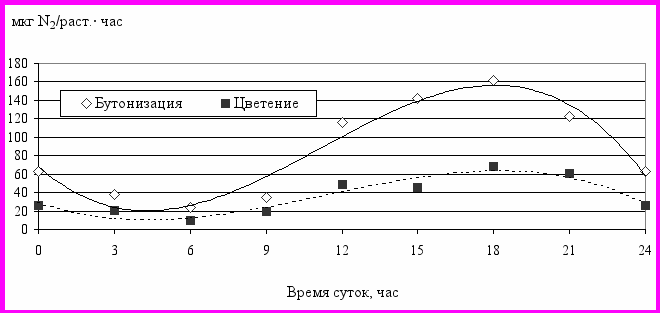
Рис. 11. Суточная динамика азотфиксации в клубеньках гороха
(в среднем за 1994-1996 гг.)
Измерения нитрогеназной активности в ризосфере яровой пшеницы показали значительные колебания ее величины в течение суток: от 7 до 58 нМ С2Н4 / раст. · час во время кущения и от 15 до 96 нМ С2Н4 / раст. · час - в фазу цветения. То есть максимальные и минимальные значения различались в 6-8 раз (рис. 12).
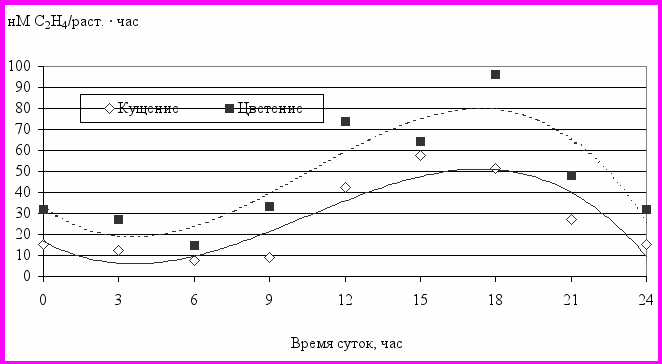
Рис. 12. Суточная динамика азотфиксации в ризосфере пшеницы
(в среднем за 1994-1996 гг.)
Самые низкие показатели азотфиксирующей активности, как в фазу кущения, так и в фазу цветения были отмечены в 6 часов утра. Затем идет нарастание скорости процесса, достигая максимума в 15 (кущение) или в 18 (цветение) часов.
В ризосфере ячменя в целом отмечен аналогичный ритм суточной активности фиксации азота: минимальные показатели в утренние часы и максимальные – между 15 и 18 часами. В отличие от пшеницы, у ячменя в меньшей степени выражены различия азотфиксирующей активности по фазам развития. Особенностью этой культуры является также более раннее начало нарастания активности процесса в утренние часы.
Суточный ход азотфиксации у всех исследованных культур хорошо описывается математически с помощью полинома 3 степени. В частности, зависимость показателя азотфиксирующей активности в клубеньках зернобобовых и ризосфере зерновых культур, выраженного соответственно в мкг N2/раст. · час (y1) и нМ С2Н4/раст. · час (y2) от времени суток (х) описывается математическими моделями, представленными в таблице 11.
Высокие значения коэффициентов детерминации (0,79-0,97), показывают, что вероятность того, что корреляция между рассматриваемыми показателями случайна, составляет менее 1,0 %.
Таблица 11 – Математические модели суточной динамики азотфиксации
в однолетних агроценозах
|
Разработанные математические модели могут быть использованы для определения коэффициентов пересчета фактических результатов измерений в среднесуточные показатели независимо от времени отбора проб.
Как ассоциативным, так и симбиотическим азотфиксаторам свойственна различная активность фиксации азота в течение вегетационного периода.
У зернобобовых культур формирование симбиотического аппарата начинается на 10-15 день после появления всходов. Затем идет постепенное нарастание числа и массы клубеньков, продолжающееся до фазы цветения, после которой происходит довольно быстрое их отмирание (рис. 13а). Отличительной особенностью симбиоза сои является более растянутый период старения клубеньков, что связано с особенностями роста этой культуры.
Активность нитрогеназы клубеньковых бактерий гороха имеет в целом схожую сезонную динамику, но максимальные значения показателя приходятся на фазу бутонизации (рис. 13б). А в период от бутонизации до цветения, несмотря на продолжающийся прирост массы клубеньков, их удельная азотфиксирующая активность уже идет на убыль. По-видимому, это связано со снижением обеспеченности клубеньковых бактерий энергетическим материалом из-за перераспределения продуктов фотосинтеза в пользу генеративных органов растения. При этом установлены существенные различия между изучаемыми культурами. Так, если у гороха активность клубеньков снижается в среднем в 2 раза, то у сои только на 42 %. Это приводит к тому, что азотфиксирующая продуктивность в расчете на растение у гороха к цветению уже падает, а у сои в этот период наблюдаются максимальные значения показателя (рис. 13в).
Наблюдения за активностью корневых диазотрофов в течение вегетационного периода показали, что у пшеницы и ячменя в целом схожая вегетационная динамика процесса: фиксация азота возрастает в вегетативный период развития, а после цветения резко снижается (рис. 14).
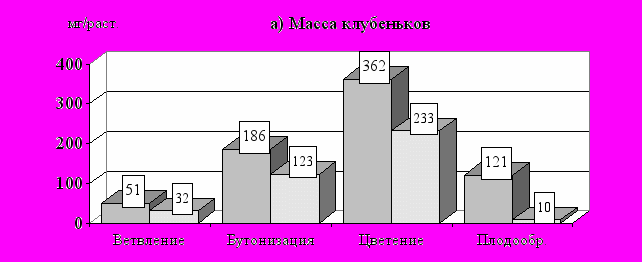
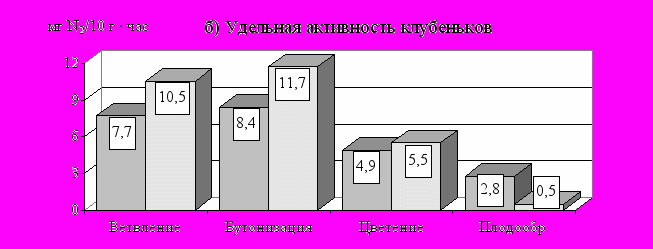
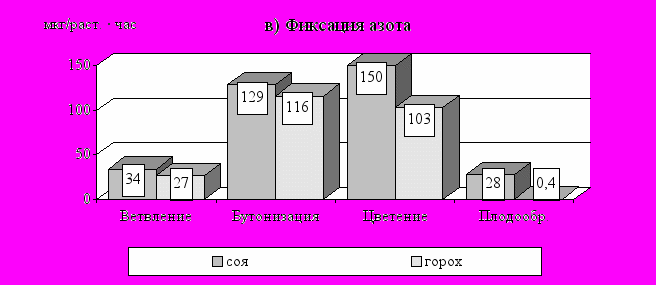
Рис. 13. Сезонная динамика характеристик симбиоза сои и гороха с клубеньковыми бактериями (в среднем за1994-1996 ггг)
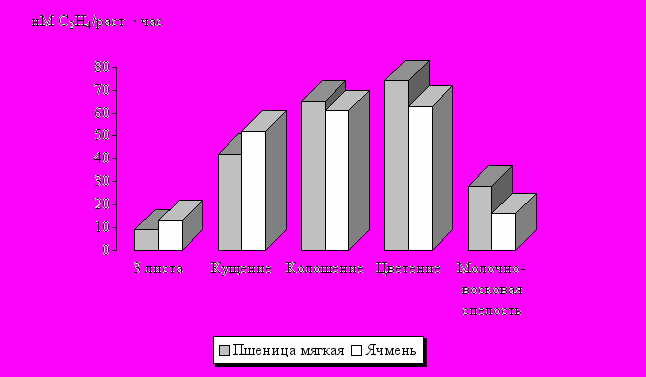
Рис. 14. Сезонная динамика азотфиксирующей активности
в ризосфере зерновых культур (в среднем за 1994-1996 гг.)
Тем не менее, биологические особенности ячменя вносят некоторые коррективы в динамику процесса. Так, по сравнению с пшеницей, отмечено более высокая скорость нарастания интенсивности связывания атмосферного азота в начале вегетации и более резкое снижение активности азотфиксирующих бактерий после цветения.
Таким образом, несмотря на существенные различия в биологии изучаемых культур, в динамике биологического связывания атмосферного азота существуют общие закономерности, обусловленные сходством механизмов процесса и требований к внешним условиям у различных групп азотфиксаторов. Таким образом, нитрогеназная активность как клубеньковых, так и ризосферных бактерий в течение суток характеризуется ярко выраженной ритмичностью. Независимо от выращиваемой культуры и фазы ее развития максимум азотфиксации наблюдается в 15-18 часов, а минимум – в 4-6 часов утра.
Для получения среднесуточных показателей активности нитрогеназы измерения необходимо проводить в 10-11 часов у зерновых, и в 11-12 часов – у зернобобовых культур.
