Тематические планы лекций, практических занятий, экзаменационные вопросы, примеры тестов тематические планы лекций по общей химии на 1 семестр ( 2-х часовые) Тематические планы лекций по биоорганической химии на
| Вид материала | Экзаменационные вопросы |
- Тематические планы лекций и практических занятий, экзаменационные вопросы, примеры, 902.02kb.
- Тематические планы лекций, практических занятий, экзаменационные вопросы, примеры тестов, 2741.92kb.
- Тематический план лекций по патофизиологии для студентов лечебного, педиатрического,, 493.28kb.
- Тематические планы лекций и практических занятий. Экзаменационные вопросы, примеры, 976.53kb.
- Тематические планы лекций, практических занятий, элективных курсов, экзаменационные, 743.05kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Тематические планы лекций и практических занятий 1 курс план лекций по истории фармации, 679.07kb.
- Тематические планы лекций и практических занятий. 1 курс план лекций по истории фармации, 424.2kb.
- Тематические планы лекций по факультетам и семестрам:, 47.16kb.
- Тематические планы лекций по специальности 060103 педиатрия (педиатрический факультет, 17.43kb.
Контрольная работа № 2
Тема: Растворы сильных электролитов.
Электрохимия. Поверхностные явления.
Растворы
Перед решением задач рекомендуется выучить следующие основные понятия темы:
1) протолитическая теория, гидролиз солей;
2) водородный показатель (рН среды);
3) степень ионизации, константы ионизации;
4) буферные системы и растворы;
5) буферная емкость.
Уметь рассчитывать:
1) pH водных растворов кислот, оснований, солей;
2) рН буферного раствора;
3) буферную емкость.
Обратить внимание на то, что:
1) при 25°С в кислой среде рН < 7, в щелочной среде рН >7, в нейтральной среде рН = 7;
2) рН величина безразмерная;
3) в уравнении для расчета рН буферного раствора под знаком логарифма могут стоять отношения:
сосн/скисл;
vосн/vкисл;
(сосн.исх*Vосн.исх)/(скисл.исх*Vкисл. исх);
(mосн*Мкисл)/(Мосн*mкисл)
4) буферную емкость по кислоте определяют по содержанию количества вещества основания буферного раствора, буферную емкость по основанию - по содержанию количества вещества кислоты буферного раствора.
Электрохимия
Перед решением задач рекомендуется выучить следующие основные понятия:
1) электродный потенциал;
2) редокс - системы первого и второго типа;
3) стандартный и формальный редокс - потенциалы;
4) ЭДС гальванического элемента;
Знать:
1) механизм возникновения электродного и редокс - потенциала;
2) устройство гальванических элементов, их условную запись;
3) устройство водородного, каломельного, хлорсеребряного и стеклянного электродов;
4) уравнение Нернста.
Уметь:
1) составлять электронно - ионное уравнение процессов окисления и восстановления;
2) записывать схемы гальванических цепей;
3) определять направление редокс - процесса;
Обратить внимание на то, что:
1) В уравнении Нернста под знаком логарифма может стоять отношение:
с(Ox)/c(Red);
v(Ox)/v(Red);
cисх(Ox)Vисх(Ox)/cисх(Red)Vисх(Red);
m(Ox)M(Red)/M(Ox)m(Red)
2) изменение редокс - потенциала определяется соотношением активностей окисленной и восстановленной форм. Если соотношение активностей окисленной и восстановленной форм больше единицы, то значение редокс - потенциала системы увеличивается по сравнению со стандартным потенциалом; если соотношение активностей окисленной и восстановленной форм меньше единицы, то значение редокс - потенциала системы уменьшается по сравнению со стандартным потенциалом.
Поверхностные явления
Перед решением задач необходимо выучить основные понятия:
1) адсорбция, предельная адсорбция;
2) поверхностное натяжение;
3) коэффициент поверхностного натяжения;
4) поверхностно-активные и поверхностно-неактивные вещества;
5) поверхностная активность;
6) адсорбент, адсорбат;
7) правило выравнивания полярностей Ребиндера.
Разобрать следующие вопросы:
1) подвижная и неподвижная поверхность раздела фаз;
2) связь между величиной адсорбции и коэффициентом поверхностного натяжения (уравнение Гиббса);
3) изменение величины поверхностной активности в гомологическом ряду (правило Траубе);
4) связь величины предельной адсорбции с площадью поперечного сечения и осевой длины молекулы;
5) уравнение изотермы адсорбции Лэнгмюра.
Обратить внимание на размерность величин адсорбции на подвижной границе фаз и на твердых адсорбентах.
Примеры решения типовых задач
Вычислите рН раствора азотной кислоты концентрации 0,001 моль/л.
Решение: Подставляя значение концентрации из условия задачи в уравнение:
рН = - lg c (Н+), где с(Н+) = с(HN03) вычисляем водородный показатель:
рН = -lg c (HN03) = -lg0,00l = 3.
Ответ: рН =3.
Вычислите рН раствора гидроксида калия, концентрация которого с = 0,012 моль/л.
Решение: Подставляя в уравнение рОН = - lg С(ОН-), где С(ОН-) = С(КОН) известное по условию задачи значение концентрации раствора КОН, находим
рН = 14 – рОН; рН = 14,0 - 1,92 =12,1.
Ответ: рН = 12,1.
Рассчитайте концентрацию протонов в слезной жидкости, рН =7,4.
Решение: При решении задачи воспользуемся уравнением: рН = -lg С(Н+),
отсюда С(Н+) =10-рН = 10-7,4 = 3,9 10-8 моль/л.
Ответ: С(Н+) = 3,9 10-8моль/л.
Рассчитать ионную силу раствора «Трисоль», применяемого в медицинской практике в качестве плазмозамещающего раствора, учитывая его пропись:
натрия хлорид – 0,5 г,
калия хлорид – 0,1 г,
натрия гидрокарбонат – 0,4 г,
вода для инъекций – до 100 мл.
Решение: Ионная сила раствора (I) определяется как полусумма произведений концентраций каждого иона на квадрат его заряда:
1
I = ci zi2
2
Для определения концентрации каждого иона необходимо найти количество веществ, входящих в состав прописи:
0,5г 0,1г
v(NaCl) = = 0,0085 моль; v(KCl) = = 0,0013 моль;
58,5г/моль 74,5г/моль
0,4г
v(NaHCO3) = = 0,0048 моль;
84г/моль
v(X) 0,0085 моль
c(X) = = c(NaCl) = = 0,085 моль/л;
Vр-ра 0,1 л
0,0013 моль
с(KCl) = = 0,013 моль/л;
0,1 л
1
I = (0,085 12 + 0,085 12 + 0,013 12 + 0,013 12 + 0,048 12 + 0,048 12) =
2
= 0,146 моль/л.
Для сравнения: ионная сила плазмы крови равна 0,15 моль/л.
Ответ: ионная сила раствора «Трисоль» равна 0,146 моль/л, что соответствует ионной силе плазмы крови.
Стеклянный электрод, соединенный в гальваническую цепь с электродом сравнения при Т = 298 К, сначала погрузили раствор с рН = 3,5, а затем – в исследуемую пробу молока. При этом ЭДС цепи возросла на 0,15 В. рН молока в норме находится в пределах 6,6 – 6,9. Оцените результат исследования молока, если учесть, что измерительный электрод заряжается отрицательно по отношению к электроду сравнения.
Решение:
- Потенциал стеклянного электрода в растворе с рН = 3,5 определяется по уравнению 1 = 0 + 0,059 3,5.
- Потенциал стеклянного электрода в исследуемой пробе молока определяется по уравнению 2 - 1 = 0,15, тогда
0,15 = 0,059 (рН – 3,5);
0,15
рН = 3,5 + = 6,04;
0,059
6,04 < 6,6, следовательно, молоко прокисло.
Ответ: рН пробы молока ниже нормы, молоко прокисло.
В каком соотношении находятся исходные компоненты фосфатной и бикарбонатной буферных систем в плазме крови при pH=7,36, если для плазмы рК(Н2РО4-)= 6,8; рК(Н2СО3)=6,1.
Решение:
pН(ф.б.)=рК(Н2РО4-)+lg[HPO42-]/[H2PO4];
pН(ф.б.)=рК(Н2СО3)+ lg[HСО3-]/[ H2СО3];
lg[HPO42-]/[H2PO4]=7,36-6,8=0,56; lg[HСО3-]/[ H2СО3]=7,36-6,1=1,26;
[HPO42-]/[H2PO4]=3,63; [HСО3-]/[ H2СО3]=18,2.
И в фосфатной, и в бикарбонатной буферных системах сопряжение оснований больше, чем кислот, что необходимо для живых организмов, в результате метаболизма которых образуется значительно больше кислот, чем оснований.
Ответ: исходные компоненты фосфатной и бикарбонатной буферных систем (основание/кислота) находятся соответственно в соотношениях 3,63:1 и 18,2:1.
К 100 мл крови для изменения рН от 7,36 до 7,00 надо добавить 3,6 мл соляной кислоты с концентрацией 0,1 моль/л. Какова буферная емкость крови по кислоте?
Решение:
Буферная емкость (В) определяется числом моль эквивалентов сильной кислоты или щелочи, которое надо добавить к 1л буферного раствора, чтобы изменить его рН на единицу:
В=n(1/z к-ты (щел.))/∆рН. V р-ра(л);
n(HCl)=n(1/zHCl)=0,1 моль/л.3,6.10-3 л = 3,6.10-4 моль;
В= 3,6.10-4 моль/ 0,36.0,1 л = 0,01 моль/л.
Ответ: буферная емкость по кислоте составляет 0,01 моль/л.
Водный раствор сульфата меди (II) с массовой долей 1% (р=1,009г/мл) назначают в малых дозах для улучшения кроветворной функции. Вычислить активность ионов меди в таком растворе.
Решение:
a(Cu2+) =.c(Cu2+).
Коэффициент активности у можно рассчитать по уравнению Дебая - Хюккеля:
lg = -0.51 . z2 . I ,
где z – заряд иона,
I – ионная сила раствора.
Ионная сила раствора
I = ½[c(Cu2+) . z2(Cu2+) + c(SO42-) . z2(SO42-)];
С(СuSO4) =W . p . 10/ М = 1. 1,009 . 10/ 160 = 0,063 моль/л;
I = ½(0,063 . 22 . + 0,063 . 22) = 0,252 моль/л;
lg = -0,51 . 22 . 0,252 = - 1,02; = 0,095;
а(Cu2+) = 0,095 . 0,063 = 0,006 моль/л.
Ответ: активность ионов меди 0,006 моль/л.
В желудочном соке содержится соляная кислота, которая относится к сильным электролитам и практически полностью диссоциирует в водных растворах. Рассчитайте рН желудочного сока, если массовая доля HCl в нем составляет в норме 0,05%. Плотность желудочного сока принять равной 1 г/см3.
Решение:
- Так как HCl диссоциирует полностью HCl H+ + Cl-, то концентрация ионов Н+ равна концентрации HCl.
- По формуле с = . . 10/ М определим молярную концентрацию HCl, а следовательно, и молярную концентрацию ионов водорода:
с(HCl)=0,5 . 1 . 10 / 36,5 = 0,137 моль/л;
с[H+] = 0,137 моль/л;
- рН = -lg a(H+), где a(H+) – активная концентрация ионов водорода;
a(H+)= . с, где – коэффициент активности, который можно рассчитать или найти по справочнику. Для простоты расчета примем, что = 1, а = с,
рН = -lg 0,137 = 1,86.
Ответ: рН(желуд. сока) = 1,86.
Рассчитайте, чему равен потенциал цинкового электрода, опущенного в раствор с молярной концентрацией ZnSO4, равной 0,001моль/л, Т=298 К.
Решение:
Величина потенциала, возникающего на границе металл/раствор, определяется по уравнению Нернста Zn2+/Zn= 0Zn2+/Zn+RT/zF ln a(Zn2+),
Где Zn2+/Zn-потенциал, возникающий на границе металл /раствор;
0Zn2+/Zn- стандартный потенциал цинкового электрода ( справочные данные);
0Zn2+/Zn= - 0,763 В;
R-универсальная газовая постоянная, 8,31 Дж/моль. К;
Т- температура (К), влияющая на величину электродного потенциала;
z- число электронов в электродной реакции
Zn2++2eZn0,z=2;
F - число Фарадея, 96500 Кл/моль;
а(Zn2+) – активная концентрация ионов цинка, равная произведению коэффициента активности () на аналитическую концентрацию(с): а=.с. При больших разведениях (с=10-3 и меньше)=1;а=с.
Zn2+\Zn= -0, 763+8,31.298/2.96500.ln0,001= - 0,852 В.
Ответ: потенциал цинкового электрода равен – 0,852 В.
Вычислите потенциал водородного электрода при 298 К, погруженного в раствор, содержащий в 1 л 5,85 г NaCl и 0,1 моль хлороводорода. Расчет произвести с учетом ионной силы раствора.
Решение:
- Вычисляем ионную силу раствора (I) по формуле:
I= 1/2 сi zi2
C(HCl)=0,1 моль/л; С(NaCl)=m(NaCl)/M(NaCl).Vр-ра= 5,85г/ 58,5 г/моль.1л= 0,1 моль/л.
I=1/2 (С(H+).12+С(Cl-).12 + С(Na+).12 + С(Cl-).12)= 1/2(0,1.1+0,1.1+ 0,1.1+0,1.1)= 0,2 моль/л.
По величине (I), пользуясь справочником, находим коэффициент активности =0,7, и определяем активную концентрацию ионов водорода:
а(Н+)= .с(Н+)= 0,7.0,1= 0,07 моль/л.
- Определяем рН исследуемого раствора: рН= - lg0,07 = 1,15.
- Потенциал водородного электрода рассчитывается по уравнению: 2н+\н2= - 0,059 рН;
2н+\н2= - 0,059.1,15= - 0,068 В.
Ответ: потенциал водородного электрода в исследуемом растворе равен
– 0,068 В.
Для измерения рН сока поджелудочной железы была составлена гальваническая цепь из водородного и хлорсеребряного (насыщенного) электродов. Измеренная при 25 С ЭДС составила 680 мВ. Вычислите рН сока поджелудочной железы и приведите схему гальванической цепи.
Решение:
- По справочнику определяем потенциал хлорсеребряного ( насыщенного) электрода при t=25С:
AgCl,KCl (насыщ.)/Ag= 0,222 В.
- Вычисляем потенциал водородного электрода из уравнения:
Е= хлорсереб. - водор., так как потенциал водородного всегда отрицательный и меньше хлорсеребрянного, водор = хлорсереб – Е;
водор = 0,222- 0,680= - 0,458 В.
- Из уравнения водор = + 0,059.lg а2 (Н+) или водор = 0,059 рН;рН= водор /0,059= - 0,458/0,059= 7,77
- Запишем схему гальванической цепи:
Pt,Н2| сок поджелудочной железы|| KCl(нас.),AgCl|Ag.
Ответ: рН сока поджелудочной железы равен 7,77(в норме).
При уменьшении концентрации новокаина в растворе с 0,2 моль/л до 0,15 моль/л поверхностное натяжение возросло с 6,9 • 10-2 Н/м до 7,1 • 10-2 Н/м, а у раствора кокаина с 6,5 • 10-2 Н/м до 7,0 • 10-2 Н/м. Сравните величины адсорбции двух веществ в данном интервале концентраций. Т= 293 К.
Решение:
- Адсорбцию на границе раздела жидкость — газ вычисляют с помощью уравнения Гиббса

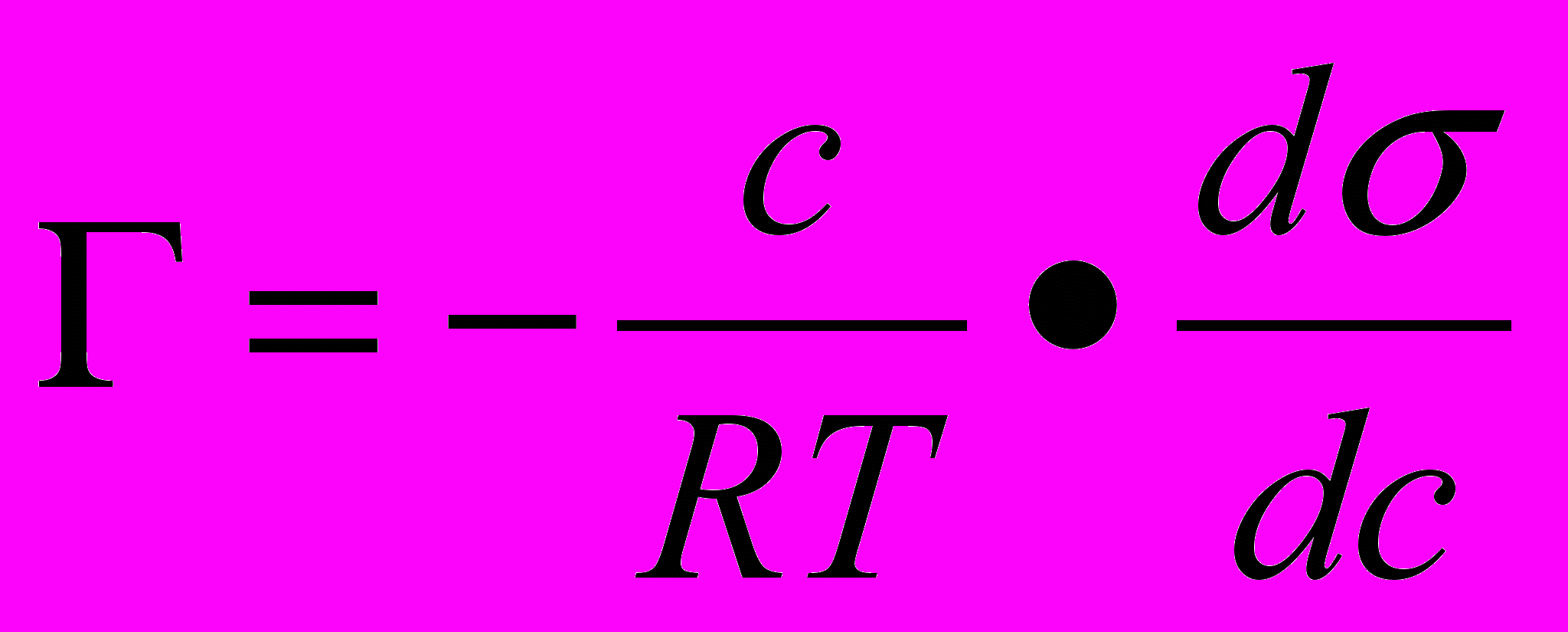
где Г — величина адсорбции растворенного вещества, измеряемая количеством этого вещества (моль), приходящегося на единицу площади поверхности адсорбента, моль/м2;
с — равновесная молярная концентрация растворенного вещества, моль/л, в узких интервалах измерений рассчитывается как средняя величина:
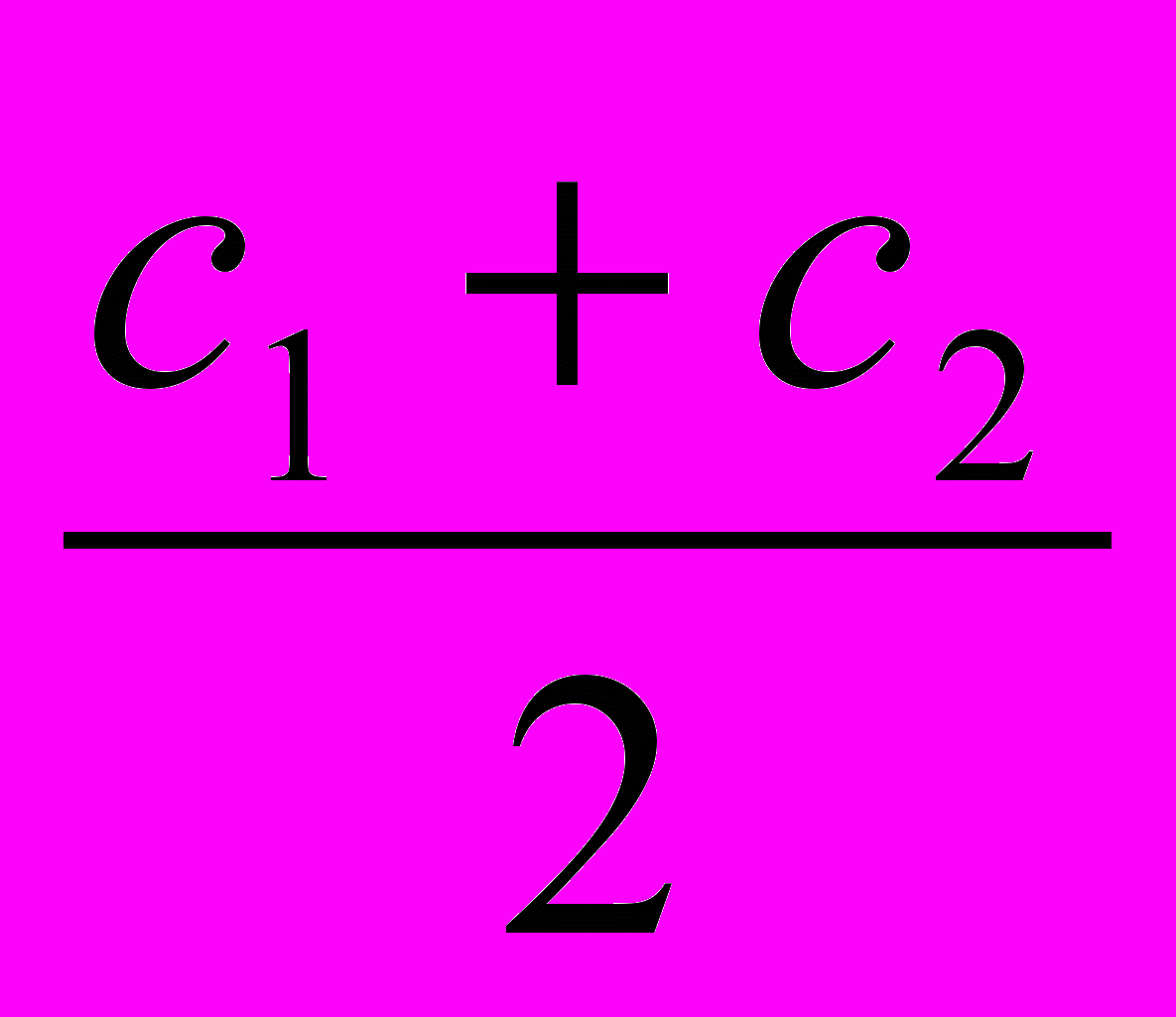
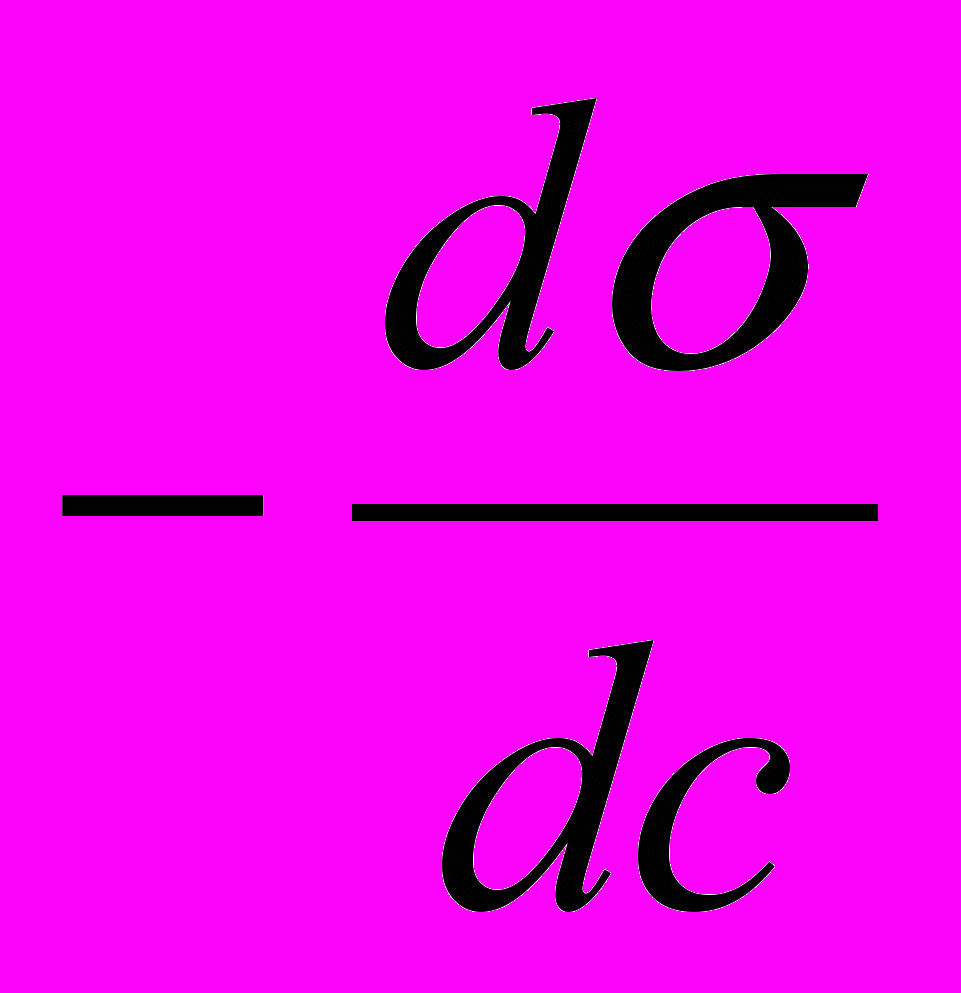 — поверхностная активность (понижение удельного поверхностного натяжения, вызванное повышением концентрации растворенного вещества в поверхностном
— поверхностная активность (понижение удельного поверхностного натяжения, вызванное повышением концентрации растворенного вещества в поверхностномслое); в узком диапазоне -
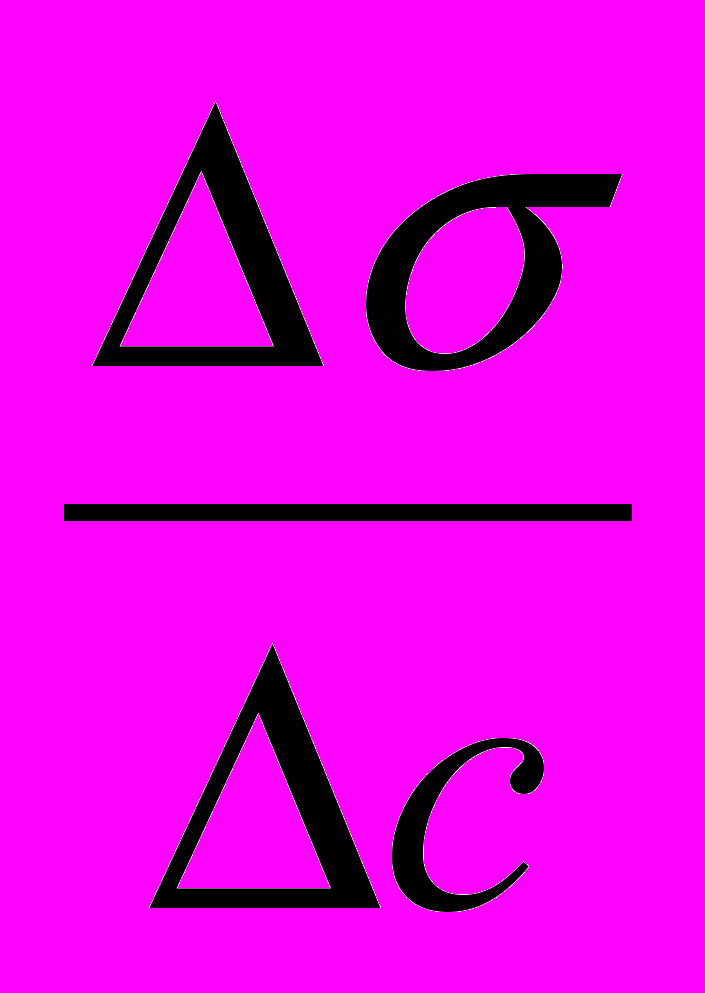 ;∆σ=σ2-σ1, ∆с=с2-с1
;∆σ=σ2-σ1, ∆с=с2-с1R — газовая постоянная, Дж/моль К.
- Определяем величину адсорбции новокаина:
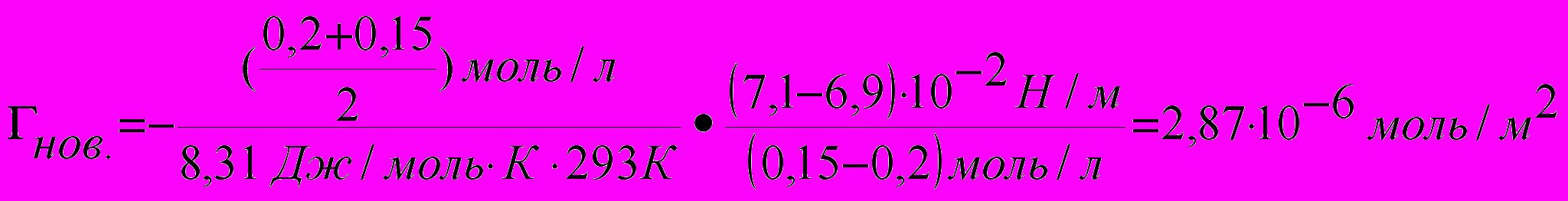
3) Определяем величину адсорбции кокаина:
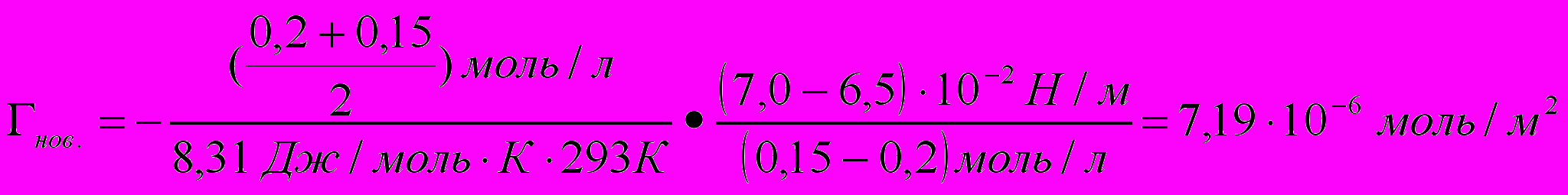
Ответ: адсорбция кокаина при прочих равных условиях выше.
В 50 мл раствора с концентрацией уксусной кислоты 0,1 моль/л поместили адсорбент массой 2 г и взбалтывали смесь до достижения адсорбционного равновесия. После этого раствор отфильтровали. На титрование 10 мл фильтрата пошло 15 мл раствора титранта с концентрацией КОН, равной 0,05 моль/л. Определите величину адсорбции уксусной кислоты.
Решение:
1) По результатам титрования находим равновесную концентрацию уксусной кислоты:
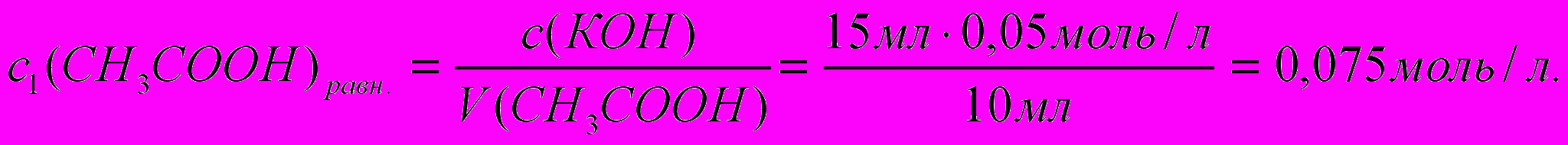
2) Определяем адсорбцию по разности концентраций исходного и равновесного растворов уксусной кислоты (адсорбата):
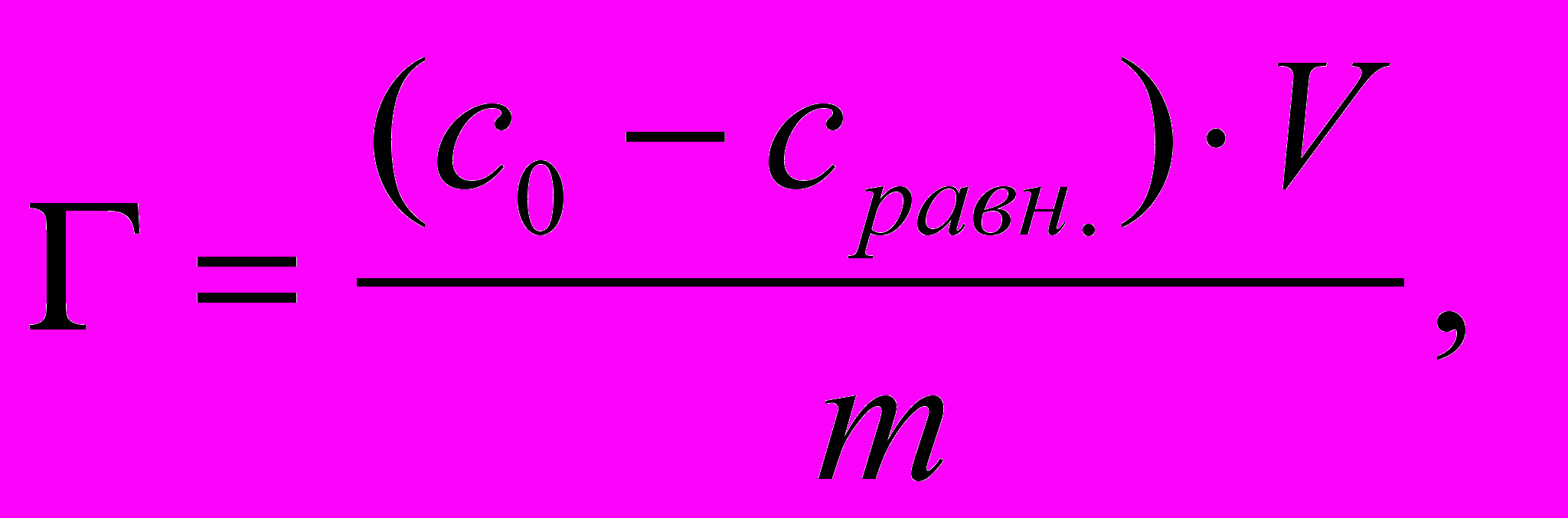
где с0 и сравн. — начальная и равновесная концентрации адсорбата;
V—объем раствора, из которого ведется адсорбция;
m —масса адсорбента.
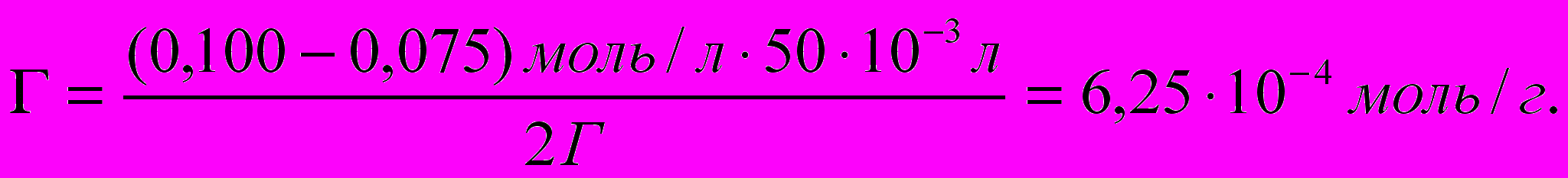
Ответ: величина адсорбции уксусной кислоты составила. 6,25-10-4 моль/г.
Емкость адсорбента АДБ по холестерину составляет 0,7 мкмоль/г. Какая масса холестерина адсорбируется из плазмы крови, содержащей 4,8 мкмоль/мл холестерина, если а = 2 мкмоль/мл, М хол. = 386,6 г/моль? Как изменится величина адсорбции, если концентрация холестерина в плазме увеличится до 5,4 мкмоль/мл?
Решение:
1) Величину адсорбции определяем по уравнению Ленгмюра, принимая, что предельная адсорбция
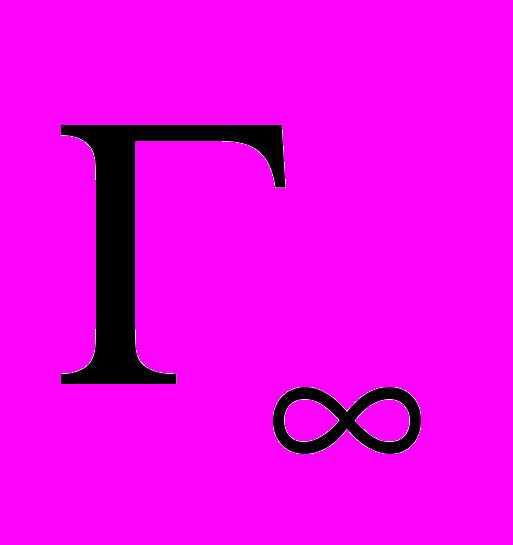 равна емкости адсорбента 0,7 мкмоль/г, или 0,7 •10-6 моль/г:
равна емкости адсорбента 0,7 мкмоль/г, или 0,7 •10-6 моль/г: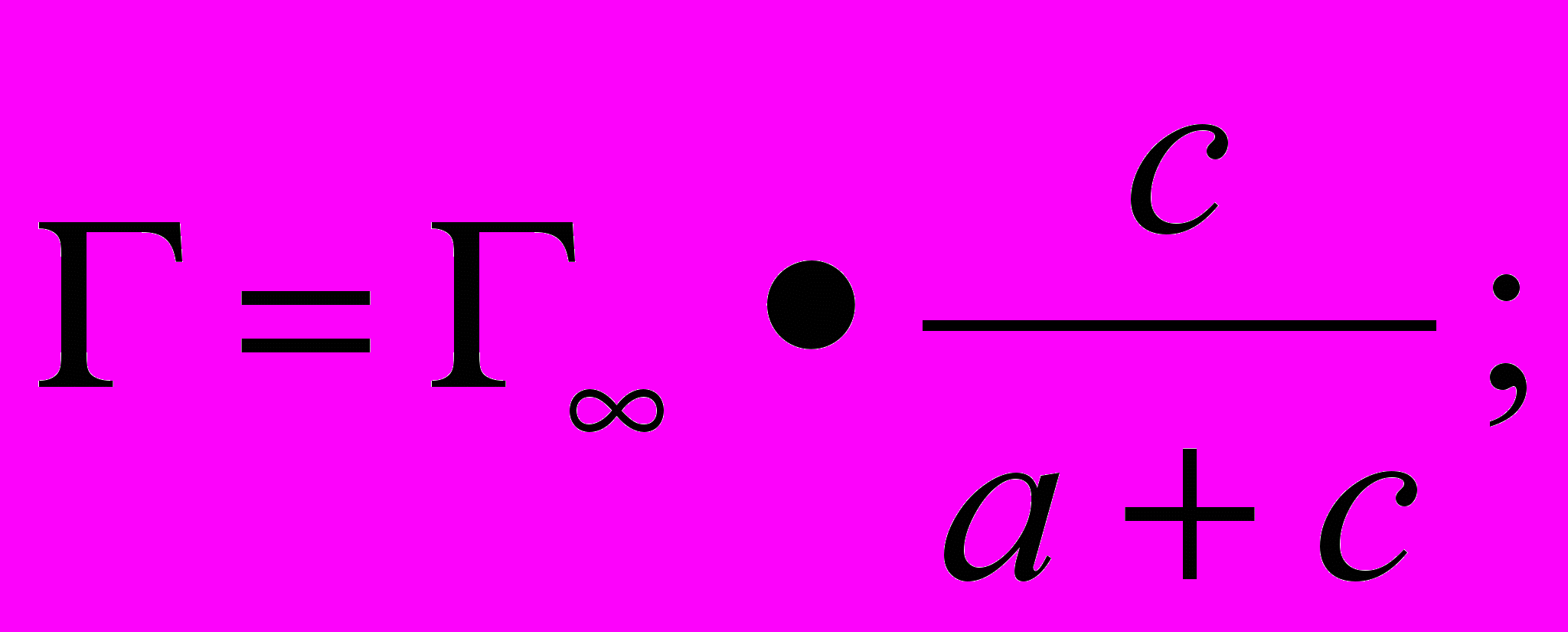
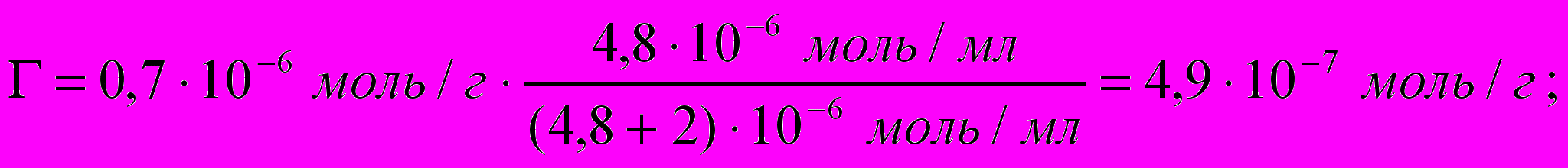
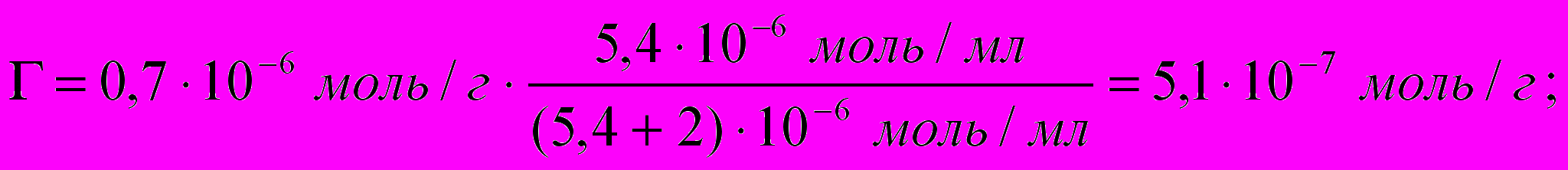
2) Массу холестерина, адсорбированного из плазмы, определяем по формуле
m=n∙M, где n = Г
m(хол)1=4,9∙10-7 моль∙386,6 г/моль=189,4∙ 10-6 г=1,89∙10-4г.
m(хол)2=5,1∙10-7 моль∙386,6 г/моль=1,97∙10-4 г.
Ответ: с увеличением концентрации холестерина величина адсорбции увеличивается; m(хол)1 =1,89∙10-4г., m(хол)2=1,97∙10-4г.
Степень адсорбции пропионовой кислоты из водного раствора углем массой 2 г составила 60%. Определите массу пропионовой кислоты (г) в 1 л водного раствора до адсорбции, если удельная адсорбция равна 2,32 • 10-3 моль/г.
Решение:
1) Величину адсорбции из раствора и степень адсорбции определяем по формулам:
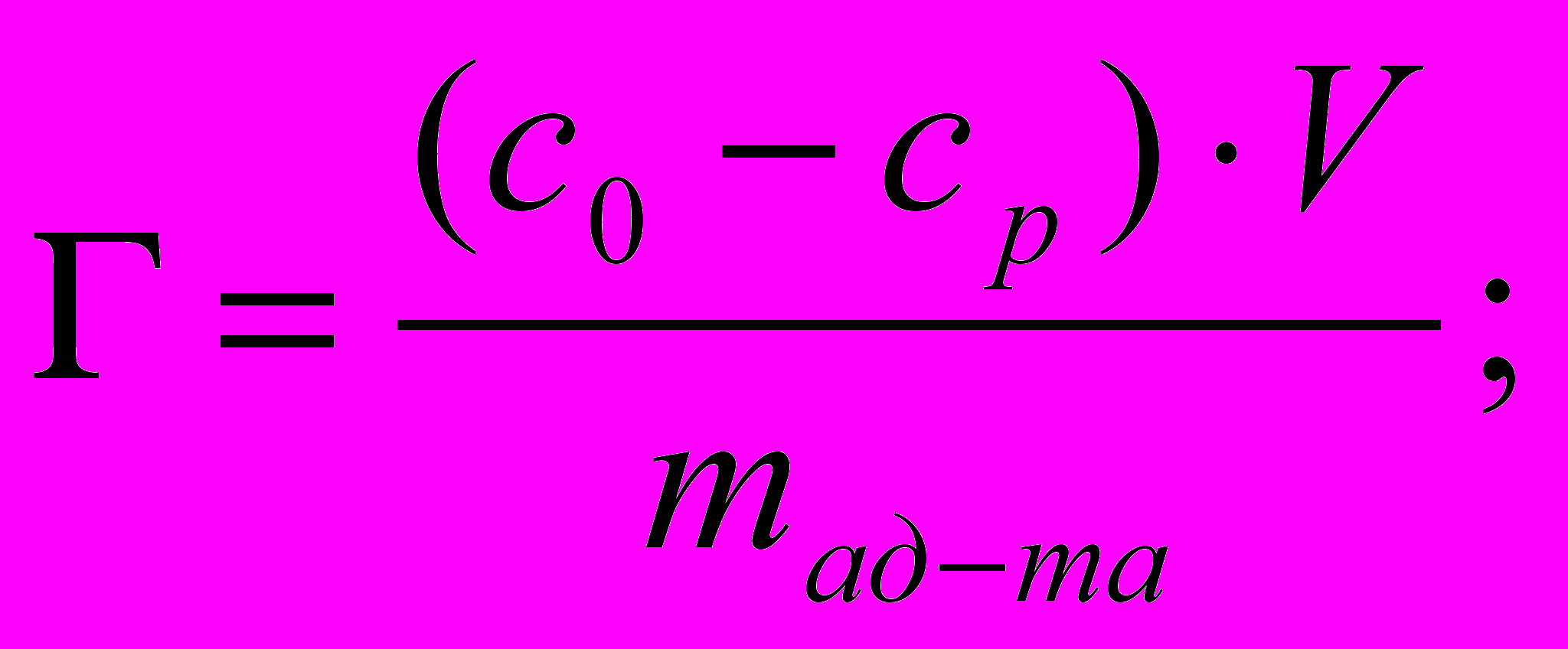
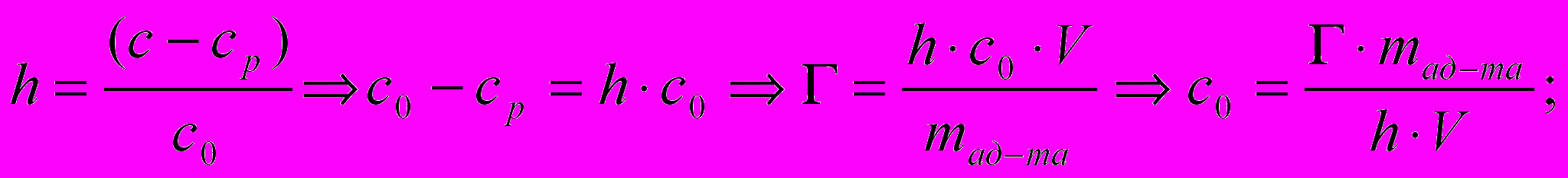
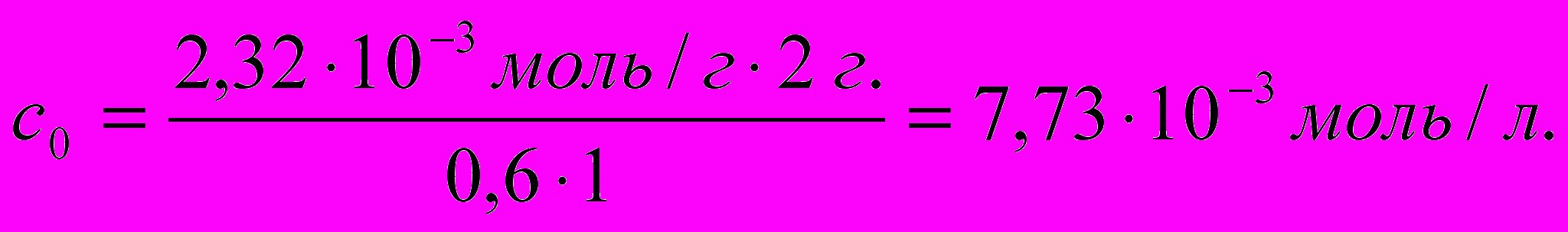
- Вычисляем массу пропионовой кислоты:
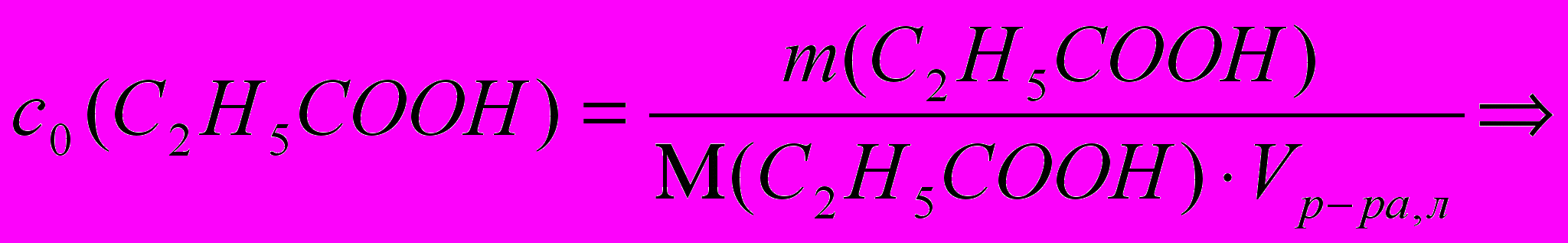
m(C2H5COOH)=c0(C2H5COOH)∙M(C2H5COOH)∙Vр-ра
m(C2H5COOH)=7,73∙10-3моль/л∙74 г/моль∙1л=0,572 г.
Ответ: m(C2H5COOH) в 1 л раствора до адсорбции составила 0,572 г.
Рассчитать рН ацетатного буферного раствора, приготовленного из 80 мл c молярной концентрацией эквивалента СН3СООН 0,1моль/л и 20 мл раствора СН3СООNa с молярной концентрацией эквивалента 0,1моль/л. Кд(СН3СООН) = 1,74 10-5.
Решение:
Расчет рН буферных растворов производится по уравнению Гендерсона – Гассельбаха:
рН= р Кк-ты + lg(C(1/z соли) V соли / C(1/z к-ты) Vк-ты), где рК=-lgКд.
рН= 4,76 +lg (20 10-3л 0,1 моль/л / 80 10-3 л 0,1 моль/л) = 4,16
Ответ: рН ацетатного буферного раствора 4,16
