Клинические и морфофункциональные особенности репаративной регенерации трофических язв нижних конечностей при их комплексном лечении с местным использованием милиацила и физических методов 14.
| Вид материала | Автореферат |
| Таблица 1 Распределение больных с трофическими язвами нижних Результаты исследований и их обсуждение |
- Отчет применение коллаген-хитозанового комплекса Коллахит в лечении трофических (флебогенных), 74.74kb.
- Кызы лимфотропная терапия в комплексном лечении воспалительных и трофических процессов, 337.78kb.
- Оценка использования раневых покрытий при лечении трофических язв венозной этиологии, 62.91kb.
- Импульсная магнитотерапия венозных трофических язв, 39.16kb.
- Особенности консервативной терапии и ее роль в комплексном лечении хронической ишемии, 300.03kb.
- Реконструкция глубокой бедренной артерии в комплексном хирургическом лечении больных, 294.19kb.
- Хафизова Альфия Фаязовна, 290.68kb.
- Венозные трофические язвы нижних конечностей. Современное состояние вопроса, 291.39kb.
- Возможности раневого покрытия Varix, 152.51kb.
- Программа третья Всероссийская научно-практическая конференция, 268.44kb.
Таблица 1
Распределение больных с трофическими язвами нижних
конечностей в зависимости от способа местного лечения
| Группа больных | Количество больных |
| Основная группа (милиацил и магнитолазеротерапия) | 122 |
| Первая контрольная группа (милиацил и лазеротерапия) | 81 |
| Вторая контрольная группа (милиацил) | 79 |
| Третья контрольная группа (1% раствор диоксидина и облепиховое масло) | 52 |
Как видно из таблицы 1, для лечения больных первой контрольной группы (81 пациент) с трофическими язвами местно применяли милиацил и лазерное излучение. Во второй контрольной группе (79 больных) использовали только милиацил. В третьей контрольной группе (52 пациента) применяли местно в течение первых 7-10 дней (до очищения язв от гнойно-некротических масс) 1% раствор диоксидина, а затем облепиховое масло.
У 122 больных с трофическими язвами проведено изучение эффективности в комплексном лечении сочетанного местного применения милиацила и магнитолазеротерапии (основная группа).
У всех больных основной и контрольных групп проводилось по показаниям аналогичное комплексное лечении.
Больные основной и контрольных групп были сопоставимы по полу, возрасту. Трофические язвы чаще всего возникали в результате нарушения венозного кровотока (у 76,2 % пациентов основной группы, у 70,3 % первой контрольной группы, у 68,3 % - второй и у 65,4 % - третьей контрольной группы).
26 больным основной группы, 21 пациенту первой контрольной группы, 20 – второй контрольной группы и 22 больным третьей контрольной группы выполнена предоперационная терапия. Из этих больных 17 пациентам основной группы, 14 – первой контрольной группы, 14 – второй контрольной группы и 15 – третьей контрольной группы произведена аутодермопластика. Причем, у 8 больных основной контрольной группы, 8 – первой контрольной группы, 7 – второй контрольной группы и 6 – третьей контрольной группы выполнена аутодермопластика и операция на венах. Операции на венах выполнялись после приживления аутотрансплантантов. У 9 пациентов основной группы, у 6 больных первой контрольной группы, 7 – второй контрольной группы и у 9 пациентов третьей контрольной группы произведена только аутодермопластика.
Из 26 оперированных больных основной группы 9 пациентам после заживления язв с помощью комплексного консервативного лечения выполнены операции на венах нижних конечностей. В первой контрольной группе из 21 оперированных больных 7 пациентам после заживления язв произведены операции на венах, во второй контрольной группе из 20 оперированных пациентов 6 больным выполнены операции на венах и из 22 оперированных больных третьей контрольной группы 7 пациентам также после заживления трофических язв комплексной консервативной терапией произведены хирургические вмешательства на венах. Операции на венах заключались в иссечении варикозно - расширенных поверхностных вен и разобщении поверхностной и глубокой систем.
У всех больных основной и контрольных групп при поступлении в стационар производили удаление патологически измененных тканей по окружности язвы и под ней. Ежедневно вокруг язвы обрабатывали кожу, удаляли рыхло лежащие гнойно – некротические ткани. Поверхность язвы обрабатывали 3 % раствором перекиси водорода.
У больных основной группы проводили ежедневно дистанционно сеанс магнитолазеротерапии. Для магнитолазеротерапии использовали аппарат магнитолазерного воздействия терапевтический «Изель – 2» с длиной волны излучения 0,85 мкм, плотностью мощности оптического излучения 20,4 мВт/см2. Магнитная индукция мтл: на рабочей поверхности не менее 40, на боковой поверхности не более 5. Продолжительность воздействия составляет 5 минут.
Лазеротерапия больным первой контрольной группы проводилась от полупроводникового инфракрасного лазера с длинной волны 0,8…0,88 мкм, общей мощностью излучения не менее 10 мВт, частотой 50 Гц от аппарата АМЛТ-10-01. Лазерное излучение проводилось дистанционно. Сеанс лазеротерапии был продолжительностью 3 минуты, проводился ежедневно. Курсовая нагрузка использования лучей лазера или магнитолазеротерапии 20 дней. Оценка результатов лечения больных основной и контрольных групп осуществлялась на основании изучения общего состояния пациентов и данных местного течения процесса.
Общее состояние больных исследовали с помощью таких показателей, как самочувствие, сон, аппетит, инструментально – лабораторных даных: общей термометрии, ЭКГ, клинических анализов крови и мочи, биохимических исследований крови (В.В. Меньшиков, 1973; В.Г. Колб, В.С. Камышников, 1976).
Местное течение патологического процесса контролировали по клиническим признакам – срокам исчезновения инфильтрации и гиперемии краев язвы, характеру и количеству раневого содержимого, срокам очищения язв от гнойно – некротического содержимого, срокам появления грануляций, краевой эпителизации и заживления. Измерение площади трофических язв (планиметрия) производили используя метод Л.Н. Поповой (М.И. Кузьмин, Б.М. Костюченок, 1981). Производилось ультразвуковое дуплексное ангиосканирование (эхосканер Diasonics Gateway – Fx).
У больных основной и контрольных групп выполнены исследования состава, микрофлоры трофических язв по общепринятой методике (Приказ МЗ СССР № 535 от 22.04.1985) перед началом лечения, на 7 день и по окончании лечения. Таким образом, устанавливалась видовая принадлежность выделенной флоры. Для оценки чувствительности микрофлоры к антибактериальным препаратам применяли метод бумажных дисков.
Морфологические исследования тканей язв проводились у больных основной и контрольных групп до лечения, на 3, 7, 14 день консервативного лечения. Забор материала для гистологических и гистохимических исследований производился под местной новокаиновой анестезией путем иссечения стерильным лезвием фрагмента из края и глубины трофической язвы.
Объекты изучены на светооптическом и электронно–микроскопическом уровнях. Гистосрезы толщиной 6 – 8 мкм, изготовленные на ротационном микротоме, после депарафинирования окрашены гематоксилином Майера и эозином, пикрофуксином по Ван Гизон, метиловым зеленым и пиронином по Браше, перйодатом К и реактивом Шиффа по Мак Манусу. Гистохимические реакции сопровождались соответствующими энзиматическими контролями (Э. Пирс, 1962). Для изучения ДНК – синтетической способности клеток проводились гистоавторадиографическме исследования биоптатов с использованием 3H тимидина. В связи с этим часть эксцизивных объектов мягких тканей инкубировали в среде 199 (1 час при t○ +37○ C) с добавлением 3H тимидина (молекулярная активность 1,96 ПБК/моль в дозе 3,75∙105 БК на г. массы биоптата).
В последующем гистоавторадиографию проводили на парафиновых срезах толщиной 6 мкм по методике Л.Н. Жинкина (1959). Фотоэмульсию типа «р» экспонировали в течение двух месяцев. Гистоавтографы окрашивали гематоксилином и эозином. Меченными считались клетки, ядра которых содержали не менее 5 зерен восстановленного серебра. В соответствии с рекомендациями О.И. Епифановой, В.В. Терских, А.Ф. Захарова (1977) в автографах подсчитывали индекс меченых ядер (ИМЯ) в промилях на 5 – 7 тысяч клеток. Подсчет клеток, включающих радиоактивную метку, прежде всего осуществлялся относительно фибробластов. Это было обусловлено существенной их ролью в репаративных процессах (В.В. Рывняк, 1977; H. Struck, 1976; I.W. Green, R.P. Wenzel, 1977).
Для электронной микроскопии часть материала фиксировали в охлажденном 2,5 % растворе глутарового альдегида на S – коллединовом буфере (pH – 7,3). Постфиксацию проводили в четырехоксиде осмия (G. Milloning, 1961). Затем объекты дегидратировали в ацетоне с возрастающей концентрацией и заключали в смолу ЭПОН – 812 и Аралдит. Ультратонкие срезы, изготовленные на ультратоме LKB – 5 (Sweden, Bromma), подвергали двойному контрастированию в 5 % спиртовом растворе уранил – ацетата и цитрате свинца (E.S. Reynolds, 1963). В последующем срезы изучали и фотографировали в электронном микроскопе ЭВМ 100 АК при увеличениях от х12000 до 50000.
Электронно – микроскопическая гистоавторадиография выполнена по методике F. Larra et B. Droz (1970). При этом ультратонкие срезы наносились на коллодиевую пленку специально приготовленных предметных стекол. Дополнительное контрастирование осуществлялось в 5% спиртовом растворе уранил – ацетата. В последующем проводили контрастирование срезов цитратом свинца. После вакуумного напыления стекол со срезами углем наносили фотоэмульсию типа «М» (НИИ ХИМФОТО). Ультраструктурные радиографы после 1,5 – 2 месяцев экспозиции проявляли в соответствующем растворе амидола и затем просматривали в электронном микроскопе.
Для идентификации клеток с экспрессией проапоптотического белка р53 и для выявления интрануклеосомальной фрагментации ДНК, кусочки ткани трофических язв фиксировали 10 % нейтральным формалином, обезвоживали и заливали в парафин. Исследование проводили на серийных парафиновых срезах толщиной 5 – 6 мкм.
Срезы инкубировали с моноклональными антителами к р53 (фирма «Dako», Дания) в рабочем разведении 1:50. Для выявления иммунного окрашивания использовали стрептавидинбиотиновый пероксиазный метод (Dako LSAB – kit, Дания), затем осуществляли докрашивание ядер водным раствором гематоксилина. С целью определения внутриядерной фрагментации ДНК использовали набор реактивов «Apoptag Plus in Situ Apoptosis Detection Kit» (фирма «Intergen», Канада), докрашивание ядер производили 0,5 % раствором метиленового зеленого на 0,1 М ацетатном буфере. При постановке Apoptag – теста ядерный хроматин клеток, вступивших в апоптоз, приобретал коричневое окрашивание.Идентификация аптиапоптотического протеина bcl-2 осуществляли иммуноцитохимически с использованием моноклональных антител(фирма “Дако”, Дания).
Экспериментальные исследования проведены на 54 белых беспородных крысах обоего пола, массой 260 – 330 г. У крыс смоделирован раневой процесс задних конечностей. Подопытным крысам после удаления волосяного покрова и обработки кожи настойкой йода и спиртом внутримышечно в область бедра вводили 1 мл взвеси суточной культуры стафилококка (2 млрд микробных тел) и 0,25 мл 0,25% раствора сульфата магния. 27 животным инфицирование производили ведением St. aureus с антилактофериновой активностью (АЛФА +) и 27 животных – микробным штаммом стафилококка без аналогичной активности (АЛФА -) . После получения через 5 – 7 дней модели гнойно – воспалительного очага производили его хирургическую обработку. Оперативное вмешательство проводили под местной новокаиновой анестезией. Далее у крыс основной серии в местном лечении гнойных ран использовали ежедневно магнитолазеротерапию, затем на рану наносилось 0,3 мл милиацила, накладывалась марлевая повязка.
В первой контрольной серии экспериментов исследовали характер течения гнойно – воспалительного процесса без лечебной коррекции. Во второй контрольной серии лечение гнойных ран осуществлялось только милиацилом. Он наносился также ежедневно по 0,3 мл, делалась повязка. В каждой серии экспериментов взято по 18 крыс (9 крыс инфицированы St. aureus АЛФА + и 9 крыс инфицированы St. aureus АЛФА –).
В процессе исследования проведены клинические наблюдения за животными, выполнены гистологические и гистоавторадиографические исследования тканей из края раны на 3, 7 и 14 день лечения после забоя крыс. Кроме того, изучены морфо – функциональные изменения в гипоталамо - гипофизарной нейросекреторной системе (ГГНС) у животных всех трех серий опытов, в указанные выше сроки. Исследованы тканевые структуры гипоталамуса, гипофиза. В указанные сроки забивали по 6 крыс каждой серии (по 3 крысы, инфицированные St. aureus АЛФА + и 3 крысы - St. aureus АЛФА –) для проведения морфологических исследований. Крыс умерщвляли путем декапитации под гексеналовым внутрибрюшинным наркозом(35-40мг/кг). Объекты исследованы на светооптическом и электронномикроскопическом уровнях. Эксперименты выполнялись с соблюдением принципов гуманности, изложенных в дериктивах Европейского сообщества(86/609/ЕЕС) и Хельсинской декларации по защите позвоночных животных, используемых для лабораторных и иных целей.
Полученные в ходе исследования данные обработаны с использованием параметрических методов вариационной статистики, в соответствии рекомендациям Е.В. Гублера, А.А. Генкина (1973).. Статистическую обработку данных проводили на IВМ РС AТ Рentium 4 в среде Windows ХР с использованием пакета программ Microsoft Excel версии 9,0.Определяли средние выборочные показатели измеряемых объектов, ошибку среднего, среднее квадратичное отклонение, доверительный интервал. За достоверность различий принимали значение р<0,05(по t-критерию Стьюдента), вероятность различий составляла 95% и более.
Результаты исследований и их обсуждение
Материалы проведенных клинических исследований 334 больных с трофическими язвами нижних конечностей различного генеза свидетельствуют о том, что наиболее эффективным оказалось использование милиацила и магнитолазеротерапии в комплексном консервативном лечении, чем применение милиацила и лазерного излучения, только милиацила или 1% раствора диоксидина и облепихового масла (табл. 2, рис. 1).
Использование милиацила и магнитолазеротерапии у больных основной группы приводило на 3 сутки лечения к значительному уменьшению гнойно – некротического содержимого язв, появлению сочных, зернистых, ярко – красных грануляций. При этом улучшалось общее состояние пациентов. На 7 сутки лечения содержимое язв было скудным, серозным, хорошо выявлялась краевая эпителизация. К 10 суткам трофические язвы у большинства пациентов заживали.
У больных первой контрольной группы на 3 день лечения милиацилом и лазерным излучением наблюдалось выраженное уменьшение гнойно – некротического содержимого язв, появление розовых грануляций. На 7 сутки комплексного консервативного лечения содержимое язв было серозным, в незначительном количестве. Язвы заполнялись зернистыми, ярко-красной окраски грануляциями. К 10 дню лечения язвы значительно уменьшались в размерах, отмечалась краевая эпителизация. К 15 дню у большинства пациентов трофические язвы заживали.
У второй контрольной группы при местном лечении трофических язв милиацилом происходили сходные с таковыми в первой контрольной группе изменения, но протекали они медленнее. К 21 дню у большинства больных этой группы наблюдалось полное заживление трофических язв.
У больных третьей контрольной группы на 3 день лечения язв 1% раствором диоксидина отличалось лишь незначительное уменьшение гнойного их содержимого. На 7 сутки лечения содержимое трофических язв оставалось прежнего характера, но в несколько меньшем количестве. К 14 дню лечения выявлялась слабая краевая эпителизация, язвы заполнялись грануляциями розового цвета, шел на убыль перифокальный воспалительный процесс. На 28 день лечения на поверхности язв сохранялись небольшие участки, содержащие гнойно-некротические массы. В среднем длительность заживления трофических язв в этой контрольной группе (при лечении язв 1% раствором диоксидина и далее облепиховым маслом) составляла 32 дня.
Таблица 2
Результаты лечения трофических язв в зависимости от способа лечения (M±m)
| Способы лечения | Сроки в днях | |||
| Очищение | Появление грануляций | Начало эпителизации | койко-день | |
| Милиацил и магнитолазеротерапия | 2,5 ± 0,1 | 2,3 ± 0,1 | 4,7 ± 0,1 | 12,6 ± 0,5 |
| Милиацил и лазерное излучение | 3,0 ± 0,1* | 2,7 ± 0,1* | 6,0 ± 0,2* | 15,6± 0,5* |
| Милиацил | 5,0 ± 0,2* | 4,5 ± 0,2* | 8,3 ± 0,2* | 20,8 ± 1,4* |
| Облепиховое масло, диоксидин | 8,8 ± 0,3* | 8,3 ± 0,2* | 13,1 ± 1,3* | 32,6 ± 1,3* |
Примечание: * - показатели, достоверно отличающиеся от таковых при применении милиацила и магнитолазеротерапии (p<0,05).
Рисунок 1 Сравнительные результаты лечения трофических язв у больных основной и контрольных групп.
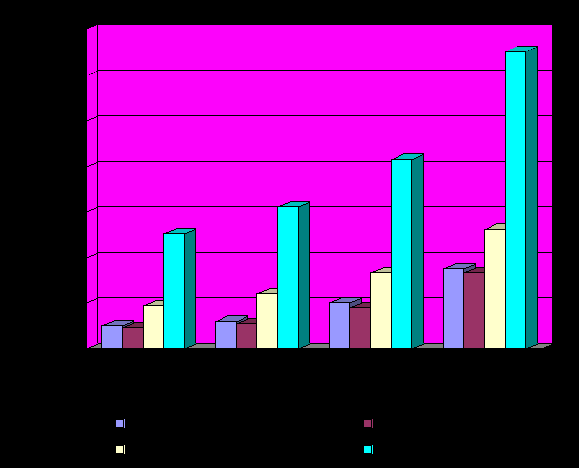
Приведенные данные, свидетельствуют о том, что по указанным показателям раневой процесс протекал более благоприятно у больных при сочетанном местном использовании милиацила и магнитолазеротерапии.
В среднем сроки лечения трофических язв нижних конечностей меньше у больных основной группы в 1,2 раза, чем у пациентов первой контрольной группы и соответственно в 1,6 и 2,5 раза, чем у больных второй и третьей контрольных групп.
О преимущественном воздействии милиацила и магнитолазеротерапии свидетельствуют и проведенные в динамике исследования площади заживления трофических язв (табл.3).
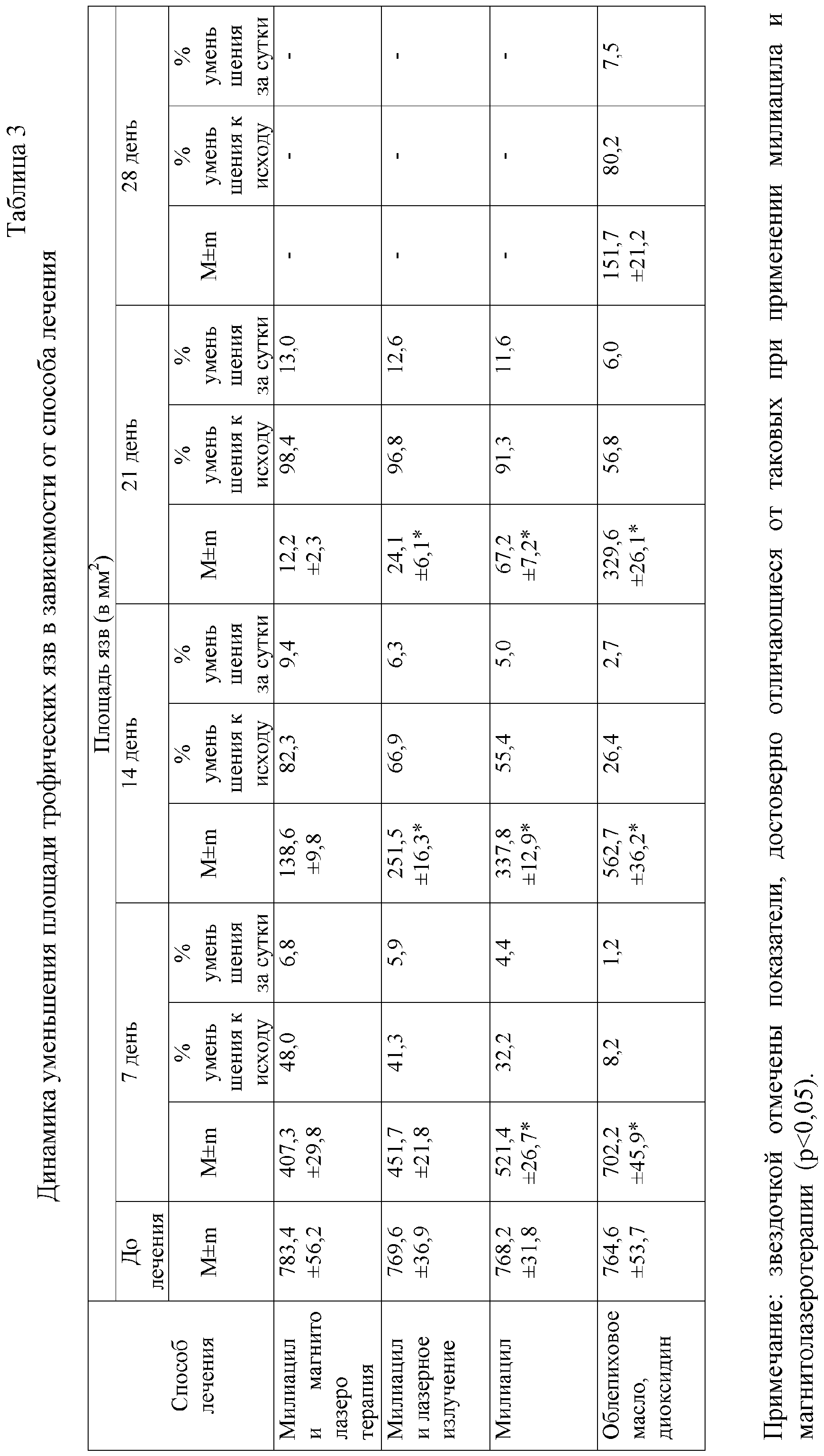
При сочетанном местном применении милиацила и магнитолазеротерапии полное заживление трофических язв выявлено у 92 (95,8%) из 96 больных, а частичное у 4 (4,2). Использованием милиацила и лазерного излучения полное заживление язв достигнуто у 55 (91,6%) из 60 больных, а частичное у 5 (8,4 %). При применении только милиацила из 59 больных полное заживление трофических язв выявлено у 51 (86,4 %) пациента, частичное у 8 (13,6 %). Местным лечением язв 1 % раствором диоксидина и облепиховым маслом достигнуто полное их заживление у 18 (60 %) из 30 больных и частичное – у 12 (40 %).
Использование милиацила и магнитолазеротерапии в лечении трофических язв позволяет также успешно применять аутодермопластику, операции на венах и нижних конечностей (табл. 4).
Таблица 4
Сроки предоперационного периода и стационарного лечения больных с трофическими язвами в зависимости от способа лечения (M±m)
| В  ид идоперации Группы больных | Аутодермопластика | Аутодермопластика и операции на венах нижних конечностей | Операции на венах нижних конечностей | |||
| Сроки в днях | ||||||
| предопе-рацион-ного периода | стацио-нарного лечения | предопе-рацион-ного периода | стацио-нарного лечения | предопе-рацион-ного периода | стацио-нарного лечения | |
| Основная группа (милиацил и магнитола-зеротерапия) | 3,9±0,4 | 12,9±0,6 | 6,2±0,5 | 20,5±0,5 | 11,7±0,5 | 21,4±0,9 |
| Первая контрольная группа (милиацил и лазерное излучение) | 5,3±0,3* | 16,2±0,6* | 7,7±0,4* | 24,7±0,6* | 15,4±0,7* | 26,3±0,6* |
| Вторая контрольная группа (милиацил) | 7,2±0,5* | 22,4±1,0* | 8,5±0,3* | 27,1±0,5* | 20,6±0,8* | 32,5±1,4* |
| Третья контрольная группа (1% раствор диоксидина и облепиховое масло) | 11,1±0,6* | 33,2±1,0* | 8,9±0,6* | 34,6±1,3* | 32,8±0,8* | 44,2±1,6* |
Примечание: * отмечены показатели, достоверно отличающиеся от таковых основной группы (p<0,05).
Сроки предоперационной подготовки трофических язв к аутодермопластике меньше у больных основной группы по сравнению с таковыми пациентами первой, второй и третьей контрольных групп соответственно в 1,3; 1,8 и 2,8 раза. При этом сроки пребывания в стационаре больных, в комплексном лечении которых применялась аутодермопластика, в основной группе меньше, чем у пациентов первой, второй и третьей контрольных групп в 1,2; 1,7 и 2,5 раза.
Сроки предоперационного периода после аутодермопластики перед операциями на венах нижних конечностей у больных основной группы меньше, чем у пациентов первой, второй и третьей контрольных групп в 1,2; 1,3 и 1,4 раза. Длительность пребывания в стационаре больных, в комплексное лечение которых входили аутодермопластика и операции на венах нижних конечностей у пациентов основной группы меньше, чем у больных контрольных групп соответственно в 1,2; 1,3 и 1,7 раза.
Сроки комплексного консервативного лечения трофических язв перед выполнением операций на венах нижних конечностей меньше, у больных основной группы по сравнению с аналогичными пациентами контрольных групп в 1,3; 1,7 и 2,8 раза.
При этом продолжительность стационарного лечения больных, у которых наступило заживление язв под воздействием комплексной консервативной терапии и в последующем, у которых выполнены оперативные вмешательства на венах нижних конечностей, меньше у пациентов основной группы, чем у пациентов первой, второй и третьей контрольных групп в 1,2; 1,5 и 2 раза.
Таким образом, местное сочетанное использование милиацила и физических методов (лучей лазера и особенно магнитолазеротерапии) в комплексном консервативном и оперативном лечении трофических язв нижних конечностей позволяет улучшить результаты лечения и получить значительный экономический эффект за счет сокращения сроков лечения.
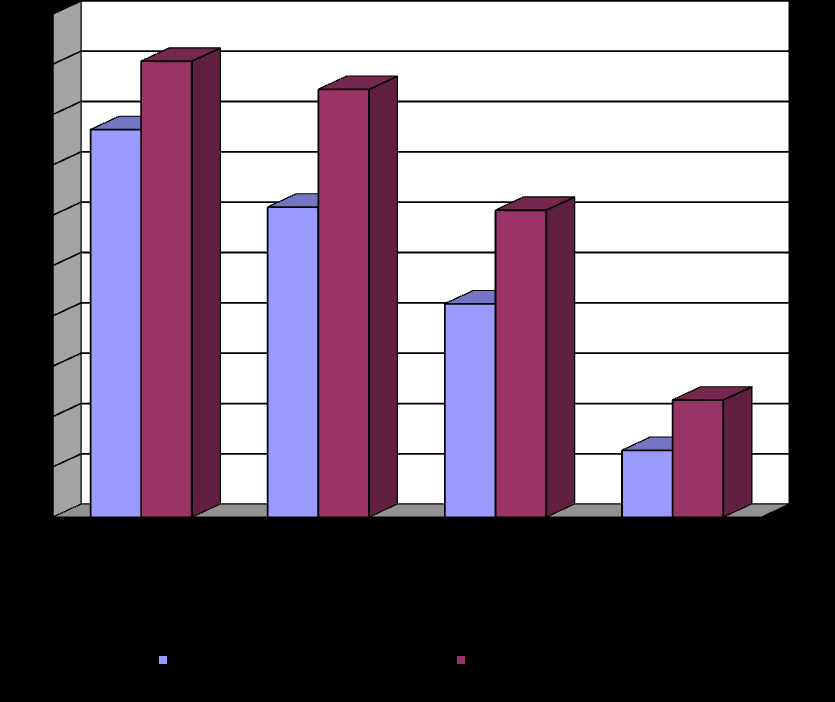
Клинические данные о более выраженном влиянии милиацила и магнитолазеротерапии на заживление трофических язв по сравнению с применением милиацила и лазерного излучения, только милиацила, 1 % раствора диоксидина и облепихового масла подтверждены микробиологическими исследованиями.
Через 7 дней лечения у 74 (77,0 %) из 96 больных основной группы микрофлора из трофических язв не высеяна. При этом обнаружено снижение числа больных с 36 до 6, у которых микроорганизмы выделены в виде ассоциаций. В конце лечения у 87 (90,6 %) пациентов основной группы микрофлора в посевах из язв не высеяна. Через 7 дней лечения у 37 (61,6 %) из 60 больных первой контрольной группы, у которых местно применяли милиацил и лазерное излучение, рост микрофлоры не выявлен. Снижение количества больных было с 18 до 8, у которых микроорганизмы выделены в виде ассоциаций. В конце лечения у 51 (85,0 %) пациентов этой группы микрофлора в посевах из трофических язв не высеяна. Через 7 дней лечения язв милиацилом больных второй контрольной группы у 25 (42,4 %) из 59 больных рост микрофлоры в посевах из язв не обнаружен. Установлено в этот срок уменьшение числа больных с 17 до 9, у которых микроорганизмы обнаружены в виде ассоциаций. В конце лечения у 36 (61,0 %) пациентов второй контрольной группы микрофлора из трофических язв не высевалась. Через 7 дней лечения у 4 (13,3 %) из 30 больных третьей контрольной группы, у которых местно использовали 1 % раствор диоксидина и облепиховое масло, рост микрофлоры в посевах из язв не установлен. Обнаружено снижение числа больных с 12 до 8, у которых микроорганизмы из язв высеяны в виде ассоциаций. В конце лечения лишь у 7 (23,3 %) больных рост микрофлоры из язв не выявлен (рисунок 2).
Рисунок 2. Отсутствие выделения микрофлоры из трофических язв в процессе лечения различными способами
Изучая с помощью световой и электронной микроскопии структурно – функциональную характеристику интраоперационного материала из трофических язв обнаружено, что в основном веществе соединительной ткани происходит накопление и перераспределение гликозаминогликанов за счет увеличения несульфатированных фракций, которым присуще выраженные гидрофильные свойства, обуславливающие повышение сосудистой и тканевой проницаемости, свойственных биологическим процессам воспаления. Коллагеновые волокна подвергаются дискомплексации, значительному разволокнению и набуханию. Изменения основного аморфного вещества и фибриллярных структур сопровождаются клеточными реакциями – лимфоцитарной, плазмоклеточной и гистиоцитарно – макрофагальной инфильтрацией. Выявлены паранекротические и некробиотические изменения эпителиоцитов, клеток фибробластического дифферона, эндотелиоцитов и адвентициальных клеток, гистиоцитов, адипоцитов как в дерме, так и в гиподерме. Установлено, что ультраструктурные изменения клеток осуществляются на фоне ограниченных явлений внутриклеточной регенерации, о чем свидетельствует низкая их пиронинофильность и малое количество (до полного их отсутствия) свободных рибосом и полисом.
Исследованием биоптатов трофических язв больных, у которых в комплексном лечении применяли 1 % раствор диоксидина и облепиховое масло, установлен выраженный очаговый отек тканей кожи, деструкция сосочкового и сетчатого слоев дермы с частыми мелкоочаговыми кровоизлияниями. Зачастую выявлялся мультифокальный интраэпидермальный некроз. В гиподерме отмечался значительный отек с неравномерной инфильтрацией полиморфноядерными лейкоцитами и некрозом адипоцитов, эндотелиальных и адвентициольных клеток.
К 15 суткам лечения число деструктивно измененных лейкоцитов, эндотелиоцитов и фибробластов снижается. Тем не менее, воспалительный процесс продолжает быть пролонгированным. Образование грануляционной ткани носит умеренный, гетеротопный характер, сопровождается микроциркуляторными нарушениями. Причем наиболее значительные изменения установлены в глубоких отделах трофических язв.
Применение милиацила в комплексном лечении трофических язв достоверно уменьшало некротические и некробиотические процессы в тканях. Установлены ультраструктурные критерии, свидетельствующие о регенераторном и мембранопротекторном воздействии милиацила, обнаруженные на тканевом, клеточном и субклеточном уровнях эпителиальной и соединительной тканей. Данный способ местного лечения трофических язв способствовал лучшей и более адекватной их эпителизации, отмеченной через 6 и 15 дней лечения. Вероятно, это связанно с тем, что в этих случаях происходит восстановление оптимальных эпителио – соединительнотканных взаимоотношений, определяющие эффективный репаративный гистогенез.
Более благоприятные результаты лечения, выявленные при сочетанном использовании милиацила и лучей лазера, подтверждены морфофункциональными исследованиями тканей язв. Обнаружено усиление лейкоцитарной и макрофагальной реакции, ускорение купирования воспалительного процесса и отделения некротических масс. Более активным оказалось образование грануляционной ткани за счет интенсификации васкулогенеза, мобилизации малодифференцированных (адвентициональных и фибробластических клеток).
На ультраструктурном уровне выявлено, что для этих клеток характерны крупные ядра с деконденсированным хроматином, слабое развитие мембранных компартментов и большое количество свободных рибосом (полисом). Число митозов увеличивалось на 17 – 20 % по сравнению с другими способами лечения (применение диоксидина и облепихового масла, только милиацила). Наряду с усилением синтеза ДНК и репродуктивной способности клеток фибробластического дифферона происходила активизация процесса фибриллогенеза. При этом более интенсивное образование грануляционной ткани сопровождалось ускорением процессов эпителизации поверхности трофических язв.
Самые выраженные позитивные изменения в тканях язв выявлены при местном сочетанном использовании милиацила и магнитолазеротерапии. Обнаружены эффекты синтеза ДНК у эндотелиальных, адвентициальных клеток, фибробластов (табл. 5) на фоне уменьшения числа эндотелиоцитов с признаками кариопикноза.
Таблица5
Морфометрические показатели, характеризующие клетки в области трофических язв в зависимости от способа их лечения (M±m).
| | Группа больных | |||||
| Контрольная группа (милиацил) | Контрольная группа (милиацил и лучи лазера) | Основная группа (милиацил и магнитолазеро-терапия) | ||||
| 7 сутки | 14 сутки | 7 сутки | 14 сутки | 7 сутки | 14 сутки | |
| Карио-пикноз эндотелио-цитов, % | 9,2 ± 1,2 | 12,6 ± 3,2 | 8,3 ± 1,1 | 7,1 ± 2,2 | 9,8 ± 1,4 | 9,7 ± 1,6 |
| Синтез ДНК эндотелио-цитов, % | – | 0,06 ±0,01* | – | 0,11± 0,01* | 0,19±0,03 | 0,24±0,04 |
| Синтез ДНК фибро-бластов, % | – | 0,15± 0,03 | – | 0,12± 0,01 | 0,13±0,01 | 0,17±0,06 |
| Синтез ДНК адвенти-циальных клеток, % | – | 0,07±0,01* | – | 0,09± 0,01 | 0,16±0,01 | 0,19±0,06 |
Примечание: * – показатели, достоверно отличающиеся от таковых при использовании милиацила и магнитолазеротерапии (p<0,05).
При этом происходила функциональная активизация клеток фибробластического дифферона, включая миофибробласты, что подтверждалось ультраструктурными показателями состояния синтеза органелл. Это также отражено и исследованием экспрессии проапоптотического гена p 53 (%) , который индуцирует синтез циклинзависимых киназ, ингибирующих пролиферативную активность клеток. Таким образом, мы установили, что при развитии трофических язв очевидно реализуются различные факторы, которые приводят к существенным нарушениям генетического аппарата клеток фибробластического ряда. Тот факт, что р53 позитивные клетки обнаруживаются (группах больных без предложенного лечебного комплекса), говорит в пользу продолжительной неблагоприятной следовой реакции. Это может приводить к накоплению патологически измененных клеток в области трофической язвы. В свою очередь данные процессы завершаются некрозом на фоне межтканевой дезинтеграции, что было ранее показано при огнестрельных ранениях кожно-мышечных и костных структур. Установлено, что у пациентов, леченных местно милиацилом и магнитолазеротерапией, данный показатель составил 9,18 ± 0,15, что достоверно меньше (p<0,05) в сравнении с аналогичным показателем больных, у которых в лечении трофических язв применяли милиацил и лучи лазера (10,4 ± 0,26), больных, леченных только милиацилом (17,85 ± 1,42) и пациентов, у которых использовали 1 % раствор диоксидина и облепиховое масло (20,72 ±1,64).
Милиацил и магнитолазерное излучение стимулирует пролиферативную активность клеток раневой области и приводит к лимитированию апоптотической доминанты (противоапоптозное действии табл.18). При этом при применении 1 % раствора диоксидина и облепихового масла, проведенными исследованиями обнаружено, что пролиферативная активность клеток была существенно снижена на фоне интенсивной экспрессии гена р53 и подавления экспрессии гена bcl 2.Последний показатель при лечении трофических язв нижних конечностей 1% раствором диоксидина и облепиховым маслом составил 0,9±0,05%. Он был ниже (р<0,05) аналогичного при использовании милиацила (1,3±0,03%), милиацила и лучей лазера (1,5±0,05%), милиацила и магнитолазеротерапии (1,7±0,06%).
Таким образом, комплексными клиническими, микробиологическими и морфофукциональными исследованиями воздействия милиацила и магнитолазеротерапии при лечении трофических язв нижних конечностей различного генеза выявлена высокая их эффективность. Милиацил и магнитолазеротерапия могут быть успешно применены при подготовке больных с трофическими язвами к оперативным вмешательствам (аутодермопластике, операциям на венах нижних конечностей). Сокращение сроков лечения в сравнении с аналогичными при использовании применяемых способов позволяет получить значительный экономический эффект. Осложнений при применении милиацила и физических методов воздействия не наблюдали. Материалы экспериментальных исследований, проведенных на 54 белых беспородных крысах, представлены в таблице 6. Данные таблицы свидетельствуют о высокой эффективности сочетанного применения милиацила и магнитолазеротерапии в лечении гнойно-воспалительного процесса у крыс. Сроки заживления гнойных ран у крыс основной серии опытов, леченных местно милиацилом и магнитолазеротерапией (6,9±0,3 сут.), меньше аналогичных у животных, у которых использовали только милиацил (11,0±0,3 сут.) и крыс, которым лечение не проводилось (не заживали к 14 суткам).
Приведенные в таблице 6 данные также свидетельствуют о том, что статистически достоверных различий сроков заживления гнойных ран у крыс, инфицированных стафилококком с антилактофериновой активностью (АЛФА+) и микробным штаммом стафилококка без антилактофериновой активностью (АЛФА-) нет в основной серии. В основной серии эксперимента у крыс, леченных милиацилом и магнитолазеротерапией, заживление гнойных ран, инфицированных St.aureus АЛФА +( 7,3±0,3дней) и St.aureus АЛФА- (6,6 ±0,3 дней) происходит почти в одни и те же сроки (Р>0,05),что не отмечено в контрольных сериях. Это обусловлено значительным противовоспалительным и стимулирующим репаративную регенерацию тканей действием милиацила и магнитолазеротерапии.
Таблица 6
Результаты лечения гнойных ран крыс в зависимости от характера местного воздействия и свойств стафилококков.
| Серии опытов | Стафило-кокк | Сроки (в днях) | |||
| Очищение ран | Появление грануляций | Начало эпителизации | Заживление | ||
| Первая контроль-ная серия (без лечения) | АЛФА+ | 9,0 ±0,3** * | 8,3 ± 0,3 ** * | 10,3 ± 0,3** * | На 14 сутки не происхо-дило заживления |
| АЛФА- | 7,3 ± 0,3** | 6,3 ± 0,3 ** | 8,3 ± 0,3 ** | ||
| | |||||
| Вторая контроль-ная серия (милиацил) | АЛФА+ | 4,7 ± 0,2** | 4,3 ± 0,2** | 7,3 ± 0,3** | 12,3 ± 0,3** * |
| АЛФА- | 4,5 ± 0,2** | 4,0± 0,4** | 7,0 ± 0,6** | 9,7± 0,3 ** | |
| | |||||
| Основная серия (милиацил и магнито-лазеро-терапия | АЛФА+ | 3,2 ± 0,2 | 2,8 ± 0,2 | 5,3 ± 0,3 | 7,3 ± 0,3 |
| АЛФА- | 3,1 ± 0,2 | 2,7± 0,2 | 5,0 ± 0,6 | 6,6± 0,3 | |
Примечание: * - достоверность различий показателей в зависимости от штамма стафилококка
** - достоверность различий показателей от таковых основной серии.
Гистологический анализ исследованных объектов у животных, которые не подвергались лечебной коррекции, показал, что в целом морфологические изменения в раневой области полностью укладывались в картину общеизвестного течения раневого процесса (альтерация тканевых структур, экссудация, пролиферация малодифференцированных клеток).
При детальном светооптическом и ультраструктурном исследовании идентифицированы главным образом некротический и дегенеративно – воспалительный типы гисто-, цитограмм. Гистологические и цитологические характеристики раневого процесса у экспериментальных животных, инфицированных St.aureus c антилактофериновой активностью ( АЛФА+) и без антилактофериновой активностью (АЛФА-) отражены в таблицах7,8.
В первые 3 суток наблюдаются некротические изменения эпидермиса, сосочкового и сетчатого слоев дермы, гиподермы, дериватов кожи (волосяных фолликулов, сальных и потовых желез). При этом в воспалительном экссудате превалируют нейтрофильные гранулоциты. Последние подвергаются деструкции, трансформируясь в «гнойные тельца». Здесь же регистрируются лимфоциты, макрофаги, некротизированные клетки эпителия и соединительной ткани, немногочисленные фибробласты, леймиоциты, адипоциты. Эти клетки подвергаются гистолизу.
В более поздние сроки наблюдений (7-14 суток) область некротически измененных тканей ограничивается валом малодифференцированной (грануляционной) соединительной тканью. Последняя богата новообразованными гемокапиллярами, через стенку которых продолжается диапедез форменных элементов крови.
Таблица 7
Гистологическая и цитологическая характеристика
раневого процесса у экспериментальных животных инфицированных St.aureus без антилактофериновой активности ( АЛФА-)
| Показатель,% | 3 сут | 7 сут | ||||
| Без лечения | Милиацил | Милиацил и магнито-лазеро-терапия | Без лечения | Милиацил | Милиацил и магнито-лазеро-терапия | |
| Число лейкоцитов (абс.) в усл. полях зрения* | 96,2 ± 6,1 | 60,1 ± 2,7* | 74,6 ± 5,0* | 57,1 ± 4,1 | 44,2 ± 3,6 | 46,8 ± 3,2 |
| Деструкция лейкоцитов % | 95,5 ± 1,6 | 58,8 ± 6,1* | 44,0 ± 2,2* | 69,8 ± 4,2 | 42,1 ± 2,4* | 31,1 ± 3,0* |
| Кариопикноз эндотелио-цитов % | 31,6 ± 3,2 | 32,4 ± 4,0 | 17,6 ± 2,1* | 28,8 ± 1,4 | 30,6 ± 3,4 | 14,6 ± 1,1* |
| Макрофаги % | 2,6 ± 0,4 | 2,8 ± 0,5 | 9,2 ± 1,6* | 4,6 ± 1,1 | 3,6 ± 1,4 | 12,2 ± 3,6 |
| Фибро-бласты % | – | – | 0,2 ± 0,01 | 1,1 ± 0,1 | 2,0 ± 0,3* | 8,8 ± 1,2* |
| Плазмати-ческие клетки % | – | – | 0,03 ± 0,01 | – | – | 0,07 ± 0,01 |
| Эпителио-циты % | единич-ные клетки | единичные клетки | единичные клетки | единич-ные клетки | единичные клетки | группы дедиффе-ренциро-ванных и пролифе-рирующих клеток |
* окулярная вставка 25 мм2: микроскоп МБИ -15,об. 90, ок. 10
Примечание: звездочкой отмечены показатели, достоверно отличающиеся от таковых контрольной группы ( без лечения), Р<0,05.
Таблица8
Гистологическая и цитологическая характеристика
раневого процесса у экспериментальных животных инфицированных St.aureus с антилактофериновой активности ( АЛФА+)
| Показа-тель,% | 3 сут | 7 сут | ||||
| Без лечения | Милиацил | Милиацил и магнито-лазеро-терапия | Без лечения | Милиацил | Милиацил и магнито-лазеро-терапия | |
| Число лейкоци-тов (абс.) в усл.полях зрения* | 98,8 ± 6,1 | 86,6 ± 6,2 | 79,9 ± 5,5* | 87,6 ± 3,6 | 74,4 ± 4,7 | 69,8 ± 4,7* |
| Деструк-ция лейкоци-тов % | 100 | 83,3 ± 4,4* | 77,6 ± 4,5* | 82,4 ± 6,6 | 65,5 ± 2,2* | 65,1 ± 3,2* |
| Карио-пикноз эндотелио-цитов % | 100 | 60,2 ± 4,1* | 50,2 ± 6,1* | 91,1 ± 5,1 | 55,2 ± 3,1* | 48,8 ± 4,4* |
| Макро-фаги % | 4,2 ± 1,1 | 5,0 ± 1,2 | 12,4 ± 2,2* | 7,6 ± 2,2 | 6,1 ± 1,4 | 19,8 ± 2,4* |
| Фибро-бласты % | – | – | – | – | 2,1 ± 0,4 | 11,2 ± 2,1 |
| Плазмати-ческие клетки % | – | – | – | – | – | 0,12 ± 0,04 |
| Эпителио-циты % | – | – | единичные клетки | единичные клетки | единичные клетки | группы дедифе-ренциро-ванных и пролифе-рирующих клеток |
* окулярная вставка 25 мм2: микроскоп МБИ -15,об. 90, ок. 10
Примечание: звездочкой отмечены показатели, достоверно отличающиеся от таковых контрольной группы ( без лечения), Р<0,05.
Следует особо подчеркнуть то обстоятельство, что во всех исследованных объектах серии (то есть без использования средств лечебной коррекции) эпителиальные структуры в раневой области находились в состоянии деструкции, некробиоза без формирования пограничных
«пиогенных мембран», что является неблагоприятным обстоятельством в аспекте отграничения некротизированных структур от жизнеспособных тканей.
Поэтому, в ряде случаев гнойных экссудат распространялся диффузно в дерме и гиподерме, вплоть до подлежащих мышечных структур (миосимпластов). Наши светооптические и электронно-микроскопические исследования показали, что некоторая (немногочисленная) часть камбиальных клеток эпидермиса, волосяных фолликулов, потовых и сальных желез сохранила потенции к реализации своих регенераторных свойств. Среди них определяются клетки дедифференцированного статуса (крупные светлые ядра с деконденсированным хроматином, узкий ободок цитоплазмы с большим количеством свободных рибосом – полисом). Данные клетки демонстрировали позитивную реакцию на монокланальные антитела bcL – 2.
Тем не менее численность подобных клеток была не велика в ранние сроки эксперимента с прогрессивным уменьшением к 14 суткам эксперимента.
Применением милиацила во второй контрольной серии эксперимента установлено в сравнении с первой контрольной серией более выраженное усиление лейкоцитарной и макрофагальной реакции, быстрее на убыль идет воспалительный процесс. Более активнее происходит репаративная регенерация тканей(образование грануляционной ткани, эпителизация раневой поверхности).
В этой связи, исходя из целевой установки клинической хирургии, предполагающей разработку и использование наиболее эффективных мер лечения раневых дефектов, мы в эксперименте апробировали оригинальный способ использования милиацила в сочетании с магнитолазеротерапией.
Установлено, что применение данного комплексного воздействия на раневой дефект экспериментальных животных позитивно влияло на ход репаративных процессов в моделируемой раневой области. Прежде всего это касалось характера и течения альтернативной и экссудативной фаз воспаления. Так, зона некротических изменений эпидермиса, его дериватов и структур дермы, гиподермы (через 3 суток) у нелеченных животных составила 73-81±2,8%, а у животных получавших лечебную коррекцию (милиацилом и магнитолазеротерапией) – 55,6 – 57, 8 ± 1,9%. Через 7 суток этот показатель составил соответственно: 69,7±1,9% и 23,9 ±2,7%.
Определение митотического индекса и анализ ДНК – синтетической способности эпителиоцитов, эндотелиальных клеток, фибробластов в этих группах экспериментальных животных показали, что применение предложенного лечебного метода в 2,2 – 3 раза повышало репродуктивную активность указанных клеточных элементов, локализованных в ране (в сравнении с таковой нелеченных животных и крыс, у которых использовали только милиацил). Мы обратили внимание на то обстоятельство, что в условиях применения милиацила и магнитолазеротерапии наблюдается значительный гетероморфизм клеток фибробластического ряда (более выраженный, нежели в контроле). Были идентифицированы: малодифференцированные фиброкласты, функционально активные фибробласты, миофибробласты, фиброкласты, фиброциты. При этом, использование милиацила и магнитолазерного воздействия создавало условия для лучшей сохранности и функционирования первых трех морфологических типов фибробластов (рис.3).
Отмечалась также активизация макрофагов в раневой области. Часть подобных клеток включала радиоактивную метку 3Н – тимидина (рис.4), что безусловно свидетельствовало о стимуляции их ДНК – синтетической способности. Создавались более благоприятные условия для последующей дифференцировки грануляционной ткани и продолжающегося васкулогенеза.
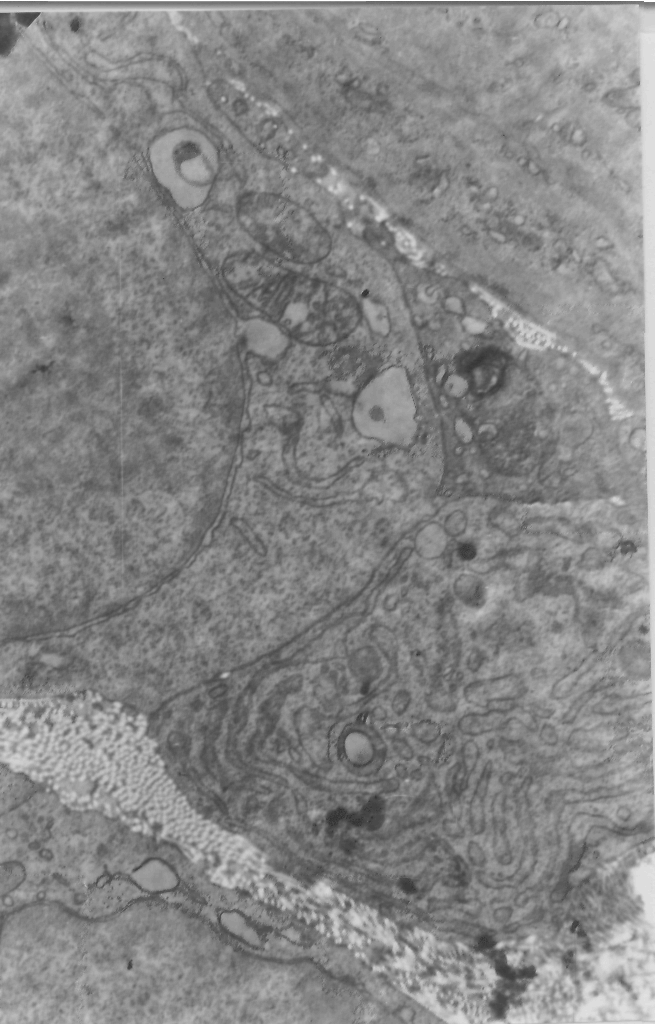
Рис.3.Фибробласты, участвующие в коллагеногенезе
Ув. х 22500
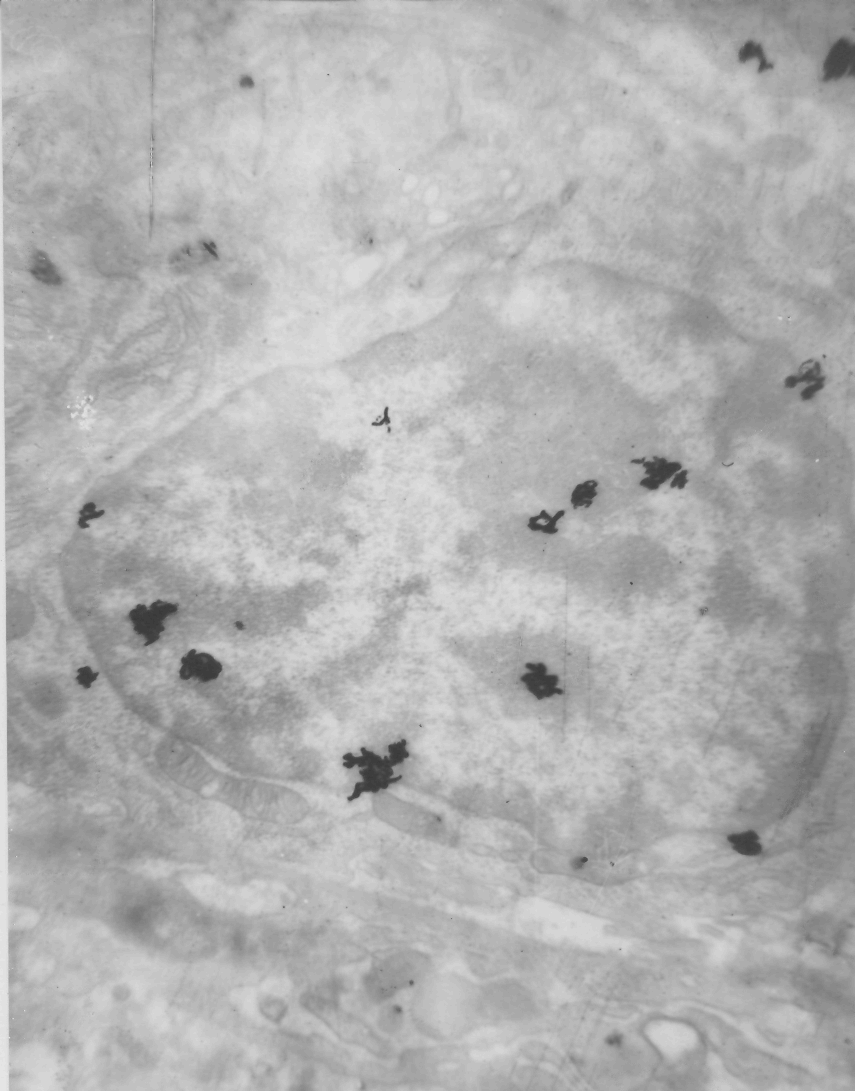
Рис.4. Гистоавтограф макрофага, локализованного в раневой
области
Электронная гистоавторадиография (3Н тимидин) по Larra et Drozz
Ув. х 28000
Ведущую роль в репаративных процессах принадлежит функционально специализированными фибробластами. Наиболее характерной чертой их ультраструктурной организации являлась гиперплазия гранулярного эндоплазматического ретикулума, представляющего собой систему канальцев с локальными расширениями, распространяющейся в парануклеарной зоне. Именно такой тип фибробластических клеток превалировал в ранах у животных, получавших лечебную коррекцию милиацилом, особенно в сочетании с магнитолазеротерапией. Следует заметить, что в контрольных группах животных, численность описываемых клеток был в 1,7 – 2,2 раза меньше (по срокам наших наблюдений).
Данные факты со всей очевидностью показывают то, что применение милиацила и магнитолазеротерапии в ходе лечебной коррекции раневого процесса существенно активизируют репарацию соединительной ткани, тем самым создавая адекватные условия для реализации ткане- и органоспецифических потенций в ходе репаративных гистогенезов. Об этом свидетельствовали следующие факты. Новообразование малодифференцированной грануляционной соединительной ткани в случае
лечебного воздействия милиацила в сочетании с магнитолазеротерапией
приводило к мобилизации камбиальных элементов, адвентициальных клеток миоэпителиальных клеток желез кожи, базальных эпителиоцитов покровного эпителия ,малодифференцированных клеток волосяных фолликулов.
В следующем разделе диссертации приводим сведения о морфофункциональной реорганизации ГГНС с параллельной оценкой репаративных процессов в области раневого дефекта, в том числе в условиях инфицирования и его лечебной коррекции. Такой подход обусловлен тем, что состояние нонапептидергической нейросекреторной системы гипоталамуса (супраоптические и паравентрикулярные ядра) прежде всего всегда коррелируют с тяжестью процессов дезадаптации организма (в том числе в ситуациях, связанных с развитием осложнений в клиническом течении ран). С другой стороны, изменения в ультраструктуре нейросекреторных клеток (НСК) рассматриваются как критериальные показатели эффективности тех или иных лечебных мероприятий.
В частности показано, что рассинхронизация фаз секреторного цикла клеточных элементов крупноклеточных ядер гипоталамуса у экспериментальных животных, подвергнутых воздействию дестабилизирующих факторов, включая ситуации с неблагоприятным течением раневых процессов, приводит к ограничению защитно-приспособительных реакций и лимитированию репаративных процессов тканей различного генеза ( А.А. Стадников, 2001).
Наши исследования показали, что у экспериментальных животных происходит усиление функционирования ГГНС, сочетающееся с активизацией аденогипофизарно-адренокортикальной системы .
Так через 3 суток от начала эксперимента происходит достоверное возрастание размеров ядер, ядрышек и цитоплазмы «светлых» (функционально активных) НСК супраоптических и паравентрикулярных ядер гипоталамуса.
При этом в эти же сроки наблюдений в условиях инфицирования ран St.aureus c антилактофериновой активностью (АЛФА+) мы отметили явления задержки (блокировки) высвобождения нейросекрета в общий кровоток на уровне аксовазальных комплексов нейрогипофиза. Одновременно отмечены процессы ультраструктурных нарушений кортикотропоцитов аденогипофиза (баллонная дилатация канальцев эндоплазматического ретикулума, набухание митохондрий и разрушение их крист, возрастание в цитоплазме числа ламеллярных телец и липосом). Среди НСК регистрируются клетки с признаками апоптоза, что не наблюдалось у крыс при инфицировании без антилактофериновой активностью St. аureus (АЛФА-).
В этой связи мы делаем заключение о том, что экспериментально моделируемый дефект тканей на фоне инфицирования приводит не только к активизации гипоталамической нонапептидергической нейросекреции, но и к дефициту адаптивных нонапептидов, а также угнетению гипоталамо-гипофизарной адренокортикальной системы (особенно на стадии 14 суток эксперимента). Об этом свидетельствует ультраструктурный анализ кортикотропоцитов аденогипофиза. Ультраструктурный анализ НСК супраоптических и паравентрикулярных ядер гипоталамуса в эти сроки наблюдений показал серьезные повреждения органелл синтеза нейросекрета (дискомплексация эндоплазматического ретикулума и диктиосом комплекса Гольджи, увеличение липосом). Одновременно значительно возрастает численность пикноморфных НСК с признаками кариопикноза и кариорексиса.
В своей совокупности полученные и проанализированные нами факты еще раз подтверждают результаты, ранее полученные в лаборатории кафедры гистологии Оренбургской государственной медицинской академии о том, что раневой процесс различной локализации, осложненный инфицированем, может протекать на фоне разбалансировки продукции и высвобождении гуморальных факторов центрального (гипоталамического) звена нейроэндокринной регуляции, что безусловно ограничивает реализацию их адаптогенного влияния на гистологические структуры (А.А.Стадников,2001).
Данные проведенных нами экспериментальных исследований показали, что позитивное действие милиацила и физических факторов в лечении гнойно- некротического процесса коррелирует с нормализацией гипоталамической нонапептидергической нейросекреции, существенно нарушенной в условиях инфицирования раневых дефектов персистентными штаммами микроорганизмов (рис.5,6). В своей совокупности эти данные свидетельствуют о развитии адаптивного ответа гипоталамо-гипофизарной нейросекреторной системы, как ведущего центрального звена регуляции клеточного и тканевого гомеостаза.
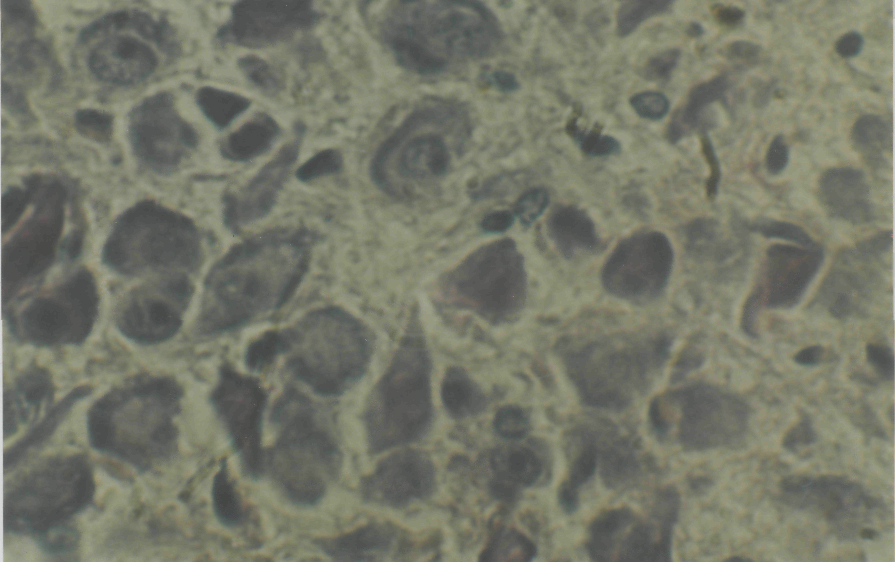
Рис. 5. Окраска паральдегид-фуксином по Гомори-Габу
Ув. х об.90,ок.10.
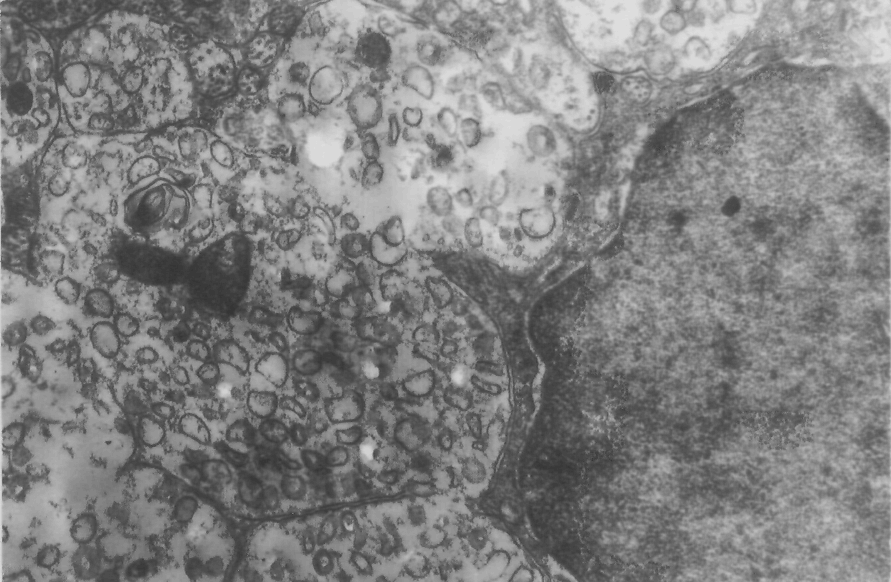
Рис.6 Электронограмма
Ув. х 24500
