Программа элективного курса для обучающихся 9 класса основной школы Томск 2006
| Вид материала | Программа |
- Методическое пособие для учителя к программе элективного курса для обучающихся 9 класса, 459.09kb.
- Программа элективного курса для обучающихся 9 класса основной школы Тип элективного, 53.13kb.
- Исламова Римма Николаевна 10 (11) класс По программе 1 час в неделю, всего 34 часа., 223.41kb.
- Приказ № от 2011 г Программа элективного курса для учащихся 9 класса «Технология, 108.88kb.
- Программа элективного курса для обучающихся 9 -10 классов Юрга 2004, 381kb.
- Программа элективного курса по химии химия в промышленности, 943.59kb.
- Ульянова Галина Михайловна, учитель химии школы №167 санкт-петербург программа, 118.75kb.
- Рабочая программа адресована учащимся 7 класса средней общеобразовательной школы, 458.59kb.
- Программа элективного курса по экономике «Азбука экономики», 26.81kb.
- Программа элективного курса «Решение задач по физике» (1ч в неделю, всего 34часа), 115.81kb.
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ, СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 28 Г. ТОМСКА

Химия и жизнь
Программа элективного курса для обучающихся 9 класса основной школы

Томск 2006
Рекомендовано к изданию НМС МОУ СОШ №28
Химия и жизнь: программа элективного курса для обучающихся 9 класса основной школы. - Составитель: Петенёва Л.М.. – Томск, 2006.
В данном сборнике представлена программа элективного курса «Химия и жизнь» для обучающихся 9 классов с подробными разработками материалов к данному курсу. Тип элективного курса предметно-ориентированный.
Пояснительная записка
В связи с переходом школ на профильное обучение учащиеся уже в основной школе должны сделать важный для их дальнейшей судьбы выбор профиля или вида будущей профессиональной деятельности. Обучение в профильной школе требует всесторонней подготовки. Опыт работы с учащимися показывает, что в основном выбор профиля обучения учащегося связан с симпатией к конкретному учителю, с классным руководителем, ориентирован на выбор одноклассников, определяется мнением родителей. При таком выборе ученик зачастую не заинтересован в процессе обучения. К моменту окончания средней школы выясняется, что выпускник не определился, не выбрал дальнейший путь обучения и профессию.
Для успешного решения этой проблемы учителю необходимо найти средство, помогающее сделать выпускнику основной школы правильный выбор. Этому способствует введение элективных курсов, как вариативной части учебного плана 9 класса.
Элективный курс «Химия и жизнь» ориентирован вызвать и поддержать познавательный интерес к химии у тех обучающихся, у которых он возник, обеспечить базу для дальнейшего обучения в профиле, связанного с естественнонаучными дисциплинами, а также на формирование у обучающихся навыков исследовательской работы. В отличии от базового курса химии программа элективного курса содержит в основном практические задания, которые выявляют и развивают склонности обучающихся к эксперименту, интерес к предмету, к открытиям в науке. Большое внимание уделяется в программе экологическим проблемам современности.
Курс носит межпредметный характер. Он тесно связано с такими дисциплинами как биология, экология, математика. Рекомендован обучающимся 9-х классов.
В результате прохождения программного материала обучающийся имеет представление о
- методике проведения химического эксперимента;
- глобальных экологических проблемах, экологических проблемах Томской области и г. Томска;
- проектной деятельности;
- видах мониторингов окружающей среды;
- методах социологических исследований.
Знает
- разные виды концентрации веществ;
- способы расчета концентрации веществ;
- качественные реакции на катионы и анионы;
- практическое применение знаний по химии в быту;
- методики проведения мониторингов и социологических исследований.
Умеет
- рассчитывать и готовить растворы разных концентраций;
- проводить качественные реакции на катионы и анионы;
- проводить мониторинг загрязнения окружающей среды;
- проводить социологические исследования
- вести диалог, дискуссию, интервьюирование;
- составлять план проведения исследования, анкеты для социологических опросов.
Владеет
- навыками публичного выступления с использованием различных средств наглядности;
- коммуникативными умениями: аргументировано, четко и ясно формулировать выводы, доказательства, работать в группах, парах и др.,
- элементами исследовательской и проектной деятельности.
Цель данного курса: создать условия для оценки обучающимися своих возможностей продолжения образования в выбранном профиле, познакомить с экспериментальными методами в науке, содействовать формированию у обучающихся углубленных знаний по химии и практическому их применению в жизни.
Задачи
- формировать систему знаний по химии;
- совершенствовать умения при поведении химического эксперимента (научить обучающихся рассчитывать и готовить растворы разных концентраций, разным способам расчета концентрации веществ, проведению качественных реакций на катионы и анионы);
- создать основу для понимания глобального экологического кризиса, рационального природопользования;
- научить оформлению и анализу полученных результатов при проведении мониторинга окружающей среды и социологических исследований;
- сформировать навык публичного выступления;
- создать условия для развития мышления, интеллектуальных и творческих способностей обучающихся в процессе приобретения знаний по химии с использованием различных источников информации, в том числе и информационных технологий.
В структуре изучаемой программы выделяются следующие основные разделы
- «Знакомство с техникой безопасности в химической лаборатории, химической посудой, приборами, реактивами».
- «Растворимость. Растворы»
- «Водные ресурсы и качество воды»
- «Безопасная химия»
- «Правовые основы охраны окружающей среды в России»
- « Защита проектов»
При выборе форм и методов работы будут использованы следующие методики: междисциплинарная интеграция, содействующая становлению целостного мировоззрения; интерактивность (работа в малых группах, имитационное моделирование, метод проектов); проведение экологического мониторинга микрорайона школы, социологических опросов.
Планируемые результаты
- сознательное самоопределение ученика относительно профиля дальнейшего обучения;
- развитие системы программных знаний и умений по химии;
- развитие познавательных интересов, интеллектуальных и творческих способностей обучающихся на основе опыта приобретения новых знаний, анализа и оценки новой информации;
- получение представления о широком практическом использовании предметных знаний;
- приобретение опыта поиска информации по выбранной теме и представление ее в виде проекта.
Измерители достижения планируемых результатов:
- степень активности обучающихся на занятиях;
- качество сообщений обучающихся, выполнение практических и исследовательских работ;
- качество представленных проектов как формы презентации личных достижений;
- уровень социальной зрелости обучающихся, выраженный в готовности участвовать в экологических акциях, реализации разработанных проектов, в готовности сделать осознанный выбор будущего профиля (выявляется через практическую деятельность, в процессе бесед с обучающимися, их родителями)
Курс завершается проектной работой, в которой обучающийся должен продемонстрировать полученные знания и умения.
Программа элективного курса «Химия и жизнь» рассчитана на 17 часов
2.ОРГАНИЗАЦИЯ СОДЕРЖАНИЯ ОБРАЗОВАНИЯ
Учебно-тематический план
| Наименование разделов и тем | Количество часов | Формы контроля | ||
| Всего | Лекции | Практика | ||
| Раздел 1.Техника безопасности в химической лаборатории
Итого по разделу | 0.5 0.5 1 2 | 0.5 0.5 1 | 1 1 | Зачет Отчет |
| Раздел 2 Растворимость. Растворы.
Итого по разделу | 1 1 1 3 | 1 1 | 1 1 2 | Защита результатов Защита результатов Защита результатов Зачетная работа |
| Раздел 3 Водные ресурсы и качество воды 3.1 Водные ресурсы и качество воды. 3.2 Очистка грязной воды 3.3 Определение качества воды. Анализ воды. 3.4 Загрязнение воды ионами тяжёлых металлов. Итого по разделу. | 2 1 1 1 5 | 2 2 | 1 1 1 3 | Защита результатов Защита результатов Защита результатов |
| Раздел 4 Безопасная химия 4.1 Лекарства и яды 4.2 Опыты с простыми лекарственными препаратами (определение качественного состава глицерина, йодной настойки, борной кислоты и др.) Итого по разделу | 1 3 4 | 1 1 | 3 3 | Защита результатов Выпуск рабочей тетради с итогами работы |
| Раздел 5 Правовые основы охраны окружающей среды в России 5.1 Основы природоохранного законодательства России (Конституция РФ) 5.2 Экономическое право и экологическое законодательство. Итого по разделу | 1 1 2 | 1 1 2 | | |
| Раздел 6 Защита проектов | 1 | | 1 | Проекты |
| Всего | 17 | 7 | 10 | |
3. СОДЕРЖАНИЕ ПРОГРАММЫ
Раздел 1 Техника безопасности в химической лаборатории
Тема 1. Правила по технике безопасности при работе в химической лаборатории. Практическая работа «Химическая посуда, приборы, реактивы».
Тема 2. Практическая работа «Простейшие химические и физические операции»
Раздел 2 Растворимость. Растворы.
Тема 1. Растворимость. Растворы. Физико-химические свойства растворов Растворимость твердых веществ, газов. Концентрация растворов: процентная, молярная, нормальная.
Тема 2. Практическая работа «Приготовление рабочих растворов для кабинета химии с долей вещества (% концентрация) »
Тема 3. Практическая работа «Приготовление рабочих растворов для кабинета химии с молярной и нормальной концентрацией»
Раздел 3. Водные ресурсы и качество воды
Тема l. Водные ресурсы. Распределение вод гидросферы. Пресные и морские воды, их минерализация. Жесткость воды и способы ее устранения.
Тема 2. Абиогенное загрязнение вод. Всепланетный круговорот воды. Кислотные дожди. Вода как сырье. Применение в промышленности закрытых цехов по использованию воды необходимое условие сохранение окружающей среды.
Тема 3. Измерения и метрическая система (СИ). Мерная посуда. Практическая работа «Очистка грязной воды»
Тема 4. Практическая работа «Определение качества воды. Анализ воды»
Тема 5. «Практическая работа «Загрязнение воды ионами тяжелых металлов»
Раздел 4 Безопасная химия
Тема 1. Лекарства и яды. Самые простые из лекарств: КМНО4. Н2О2.
I2 (настойка), борная кислота, аспирин. Состав этих веществ, свойства, применение в быту.
Тема 2 Практическая работа «Определение качественного состава глицерина, йодной настойки, перманганоя калия, борной кислоты» Тема 3. Практическая работа «Определение качественного состава карандаша ляписного, фосфата натрия, тиосульфата натрия»
Тема 4. Практическая работа «Определение качественного состава этилового спирта, аспирина, уротропина»
Раздел 5 Правовые основы охраны окружающей среды в России.
Тема 1. Основы природоохранного законодательства России (Конституция РФ). Краткая история развития российского природоохранного законодательства.
Тема 2. Экономическое право и экологическое законодательство.
Раздел 6. Защита проектов
ВОЗМОЖНЫЕ ТЕМЫ ПРОЕКТОВ
- «Динамика изменения химического состава в помещениях школы в течение дня».
- Пищевые продукт. Анализ некоторых продуктов, поступающих в продажу через магазины на наличие добавок.
- Свойства воды, исследование проб воды на территории микрорайона «Черемошники».
- «Чистая вода в нашем доме».
- Сколько стоит стакан чистой воды?
- Анализ моющих веществ, применяемых для посуды.
- О химии в стихах (творческий).
ДИДАКТИЧЕСКИЕ МАТЕРИАЛЫ
Занятие №1
Тема: Изготовление простейших приборов.
Цель занятия: ознакомить учащихся с простейшими навыками работы со стеклом: резанием трубок, изготовление капилляров, запаивание трубок; проделыванием в пробках отверстий заднего диаметра; научиться готовить детали и собирать простейший прибор, соблюдая меры предосторожности.
Оборудование: стеклянные трубки диаметром от 3 до 7мм., напильники, спиртовки, каучуковые резиновые пробки, свёрла, колбы.
Выполнение работы:
- Инструктаж по ТБ при работе со стеклом.
- Резание стеклянных трубок.
- Обработка концов стеклянных трубок.
- Изготовление изогнутых стеклянных трубок.
- Изготовление трубок с оттянутым концом.
- Изготовление пипеток.
- Обработка пробок
А) каучуковых
Б) корковых
VIII. Изготовление простейших приборов.
Рис.1 Рис.2 Рис3
- Привести в порядок рабочее место. Будьте внимательны! Убирая осколки стекла, можно легко поранить рук
Занятие №2
Тема: Растворы, их приготовления.
Цель занятия: закрепление теоретического материала для приготовления растворов и работы с ними.
Оборудование: колбы, мерные цилиндры, соли, кислоты, весы, разновесы.
Ход занятия.
- Теоретическая часть.
- Растворы – твёрдая или жидкая однородная система, состоящая из двух или более компонентов.
 Растворы
Растворыненасыщенные насыщенные перенасыщенные
(можно ещё (при данной температуре (содержит
растворить данное скорость растворения растворённого
вещество) скорость осаждении) вещества больше,
чем требуется
для насыщенного
раствора)
 Вещества
ВеществаЛегко растворимые малорастворимые практически нерастворимые
( в 100г. H2O (0,01 – 1г. ) (0,о1г.)
раств. 10г. вещества
и больше)
Абсолютно нерастворимых веществ нет.
- Практическая часть
- Инструктаж по ТБ
- Приготовление 500г. 5% раствора СuSO4. В лаборатории есть кристоллогидрат СuSO4 * 10 H2O
Мг (СuSO4* 10 H2O)= 250
Мm (СuSO4* 10 H2O)= 250г/моль
Мг (СuSO4 )= 160
Мm (СuSO4 )= 160г/моль
В 250г. СuSO4 * 10 H2O – 160г. СuSO4
Х – 25г. СuSO4
Х= 250*25 = 39г. СuSO4 * 10 H2O
160
m (H2O) = 500г. – 39г. = 461г.
ω = m(вещества) ; m(вещества)= ω* m (раствора); m(СuSO4 )= 0,025*500=25г.
m (раствора)
- Отмерить цилиндром 461г. H2O, отвесить 39г. СuSO4 * 10 H2O и приготовить раствор.
- Приготовленный раствор разместить в стеклянные ёмкости с надписью «СuSO4» для использования на уроках химии.
Занятие №3
Тема: Приготовление раствора кислоты из более концентрированного.
«Сначала – вода, потом – кислота, иначе – беда!»
Цель работы: приготовить 100г. 2% раствора серной кислоты из более концентрированного раствора.
Приборы и реактивы: набор ареометров, цилиндр для определения плотности растворов, термометр, мерные цилиндры вместимостью 10-25 и 100мл, стаканы вместимостью 150-200мл, раствор серной кислоты 10-20%, ёмкость для слива приготовленного раствора.
Выполнение работы:
- Определить плотность исходного раствора.
- Вычислить необходимые объёмы исходного концентрированного раствора и воды для приготовления заданного раствора.
Для расчёта удобно пользоваться правилом диагональных схем (правило «креста»):
ω
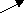
 1 m1
1 m1
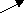 ω
ωω2 m2 (1)
ω – это массовая доля заданного раствора, ω1 - массовая доля концентрированного раствора, ω2 – массовая доля раствора, используемого для разбавления (в случае с водой ω2 =0), m1 и m2 – массы исходных растворов, устанавливающие соотношения, в которых следует смешивать исходные растворы:
m1 = ω1 – ω2
m2 = ω1 – ω.
Масса и объём раствора взаимосвязаны через плотность соотношением:
Плотность раствора
Ρ = mp-pa/V (2)
2
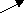
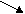
 0 2 1 Соотношение массовых долей
0 2 1 Соотношение массовых долей
 ω исходного 20% раствора серной кислоты
ω исходного 20% раствора серной кислоты0 18 9
10 – Сумма массовых долей
Обозначая массу 20% раствора серной кислоты через Х , составим соотношения и рассчитаем массы кислоты воды:
100/10 = Х/1, Х= 100/10, Х=10 (г 20% раствора серной кислоты).
Масса воды: 100 – 10=90 (г воды).
Воспользовавшись формулой (2), рассчитаем объёмы растворов кислоты и воды, предварительно узнав, что плотность 20% раствора серной кислоты равна 1139кг/м3, плотность воды приблизительно равна 1000кг/м3.
Мерным цилиндром на 100мл отмерить рассчитанный объём воды и вылить в стакан. Другим цилиндром на 10-25мл отмерить необходимыё объём раствора серной кислоты и малыми порциями при помешивании внести в стакан с водой. Охладить раствор до 200С, определить его плотность.
Полученный раствор разместить в стеклянные ёмкости для использования растворов на уроках химии.
Занятие №4
Тема: Анализ воды из природного водоёма, водопроводной.
Цель: познакомить с простейшими способами анализа воды, определением её качества.
Оборудование: образцы воды из разных источников, мерный цилиндр высотой 30см и диаметром 2,3см. 0,03% раствор KMnO4, кольцо из медной проволоки диаметром меньше диаметра цилиндра, колбы, химические стаканы, мыло.
Ход занятия.
- Теоретическая часть.
- Обсуждение проблемы пресной воды на планете. (Доклады, сообщения).
- Основные проблемы пресной воды (Доклады).
- Обсуждение проблемы пресной воды на планете. (Доклады, сообщения).
- Практическая часть.
Инструктаж по ТБ,
- Определение запаха воды по таблице t0 воды = 20-400С.
Оценка запаха воды
| Интенсивность запаха | Описательное определение | Балл |
| Нет | Отсутствие ощутимого запаха | 0 |
| Очень слабый | Запах ощущается опытным наблюдателем, не ощущается потребителем | 1 |
| Слабый | Запах не привлекает внимания потребителя, но обнаруживается наблюдателем | 2 |
| Заметный | Ощущается легко каждым человеком | 3 |
| Отчётливый (сильный) | Запах обращает на себя внимание, делает воду неприятной для питья | 4 |
| Очень сильный | Запах настолько сильный, что делает воду непригодной для питья | 5 |
Если 2 балла – пригодна для использования в быту.
- Определение прозрачности.
На дно цилиндра положите кольцо проволоки и доливайте постепенно воду, пока кольцо видно. Высота столба воды, при котором кольцо становится невидимым, является мерой прозрачности.
Либо под цилиндр положите стандартный лист с высотой букв 3,5мм.
3. Определение плотности.
Налить воду в цилиндр, опустить ареометр. Записать показания прибора с точностью до третьего знака после запятой.
4. Окисляемость.
В пробирку налить 10мм H2O, добавить 3 капли 0,03% раствора KMnO4, оставить на 20мин. Сравнить окраску:
- малиновая окраска сохранилась - H2O удовлетворительная;
- красная окраска - H2O подозрительная;
- желто-бурая - H2O недоброкачественная.
Вода пригодная для питья:
- знак в баллах – не более 2х
- прозрачность – не менее 30см.
5. Жёсткость воды (приблизительная).
В пробирку налить 10мл H2O и кусочек мыла (1см х 1см х 1см), встряхивать периодически в течение 5 минут, дать отстоятся, написать внешний вид полученных растворов: есть осадок в виде хлопьев, много осадка или мало, прозрачный раствор или нет.
Занятие №5
Тема: Анализ воды на анионы и катионы.
Цель: состоит в качественном определении 2х катионов и 2х анионов в различных образцах воды.
Оборудование: химическая посуда, реактивы: BaCl2, AgNO3, KCNS, NaC2O4, образцы воды, дистиллированная вода.
Ход работы.
- Теоретическая часть.
Для определения количества и химического состава, находящихся в водных растворах ионов, существует широкий набор методов. В этой работе вы будите использовать методы, которые действительно могут использоваться для проверки наличия в воде тех или иных ионов.
В каждом опыте вы будите наблюдать за изменением окраски раствора или появлением нерастворимого осадка. В случае положительного результата вы можете быть уверенными, что анализируемый ион присутствует в растворе. Однако отрицательный результат (цвет не изменился или осадок отсутствует) не обязательно означает. Что тот или иной ион отсутствует в растворе. Ион может присутствовать в таком малом количестве, что изменение цвета или образование осадка не заметно.
Для анализа берём:
- стандартный раствор H2O;
- водопроводная вода;
- вода из частного сектора;
- контроль (дистиллированная вода)
Результаты опытов занести в таблицу наблюдений.
| Растворы | Цвет | Осадок | Содержится ли ион? |
| Стандартный раствор, содержащий Fe3+ | | | |
| Водопроводная вода | | | |
| Контроль | | | |
| Стандартный раствор, содержащий Ca2+ | | | |
| Водопроводная вода | | | |
| Контроль | | | |
| Стандартный раствор, содержащий Cl- | | | |
| Водопроводная вода | | | |
| Контроль | | | |
| Стандартный раствор, содержащий SO42- | | | |
| Водопроводная вода | | | |
| Контроль | | | |
При проведении опытов тщательно перемешивайте содержание пробирки.
Если метод исследования основан на изменении цвета, то поместите лист белой бумаги сзади или сбоку от пробирки. Сравнивайте окраску раствора, полученного при работе с контролем (дистиллированной водой).
II. Практическая часть.
Реакция на ионы Fe (III), (Fe3+).
Для проведения реакции в пробирку налить 2 мл. стандартного раствора, добавить 3 капли раствора тиоцианата калия (KCNS). Перелейте раствор. Запишите результаты в таблицу наблюдений.
Провести данную реакцию с водопроводной водой, дистиллированной водой.
Fe3+ (водн.) + CNS- -- > Fe(CNS) 2+(водн.) (красная окраска)
Реакция на ионы Ca2+.
В пробирку налить 2мл раствора сравнения, добавить 3 капли CH3COOH (раствор), добавить 3 капли раствора оксалата натрия (Na2C2O4).
Записать в таблицу наблюдений.
Ca2+(водн.) + C2O42(водн.) -- > CaC2O42(тв)↓
Провести данную реакцию с водопроводной и дистиллированной водой.
Реакция на ионы хлора (Cl-).
В пробирку налить 2мл раствора сравнения, добавить 3 капли AgNO3.
Тщательно перемешайте раствор.
Ag+ (водн.) + Cl-(водн.) -- > AgCl(тв)↓
Реакция на сульфат- ионы (SO42-).
В пробирку налить 2мл раствора сравнения, добавить 3 капли BaCl2.
Тщательно перемешайте раствор.
Ba2+ + SO42- -- > Ba SO4 (белый)↓
Повторить эту реакцию с другими образцами. Данные занести в таблицу.
Занятие №6
Тема: Сколько стоит стакан чистой воды?
Цель: ознакомиться с качеством питьевой воды в своём населённом пункте, способами её улучшения, ассортиментом и принципами работы бытовых фильтров для очистки воды.
Хозяйственная цель: выбрать оптимальную модель фильтра для всей семьи.
Проект выполняется учащимися индивидуально, по желанию, или группами по 2-3 человека. Желательно, чтобы объектом изучения стали 2-3 различных типа фильтров.
Ход работы.
Бытовые фильтры для дополнительной очистки водопроводной воды стали неотъемлемым атрибутом жизни современных россиян. На рынке представлено множество различных моделей этих устройств. Какую из них выбрать? По каким показателям оцениваются бытовые фильтры? Это имеет большое значение для многих семей.
Задания и вопросы.
- Если ваша семья уже пользуется фильтром для очистки воды, исследуйте его преимущества и недостатки.
- Поинтересуйтесь, какими фильтрами пользуются ваши родственники, соседи, друзья. Предложите своим товарищам, которые уже изучают химию, провести такое же исследование в своей семье. Совместно обсудите полученные результаты.
- Постарайтесь найти в газетах, журналах, рекламных проспектах информацию о других моделях фильтров и изучите её.
- По каким показателям принято оценивать качество питьевой воды?
- Что вы знаете о качестве воды, которой пользуются житель вашего населённого пункта, в том числе и ваша семья?
- Из каких источников вы получили информацию?
- Как вы оцениваете качество воды, которой пользуетесь (по пятибалльной шкале)?
- В какое время года вода особенно загрязнена?
- Какие посторонние запахи присущи воде, которую вы используете (хлора, горюче-смазочных материалов, неизвестных химических соединений, гнили, навоза и т.д.)?
- Как вы оцениваете жёсткость воды (мягкая, жёсткая, очень жёсткая)? По каким признакам вы оцениваете жёсткость воды?
- Знаете ли вы нормы содержания примесей в питьевой воде и название документа, которым они регулируются
- Сформулируйте выводы :
- есть ли необходимость в дополнительной очистке воды, которой пользуется ваша семья для питья и приготовления пищи;
- если такая необходимость есть, то какие именно показатели воды нужно улучшить (жёсткость, неприятный запах и др.).
Для самых любознательных.
В любом населённом пункте, где есть станция водоочистки, регулярно проводятся химические анализы воды. Попробуйте получить информацию о результатах анализов воды, которая поступает в водопроводную сеть вашего населённого пункта. Этими данными обычно обладают санитарно-эпидемиологические службы (СЭС), лечебные и оздоровительные учреждения.
Вспомните всё, что вы уже знаете о бытовых фильтрах для воды.
- Что вы знаете о принципах действия бытовых фильтров для очистки воды?
- Какие вещества чаще всего используют в качестве наполнителя фильтров для очистки воды?
- Благодаря каким процессам происходит очистка воды бытовыми фильтрами?
- Есть ли в вашей семье фильтр для воды, и какой марки?
- Какими ещё марками фильтров вы пользовались?
- По каким характеристикам различаются фильтры?
- Возьмите упаковку от фильтра, которым пользуется ваша семья (или попросите в магазине рекламную листовку), и заполните таблицу.
| Название модели | | |
| Тип фильтра (кувшинный, насадка на кран) | | |
| Срок службы кассеты | | |
| Ресурс кассеты | | |
| Наполнитель кассеты | | |
| Эффективность очистки воды: от активного хлора, % от фенола, % от хлорорганических соединений (хлороформ), % от токсичных металлов (медь, свинец), % от нефтепродуктов, % | | |
| Подходит ли для очистки воды повышенной сложности | | |
| Стоимость кассеты, р. | | |
| Стоимость 1л очищенной воды | | |
| Ежедневный расход питьевой воды семьёй | | |
| Срок службы одной кассеты | | |
| Количество кассет, которые необходимо приобрести в течение года | | |
| Общий расход средств на очистку воды для семьи в течение года | | |
- Если в вашей семье ещё нет фильтра, постарайтесь собрать информацию о 2-3х моделях, выполните экономические расчёты и посоветуйте родителям, какую модель лучше приобрести.
- Проведите в классе презентацию той модели фильтра, которую вы считаете наиболее подходящей для дополнительной очистки питьевой воды в вашем населённом пункте.
- Составьте список тех источников информации, которые вы использовали при выполнении проекта.
Занятие №7
Тема: Проверьте свой образ жизни.
Цель: Углубить знания учащихся о здоровом образе жизни.
Ход занятия.
- Теоретическая часть.
- Здоровый образ жизни (беседа с учащимися).
Таблица самоконтроля.
| | Всегда | Иногда | Никогда |
| Курение Если вы не курите, запишите себе 10 очков и переходите к следующему разделу. | | | |
| I. 1. Я избегаю курения. | 2 | 1 | 0 |
| II. Алкоголь и наркотики. 1. Я избегаю использовать алкоголь, наркотики 2. Я читаю соответствующие инструкции и следую предписаниям при употреблении лекарств. | 4 2 | 1 1 | 0 0 |
| III. Привычка в еде. 1. Питаюсь разнообразно: фрукты, овощи, хлеб, каши, мясо, молоко. 2. Избегаю есть жирную пищу, пирожные 3. Ограничиваю количество соли 4. Избегаю есть продукты, содержащие сахар. Кондитерские изделия | 4 2 2 2 | 1 1 1 1 | 0 0 0 0 |
| IV. Физические упражнения. 1. Поддерживаю оптимальный вес 2. Занимаюсь физической подготовкой | 3 3 | 1 1 | 0 0 |
| V. Стрессовый контроль. 1. Моя работа или занятия мне нравятся 2. Я легко отдыхаю и свободно выражаю свои чувства 3. У меня есть близкие друзья, с которыми могу обсуждать проблемы 4. Я легко преодолеваю стрессовые ситуации 5. У меня есть любимое хобби | 2 2 2 2 2 | 1 1 1 1 1 | 0 0 0 0 0 |
Что означает набранная сумма.
9-10 ответов
Вы ведёте правильный образ жизни
6-8 ответов
Ваши привычки приемлемы, но их можно и улучшить. Обратите внимания на ваши ответы на «Иногда», «Никогда».
3-5 ответов
Ваше здоровье в опасности! Вы можете начать правильную жизнь прямо сейчас!
- Избегайте сигарет.
- Алкоголь и здоровый образ жизни не совместимы.
- Будьте осторожны пари употреблении лекарств.
- Будьте разборчивы в еде.
- Учитесь держать себя в руках.
Практическая часть.
Лекарственные вещества.
Многие домохозяйки используют таблетки аспирина при консервировании овощей. Можно ли так делать?
- Растолките в ступке 1т. Аспирина.
- Растворите в пробирке с водой.
- Добавьте несколько капель хлорида железа (III).
- Встряхните содержимое пробирки.
Аспирин + вода = фенолпроизводное + уксусная кислота
Фенолпроизводное – яд.
На основании этого опыта можно сделать вывод: аспирином не следует злоупотреблять в качестве лекарств, использовать при консервировании, добавлять в воду для срезанных цветов.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
При изучении данного элективного курса используются практические работы, при выполнении которых используется химическая посуда, реактивы. Это требует соблюдение определенных правил поведения в кабинете химии и техники безопасности при выполнении практических работ.
- Правила работы в лаборатории.
- Работать в кабинете химии можно только в присутствии учителя. Нельзя ставить никаких опытов, которые не одобрены учителем.
- Забота о безопасности начинается ещё до того, как вы приступили к опытам. Предварительно надо прочитать инструкции и продумать смысл всех операций и назначение оборудования.
- Перед работой надо убрать всё лишнее, включая книги.
- проверьте, что написано на этикетке той посуды, из которой вы берёте реактивы. Учтите, что некоторые химические формулы и названия могут отличаться друг от друга всего одной какой-нибудь буквой или цифрой, но это будут совсем разные вещества.
- При выполнении опыта вам может быть предложено, набрать в свою пробирку или стакан некоторое количество вещества из общей банки. Никогда не кладите в банку ничего из своей посуды, даже если вы взяли чего-либо в избытке.
- Избегайте лишних движений и разговоров в кабинете.
- Никогда не пробуйте на вкус никакие реактивы. Не приносите жевательную резинку, пищевые продукты и напитки.
- никогда не пытайтесь заглядывать внутрь пробирки сверху – только сбоку, через стенку. Никогда не направляйте открытый конец пробирки к себе или в сторону вашего соседа.
- О всяком происшествии, даже самом незначительном, надо сразу же сказать учителю.
- Не стесняйтесь спрашивать обо всём, в чём у вас есть сомнения!
- МЕТОД ПРОЕКТОВ.
Одним из методов организации учебного процесса предполагается использования метода проектов, в основе которого лежит развитие познавательных, творческих навыков обучающихся, умений самостоятельно конструировать свои знания, ориентироваться в информационном пространстве. Работа по методу проектов предполагает не только наличие и осознание какой-то проблемы, но и раскрытие ее, решение. А это включает четкое планирование действий, наличие замысла или гипотезы решения выдвинутой проблемы, распределение ролей для каждого участника при групповой работе.
Основные требования к использованию метода проектов.
- Наличие значимой в исследовательском, творческом плане проблемы (задачи) требующей исследовательского поиска для ее решения (см. возможные темы проекта).
- Практическая, теоретическая, познавательная значимость предполагаемых результатов.
- Самостоятельная (индивидуальная, парная, групповая) деятельность обучающихся.
- Определение конечных целей совместных или индивидуальных проектов.
- Структурирование содержательной части проекта с указанием поэтапных результатов.
- Использование исследовательских методов:
- определение проблемы, вытекающих из нее задач исследования;
- выдвижение гипотезы их решения, обсуждение методов исследования;
- оформление конечных результатов;
- анализ полученных данных;
- подведение итогов, корректировка, выводы.
- определение проблемы, вытекающих из нее задач исследования;
Этапы работы методом проектов.
Начальный этап. Учитель и ученик (в случае групповой деятельности – ученики) определяют проблемы проекта, сюжетную ситуацию с учетом социальных и познавательных интересов обучающихся, уточняют и конкретизируют цели и задачи.
Организационный этап. Ученики распределяют роли в сложившихся группах, планируют работу, выбирают формы и способы презентации предполагаемых результатов по своему желанию, учитывая, однако, рекомендации учителя.
Деятельностный этап. Самостоятельная работа обучающихся, работа с информационными источниками, подготовка презентации результатов. Учитель контролирует эту деятельность, при необходимости дает консультации.
Завершающий этап. Учитель обобщает и резюмирует полученные результаты, подводит итоги обучения. Обучающиеся демонстрируют понимание проблемы, найденные способы ее решения, умение планировать и осуществлять совместную деятельность.
ЛИТЕРАТУРА ДЛЯ УЧИТЕЛЯ
- Алекберова Л.Ю. Занимательная химия /АСТ-ПРЕСС-, 1999,
- Артеменко А.И. Органическая химия и человек: учеб. пособие
/ Артеменко А.И.- М: Просвещение, 2000.
- Гололобов М.Ю. Химия и общество. / Гололобов М.Ю М: Дрофа, 2004
- Злотникова Э.Г. Внеклассная работа по химии: метод. пособие
/ Злотникова Э.Г. -М.: Просвещение, 2004
- Кузьменок Н. М. Экология на уроках химии: метод. пособие /Кузьменок Н. М.- Минск, 1996.
- Пичугина Г.В Химия и повседневная жизнь: / Пичугина Г.В. -М.: Дрофа, 2004
- Сибнева Е.И.. Современные открытые уроки химии 8-9 классы.: метод. пособие / Сибнева Е.И. - Ростов - на Дону:
Феникс, 2002.
- Фадеева Г.А. Химия и экология: метод. пособие / Фадеева Г.А. - Волгоград: Учитель, 2004
ЛИТЕРАТУРА ДЛЯ УЧАЩИХСЯ
- Кузьменко Н.Е. Справочник школьника по химии. – М.: «Мир и образование».- 2003.
- Николаев Л.А. Химия жизни. – М.: «Просвещение». –1973.
- Рудник В.А. Фабрика чистой воды. – Киев, «Техника» - 1984.
- Феликс Р. Патури Зодчие XXI века. – М.: «Прогресс». 1980.
- Штремпер Г.И. Химия на досуге. – Фрунзе – 1990.
- Фадеева Г.А. Химия и экология: метод. пособие / Фадеева Г.А. - Волгоград: Учитель, 2004
Приложение 1.
ТЕХНОЛОГИИ XXI ВЕКА
Выполнил: Баранов Алексей
Руководитель: Петенёва Лидия Максимовна
Видеть изнутри.
Не останавливаться
на достигнутом.
Цель:
Познакомить с новыми технологиями ХХI века в водоочистке, проведение экспертизы на опасных производственных объектах: химических, нефтехимических производствах.
Задачи:
- знакомство с научно-техническими комплексами при ТГПУ: НИИ интроскопии;
- достижения томских учёных в разработке диагностических приборов;
- современные способы очистки воды.
НИИ электронной интроскопии при Томском политехническом университете был образован в 1968 году.
Основное научное направление – разработка научных основ, технических средств и методов дефектоскопии.
Переносные моноблочные рентгеновские аппараты для промышленного применения.
Рентгеновский и бетатронный интроскопы – предназначены для неразрушающегося контроля сварных соединений, сосудов высокого давления.
Компактные медицинские электронные ускорители МИБ-6э, БМ-10э - предназначен для лучевой терапии больных.
Система измерения уровней нефтепродуктов «Термозонд-300» - предназначен для измерения уровня и температуры светлых нефтепродуктов.
Слабополяризирующиеся хлорсеребряные электроды – для регистрации ЭКГ.
Большое значение имеет разработка комплекса водоподготовки серии «Лотос», над которой работает лаборатории, под руководством А.А. Мынка.
- Только 40% населения Земли обеспечены качественной питьевой водой
- Массовые инфекционные заболевания населения Томска в XXвеке, высокая смертность – таковы были негативные последствия употребления недоброкачественной воды.
- В мире около 80% болезней человека являются следствием потребления воды низкого качества, так как с водой в организм попадают патогенные микробы, тяжёлые металлы и так далее.
Фильтры для очистки воды.
Существуют бытовые фильтры:
Преимущество:
- просты в обращении;
- не уступает по качеству бутилированной питьевой воде;
- можно использовать для приготовления детского питания.
Недостатки:
- старая кассета не только практически не очищает воду, но и загрязняет её теми примесями, которые были поглощены сорбентом за период её использования.
- ресурс фильтра – 300литров, стоимость 1 литра – 0, 57 рублей. Дорого.
В недрах томской области подземные воды имеют широкое распространение и связаны с отложениями разного возраста, от палеозойского до четвертичного. Использование подземных вод в хозяйстве области самое разнообразное. Наиболее широко они используются при организации хозяйственно-питьевого водоснабжения.
Обеспеченность населения области ресурсами подземных вод питьевого качества неограниченна. Среднесуточный расход Томского водозабора превышает 200тыс м3/сутки.
В городской черте на территориях различных предприятий действует около 170 одиночных водозаборных скважин.
Подземные воды на территории Томской области, в большинстве случаев, не соответствует требованиям санитарных норм и правил (Сан Пин 2.1.4.1074 - 01) Госкомсанэпидемнадзора России из-за характерных для западной Сибири природных условий формирования их химического состава. В водах повышенного содержания железа, кремния, марганца, бромидов, но очень низкая концентрация фтора.
Подземные воды обладают повышенной мутностью нередко цветностью, так как в них присутствуют повышенные концентраты растворённых органических веществ гумидного типа. В нефтеносных и газоносных районах области подземные воды характеризуются иногда значительным содержанием нефтепродуктов, фенолов, и водорастворённых газов – метана, сероводорода. Поэтому перед использованием подземных вод в питьевых целях требуется специальная подготовка для удаления избытков железа, марганца, органических составляющих и других компонентов, понижающих физические свойства питьевых вод.
Основные факторы, обуславливающие низкое качество водопроводной воды по санитарно-химическим показаниям:
- высокая природная концентрация в подземной воде железа, марганца, аммиака, кремния;
- отсутствие в составе головных водопроводных сооружений санитарной водоочистки;
- низкая эффективность работы имеющихся на водопроводах санитарной водоочистки.
Фильтры не заменимы на дачах, в домах, в городских условиях для очистки от побочных продуктов хлорирования.
Нередко городские очистные сооружения просто не справляются с объёмом и разнообразием загрязнений природной воды, снижение жёсткости воды.
АНКЕТИРОВАНИЕ
- Если ваша семья уже пользуется фильтром для очистки воды, исследуйте его преимущество и недостатки.
- Какими фильтрами пользуются ваши родственники и соседи? (кувшины).
- Что вы знаете о качестве воды, которой пользуются жители вашего района, ваша семья?
- Как вы оцениваете жёсткость воды, которой пользуетесь (по пятибалльной системе).
- Как вы оцениваете жёсткость воды (мягкая, жёсткая, очень жёсткая)? По каким признакам вы оцениваете жёсткость воды?
| Вопрос | Кол-во человек | Да | Нет |
| 1. Если ваша семья уже пользуется фильтром для очистки воды, исследуйте его преимущество и недостатки. | 62 | 30 | 32 |
| 2. Какими фильтрами пользуются ваши родственники и соседи? (кувшины). | 62 | 30 | 32 |
| 3. Что вы знаете о качестве воды, которой пользуются жители вашего района, ваша семья? | 62 | 12 | 50 |
| 4. Как вы оцениваете жёсткость воды, которой пользуетесь (по пятибалльной системе). | 62 | 5б – 8; 4б – 30; 3б – 18; 2б – 12; | |
| 5. Как вы оцениваете жёсткость воды (мягкая, жёсткая, очень жёсткая)? По каким признакам вы оцениваете жёсткость воды? | 62 | Все ответили, что вода жёсткая, много накипи. | |
Учёные НИИ интроскопии разработали и успешно внедряют современную, экологически чистую технологию, создано новое устройство обескремнивания воды. Учёные разрабатывали вакуумно-эжекционное устройство, эффективность которого в 3-4 тысячи раз выше простого аэратора производительность комплекса - от 1,0 до 100 м3/час.
Установки «Лотос» нужны в любом населённом пункте, хоть в большом, хоть в своём маленьком. Ростов-на-Дону, Уренгой, Чита, Ханты-Мансийск, Чажемто, Колпашево, Кемерово – города и посёлки, где работают установки «Лотос».
В НИИ ждут молодых, талантливых и креативных специалистов.
Литература:
- Астафуров В.И. «Основы химического анализа» М., 1986.
- Осипова М.А. «Методы оценки качества водных объектов» Томск, «Дельтаплан» 2004.
- Пичурина Г.В. «Химия и повседневная жизнь», М., «Дрофа» 2004.
