«Военно-медицинская академия имени С. М. Кирова»
| Вид материала | Автореферат |
| Схема проведения экспериментального исследования Результаты исследований и их обсуждение |
- «Военно-медицинская академия имени С. М. Кирова», 449.26kb.
- «Военно-медицинская академия имени С. М. Кирова», 465.69kb.
- «Военно-медицинская академия им. С. М. Кирова», 377.83kb.
- «Военно-медицинская академия им. С. М. Кирова», 327.67kb.
- Кувакин Владимир Иванович Заслуженный деятель науки РФ доктор медицинских наук профессор, 361.78kb.
- Осложненных фибрилляцией предсердий, 434.13kb.
- Химических и радиационных воздействиях, 373.8kb.
- «Военно-медицинская академия имени С. М. Кирова», 394.13kb.
- «Военно-медицинская академия им. С. М. Кирова», 845.84kb.
- «Военно-медицинская академия имени С. М. Кирова», 1026.04kb.
Схема проведения экспериментального исследования
| | Токсиканты | Дозы, режим | Сроки исследования | Фармакологические препараты | Кол-во особей |
| 1 | Циклофосфан | 400 мг/кг, 200 мг/кг, 60 мг/кг однократно | 3, 6, 12, 24 ч | Изопропиловый эфир глутатиона, мексидол, ремаксол | 400 |
| 2 | Циклофосфан | 20 мг/кг, 40 мг/кг Ежедневно 10 сут | 1, 3, 5, 7, 10 сут | ацетилцистеин, трисан, цитофлавин, мексидол, глутоксим | 220* |
| 3 | Доксорубицин | 7,47 мг/кг, 2,24 мг/кг однократно | 3, 6, 12, 24 ч; 3, 5, 7 сут; | - | 180 |
| 4 | Доксорубицин | 2,24 мг/кг четырехкратно через 7 сут | 7, 14, 21, 28 сут | Ацетилцистеин, изопропил-глутатион, кардиоксан, мексидол, цитофлавин | 180 |
* - в том числе 50 особей с перевитой лимфосаркомой Плисса
Для коррекции цитотоксического действия через 30 мин после введения ЦФ или ДР животным внутрибрюшинно вводили один из следующих препаратов: ацетилцистеин – в виде 3 % официнального раствора, 150 мг/кг, глутоксим – в виде 1% водного раствора, 100 мг/кг, изопропиловый эфир глутатиона – в виде 5% водного раствора, 500 мг/кг, кардиоксан – в виде 0,8% раствора (на растворе Хартмана), 48 мг/кг, мексидол – в виде 1 % водного раствора, 50 мг/кг, ремаксол – в виде 10% водного раствора (по янтарной кислоте), 118 мг/кг, трисан – виде 1% официнального раствора, 15 мг/кг, цитофлавин – в виде 10% официнального раствора, 118 мг/кг.
Контрольным животным (отравленным или интактным) в те же сроки внутрибрюшинно вводили физиологический раствор в дозе 10 мл/кг массы тела.
В процессе клинического исследования проводили оценку влияния противоопухолевой терапии с использованием циклофосфана и доксорубицина на состояние системы глутатиона и динамику интенсивности процессов перекисного окисления липидов в эритроцитах пациентов в различные сроки нахождения в стационаре. Исследование проводили на базе хирургического отделения Ленинградского областного онкологического диспансера (г.п. Кузьмолово, Ленинградская обл.) в процессе лечения 35 пациенток, поступивших для курсовой полихимиотерапии рака молочной железы. Всем больным, включенным в исследование, проводилось лечение по схеме FAC: циклофосфан 500 мг/м2, внутривенно капельно; доксорубицин 50 мг/м2, внутривенно капельно по методике, рекомендованной производителем; 5-фторурацил 500 мг/м2, внутривенно капельно. Продолжительность цикла составляла 21 день. Полный курс лечения включал пять циклов полихимиотерапии. Профилактическое назначение антиэметиков осуществлялось в соответствии с общепринятыми методиками, принятыми в онкологических центрах.
Наряду с группой больных, получавших полихимиотерапию по выбранной схеме, была выделена группа пациенток, лечение которых дополнялось применением токсикомодифицирующим препаратом глутоксимом. 1,5 % раствор глутоксима вводили в день начала очередного цикла полихимиотерапии однократно подкожно через сутки в течение 14 дней. Назначение препарата осуществляли методом случайной выборки.
Оценку состояния системы глутатиона и интенсивности процессов перекисного окисления липидов проводили в эритроцитах пациентов перед каждым циклом химиотерапии и на 7-й день после введения препаратов. Оценка безопасности лечения осуществлялась на основании регистрации нежелательных явлений. Побочные эффекты регистрировали соответственно критериям шкалы Карновского, при этом путем целенаправленного опроса больных выявляли и отмечали наличие или отсутствие ожидаемых реакций. На протяжении всего периода терапии осуществлялся контроль показателей функции костного мозга, печени и почек, при этом полный анализ крови и биохимическое исследование крови выполнялись перед каждым циклом химиотерапии и на 7-й день после введения препаратов.
При выполнении клинического раздела работы также анализировали анамнез заболевания, медицинскую документацию догоспитального этапа, данные объективного исследования при поступлении в лечебное учреждение и в динамике, результаты других дополнительных методов обследования (ЭКГ, данные рентгенологического исследования).
Контрольную группу составили здоровые доноры (40 женщин) в возрасте от 43 до 61 года.
У экспериментальных животных в тканях печени, почек, сердца, головного мозга и эритроцитах, а также в эритроцитах пациентов, определяли содержание восстановленного глутатиона (ВГ), уровень свободных сульфгидрильных групп белков (СГ) и активность ферментов системы глутатиона и сопряженных систем – глутатионредуктазы (ГР), глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ), глутатионпероксидазы (ГП), глутатион-S-трансферазы (ГТ) и каталазы. Для оценки интенсивности процессов перекисного окисления липидов (ПОЛ) в тканях животных определяли концентрацию диеновых конъюгатов (ДК) и малонового диальдегида (МДА).
Концентрацию ВГ определяли методом G.L. Ellman (1959) в модификации, заключавшейся в осаждении белка 20% раствором сульфосалициловой кислоты (Глушков С.И., 2006). Содержание СГ определяли согласно методике G. Bellomo et al. (1990). Определение концентрации ДК проводили по методике И.Д. Стальной (1977). Концентрацию МДА определяли по методу M. Uchiyama (1978). Определение активности ферментов системы глутатиона проводили в гемолизате эритроцитов или в цитозольной фракции, полученной после центрифугирования гомогенатов тканей в течение часа при 150000 g на ультрацентрифуге L8-М («Beckman», США). Активность глутатионредуктазы определяли по методу I. Garlberg, B. Mannervik (1985), глюкозо-6-фосфатдегидрогеназы – по A. Kornberg et al. (1955), глутатионпероксидазы – по методу А.Н. Гавриловой и Н.Ф. Хмары (1986) с использованием в качестве субстрата гидроперекиси трет-бутила, каталазы – по М.А. Королюку (1988), глутатион-S-трансферазы – методом W.H. Habig, W.B. Jakoby (1981). Расчет активности ферментов производили на грамм белка или гемоглобина (в гемолизате эритроцитов). Концентрацию белка определяли методом Лоури в модификации G.L. Peterson (1977), гемоглобина – гемиглобинцианидным методом.
Биохимические показатели токсичности (активность аланинаминотрансферазы, аспартатаминотрансферазы, содержание мочевины, креатинина, общего билирубина) в сыворотке крови экспериментальных животных и больных определяли на автоматическом биохимическом анализаторе «Synchron» («Beckman Соulter», США), активность щелочной фосфатазы и концентрацию мочевины на автоматическом биохимическом анализаторе Hitachi – 902 Automatik («Hitachi», Япония).
Статистическую обработку полученных результатов проводили на персональном компьютере с помощью пакета прикладных программ «SPSS 16.0». В каждой группе рассчитывали средние значения и ошибку среднего. Проводился корреляционный анализ изменений показателей системы глутатиона в эритроцитах и ткани печени отравленных животных. Достоверность различий с соответствующей контрольной группой оценивали по t-критерию Стьюдента. Приведенные в тексте и таблицах значения представляли в виде Xср mx. Для установления различий между несколькими группами по нескольким вариантам значений различных переменных одновременно применялся дискриминантный анализ.
Результаты исследований и их обсуждение
Проведенное клинико-экспериментальное исследование, посвященное изучению состояния системы глутатиона и сопряженных биохимических процессов в различных тканях лабораторных животных и в эритроцитах человека при применении циклофосфана и доксорубицина, подтвердило, что указанной биохимической системе принадлежит одно из ведущих мест в механизмах естественной цитопротекции, а нарушения ее функционирования имеют существенное значение в патогенезе развития нежелательных побочных эффектов противоопухолевых препаратов. Изучение состояния системы глутатиона в условиях воздействия цитостатиков является важным для поиска новых подходов к профилактике и лечению цитотоксических поражений тканей ряда органов, которые могут быть основаны на использовании препаратов, нормализующих состояние изучаемой системы цитопротекции – системы глутатиона.
Анализ полученных данных показал, что для полноценной реализации основных функций системы глутатиона, таких как поддержание тиол-дисульфидного равновесия, антиоксидантная защита и конъюгация при применении циклофосфана и доксорубицина необходимо три фактора: 1) достаточный уровень восстановленного глутатиона; 2) адекватная активность ферментов антиоксидантной защиты; 3) наличие энергетических ресурсов для осуществления рециклирования восстановленного глутатиона и процессов конъюгации.
На направленность изменений показателей системы глутатиона существенно влияли условия применения цитостатика (дозовая нагрузка, временной фактор, токсикокинетические и токсикодинамические особенности его метаболизма), характер исследуемой ткани и тканевые особенности обмена глутатиона.
Ярко выраженный дозозависимый характер снижения показателей системы глутатиона наблюдался во всех исследуемых органах. Межтканевые отличия характеризовались тем, что наиболее существенные нарушения обмена глутатиона отмечались в тканях, в которых происходило развитие побочного гепато-, нефро- или кардиотоксического эффекта. Так, при применении кардиотоксического цитостатика доксорубицина максимальное по степени снижение концентрации ВГ отмечалось в тканях сердца (более, чем 10-кратное), циклофосфана – в тканях печени (более, чем 3-кратное) (Рис. 1).
Более умеренные сдвиги были обнаружены в эритроцитах, а снижение содержания глутатиона в тканях головного мозга было наименее значимым.
Центральное место в патогенезе цитотоксического действия ЦФ при однократном введении в больших дозах (200 и 400 мг/кг) принадлежало снижению внутриклеточного уровня ВГ, который необратимо расходовался на процессы конъюгации с различными метаболитами ксенобиотика, а также превращался в окисленную форму в процессах детоксикации АФК и органических перекисей. Истощение резервов системы глутатиона сопровождалось также выраженным повышением концентрации продуктов ПОЛ, снижением активности глюкозо-6-фосфатдегидрогеназы, глутатионредуктазы, глутатионпероксидазы, глутатионтрансферазы и каталазы (Рис.2). Данные изменения лежат в основе нарушений ряда функций системы глутатиона, что приводит к выраженным сдвигам тиол-дисульфидного статуса и активации процессов перекисного окисления липидов.
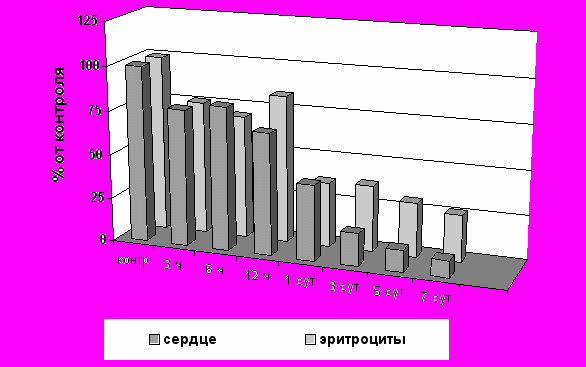
Рис. 1. Изменения концентрации ВГ в тканях сердца и в эритроцитах крыс при однократном введении доксорубицина в дозе 7,47 мг/кг
В отличие от интоксикации высокими дозами, повторное введение ЦФ сопровождалось развитием длительного «токсического стресса», характеризующегося постепенной мобилизацией, а затем расходованием резервов системы глутатиона. За периодом напряжения адаптивных процессов следовал период компенсации, направленный на временное возмещение поврежденных функций системы глутатиона в процессе интоксикации. Если действие цитостатика продолжалось, наступал срыв компенсации. Подтверждением этого может служить двухфазный характер изменений, который отмечался и при исследовании активности ряда ферментов системы глутатиона в наиболее повреждаемой ткани – печени.
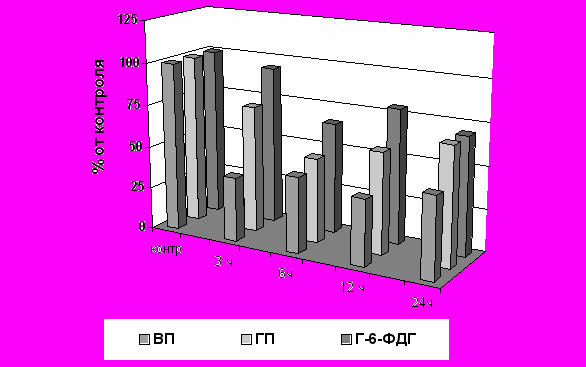
Рис. 2. Изменения концентрации ВГ, активности ГП и Г-6-ФДГ в тканях печени крыс при однократном введении циклофосфана в дозе 200 мг/кг
Например, введение ЦФ в дозе 20 мг/кг приводило к повышению активности ГР в течение 3 суток с последующим достоверным ее снижением. При исследовании ГП и каталазы компенсаторная активация (p<0,05) этих ферментов в ткани печени наблюдалась на 5-е сутки эксперимента при использовании дозы токсиканта 20 мг/кг (в 1,37 и 1,30 раза, соответственно). Однако при исследовании активности Г-6-ФДГ в ткани печени периода компенсаторных изменений выявлено не было. Напротив, в течение всего эксперимента наблюдалось достоверное выраженное дозозависимое ее снижение, которое можно объяснить наличием в активном центре фермента сульфгидрильной группы (Рис. 3).
Снижение активности Г-6-ФДГ при повторном введении ЦФ может быть связано с необратимым алкилированием тиоловых групп энзима активными метаболитами ЦФ и повреждающим действием на молекулы фермента АФК и свободных радикалов (Голиков С.Н., 1986). В свою очередь, усиленное расходование НАДФ·Н в глутатионредуктазной и цитохром P-450-редуктазной реакциях усугубляет процессы истощения резервов компенсаторного ответа системы глутатиона (Тиунов Л.А., 1995; Еропкин М.Ю., 2003). Подтверждением роли активации СРО и алкилирования SН-групп в снижении активности Г-6-ФДГ может служить выраженное снижение концентрации сульфгидрильных групп и повышение уровня ДК, МДА в ткани печени.
Р
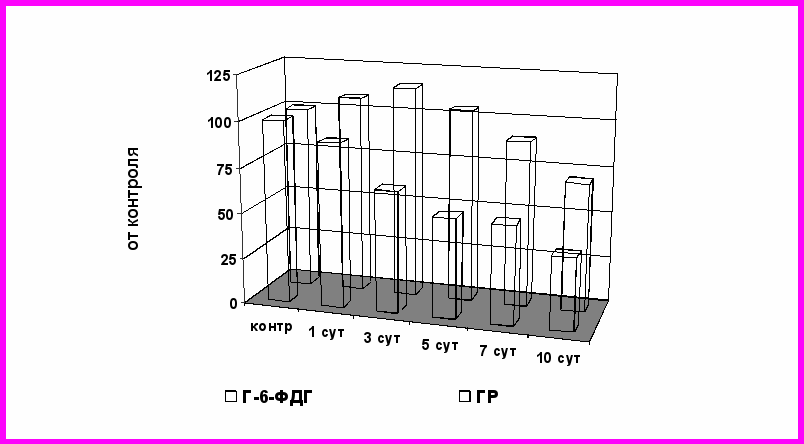 ис. 3. Изменения активности Г-6-ФДГ и ГП в тканях печени крыс при повторном введении циклофосфана в дозе 20 мг/кг
ис. 3. Изменения активности Г-6-ФДГ и ГП в тканях печени крыс при повторном введении циклофосфана в дозе 20 мг/кгУгнетение активности ферментов редокс-циклирования глутатиона, происходившее при введении доксорубицина, также подтверждает важную роль нарушений обмена глутатиона в патогенезе развития доксорубициновой кардиомиопатии. Динамика снижения уровня ВГ в тканях сердечной мышцы экспериментальных животных имела прямую положительную корреляционную связь с динамикой уменьшения активности Г-6-ФДГ и ГР. Снижение уровня ВГ в сердечной мышце, существенно превосходящее по времени сроки интенсификации процессов ПОЛ, подтверждает, что истощение концентрации ВГ в кардиомиоцитах объясняется не столько его расходованием на осуществление антиоксидантной защиты кардиомиоцитов, сколько нарушением ферментативного звена восстановления глутатиона (Рис. 4).
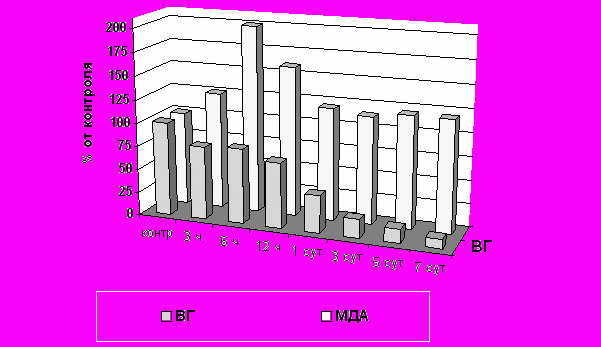 Рис. 4. Изменения концентрации ВГ и МДА в тканях сердца крыс при однократном введении доксорубицина в дозе 7,47 мг/кг
Рис. 4. Изменения концентрации ВГ и МДА в тканях сердца крыс при однократном введении доксорубицина в дозе 7,47 мг/кгУгнетением активности ферментов редокс-циклирования глутатиона объясняется мощное снижение концентрации ВГ в тканях печени, почек и в эритроцитах крыс с перевитой лимфосаркомой Плисса. На первый взгляд, обратимое расходование ВГ на обезвреживание АФК, активно образующихся в результате характерного для различных форм онкологической патологии нарушения общего метаболизма, становится фатальным в результате снижения активности Г-6-ФДГ вследствие недостатка глюкозо-6-фосфата из-за преобладания процессов гликолиза. Длительная прооксидантная нагрузка приводит к истощению запасов ВГ и уменьшению активности ферментов антиперекисной защиты ГП и ГТ. Все это служит основой для перехода оксидативного стресса в декомпенсированную фазу (табл. 2).
Таблица 2
Изменения некоторых показателей системы глутатиона в тканях
различных органов при однократном введении циклофосфана в дозе
20 мг/кг экспериментальным животным с лимфосаркомой Плисса
| Показатель | Группы животных | Исследуемый орган (ткань) | |||
| Печень | Почки | Опухоль | Эритроциты | ||
| ВГ ммоль/г ткани | Контроль | 10,12 0,37 | 3,75 0,47 | | 9,12 0,17 |
| опухоль Плисса без лечения | 4,12 0,05* | 2,13 0,12* | 1,02 0,06 | 7,370,39* | |
| опухоль Плисса + циклофосфан | 4,89 0,36 * | 2,74 0,32 | 0,61 0,04 | 7,03 0,28* | |
| МДА ммоль/г ткани | Контроль | 143,14 4,75 | 358,89 5,90 | | 14,92 0,69 |
| опухоль Плисса без лечения | 484,03 42,54* | 443,3323,17* | 165,645,48 | 20,271,51* | |
| опухоль Плисса + циклофосфан | 403,7120,36 * | 411,6218,79* | 178,885,08 | 18,711,37* | |
| Г-6-ФДГ мкмоль/(мин г белка) | Контроль | 209,77 13,04 | 20,41 1,66 | | 4,63 0,38 |
| опухоль Плисса без лечения | 100,04 5,23* | 18,80 4,11 | 27,20 1,50 | 2,770,24* | |
| опухоль Плисса + циклофосфан | 96,23 6,60 * | 19,60 1,77 | 23,72 1,37 | 3,67 0,24* | |
| ГП мкмоль/(мин г белка) | Контроль | 15,43 0,27 | 7,00 0,18 | | 5,33 0,17 |
| опухоль Плисса без лечения | 13,36 0,46* | 6,55 0,60 | 0,16 0,007 | 4,110,18* | |
| опухоль Плисса + циклофосфан | 12,11 0,35 * | 5,85 0,39* | 0,17 0,006 | 5,65 0,23 | |
* - достоверность отличия p<0,05 по сравнению с группой контроля.
- достоверность отличия p<0,05 по сравнению с нелеченой опухолью Плисса
Проведенный анализ полученных данных указывает на взаимосвязь механизмов повреждений системы глутатиона и реализации цитотоксических эффектов исследуемых противоопухолевых препаратов. Исследование динамики изменений активности ферментов обмена глутатиона (ГР, Г-6-ФДГ, ГП, ГТ) и сопряженных биохимических процессов (интенсивности протекания процессов ПОЛ, состояния тиол-дисульфидного равновесия, активности каталазы) позволило представить участие системы глутатиона в патогенезе побочного цитотоксического действия исследуемых цитостатиков в следующем виде:
- Метаболизм циклофосфана и доксорубицина с участием цитохрома P450 приводит к образованию их активных метаболитов (гидроксифосфамида и доксорубицинола), свободнорадикальных промежуточных метаболитов (циклофосфана – карбониевого иона, доксорубицина – семихиноновых радикалов) и активных форм кислорода.
- В результате глутатионовой конъюгации активных метаболитов доксорубицина и циклофосфана происходит необратимое потребление ВГ, восполняемое за счет синтеза глутатиона de novo, возможности которого весьма ограничены.
- Увеличение наработки АФК приводит к более интенсивному, хотя и обратимому, расходованию восстановленного глутатиона в глутатионпероксидазной реакции и переходу его в окисленную форму.
- Обезвреживание свободнорадикальных промежуточных продуктов метаболизма карбониевого иона и семихиноновых радикалов также может привести к снижению уровня восстановленного глутатиона. В условиях нарастающего потребления ВГ на процессы конъюгации и обезвреживания АФК уровень концентрации трипептида сохраняется за счет активации как процессов непосредственного синтеза ВГ, так и процессов его рециклирования. В то же время увеличение наработки продуктов СРО приводит к индукции активности ферментов АОЗ. Данные изменения характеризуют компенсаторный период при применении исследуемых цитостатиков.
- Последующая возрастающая прооксидантная нагрузка, нарушение тиол-дисульфидного статуса приводят к истощению резервов системы red-ox-циклирования глутатиона (относительный дефицит, а затем и снижение активности глутатионредуктазы и глюкозо-6-фосфатдегидрогеназы вследствие потребления глюкозо-6-фосфата и снижения уровня НАДФ·H), а затем и к уменьшению глутатионпероксидазной активности. Все это служит основой для перехода оксидативного стресса в декомпенсированную фазу в связи с невозможностью поддержания необходимого тканевого уровня восстановленного глутатиона.
- Снижение активности ряда ферментов обмена глутатиона может быть вызвано в результате прямого их повреждения цитостатиками или их метаболитами, свободными радикалами или грубыми расстройствами процессов биосинтеза энзимов этой биохимической системы. Высокая алкилирующая способность метаболитов ЦФ, образующихся в процессе активации системой цитохрома P450, лежит в основе их взаимодействия не только с ВГ, но и с функциональными (в том числе и с сульфгидрильными) группами различных биомолекул (Голиков С.Н., 1986). Процессы обратимого S-тиолирования функциональных групп белков окисленным глутатионом и образование смешанных дисульфидов также может приводить к снижению содержания СГ (Кулинский В.И., 1990). Последнее изменение имеет неоднозначное значение: во-первых, сохранение в клетке пула глутатиона; во-вторых, защита SH-групп белков от необратимой их модификации как продуктами метаболизма ЦФ, так и свободными радикалами и продуктами ПОЛ. Таким образом, система глутатиона принимает участие в защите тиольных групп различных белков и сохранении активности ряда ферментов. Однако в условиях дефицита ресурса глутатиона, в значительном количестве расходуемого в процессах конъюгации, закономерным является нарушение тиолового статуса.
- Нарастание активности перекисного окисления липидов, снижение концентрации SH-групп косвенно указывают и на нарушения энергетического метаболизма клетки, возникающего в результате повреждения митохондриальных мембран, алкилирования SH-зависимых ферментов цикла Кребса и нарушений в клетке равновесия между белковыми тиолами и дисульфидами. Как известно, обмен глутатиона в тканях (как за счет биосинтеза de novo, так и за счет его восстановления из окисленной формы) является энергоемким процессом и требует, по крайней мере, затрат 3-х молекул АТФ на одну молекулу субстрата. Кроме того, развитие различных форм гипоксии закономерно приводит к повышенной наработке АФК и активации свободнорадикальных процессов. Гиперактивация свободнорадикального окисления и ПОЛ митохондриальных мембран приводят к усугублению угнетения клеточного дыхания, развитию энергодефицитных состояний и может способствовать формированию патогенетического порочного круга.
Таким образом, нарушения системы глутатиона при применении циклофосфана и доксорубицина, несмотря на специфические особенности их действия, протекают по единому патогенетическому механизму.
Расширение представлений об особенностях функционирования системы глутатиона в условиях применения противоопухолевых препаратов в различных дозах и режимах введения имеет не только теоретическое значение, связанное с уточнением роли изучаемой системы цитопротекции в патогенезе побочного действия цитостатиков, но и существенное практическое значение. Они позволяют не только определить роль нарушений системы глутатиона в реализации цитотоксических эффектов исследуемых цитостатиков, но и показать возможные маркеры цитотоксичности. Перспективным направлением практического использования показателей системы глутатиона является возможность оценки с их помощью тяжести цитотоксических поражений паренхиматозных органов при развитии побочных эффектов противоопухолевых средств.
Полученные биохимические данные изменений показателей системы глутатиона подтверждаются одновременно проведенным морфологическим исследованием тканей печени в различные сроки повторного введения ЦФ, которое выявило сопряжение нарастающих морфологических признаков повторной интоксикации (выраженность жировой дистрофии, гиперхромия ядер, расширение синусоидов) с увеличением кумулятивного эффекта ксенобиотика.
Проведенное экспериментальное исследование подтвердило предположение о возможности использования определения показателей системы глутатиона в эритроцитах для диагностической оценки степени тяжести цитотоксических эффектов при повторном воздействии исследуемых цитостатиков. Это подтверждается одинаковым характером изменений показателей данной системы во внутренних органах и в эритроцитах.
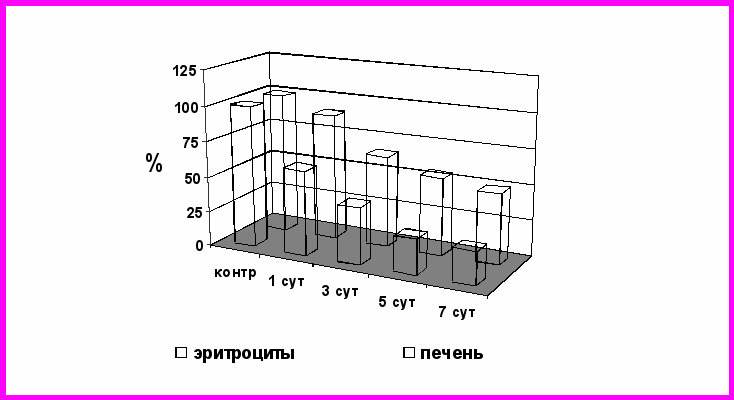
Рис. 5. Изменение активности глюкозо-6-фосфатдегидрогеназы в ткани печени и эритроцитах при повторном введении ЦФ в суточной дозе 20 мг/кг
Например, динамика изменений активности Г-6-ФДГ в клетках красной крови коррелировала с таковыми в ткани печени. Была установлена прямая положительная корреляционная связь, коэффициент корреляции составил при введении ЦФ в дозе 20 мг/кг – 0,65 (Рис. 5), при дозе 40 мг/кг – 0,53. При применении доксорубицина между содержанием восстановленного глутатиона в тканях сердца и в эритроцитах через сутки после повторных воздействий цитостатика выявлена прямая положительная корреляционная связь (коэффициент корреляции – 0,95).
Кроме того, в ходе экспериментального исследования проведена сравнительная оценка между сроками появления и выраженностью изменений маркеров гепато- и нефротоксичности ВОЗ (АЛТ, АСТ, ЩФ, содержания общего билирубина, креатинина, мочевины) и показателей системы глутатиона при повторном введении ЦФ в суточной дозе 20 мг/кг в течение 10 суток (табл. 3).
Таблица 3
Сроки появления и выраженность изменений маркеров гепатотоксичности, показателей системы глутатиона и морфологических признаков поражения печени при повторном введении ЦФ в суточной дозе 20 мг/кг
| Показатели | Сроки исследования | ||
| 1-3 сут | 5-7 сут | 10 сут | |
| Активность Г-6-ФДГ, ГР | снижение на 10–20% | снижение на 25–50% | снижение более, чем на 50% |
| Концентрация МДА | повышение на 30–40% | повышение на 50–70% | повышение более, чем на 75% |
| Морфологические признаки поражения печени | слабо выраженные | умеренно выраженные | сильно выраженные |
| Активность АЛТ, АСТ, концентрация билирубина | норма | норма | повышение на 25– 50% |
Установлено, что изменения таких показателей обмена глутатиона, как активность Г-6-ФДГ, ГР, содержание ДК, МДА происходили в более ранние сроки и выявлялись при отсутствии достоверных изменений со стороны большинства общеизвестных биохимических показателей, а к окончанию эксперимента носили более выраженный характер.
Правильность предположения о возможности использования показателей системы глутатиона для оценки побочных цитотоксических поражений паренхиматозных органов при применении противоопухолевых средств подтвердили результаты дискриминантного анализа, с помощью которого удалось по показателям системы глутатиона в эритроцитах экспериментальных животных с максимальной четкостью провести разделение животных на три группы: с выраженными и незначительными морфологическими признаками поражения печени и их отсутствием (Рис. 6). Применение результатов дискриминантного анализа в алгоритме обследования животных дало возможность правильно прогнозировать выраженные токсические поражения печени: чувствительность метода составила 97%, специфичность – 93%.
Уточнение механизмов повреждения изучаемой системы цитопротекции, основанное на данных динамического исследования не только уровня ВГ, но и активности ферментов обмена глутатиона, а также показателей ПОЛ позволяет в дальнейшем сформулировать подходы к использованию цитопротекторной терапии побочного действия противоопухолевых препаратов. При этом, основываясь на преобладании тех или иных патогенетических механизмов воздействия противоопухолевых средств на состояние системы глутатиона, поиск и применение препаратов цитопротекции может быть построен с учетом их специфичности воздействия на естественную систему защиты клетки. Таким образом, открывается перспектива использования таких препаратов, патогенетическое действие которых будет направлено на коррекцию определенных звеньев системы глутатиона.
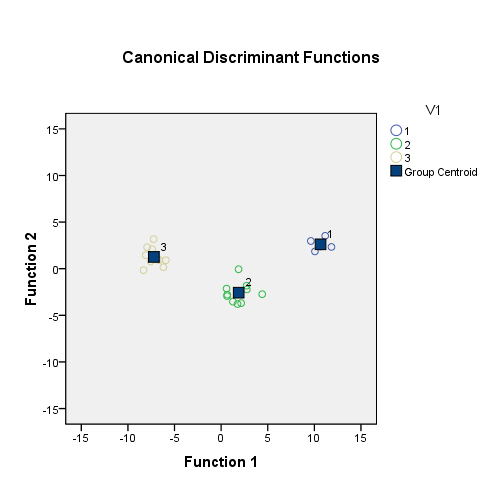
Канонические дискриминантные функции
1 группа – морфологические признаки поражения печени отсутствуют
2 группа – морфологические признаки поражения печени незначительны
3 группа – морфологические признаки поражения печени значительны
Функция 2
Функция 1
Рис. 6. Распределение значений канонических функций дискриминации в 1, 2 и 3 группах животных при введении ЦФ в дозе 40 мг/кг.
Выявленные механизмы цитотоксического действия циклофосфана и доксорубицина, связанные с нарушениями системы глутатиона, позволили обосновать направления цитопротекторной терапии:
1. Применение препаратов экзогенного глутатиона (изопропиловый эфир глутатиона), предшественников его синтеза (ацетилцистеин) и производных окисленного глутатиона (глутоксим) было направлено на увеличение пула восстановленного глутатиона, расходующегося на процессы конъюгации с ксенобиотиками и их метаболитами, репарации поврежденных биомолекул.
2. Применение антиоксидантов (мексидол, ремаксол) и комплексообразователей (кардиоксан) было направлено на снижение образования активных форм кислорода и свободнорадикальных промежуточных продуктов метаболизма цитостатиков.
3. Применение антигипоксантов (цитофлавин, трисан) было направлено на устранение нарушений энергетического обмена.
Проведенное исследование показало, что реализация цитопротекторных свойств этих препаратов, несмотря на разный механизм их действия, патогенетически связана с восстановлением повреждений системы глутатиона и нарушений ее функций. Причем воздействие разных препаратов на состояние системы глутатиона и процессы ПОЛ сопровождалось принципиально одинаковыми эффектами: положительным влиянием на динамику концентрации ВГ и СГ; снижением интенсивности протекания процессов ПОЛ; увеличением активности ферментов восстановления глутатиона; стимулирующим влиянием на активность антиоксидантных ферментов.
Выраженность воздействия препаратов фармакологической коррекции на показатели системы глутатиона была различной. Так, при однократном введении ЦФ наибольшее влияние на показатели системы глутатиона отмечалось при использовании изопропилового эфира глутатиона. Препарат позволял добиться не только наиболее длительного по времени предупреждения снижения уровня ВГ в тканях печени (тогда как действие антигипоксантов и антиоксидантов было обратимо), но и максимально предупреждал накопление продуктов ПОЛ в тканях, а также оказывал индуцирующее действие на активность глутатион-S-трансферазы и глутатионпероксидазы. Все эти данные не только подтвердили лидирующую роль срыва механизмов глутатионовой конъюгации при реализации цитотоксических эффектов действия ЦФ, но и указывают на то, что дальнейшим направлением поиска наиболее эффективных средств цитопротекции в условиях цитотоксического воздействия ЦФ может явиться применение препаратов, повышающих уровень глутатиона в тканях. Неслучайно наиболее выраженное положительное влияние на систему глутатиона при повторном введении ЦФ оказывало использование метаболического предшественника синтеза глутатиона – ацетилцистеина. Его применение приводило к повышению уровня восстановленного глутатиона в тканях паренхиматозных органов и в эритроцитах экспериментальных животных. Повышение концентрации ВГ закономерно приводило и к восстановлению показателей тиол-дисульфидного обмена, повышению активности ферментативного звена системы глутатиона и снижению интенсивности процессов СРО. У животных с лимфосаркомой Плисса наиболее эффективное влияние на показатели системы глутатиона оказал глутоксим (Рис. 7).
Р
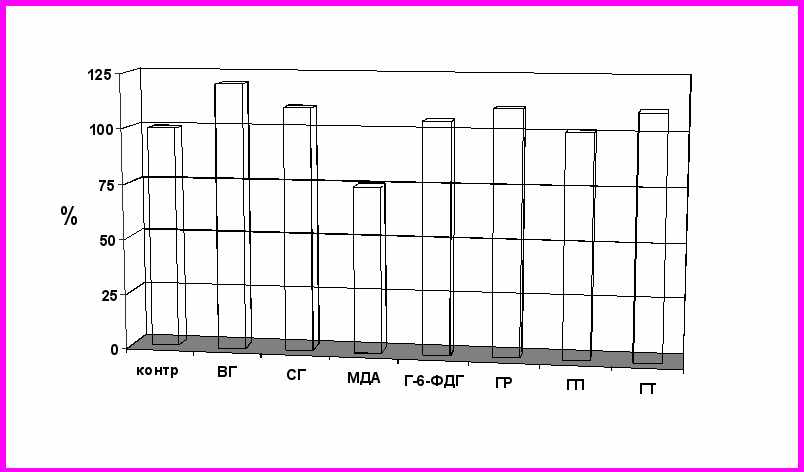 ис. 7. Влияние глутоксима на изменения показателей системы глутатиона в эритроцитах крыс с лимфосаркомой Плисса при повторном введении ЦФ в суточной дозе 20 мг/кг в течение 10 суток
ис. 7. Влияние глутоксима на изменения показателей системы глутатиона в эритроцитах крыс с лимфосаркомой Плисса при повторном введении ЦФ в суточной дозе 20 мг/кг в течение 10 сутокПри его введении в тканях печени и в эритроцитах концентрация ВГ и СГ восстанавливалась до уровня здоровых животных, отмечалось снижение интенсивности протекания процессов ПОЛ, увеличение активности ферментов восстановления глутатиона. Причем механизм действия данного препарата, учитывая невозможность его проникновения внутрь клетки, связан, вероятнее всего, с сенситизацией клеточных рецепторов к различным лигандам.
Система глутатиона по многим параметрам соответствует понятиям скрининговой системы при выборе средств цитопротекции. Так, результаты проведенного исследования показали, что при повторном введении доксорубицина АЦЦ, цитофлавин, изопропиловый эфир глутатиона и мексидол по выраженности кардиопротекторных свойств, по крайней мере, не уступают и даже превосходят кардиоксан (Рис. 8). Более того, в отличие от последнего они защищали от повреждения клетки красной крови.
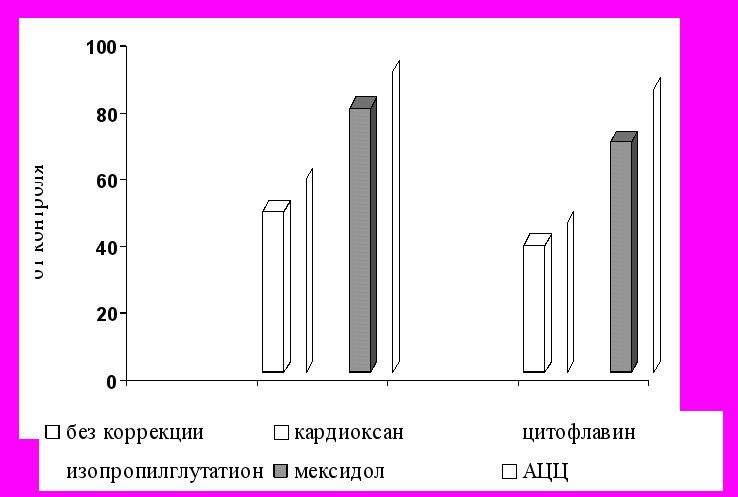
Рис. 8. Динамика изменений активности Г-6-ФДГ в тканях сердца и в эритроцитах крыс при фармакологической коррекции повторного введения доксорубицина в дозе 2,27 мг/кг
Эти же препараты, в отличие от кардиоксана, использование которого не позволяло предотвратить снижение активности ключевого фермента пентозофосфатного шунта и глутатионредуктазы, оказали положительное влияние на интенсивность свободнорадикальных процессов и, что особенно важно, на активность ферментов редокс-циклирования глутатиона, так как нарушения именно в этом звене системы глутатиона при применении ДР, видимо, детерминируют дальнейшую цепь патологических событий.
Данные о наличии положительных корреляций между изменениями состояния системы глутатиона в эритроцитах и тканях внутренних органов лабораторных животных при применении фармакологических средств указывают и на возможность использования показателей системы глутатиона для оценки эффективности назначения ряда цитопротекторов. Применение цитопротекторных препаратов приводило не только к существенному снижению выраженности нарушений обмена глутатиона в ткани печени, но и к уменьшению выраженности гистологических признаков поражения в гепатоцитах, где определялась мелкокапельная жировая и зернистая дистрофия, пространства Диссе были несколько расширены. Исследование маркеров гепато- и нефротоксичности в сыворотке крови крыс с лимфосаркомой Плисса, не леченых и леченных циклофосфаном, не в полной мере отражало тяжесть морфологических изменений, наблюдавшихся в этих тканях, и поэтому может использоваться для оценки эффективности цитопротекторной терапии лишь в качестве дополнительного теста к показателям системы глутатиона.
Подтверждение возможности использования показателей системы глутатиона в эритроцитах в качестве лабораторных диагностических тестов для оценки эффективности фармакологической коррекции побочного действия циклофосфана было получено с помощью дискриминантного анализа, применив который, удалось по показателям системы глутатиона с максимальной четкостью провести разделение животных на группы, не получавшие цитопротекторы (с выраженными морфологическими признаками поражения печени), получавшие цитопротекторы (с незначительными морфологическими признаками поражения печени) и здоровые (без признаков поражения печени). Кроме того, результаты дискриминантного анализа позволили выявить более выраженный цитопротекторный эффект у препаратов-предшественников глутатиона, что указывает на возможность использования показателей системы глутатиона в качестве скрининговой системы оценки цитопротекторных свойств различных средств патогенетической терапии (Рис 9).
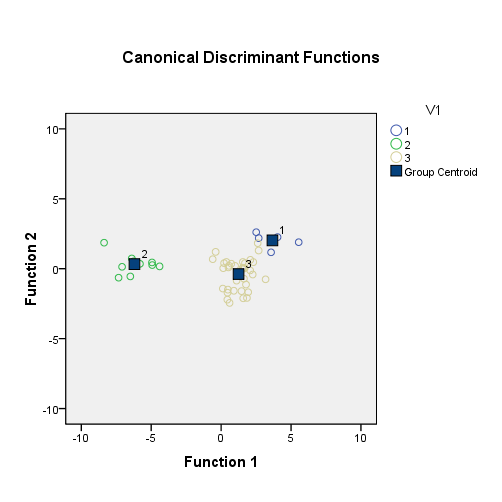
Канонические дискриминантные функции
1 группа (контрольные животные) – поражений печени нет;
2 группа (леченные ЦФ) – морфологические признаки поражения печени значительны;
3 группа (леченные ЦФ и препаратами фармкоррекции) – морфологические признаки поражения печени незначительны
Функция 2
Функция 1
Рис. 9. Распределение значений канонических функций дискриминации в 1-й, 2-й и 3-й группах животных при введении ЦФ в дозе 40 мг/кг и препаратов фармакологической коррекции
Клиническое исследование подтвердило патогенетическую значимость изменений активности Г-6-ФДГ и ГР и показало высокую диагностическую информативность определения их активности в эритроцитах пациентов при полихимиотерапии циклофосфаном и доксорубицином.
Выраженность угнетения активности Г-6-ФДГ и ГР в эритроцитах пациентов с цитотоксическими осложнениями на 7-е сутки после введения цитостатиков и дальнейшее отсутствие восстановления их активности к началу очередного курса полихимиотерапии явились наиболее информативными данными, свидетельствующими об истощении возможностей восстановления глутатиона. Определение содержания МДА в эритроцитах также может использоваться с диагностическими и прогностическими целями при развитии побочных эффектов полихимиотерапии.
Обследование пациентов показало, что цитостатическая терапия сопровождается накоплением продуктов ПОЛ в эритроцитах, выраженность которого соответствует тяжести токсического действия препаратов. Обращает на себя внимание, что в группе больных с выраженными осложнениями нарастание концентрации МДА в эритроцитах было более интенсивным и происходило в более ранние сроки, что свидетельствует о низких резервах антиоксидантной защиты.
Глутоксим, применявшийся в качестве токсикомодифицирующего препарата при полихимиотерапии РМЖ, также оказал положительное действие на систему глутатиона, достоверно повышая в эритроцитах пациентов концентрацию ВГ, активность Г-6-ФДГ, глутатионредуктазы и каталазы. Таким образом, выраженная цитопротекторная активность глутоксима достоверно отражала эффективность проводимой им коррекционной терапии.
Исследование лабораторных показателей гепато- и нефротоксичности у больных раком молочной железы в процессе курсового лечения циклофосфаном и доксорубицином показало незначительные колебания маркеров цитолиза печени (активности АЛТ и АСТ, концентрации билирубина) на протяжении всего исследования у больных с отсутствием существенных осложнений со стороны паренхиматозных органов. Выраженные признаки гепатотоксичности были отмечены в 2-х случаях после 3-го и 4-го цикла полихимиотерапии, что проявилось повышением активности АЛТ в 2,1 раза и увеличением концентрации билирубина в 1,8 раза (p<0,05) по сравнению со значениями перед началом химиотерапии. Следует отметить, что на 7-й день после второго курса ПХТ и перед началом третьего курса концентрация билирубина и активность трансаминаз в сыворотке крови в этой группе больных были в пределах нормы. В то же время такие показатели системы глутатиона в эритроцитах этих пациентов, как концентрация сульфгидрильных групп белков, активность Г-6-ФДГ и каталазы были достоверно ниже, чем показатели доноров не только после второго курса ПХТ, но и перед началом третьего. Таким образом, изменения показателей системы глутатиона в эритроцитах больных происходили в более ранние сроки по сравнению с лабораторными показателями цитолиза печени в сыворотке крови.
Дискриминантный анализ показателей системы глутатиона в эритроцитах больных перед третьим циклом ПХТ позволил правильно спрогнозировать по исходным данным вероятность развития выраженных осложнений с точностью 97,1%, а по результатам кросс-проверки – 91,4%.
Таким образом, полученные данные экспериментального и клинического исследований существенно расширяют наши представления о механизмах цитотоксичности и естественной цитопротекции, подтверждают участие системы глутатиона в патогенезе побочного действия ЦФ и ДР и перспективность практического использования показателей обмена глутатиона для оценки и прогноза тяжести цитотоксических поражений паренхиматозных органов, определяют направления поиска новых средств цитопротекции и оценки их эффективности в условиях эксперимента и клиники.
