Метаболические и нейрофизиологические аспекты артериальной гипертензии у детей и подростков 14. 00. 09 педиатрия
| Вид материала | Документы |
СодержаниеОбъем и структура диссертации Содержание работы Специальные методы исследования Результаты исследования и их обсуждение |
- Рекомендации по диагностике, лечению и профилактике артериальной гипертензии у детей, 735.42kb.
- Лаборатория артериальной гипертензии была создана 01. 06. 1981 года на базе клинического, 74.72kb.
- Национальные рекомендации по диагностике и лечению артериальной гипертензии Всероссийское, 609.76kb.
- Расписание занятий по курсу госпитальной терапии, 138.36kb.
- Артериальная гипертензия, 66.85kb.
- Храмов Ю. А. Хронобиологические аспекты лечения артериальной гипертензии на курортах, 211.99kb.
- Оптимизация профилактики, диагностики и лечения первой степени артериальной гипертензии, 248.04kb.
- Характеристика артериального давления и состояние вегетативной регуляции сердечной, 286.96kb.
- Клинико-патогенетические аспекты формирования церебральных нарушений при сахарном диабете, 838.38kb.
- Динамика содержания цитокинов и оксида азота при легочной гипертензии у детей с хронической, 329.09kb.
Объем и структура диссертации
Работа изложена на 350 страницах, состоит из введения, обзора литературы, пяти глав результатов исследования, заключения, выводов и практических рекомендаций, содержит 51 таблицу, 30 рисунков, 1 фотографии и три клинических примера. Библиография включает 230 отечественных и 207 иностранных авторов. Весь представленный материал получен, обработан и проанализирован лично автором.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Всего под наблюдением находилось 328 больных в период с 1995 по 2006 гг. в возрасте от 11 до 18 лет (средний возраст – 13,2±0,7 лет), в том числе 121 девочка и 207 мальчиков. Контрольную группу составили 127 практически здоровых детей и подростков этого же возраста, имеющих нормальные показатели АД, отсутствие АГ у родственников первой линии родства.
По генезу АГ была представлена следующим образом: 1) АГ у больных с дисплазией соединительной ткани – 146 наблюдения; 2) 122 случая АГ при гипоталамическом синдроме; 3) в 60 наблюдениях была диагностирована эссенциальная гипертензия.
Диагностика АГ - на основе существующих методических рекомендаций экспертов Всероссийского научного общества кардиологов и ассоциации детских кардиологов России (Москва, 2003). У всех пациентов выделялась степень АГ (I и II). У больных старше 16 лет – группы риска развития сердечно-сосудистых заболеваний. По данным результатам проведения суточного мониторирования АД выделялись лабильная и стабильная АГ.
При сборе анамнеза обращалось внимание на жалобы пациентов, продолжительность АГ, течение беременности и родов у матери, возраст родителей на момент беременности, масса тела при рождении, социальный статус семьи, перенесенные заболевания (в том числе и течение неонатального периода), злоупотребление поваренной солью, крепким чаем, кофе, пассивного и/или активного курения, прием наркотиков, алкоголя. Составлялась и оценивалась родословная. Всем пациентам при поступлении и в ходе проводимой терапии проводилось СМАД.
Больные с АГ на фоне недифференцированного варианта мезенхимальной дисплазии соединительной ткани были выделены в самостоятельную группу вновь в соответствии с рекомендациями ряда исследований (Верещагина Г.Н., Яхонтов Д.А., с соавт. 1993; Викторовой И.А., 1993, 1994), утверждающие самостоятельность этой формы заболевания, в качестве представителя симптоматической гипертензии. Продолжительность течения АГ в данной группе больных составляла от 6 месяцев до 2 лет.
Критериями отбора в данную клинико-патогенетическую группу были следующие признаки: сколиотическая деформация грудной клетки, плоскостопие, аномалия прикуса, гипермобильность суставов (не менее двух), признаки гиперэластоза и дизэластоза кожи, «тонкая» кожа, множественные невусы, участки гипер- и депигментации, приросшие мочки ушей, рудиментарные соски, высокое небо, сандалевидная щель, наличие спондилодисплазии (дисплазия и лестничное смещение шейных позвонков, нестабильность дисков, подвывихи межпозвоночных суставов, деформация вертебральных отростков, шейный остеохондроз, изменения в области сердца по данным эхокардиографии (пролапс митрального клапана, добавочные хорды), по результатам проведения УЗИ внутренних органов – аномалии развития желчного пузыря.
Вторую группу обследованных составили пациенты с гипоталамическим синдромом. Для отбора в указанную группу использовались следующие критерии: дебют заболевания в пубертатном периоде жизни; в анамнезе – указания на перенесенные травмы центральной нервной системы, хроническую носоглоточную инфекцию, стрессы; клинические проявления: ускорение полового развития, увеличение роста и массы тела, быстрое прогрессирование ожирения (прибавка массы тела + 8-10 кг за 6 –12 месяцев) стойкая или транзиторная артериальная гипертензия, вегетативные реакции (преобладание влияния симпатического отдела вегетативной нервной системы), истинная гинекомастия у мальчиков, нарушение терморегуляции, выраженная головная боль, мотивационные нарушения (избыточный аппетит, иногда до булимии, полидипсия, гиперфагическая реакция на стрессовую ситуацию), нарушение менструального цикла у девочек в виде аменореи (задержка менархе до 12 и более месяцев), по типу гипоменструального синдрома – олигоаменареи (задержка менархе от 2 до 6 месяцев), маточные кровотечения, возможно длительное установление ритма менархе (более 6 месяцев), трофические изменения кожи (фолликулит, стрии от бледно-розовых до розово-фиолетовых в области наружных поверхностях живота, бедер, внутренних поверхностей плеч, участки гиперпигментации естественных складок;лабораторно-инструментальные методы исследований: по данным РЭГ признаков асссиметрии, повышения тонуса мозговых сосудов, снижение кровенаполнения головного мозга; по данным ЭХО-ЭГ на более поздних стадиях возможны асимметричные изменения желудочков мозга, расширение основания III желудочка до 9-12 мм и появление изменений по данным ЯМРТ головного мозга.
При верификации диагноза «эссенциальная гипертензия» учитывались случаи возникновения АГ, которые не были связаны с патологией какого-либо внутреннего органа, на основе методических рекомендаций экспертов Всероссийского научного общества кардиологов и ассоциации детских кардиологов России (Москва, 2003). У всех больных с ЭГ имелся отягощенный наследственный анамнез по развитию АГ. Давность течения АГ не менее 1-3 лет.
Из методов стандартного обследования проводились лабораторные и диагностические процедуры для выявления патологических изменений в органах-мишенях и некоторых факторов риска развития сердечно-сосудистых заболеваний в дальнейшем. Использовался у всех больных рекомендуемый объем исследований: клинический анализ крови, общий анализ мочи, развернутый биохимический анализ крови, электрокардиография (запись проводилась в 12 стандартных отведениях), эхокардиографические показатели исследовали с помощью аппаратов ультразвукового исследования «Acuson Seguoja” (USA) в М-, В- и доплеровских режимах по стандартной методике с учетом рекомендаций Американского кардиографического общества.
Из дополнительных лабораторных методов исследования при поступлении проводились определение суточной экскреции альбумина с мочой (тест на микроальбуминурию).
Оценка гормонального спектра крови проводилась в лаборатории ЦНИЛ НГМА (зав. лабораторией, к.м.н. Таранов А.Г.) с помощью оценки уровней тироксина (Т4), тиреотропина (тиреотропный гормон, ТТГ), соматотропного гормона в сыворотке крови больных с АГ различного генеза радиоиммунологическим методом.
Референтные пределы значений тироксина (Т4)– 5,6-11,7 мкг/мл (Menezes-Ferreira M.M., Petrick P.A., Weintraub B.D.: Regulation ofthyrotropin (TSH) bioactivity by TSH-releasing hormone and thyroid hormone. Endocrionology 118, 2125-2130 (1986).
Нормальные показатели (ТТГ): 0,8-4,6 мМЕ/мл (Клиническая эндокринология / Под редакцией Н.Т. Старковой/, М. «Медицина», 1991, С.512). Референтные показатели соматотропного гормона: мальчики - 0,2-2,0 нг/мл и девочки – 2,0 – 10,0 нг/мл (А.Г. Таранов Диагностические тест-системы: радиоиммунный и иммуноферментный методы диагностики – Новосибирск: Издательство НГМУ, 2000.- 139-141).
Исследование состояния органов зрения: глазное дно проводилось в соответствии с последними Российскими рекомендациями, а также оценка состояния микроциркуляции по данным бульбарной микроскопии глаз.
В обследовании больных применялась проба с дозированной физической нагрузкой – велоэргометрия. Данный тест обеспечивал точную оценку функционального состояния организма и физической работоспособности обследуемого. У всех пациентов применялась кардиоинтервалография, при этом оценивался исходный вегетативный тонус, вегетативная реактивность, вегетативное обеспечение.
Патогенетическая терапия у больных назначалась с учетом существующих рекомендаций экспертов Всероссийского научного общества кардиологов и ассоциации детских кардиологов России (Москва, 2003). Медикаментозную коррекцию (монотерапия: эналаприл, пропранолол) получали 197 пациентов с АГ различного генеза.
Впервые в педиатрии был использован метод аппаратной аудио-визуально-вибротактильной стимуляции (АВВС) для коррекции повышенного АД в качестве монотерапии и в сочетании с традиционными гипотензивными препаратами (эналаприл, пропранолол). Метод (АВВС) основан на использовании эффектов слабых ритмических световых, звуковых и вибротактильных воздействий в частотных диапазонах активности электроэнцефалограммы (3,5-16 Гц). Одновременная мультимодальная стимуляция с изменяющейся частотой ритмических воздействий вызывает синхронизация источников спонтанной ритмики головного мозга, а также выявляет потенциальные осцилляторы с повышенной резонансной активностью (Salansky, N., 1998). Вибротактильные стимулы создают физиоакустический эффект, способствующий снятию соматического напряжения. Эффект «когерентного сенсорного резонанса» достигался при помощи синхронизации зрительных, слуховых и вибротактильных сигналов в диапазоне частот биоэлектрической активности головного мозга, что позволяло получить переупорядочивание корковых нейронных сетей и ликвидацию обусловленных стрессом очагов «застойного» возбуждения в мозге.
У больных с АГ на фоне ДСТ применялась монотерапия пропранололом в 83 наблюдениях, проранолол + АВВС – 10 случаев. При этом суточная доза пропранолола составила 0,5-1 мг/кг за 3 приема (per os). Положительный гипотензивный эффект наблюдался через 45 минут у 42 больных (72,4%) и через 1 час – 16 пациентов. Без медикаментозной коррекции в группе с ДСТ были 10 пациентов (АВВС).
У больных с ГС в качестве гипотензивного препарата использовался эналаприл, который получали 80 пациентов. Суточная доза эналаприла составляла дети: 0,-0,2 мг/кг (максимально 0,5 мг/кг) в сутки в два приема per os, а у подростков: 5-40 мг в сутки 2 раза в сутки per os. Медикаментозная терапия в сочетании с АВВС – 10 случаев. Немедикаментозная терапия в этой группе обследованных была назначена у 10 больных – АВВС.
В группе с ЭГ (40 человек) получали эналаприл. В 10 наблюдениях – сочетание эналаприла + АВВС. Суточная доза эналаприла составляла дети: 0,-0,2 мг/кг (максимально 0,5 мг/кг) в сутки в два приема, у подростков: 5-40 мг в сутки 2 раза в сутки per os.
При назначении терапии подход был индивидуальный к каждому больному, дозы использовались минимальные в начале терапии, учитывались результаты неоднократных измерений АД, показатели суточного мониторирования АД, проведенных при поступлении больных в стационар, степень АГ, у подростков старше 16 лет группы риска АГ.
Специальные методы исследования
Все пациенты были обследованы с помощью специальных методов исследования:
- Личностный опросник Грея-Уильсона, личностный опросник Айзенка для подростков, опросник «Сильные стороны и трудности».
- Психофизиологическое обследование с использованием электроэнцефалографии. Регистрация ЭЭГ проводилась в состоянии физиологического покоя при открытых (ОГ) и закрытых глазах (ЗГ) в следующей последовательности: ОГ (90 сек), ЗГ (90 сек), ОГ (90 сек), ЗГ (180 сек).
Многоканальная ЭЭГ (отведения Fz, Cz, Pz, Fp1, Fp2, F7, F8, F3, F4, T3, T4, С3, С4, P3, P4, T5, T6, O1, O2) регистрировалась с помощью Ag/AgCl электродов монополярно в полосе пропускания 0,3-30 Гц и при частоте дискретизации 125 Гц на компьютеризированном ЭЭГ-картографе Neurovisor-24 (“Медицинские компьютерные системы”, г. Зеленоград, Россия). В качестве референта использовался объединенный ушной электрод, заземляющий электрод располагался в центре лба, биоэлектрическая активность регистрировалась при импедансе ≤ 10 кОм. В качестве проводящей среды использовался электродный гель. После регистрации ЭЭГ проводилась коррекция глазодвигательных артефактов с помощью специализированного алгоритма (Semlitch et al., 1986). Дополнительно после визуального анализа были исключены эпохи, содержащие нескорректированные глазодвигательные, а также миографические, двигательные и иные артефакты. Для последующих анализов использовались только безартефактные эпохи ЭЭГ. В анализ включали по 3 фрагмента безартефактной ЭЭГ для каждого экспериментального условия (открытые глаза и закрытые глаза) длиной 8,192 с. Фрагменты ЭЭГ разделялись на две эпохи по 4,096 с (2048 отсчетов АЦП) и подвергались быстрому преобразованию Фурье (Fast Fourie Transformation) с использованием перекрывающихся окон Парзена. Для каждого испытуемого и экспериментального условия полученные значения спектров мощности (mV2) усреднялись в пределах дельта- (2-4 Гц), тета1- (4-6 Гц), тета2- (6-8 Гц), альфа1- (8-10 Гц), альфа2- (10-12 Гц), бета1- (12-18 Гц), бета2- (18-22 Гц), бета3- (22-30 Гц) частотных полосах и подвергались логарифмированию для нормализации распределения. Полученные значения мощности далее обрабатывались в программном пакете STATISTICA и SPSS.
Для статистических анализов ЭЭГ электроды были распределены на 3 зоны: лобная – F (Fp1, Fp2, F7, Fz, F8), центральная – C (C3, Cz, C4) и теменно-затылочная – PO (P3, Pz, P4, O1, O2). Для каждого испытуемого полученные значения мощностей спектра в исследуемых диапазонах усреднялись внутри каждого кластера. С целью сравнительного анализа межгрупповых различий до лечения и динамики изменений ЭЭГ в результате терапии были проведены 4-факторные ANOVA с повторными измерениями по схеме: Группа (4: КИ, ДСТ, ГС и ЭГ) ´ Экспериментальное условие (2: открытые глаза, закрытые глаза) ´ Локализация (3: F, C, PO) ´ Диапазон (4: тэта-1, тэта-2, альфа-1 и альфа-2). В зависимости от полученных эффектов использовались дополнительные простые ANOVA для детализации возникающих взаимодействий факторов. Для всех видов анализов в случае необходимости проводилась коррекция значений уровня статистической достоверности с помощью поправки Гринхауза-Гейсера. Для post-hoc сравнений использовались тесты Тьюки.
- Оценка липидного спектра крови: 1) исследование общего холестерина, триглицеридов, холестерина липопротеидов высокой плотности проводилось ферментными колорометрическими тестами (прямой метод Либермана-Бурхарда) с помощью аппарата “LabSystem” (Финляндия) и реактивов Biocon (Германия); 2) уровень холестерина липопротеидов низкой плотности рассчитывался по формуле Friedwald. Индекс атерогенности определялся по Климову А.Н.(1977).
- Оценка углеводного обмена: 1) определение уровня глюкозы (Сrocer C. L., 1976) в ходе ГТГ (радиоиммунные методы); 2) уровни С-пептида (Cousins L. Et al., 1980) натощак; 3) уровни инсулина (Диденко В.А., 1999) натощак; 4) индекс инсулинорезистентности (индекса Caro), (норма более 0,33).
- Оценка гормонального спектра крови (методы радиоиммунного анализа): 1) активность ренина плазмы, содержание альдостерона, ангиотензина I, ионов калия, натрия, кортизола, тиреотропного, соматотропного гормонов, тироксина.
- Уровень мочевой кислоты в сыворотки крови определялся по методу Мюллера-Зейферта.
- Оценка системы гемостаза: 1) общее количество тромбоцитов – фазовоконтрастная микроскопия; 2) АДФ-агрегация, коллаген агрегация, адреналин –ристомицин-агрегация тромбоцитов (по Б.Ф. Архипову,1981); адгезия тромбоцитов (по Архипову Б.Ф., 1981); 3) АПТВ – активированное парциальное тромбопластиновое время; 4) ПТ- протромбиновый тест ( по Л.З. Баркагану, Б.Ф. Архипову, 1980); 5) определение уровня фибриногена (по Р.А. Рутберг, 1961);6) определение уровня АТ 111 по Hetsen, Loeligert в модификации К.М. Бищевского,1978); 7) ОФТ – ортофенантролиновый тест (по В.А. Елыкову, А.П. Момоту, 1987); 8) каолииндуцированный фибринолиз (по Г.Ф. Еремину, А.Г. Архипову, 1982); 9) спонтанный фибринолиз; 10) определение активности фактора Виллебранда на фотоэлектрокалориметре по З.С. Баркаган, А.П. Момот (1999). Вышеописанные методы исследования системы гемостаза использовались для оценки состояния эндотелия сосудистой системы при проведении венооклюзионного теста.
В работе были использованы тесты с гетерогенными коагулазами змеиных ядов – либетоксовый, эхитоксовый и анцистродонтовый тесты по Л.П Цывкиной (1997) другие современные методы оценки системы гемостаза: 1) оценка спонтанной агрегации кровяных пластинок и индуцированной физиологическими индуктарами: АДФ, адреналином, коллагеном, тромбином, фибриногеном, ристомицином по методу Born G.V.R. (1962) в модификации В.Г. Лычева, О.И. Толочко (1974) на лазерном анализаторе микрочастиц «ЛАСКА-БИО» (НПФ «Люмекс», г.Санкт-Петербург, Россия); 2) определение доступности 3 пластинчатого фактора по R. Hardisti (1962); количественная оценка реакции высбобождения АДФ по Г.А. Сухановой, А.Е. Дороховой (авт. Свид. №1649447 от 15.01.1991).
- Оценка реологии крови: 1) определение гематокрита; 2) метод оценки степени повреждения эритроцитов по З.С. Баркагану, И.В. Тамарину; 3) степень деформируемости эритроцитов (метод определения деформируемости эритроцитов на аппарате ИДА-1).
- Оценка состояния ПОЛ, антиоксидантной активности плазмы и оксида азота проводилась при помощи следующих методов: 1) интенсивность реакций перекисного окисления липидов оценивалась по уровню диеновых коньюгатов в плазме крови, определяемых по методу Plazer в модификации В.Б. Гаврилова и М.И. Мишкорудной (1983), и малонового диальдегида – по Staucliff в модификации Э.Н. Коробейниковой (1988); 2) определение концентрации церулоплазмина - по методу Ravin H. в модификации Тена Э.В. (1981); 3) определение уровня оксида азота по значениям показателей нитритов азота методом Jgnarrj L.G. (1987).
Проведение всех вышеперечисленных исследований осуществлялось до назначения и в ходе проводимой терапии (10-14 и 28 дни лечения).
Для математической обработки полученного материала были использованы методы вариационной статистики с вычислением средней арифметической величины (М), среднего квадратичного отклонения (с), ошибки средней арифметической (m). Достоверность различий выборок оценивалась с помощью критерия Стьюдента (t). Для выражения связи между варьирующими признаками был проведен корреляционный анализ, при помощи которого изучали частоту и степень сопряженности между изучаемыми признаками. Корреляционный анализ позволил определить форму и направления связи между варьирующими признаками, а также определить силу или тесноту взаимосвязи и ее направленность. При этом был использован коэффициент корреляции (r) по способу квадратов К. Пирсона. Сравнение проводилось также с помощью различных схем дисперсионного анализа. Поскольку численность обследованных групп при различных видах анализа была неодинаковой, величина выборки в каждом случае указана отдельно. Критерием статистической достоверности был уровень p=0,05. Обработка полученных результатов проводилась с использованием пакета прикладных программ статистического анализа SPSS, version 10.07, позволяющих вести математическую обработку данных по статистическим параметрам. Также полученные данные анализировали с помощью методов параметрической (t-тест Стьюдента для сопряженных и независимых выборок) и непараметрической (тесты Вилкоксона и Мана-Уитни) статистики с использованием статистического пакета STATISTICA for Windows v.6.0 (StatSoft, USA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Первоначально проводилась оценка течения АГ в изучаемых клинико-патогенетических группах. Обнаружено, что независимо от генеза АГ чаще диагностировалась у мальчиков в возрастной группе от 13 до 15 лет, при этом длительность течения АГ составила от 1 до 3 лет.
При поступлении большинство пациентов с АГ предъявляли жалобы на стойкие повышения АД, сопровождающиеся выраженными цефалгиями с различной локализацией (лобная, затылочная, теменная, височные области головы), тошнотой, головокружениями, мельканием «мушек» перед глазами. При этом с наибольшей частотой указанные жалобы регистрировались в группе с ЭГ (100%), а среди пациентов с ГС в 72% наблюдениях и в группе с ДСТ – 60,2% больных. В соответствии с существующими рекомендациями выделялись степени АГ. В группе с ЭГ все пациенты имели II степень АГ. Обнаружено, что I степень АГ с наибольшей частотой встречалась в группе больных с ДСТ (61,2%), затем в группе с ГС (35%) и не было у больных с ЭГ. II степень АГ чаще регистрировалась у пациентов с ЭГ (100%), затем в группе с ГС (65%) и у больных с ДСТ (38,8%). В возрастной группе от 16 до 18 лет в соответствии с существующими рекомендациями в группах с ЭГ и ГС чаще (соответственно 32% и 30%), чем у больных с ДСТ (22%) регистрировался «высокий риск» развития сердечно-сосудистых заболеваний в дальнейшем.
По данным проведения суточного мониторирования АД при поступлении и до назначения терапии обнаружено, что пациенты с ЭГ и ГС имели стабильную гипертензию, а больные с ДСТ – лабильную АГ.
При сравнении особенностей наследственного анамнеза по развитию сердечно-сосудистых заболеваний и наличию маркеров «Х» синдрома с другими обследованными группами больных с вторичной АГ обнаружено, что по частоте встречаемости отягощенный наследственный анамнез встречался чаще у больных с ЭГ (100%), чем у пациентов с ГС (92%) и с ДСТ (62,13%). Отягощенный наследственный анамнез в большей степени независимо от генеза АГ регистрировался по материнской линии. Обнаружилось, что родственники больных с ЭГ, ГС, ДСТ страдали одинаково часто гипертонической болезнью, инфарктом миокарда, ишемической болезнью сердца. Единственным отличием было то, что родственники пациентов с ДСТ не имели ожирения.
Исследования были посвящены изучению личностных особенностей и психического здоровья в исследуемых клинико-патогенетических группах. Данные предшествующих исследований позволяют предположить, что повышенному АД сопутствуют склонность к отрицательным эмоциям и тенденции подавлять свои чувства и их открытое проявление. Что касалось психического здоровья, то в выборке из популяции повышенное АД сопровождалось значительно меньшим уровнем проблем. Полученные данные не выявили существенных различий между группами пациентов с ДСТ, ГС и ЭГ. При сравнении с контрольной группой оказалось, что у пациентов с АГ уровень психотизма значительно ниже, а нейротизма – несколько выше, чем у обычных школьников. Это означает, что дети и подростки с АГ по сравнению со здоровыми сверстниками отличаются большей осторожностью и мягкосердечностью; они менее импульсивны, более ответственны и меньше нуждаются в острых ощущениях. Кроме того, они несколько более тревожны и несчастны, а также имеют о себе невысокое мнение (H.J. Eysenck, G.D. Wilson, 2000.).
При более детальном анализе оказалось, что больше всего от контрольной группы отличались пациенты с ГС: у них были менее выражены экстраверсия (7,0±2,9; p<0,05) и более выражено торможение поведения (14,3±4,9). Выраженное повышение торможение у больных с ГС позволяет предположить у них повышенный уровень тревоги (таб.1).
Таблица 1
Черты личности у подростков с разными формами артериальной гипертензии
| Шкалы | Вся выборка | ЭГ | ДСТ | ГС | Различия |
| | М | М | М | М | F |
| ЛОА | (N = 65-67) | (N = 17) | (N = 24-25) | (N = 24-25) | |
| Экстраверсия | 8,1 2,8 | 8,9 2,7 | 8,7 2,6 | 7,0 2,9 | 2,95 |
| Нейротизм | 7,9 2,9 | 8,4 3,4 | 7,4 3,0 | 8,2 2,5 | 0,70 |
| Психотизм | 0,6 0,8 | 0,5 0,6 | 0,6 0,8 | 0,7 1,0 | 0,14 |
| Диссимуляция | 6,2 3,2 | 6,7 3,1 | 5,9 3,6 | 6,2 3,2 | 0,34 |
| ЛОГУ | (N = 66-67) | (N = 17) | (N = 25) | (N = 24-25) | |
| САП | 11,5 5,9 | 9,6 5,8 | 12,4 6,3 | 12,0 5,6 | 1,28 |
| СТП | 13,2 5,6 | 12,2 6,4 | 12,9 5,7 | 14,3 4,9 | 0,78 |
Родители пациентов оценивают психическое здоровье своих детей хуже, чем родители в общей выборке детей и подростков, в первую очередь за счет эмоциональных проблем и проблем со сверстниками. При сравнении подгрупп с АГ различного генеза оказалось, что изменение показателей психического здоровья наиболее выражено у пациентов с ГС. Результаты исследований согласуются с полученными данными взрослых пациентов с АГ и лиц с повышенным АД. У детей и подростков с клинически подтвержденной АГ отмечается повышенный контроль поведения с подавлением нежелательных проявлений, склонность к отрицательным эмоциям и трудности в общении со сверстниками. При этом важное значение имеет пол: у мальчиков с АГ отличие показателей психического здоровья от среднего уровня в популяции касается в основном поведенческих проблем, а у девочек – эмоциональных, так, что общая оценка отклонений психического здоровья разного пола имеет разнонаправленный характер. Эти данные позволяют предполагать существенную роль личностных факторов в патогенезе АГ. В связи с этим можно рекомендовать включение в программы профилактики и коррекции АГ соответствующих методов психотерапии.
Следующим этапом исследования было проведение электроэнцефалографии у пациентов всех клинико-патогенетических групп. Установлено, что пациенты с АГ в целом характеризуются подавлением мощности ЭЭГ в диапазонах альфа-активности. При сравнении со здоровыми, у всех пациентов наблюдается значимое снижение мощности высокочастотной альфа-активности ЭЭГ в лобной и теменно-затылочной коре, а пациенты с АГ дополнительно характеризуются подавлением низкочастотной альфа-активности в теменно-затылочной коре. Важно отметить, что в результате комплексной терапии лишь пациенты с ЭГ демонстрируют положительную динамику, отражающуюся в увеличении мощности в альфа-1 диапазоне до значений, характерных для здоровых испытуемых. В то же время, у всех пациентов с повышенными значениями АД наблюдается ригидность обнаруженных нарушений в альфа-2 диапазоне - комплексная терапия, несмотря на нормализацию показателей АД, не приводит к повышению исходно сниженной мощности в лобной и затылочной коре. Топографически различия между пациентами и контрольными испытуемыми обнаружены в лобной коре, ассоциируемой с планированием и контролем поведенческих актов, и в теменно-затылочной коре, активность которой связывают с процессами памяти, воображения, а также механизмами ‘бдительного’ (‘alerting’) и ‘мотивационного’ (‘motivated’) внимания (Posner, Rothbart, 1998; Keil et al., 2002; Афтанас с соавт., 2004). А в частотной области межгрупповые различия ассоциировались с диапазонами альфа-активности. Сниженные показатели мощности ЭЭГ в альфа-диапазонах ЭЭГ свидетельствуют о повышенной активированности лобной и теменно-затылочной коры у пациентов с различными формами АГ. Как было отмечено выше, снижение мощности в низкочастотном альфа-диапазоне ассоциируется с усилением процессов бдительности и физиологической активации, а в высокочастотном – интенсификацией когнитивных процессов и когнитивных аспектов эмоционального реагирования (Klimesch, 1999; Афтанас, 2000; Aftanas et al., 2002).
Можно предполагать, что наблюдаемое у пациентов подавление мощности ЭЭГ в альфа-1 диапазоне отражает напряжение регуляторных процессов, связанных с повышенной активностью механизмов ‘бдительного’ (‘alerting’) и ‘мотивационного’ (‘motivated’) внимания (Keil et al., 2003; Афтанас с соавт., 2004). Пациенты с АГ демонстрируют усиление “сканирования” внешнего и внутреннего пространства с целью повышенного контроля за вновь поступающими стимулами, отражая повышенную активность мотивационной системы оборонительного поведения, осуществляющей важный вклад в формирование индуцированной эмоциональным стрессом артериальной гипертонии (Henry et al., 1993; Sgoifo et al., 2005). Повышенная активированность лобной и теменной коры у всех пациентов (группы ЭГ, ГС и ДСТ) в альфа-2 диапазоне отражают, по-видимому, активизацию таких важных когнитивных процессов, как память и воображения, связанных с характерной для АГ непрерывной актуализацией отрицательных эмоциональных сценариев, направленных на “утилизацию” ‘эмоций гнева и психоэмоционального конструкта враждебности (Brosschot et al., 2007), (рис.1).
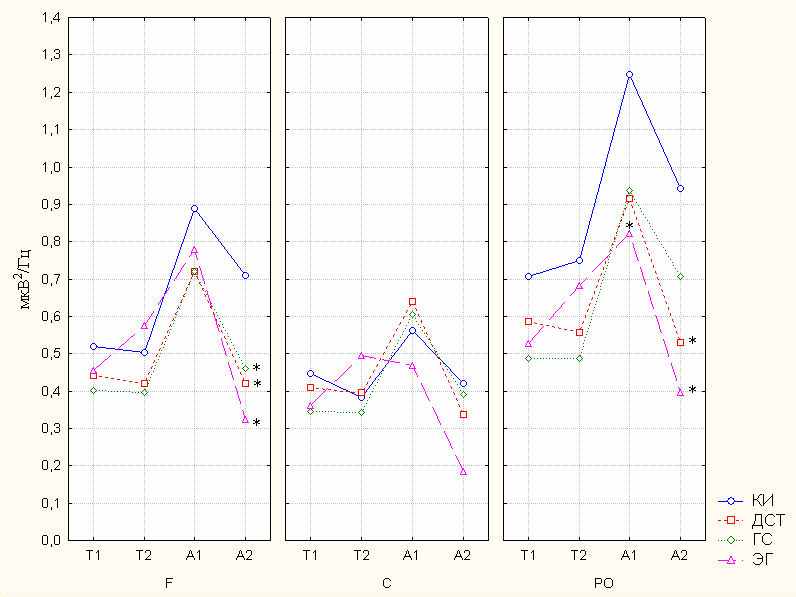
Рис.1 Показатели ЭЭГ у детей и подростков с АГ до лечения
Следующим этапом исследований было изучение метаболических особенностей до проводимой гипотензивной терапии в изучаемых клинико-патогенетических группах.
В результате проведенного обследования у пациентов с АГ были выявлены следующие нарушения липидного обмена (рис 2 ). Наибольшие изменения были свойственны пациентам с ГС, у которых выявлена пограничная гиперхолестеринемия в 27% наблюдениях (p<0,05 при сравнении с контролем), гипертриглицеридемия (53%), снижение уровня ХС-ЛПВП (70%), повышение значений ХС-ЛПНП (36%) , повышение уровня ИА в 4,6 раза больше относительно здоровых лиц. Для больных с ЭГ – гипертриглицеридемия – 40% случаев (21 пациент), снижение уровня ХС-ЛПВП у 16 обследованных (32%), повышение уровня ИА в 3 раза по сравнению с контролем. Пациенты с ДСТ не имели изменений показателей липидного обмена.
 Рис.2 Исходные показатели липидного спектра крови у детей и подростков с АГ.
Рис.2 Исходные показатели липидного спектра крови у детей и подростков с АГ.Примечание: * - достоверность различия по критерию Стьюдента при сравнении с контрольной группой (р<0,001); ** - достоверность различия по критерию Стьюдента при сравнении подгрупп обследованных 1 и 2 между собой (р<0,001); *** - достоверность различия по критерию Стьюдента при сравнении подгрупп обследованных 1 и 3 между собой (р<0,001); **** - достоверность различия по критерию Стьюдента при сравнении подгрупп обследованных 2 и 3 между собой (р<0,001).
Рядом авторов показано, что распространенность АГ у взрослых ассоциируется с уровнем гипергликемии, значениями инсулина крови (Ansel B.J., 2002; Isomaa B. et al., 2001). Гипергликемия вызывает гликозилирование различных белков, что приводит к изменению их свойств, повышению иммуногенности и развитию сосудистых осложнений (Камышников В.С., 2000). Еще важным фактором развития и прогрессирования АГ – нарушение пуринового обмена в виде гиперурикемии (Бриттов А.Н., 2006). Независимо от генеза АГ не выявлено случаев гипергликемии, гиперинсулинемии, инсулинорезистентности (по данным индекса Caro). Хотя по результатам проведения глюкозотолерантного теста в группах обследованных выявлены случаи нарушений толерантности к глюкозе. Так, в группе с ЭГ – по данным ГТТ – нарушение толерантности к глюкозе – 6 пациентов (12%), у больных с ГС – 9 случаев (9%) и у пациентов с ДСТ – 4 наблюдения (3,8%).
Исходная оценка уровня мочевой кислоты в крови показала, что наличие гиперурикемии свойственно в большей степени с ДСТ (65 обследованных , 67%) и больным с ЭГ (32 пациента, 64%). У детей и подростков с ГС показатели МК не отличались от значений контроля (рис.3) .

Рис. 3. Исходные показатели мочевой кислоты у детей и подростков с АГ.
Примечание: *- достоверность различия по критерию Стьюдента при сравнении с контрольной группой (р<0,001); ** - достоверность различия по критерию Стьюдента при сравнении 1 и 2 подгрупп обследованных между собой (р<0,001); *** - достоверность различия по критерию Стьюдента при сравнении 1 и 3 подгрупп обследованных между собой (р<0,001); **** - достоверность различия по критерию Стьюдента при сравнении 2 и 3 подгрупп обследованных между собой (р<0,001).
По результатам проведенных исследований проведена диагностика метаболического синдрома (МС) в соответствии с рекомендациями ВОЗ (1999 г.) во всех группах обследованных документирован у 6 пациентов с ЭГ (12%): гиперурикемия +нарушение толерантности к глюкозе (НТГ) +АГ+ висцеральный тип ожирения. Мономаркеры и сочетания проявлений МС - 35 пациентов (70%): гиперурикемия – 5 (10%); гипертриглицеридемия – 7 наблюдений (14%); гипертриглицеридемия + гиперурикемия – 7 (14%) случаев; гипертриглицеридемия + гиперурикемия + снижение уровня ХС-ЛПВП – 16 (32%) больных.
У 9 (9%) пациентов с ГС выявлен полный МС: у 3 больных - сочетание нарушение толерантности к глюкозе (НТГ) + висцерального типа ожирения+АГ; в 6 наблюдения - ожирение IV степени +гиперхолестеринемия+ повышение уровня ХС ЛПНП+АГ+снижение уровня ХС ЛПВП+НТГ. Мономаркеры и сочетания различных проявлений МС - у 83 больных (83%): – ожирение I степени – 15 больных (15%); гипертриглицеридемия – 4 случаев (4%); ожирение I степени + снижение уровня ХС ЛПВП +гипертриглицеридемия – 17 (17%); висцеральный тип ожирения+ ожирение III степени + АГ + снижение уровня ХС ЛПВП + гипертриглицеридемия – 10случаев (10%); ожирение II степени +снижение уровня ХС-ЛПВП + АГ – 20 больных (20%); висцеральный тип +снижение уровня ХС ЛПВП + гипертриглицеридемия + АГ + ожирение II степени – 8 случаев (8%); ожирение II степени + гиперхолестеринемия+ висцеральный тип ожирения + повышение уровня ХС ЛПНП+ АГ+ снижение ХС ЛПВП – 9 пациентов (9%).
У больных с ДСТ не было документировано случаев полного метаболического синдрома. Выявлены единичные маркеры данного синдрома: в 3,8% случаев (4 пациента) – нарушение толерантности к глюкозе по данным результатов проведения глюкозотолерантного теста; гиперурикемия - 65 пациентов (67%).
Заключая данный раздел важно отметить то, что среди детей и подростков МС в соответствии с рекомендациями ВОЗ (1999 г.) был документирован у 5% обследованных, что не противоречит данным литературы.
Независимо от генеза АГ уровень продуктов реакций ПОЛ в плазме всегда превышал контрольные значения, причем наибольшая интенсивность у больных с ЭГ (рис.4). Важной особенностью антиоксидантного потенциала плазмы крови оказалось его истощение в группах пациентов с ГС и ЭГ. Уровни оксида азота были значительно меньше в группах больных с ГС и ЭГ по сравнению с контрольными значениями и показателями пациентов с ДСТ. Отличий по полу изучаемых показателей не обнаружено.

Рис. 4. Исходные показатели ПОЛ, уровня церулоплазмина, оксида азота у детей и подростков с АГ.
Примечание: *- достоверность различия по критерию Стьюдента при сравнении с контрольной группой (р<0,001); ** - достоверность различия по критерию Стьюдента при сравнении 1 и 2 подгрупп обследованных между собой (р<0,001); *** - достоверность различия по критерию Стьюдента при сравнении 1 и 3 подгрупп обследованных между собой (р<0,001); **** - достоверность различия по критерию Стьюдента при сравнении 2 и 3 подгрупп обследованных между собой (р<0,001).
Независимо от генеза АГ в целом система гемостаза характеризовалась преимущественным нарушением в тромбоцитарном звене, что сочеталось с фоновой тромбинемией. Аналогичные результаты были получены и в терапевтических клиниках (Бокарев И.Н., 1991; Василенко А.М., Коваленко В.Н., Кузьмина А.П. 1992.) Детализированная оценка этих показателей позволила показать отсутствие убедительных доказательств, что выявленные нарушения имели связь с полом и возрастом больных. Как известно, у взрослых пациентов показатели АД отчетливо коррелируют как с полом, так и возрастом.
При изучении прокоагулянтного и антитромботического резервов эндотелиальной выстилки сосудов с помощью веноокклюзионного теста были выявлены определенные сдвиги, свидетельствующие о наличии скрытой патологии. В частности, обнаружился недостаточный прирост показателей каолининдуцированного фибринолиза в ходе ВОТ, о чем убедительно свидетельствовал низкий по сравнению с контролем индекс (менее 30% прирост) фибринолитической активности. Эти факты, выявленные впервые, позволили говорить об ограничении резервных возможностей эндотелия в отношении фибринолиза, т.е. о готовности системы гемостаза к повышенному образованию фибрина при прогрессировании АГ. Указанный сдвиг может быть связан со снижением биосинтеза простациклина в сосудистом эндотелии.
Независимо от генеза АГ была документирована повышенная жесткость мембран эритроцитов (по данным оценки деформируемости эритроцитов), гиперагрегация тромбоцитов определялась в основном на базе двух лабораторных методик – коллаген- и гемолизат-агрегационного тестов, нормальные показатели уровня фактора Виллебранда и адгезивная способность тромбоцитов. При этом изменения в сосудисто-тромбоцитарном звене системы гемостаза у пациентов с мезенхимальной дисплазией обычно были минимальны по сравнению с другими группами обследованных.
По сравнению со здоровыми сверстниками, у больных с ДСТ, ГС и ЭГ на базе веноокклюзионного теста выявилось достоверное снижение антиагрегационного индекса при определении ряда агрегационных тестов. Это позволило сделать вывод о наличии у данной категории пациентов ограничения антитромботического резерва и снижении тромборезистентности эндотелия стенки сосудов в условиях достаточного прокоагулянтного потенциала (в ходе веноокклюзионного теста содержание фактора Виллебранда увеличилось в среднем в 1,2 раза по сравнению с исходной величиной).
Все выявленные изменения показателей сосудисто-тромбоцитарного гемостаза практически мало зависели от генеза АГ. При этом основным является сдвиг в сосудисто-тромбоцитарном звене, что выражалось внутрисосудистой активацией кровяных пластинок в ответ на большинство физиологических индукторов агрегации ((АДФ (5; 10мкг/мл), адреналин (5; 10мкг/мл), коллаген)). Эти изменения сочетались со скрытой тромбинемией, позволяя говорить о наличии гиперкоагуляционного статуса (обратимая тромбинемия).
Выявленные сдвиги в системе гемостаза на всех этапах исследования подтверждают существующую теорию о том, что развитие и формирование АГ сопровождаются закономерным усилением внутрисосудистой активации тромбоцитов, а также патологическими изменениями клеточных мембран, универсальной моделью которой является эритроцитарная мембрана (Постнов Ю.В., 1995.).
Полученные результаты изучения РААС, электролитного обмена, показателей секреции кортизола до назначения гипотензивной терапии свидетельствовали о том, что у детей и подростков, имеющих проявления ДСТ каких-либо изменений в РААС, электролитном обмене и в секреции кортизола не обнаружили, а в группах с ГС и ЭГ уже на ранних этапах развития АГ выявили повышение активности РААС, напряженность электролитного обмена крови (увеличение уровня ионов натрия в сыворотке крови) и отсутствие изменений в процессе секрецию кортизола, что может являться показаниями для использования в качестве гипотензивного препарата ИАПФ (эналаприла) у этих пациентов.
На основании полученных данных представлялось важным определить влияние основной патогенетической терапии на изучаемые показатели. Пропранолол использовался у больных с ДСТ. При этом стойкая нормализация АД наблюдалась к 3-4 дню терапии. Однако применение данного препарата не оказало какого-либо воздействия на показатели процессов ПОЛ, уровня церулоплазмина, нитрита азота, мочевой кислоты, РААС, электролитного обмена, системы плазменного и коагуляционных звеньев системы гемостаза, ЭЭГ, углеводного и липидного обменов. В ходе использования пропранолола произошла нормализация показатели фибрин- и коллаген-агрегации тромбоцитов на 10-14 день терапии .
У больных с ЭГ и ГС был использован эналаприл. Спустя 7-10 дней после его назначения наблюдалась постепенная нормализация показателей АД. Применение данного препарата на 10-14 день терапии независимо от генеза АГ приводило к нормализации следующих изучаемых показателей в крови: малонового диальдегида, диеновые коньгаты, церулоплазмина, нитрита азота, АДФ-агрегации тромбоцитов, ренина, ангиотензина I, альдостерона, ионов натрия. На 28 день использования эналаприла вновь независимо от генеза АГ документировано положительное влияние данного гипотензивного препарата на измененные исходно показатели липидного обмена, адреналин-агрегации тромбоцитов, Хагеман-зависимого фибринолиза, РФМК (рис.5). Действие препарата было нейтральным на показатели углеводного обмена, мочевой кислоты, ионов калия, секреции кортизола, на ряд показателей системы гемостаза – активность XIII фактора, ядовых тестов.

Рис. 5. Показатели агрегации тромбоцитов в ходе лечения эналаприлом.
Примечание: *- достоверность различия показателей по критерию Стьюдента по сравнению с контрольной группой (р<0,001); ** - достоверность различия показателей по критерию Стьюдента при сравнении подгрупп обследованных 1 и 2 между собой (р<0,001); *** – достоверность различия показателей по критерию Стьюдента при сравнении подгрупп обследованных 1 и 3 между собой (р<0,001); **** - достоверность различия показателей по критерию Стьюдента при сравнении подгрупп обследованных 2 и 3 между собой (р<0,001).
Применение нового немедикаментозного способа коррекции АД АВВС приводило к нормализации в более ранние сроки повышенного АД при использовании комбинации АВВС и пропранолола, а также АВВС и эналаприла показателей СМАД (10-14 день лечения). Монотерапия АВВС обладала положительным действием на показатели оксида азота и адреналин-агрегации тромбоцитов (все индукторы).
Суммируя результаты проведенного исследования представляется возможным говорить о том, что артериальная гипертензия у детей и подростков в отличие от взрослых пациентов с АГ имеет свои особенности.
Из основных факторов риска в соответствии с Российскими рекомендациями, разработанными Комитетом экспертов Всероссийского научного общества кардиологов (Москва, 2004 г.), влияющих на прогноз заболевания для детей и подростков с АГ можно выделить только наличие отягощенного наследственного анамнеза ранних сердечно-сосудистых заболеваний.
Характерными психологическими особенностями детей и подростков с АГ являются повышенный контроль поведения с подавлением нежелательных проявлений, склонность к отрицательным эмоциям и трудности в общении со сверстниками. При этом важное значение имеет пол: у мальчиков с АГ отличие показателей психического здоровья от среднего уровня в популяции касается в основном поведенческих проблем, а у девочек – эмоциональных, так, что общая оценка отклонений психического здоровья разного пола имеет разнонаправленный характер. Эти данные позволяют предполагать существенную роль личностных факторов в патогенезе АГ. В связи с этим можно рекомендовать включение в программы профилактики и коррекции АГ соответствующих методов психотерапии. Дети и подростки с АГ демонстрируют по результатам проведения ЭЭГ усиление “сканирования” внешнего и внутреннего пространства с целью повышенного контроля за вновь поступающими стимулами, отражая повышенную активность мотивационной системы оборонительного поведения, осуществляющей важный вклад в формирование индуцированной эмоциональным стрессом артериальной гипертонии.
У детей и подростков с АГ встречается полный МС в соответствии с рекомендациями ВОЗ (1999 г.) в 5% наблюдений. Ориентацией для выявления МС в педиатрии должны быть следующие факторы: отягощенный наследственный анамнез по развитию ранних сердечно-сосудистых заболеваний у родственников, генез АГ (ГС или ЭГ), ожирение, абдоминальное ожирение, нарушение толерантности к глюкозе, гипертриглицеридемия, снижение уровня ХС ЛПВП, повышение уровня ХС ЛПНП, гиперурикемия.
У детей и подростков артериальная гипертензия является пусковым фактором активации тромбоцитов и повреждения эритроцитарных мембран в сосудистом русле. Это, а также выявленная на базе проведения манжеточной пробы тенденция к снижению продукции простациклина, сочетающаяся с напряженным синтезом основных компонентов кининоге-кининовой системы в эндотелии сосудов, позволяет отнести больных с АГ к группе риска по развитию тромботических осложнений. В этой связи представляется логичными рекомендации по использованию в этой категории больных препаратов, обладающих дезагрегационным эффектом.
С учетом выявленных изменений в процессах ПОЛ, антиоксидантной активности плазмы крови, сниженных значений уровня нитрита азота можно говорить об имеющейся уже на ранних этапах развития АГ эндотелиальной дисфункции, для коррекции которой показано дополнительное назначение антиоксидантов.
Для больных и подростков с АГ в большей степени в группах с ГС и ЭГ свойственна активация показателей ренин-ангиотензин-альдостероной системы, что является показанием для назначения в этих клинико-патогенетических группах эналаприла.
