«Электронное строение атомов химических элементов»
| Вид материала | Реферат |
- Химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых, 461.43kb.
- Химических элементов Д. И. Менделеева, 32.78kb.
- Металлы побочных подгрупп характеристика переходных элементов – меди, хрома, железа, 231.82kb.
- Закон. Периодическая система Химических элементов, 97.52kb.
- Урок в 9 классе по теме «Бериллий, магний и щелочноземельные металлы.», 43.76kb.
- Характеристика химических элементов малых периодов по их положению в периодической, 97.2kb.
- Кластерная система химических элементов Хорошавин Лев Борисович Докт техн наук Реферат, 748.35kb.
- Учебного материала по химии для 11 класса, 103.96kb.
- План лекций по общей химии для студентов 1 курса лечебного, педиатрического и медико-профилактического, 26.46kb.
- Билеты для переводной аттестации по химии, 8 класс Билет, 100.43kb.
МУ «Управление образования Администрации города Бийска»
МОУ «Кадетская школа»
Конкурс «Мониторинг качества образования»
Номинация «Педагогические тесты (тесты учебных достижений)»
Тесты по неорганической химии
для учащихся 9 класса
Выполнила:
Юрова Галина Юрьевна,
учитель химии высшей категории
МОУ «Кадетская школа»
домашний адрес:
ул. Васильева, 50- 5; тел. 44-95-86
г. Бийск, 2010 год
Содержание:
Введение………………………………………………………………………………3
1. Понятие теста……………………………………………………………………...4
2. Структура и формы тестов………………………………………………………5
3. Тесты по теме «Электронное строение атомов химических элементов»
- вариант 1…………………………………………………………………………6
- вариант 2…………………………………………………………………………7
4. Тесты по теме «Виды химической связи. Кристаллические решетки»
- вариант 1…………………………………………………………………………8
- вариант 2…………………………………………………………………………9
5. Тесты по теме «Скорость химических реакций»
- вариант 1…………………………………………………………………………10
- вариант 2…………………………………………………………………………11
6. Тесты по теме «Металлы»
- вариант 1…………………………………………………………………………12
- вариант 2…………………………………………………………………………13
7. Тесты по теме «Неметаллы»
- вариант 1………………………………………………………………………….14
- вариант 2………………………………………………………………………….15
6. Тесты по теме «Азот и его соединения»
- вариант 1………………………………………………………………………….16
- вариант 2………………………………………………………………………….17
7. Тесты по теме «Электролитическая диссоциация»
- вариант 1………………………………………………………………………….18
- вариант 2………………………………………………………………………….19
Ключ к тестовым заданиям с выбором ответа………………………………….20
Список используемой литературы…………………………………………………21
Введение
С 2008 года в регионах Российской Федерации в рамках создания Общероссийской системы оценки качества образования производится государственная итоговая аттестация выпускников 9-х классов в новой форме. Несмотря на то, что экзамен в новой форме пока проводится в режиме эксперимента, число регионов, реализующих эту форму итогового контроля, неуклонно растет.
Введение в практику новой модели экзамена для выпускников основной школы продиктовано необходимостью совершенствования форм итогового контроля с учетом принципа вариативности. Увеличения числа таких форм – положительная тенденция современной системы общественного образования, и экзамен в 9-ом классе в новой форме, безусловно, займет достойное место наряду с традиционными письменными экзаменами по русскому языку и алгебре, устными экзаменами по билетам, защитой реферата или проектной работой и другими.
В связи с вышеизложенными фактами, возникает необходимость уже в основной школе (8-9 классах) подготовить учащихся к сдаче экзамена по химии в форме теста. В данной работе вашему вниманию предлагаются тесты, разработанные по основным темам, изучаемым в курсе «Неорганическая химия» в 8-9 классах. Тесты могут быть использованы при проведении контрольных работ и при подготовке учащихся к сдаче ГИА.
Каждый тест максимально оценивается в 28 баллов. Примерная шкала перевода в пятибалльную систему оценки:
0 -14 баллов……. «2»,
15 – 19 баллов…. «3»,
20 – 25 баллов…. «4»,
26 – 28 баллов…. «5».
1. Понятие теста
Слово "тест" вызывает самые различные представления. Одни полагают, что это вопросы или задачи с одним готовым ответом, который надо угадать. Другие считают тест формой игры или забавы. Третьи пытаются истолковать это как перевод с английского слова "test", (проба, испытание, проверка). В общем, по этому вопросу нет единства мнений.
В науке проводят существенные различия между простым переводом слова и смыслом понятия.
Чаще всего мы встречаемся с упрощенным восприятием понятия "тест" как простой выбор одного ответа из нескольких предложенных к вопросу. Многочисленные примеры таких, казалось бы, "тестов" легко найти в газетно-журнальной периодике, в различных конкурсах и в многочисленных книжных публикациях под названием "Тесты". Но и это часто оказываются не тесты, а нечто внешне похожее на них. Обычно это сборники вопросов и задач, рассчитанных на выбор одного правильного ответа из числа предложенных. Они только по внешней видимости похожи на настоящий тест. Различия в понимании сущности тестов порождают различия в отношении к тестам.
В наши дни существует много видов тестов, поэтому дать универсальное определение для всех этих видов вряд ли можно.
Традиционный тест представляет собой стандартизованный метод диагностики уровня и структуры подготовленности. В таком тесте все испытуемые отвечают на одни и те же задания, в одинаковое время, в одинаковых условиях и с одинаковыми правилами оценивания ответов. Главная цель применения традиционных тестов - установить отношение порядка устанавливаемых между испытуемыми по уровню проявляемых при тестировании знаний.
В российском образовании большинство учебных заданий дается учащимся в нетестовой форме. В основном, это вопросы, задачи, упражнения. В зарубежном образовании доля заданий в тестовой форме существенно выше, что объясняется соображениями проводимой там образовательной политики, имеющихся там педагогических теорий, методик, обучающей техники и технологии.
Начиная с 30-х годов наука о тестах называлась буржуазной, все цели которой считались "реакционными". И хотя такие суждения пролеткультовского толка теперь уже считаются неадекватными духу нашего времени, все-таки появляются публикации, где тестам по-прежнему пытаются отказать в научности .
Первые научные труды по теории тестов появилась в начале ХХ века, на стыке психологии, социологии, педагогики и других так называемых поведенческих наук (Behavioral Sciences). Зарубежные психологи называют эту науку психометрикой (Psychometrika), а педагоги - педагогическим измерением (Educational measurement).
Тест - оптимальное отображение учебного материала в системе тестовых заданий. Такое отображение открывает возможность нетрадиционного построения учебного процесса, в котором тестовые материалы используются не только для контроля, но и для обучения. Например, применение заданий в компьютерных контрольно-обучающих программах позволяет учащимся самостоятельно обнаруживать пробелы в знаниях и принимать меры для их ликвидации. В таких случаях можно говорить об обучающем потенциале тестовых заданий.
2. Структура и формы тестов
Структура теста образует способ связи заданий между собой. В основном, это так называемая факторная структура, в которой каждое задание связано с другими через общее содержание и общую часть вариации тестовых результатов.
При организации контроля знаний по химии используются различные формы тестовых заданий. Существует, по крайней мере, четыре формы тестовых заданий:
- Открытая форма – эта форма имеет вид незаконченного суждения; задача тестируемого – его завершить, правильно подставив слово (цифру).
Например: Соли фосфорноватистой кислоты называются: __________
- Закрытая форма предполагает один или несколько ответов, которые тестируемый должен выбрать из предложенных.
Например: Соли фосфорноватистой кислоты называются:
а) ортофосфаты, б) ортофосфиты, в) фосфиды, г) метафосфаты, д) гипофосфиты.
- Выбор правильных соответствий – выполняющему тестовое задание предлагается сопоставить элементы разных групп, причем так, чтобы каждому элементу одной группы соответствовал один или несколько элементов из другой группы.
Например: Выберите для каждого соединения фосфора, представленного в столбце (а) соответствующее название из столбца (б).
-
Установление правильной последовательности – тестируемый должен выстроить единственно верную последовательность из предложенного набора элементов.
а)
б)
Ca3P2, Ca3(PO4)2, Mg2P2O7, NaPO3, Na2HPO3, NaH2PO2., AlPO4
ортофосфат, метафосфат, фосфид, ортофосфит, пирофосфат, гипофосфит
Например: Расположите соединения в порядке возрастания степени окисления фосфора:
а) H3PO2, б) H3PO4, в) PH3, г) H3PO3.
При создании тестовых заданий, важно выбрать способ формирования ответов для различных уровней знаний тестируемых.
Первый уровень знаний (репродуктивное узнавание) проверяется с использованием выборочных ответов (формы заданий 2 и 3).
Средний уровень знаний (умение применять полученные знания на практике) проверяют с использованием форм заданий 2, 3, 4.
Самый высокий уровень знаний (творческий) проверяют, используя формы 1, 4.
Рассмотренные способы формирования тестовых заданий были использованы для создания тестов по химии для учащихся 8-9 классов.
Тема «Электронное строение атомов химических элементов»
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Электронная формула внешнего энергетического уровня атома кремния
А. 3s23p2 Б. 3s23p4 В. 4s24p2 Г. 4s24p4
2 (2 балла). Порядковый номер элемента в Периодической системе определяется:
A. Зарядом ядра атома.
Б. Числом электронов в наружном слое атома.
B. Числом электронных слоев в атоме.
Г. Числом нейтронов в атоме.
3 (2 балла). Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. Si и SiH4 Г. S и H2S
4 (2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и Se. В. К и Са. Г. Мn и Fe.
5 (2 балла). s-Элементом является:
А. Барий. Б. Галлий. В. Америций. Г. Ванадий.
6 (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Sr—Rb—К. Б. Na—К—Са. В. Be—Li—К. Г. А1—Mg—Be.
7(2 балла). Элемент Э с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле:
А. Э2О. Б. Э2О3. В. ЭО2. Г. Э2О5.
8 (4 балла). Установите соответствие.
Элемент:
I. Бериллий. II. Натрий. III. Хлор. IV. Азот.
Электронная формула:
A. 1s22s2. В. 1s22s22p63s¹
Б. 1s22s22p3. Г. 1s22s22p63s23p5.
ЧАСТЬ Б. Задания со свободным ответом
9 (5 баллов). На основании положения в Периодической системе расположите элементы: бериллий, бор, магний, натрий — в порядке возрастания восстановительных свойств. Объясните ответ.
10 (5 баллов). Составьте электронную формулу элемента с порядковым номером 12 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1 (2 балла). Электронная формула атома фосфора
А. 1s22s2 2p3 Б. 1s22s22p63s23p3 В. 1s22s22p5 Г. 1s22s22p63s23p5
2 (2 балла). Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А. алюминия Б. азота В. фосфора Г. хлора
3 (2 балла). Электронная формула атома 1s22s22p63s23p3. Химический знак и формула водородного соединения этого элемента
А. C и CH4 Б. О и Н2О В. P и PH3 Г. S и H2S
4 (2 балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А. В и Si. Б. S и P. В. К и Nа. Г. Мn и Fe.
5 (2 балла). s-Элементом является:
А. натрий. Б. фосфор. В. уран. Г. ванадий.
6 (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
A. Mg—Ca—Zn. Б. Sr—Rb—К. В. А1—Mg—Са. Г. Ge—Si—Sb.
7(2 балла). Формула высшего оксида элемента, электронная формула которого 1s22s22p63s23p3 ,
А. B2O3 Б. Al2O3 В. N2O5 Г. P2O5
8 (4 балла). Установите соответствие.
Элемент:
I. Алюминий. II Калий. III. Селен. IV. Магний.
Электронная формула:
A. 1s22s22p63s23s² Б. 1s22s22p63s2. B. 1s22s22p63s23p63d104s24p4. Г. ls22s22p63s23p64sl
ЧАСТЬ Б. Задания со свободным ответом
9 (5 баллов). На основании положения в Периодической системе расположите элементы: германий, мышьяк, сера, фосфор в порядке возрастания неметаллических свойств. Объясните ответ.
10 (5 баллов). Составьте электронную формулу элемента с порядковым номером 13 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
Тема «Виды химической связи. Кристаллические решетки»
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа
1(2 балла). Формула вещества с ионной связью:
А. НС1 Б. КВг В. Р4. Г. СН3ОН.
2 (2 балла). Вещество с металлической связью:
А. Оксид калия. В. Кремний. Б. Медь. Г. Гидроксид магния.
3 (2 балла). Химическая связь в молекуле NH3
А. ионная
Б. ковалентная полярная
В. металлическая
Г. Ковалентная неполярная
4 (2 балла). Число общих электронных пар в молекуле азота:
А. Одна. Б. Две. В. Три. Г. Четыре.
5 (2 балла). Полярность химической связи уменьшается в ряду соединений, формулы которых:
А. С12, H2S, CO2. Б. NH3, PH3, SO2. В. НС1, HBr, HI. Г. ВН3, NH3, HF.
6 (2 балла). Кристаллическая решетка оксида кремния (IV):
А. Атомная Б. Металлическая В. Ионная. Г. Молекулярная.
7(2 балла). Вещество, формула которого Na2S, называют:
A. Гидросульфид натрия. Б. Сульфит натрия. B Сульфат натрия. Г. Сульфид натрия.
8(4 балла). Сера образует химические связи с калием, водородом, бромом и углеродом. Какая из связей наименее полярна?
А. сера – калий;
Б. сера – водород;
В. сера – бром;
Г. сера – углерод.
ЧАСТЬ Б. Задания со свободным ответом
9 (5 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Кальция и фтора. Б. Мышьяка и водорода.
Укажите тип химической связи в каждом соединении.
10 (5 баллов). Пользуясь данными таблицы относительных электроотрицательностей элементов, рассчитайте, какая из связей: Ca-H; S-H; N-H; Si-H наиболее полярная.
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Формула вещества с ковалентной неполярной связью:
A. MgCl2. Б. HF. В. N2. Г. А1.
2 (2 балла). Вещество с ионной связью:
А. Кислород. Б. Фторид натрия. В Метан. Г. Этаналь.
3 (2 балла). Химическая связь в молекуле CaCl2
А. ионная
Б. ковалентная полярная
В. металлическая
Г. Ковалентная неполярная
4 (2 балла). Число общих электронных пар в молекуле фтора:
А. Одна. Б. Две. В. Три. Г. Четыре.
5 (2 балла). Полярность химической связи увеличивается в ряду соединений, формулы которых:
A. HI, HC1, HF Б. HBr, O2, H2S. В. H2S, NH3, СН4. Г. Н2О, РН3, HI.
6 (2 балла). Кристаллическая решетка белого фосфора:
А. Атомная. Б. Металлическая. В. Ионная. Г. Молекулярная.
7 (2 балла). Вещество, формула которого NaH2PO4, называют:
A. Гидрофосфат натрия. Б. Фосфат натрия .B. Дигидрофосфат натрия. Г. Фосфид натрия.
8 (4 балла). Сера образует химические связи с калием, водородом, углеродом. Укажите, в сторону какого атома происходит смещение электронной плотности связи?
А. смещение в сторону атома водорода;
Б. смещение в сторону атома калия;
В. смещение в сторону атома серы;
Г. смещение в сторону атома углерода.
ЧАСТЬ Б. Задания со свободным ответом
9(8 баллов). Составьте схему образования соединений, состоящих из химических элементов: А. Бора и фтора. Б. Калия и серы.
Укажите тип химической связи в каждом соединении.
10 (5 баллов). Пользуясь данными таблицы относительных электроотрицательностей элементов, рассчитайте, какая из связей: O-H; O-Na; О-К; О-Са наиболее ионная.
Тема «Скорость химических реакций»
Вариант 1
1.(4 балла) Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Концентрации реагирующих веществ.
Г. Форма сосуда, в котором протекает реакция.
2.(4 балла) Фактор, влияющий на смещение химического равновесия:
A. Вид химической связи.
Б. Катализатор.
B. Природа реагирующих веществ.
Г. Температура.
3.(4 балла) При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза. В. В 8 раз.
Б. В 4 раза. Г. В 16 раз.
4.(4 балла) С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(г) + Н2О(г) ↔ С2Н5ОН(г)
A.He изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
5.(4 балла) Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + 02 ↔ 2SO3 + Q,в сторону исходных веществ необходимо:
A. Увеличить давление.
Б. Повысить температуру.
B. Понизить температуру.
Г. Применить катализатор.
6.(4 балла) Повышение температуры смещает химическое равновесие вправо (→) в обратимой реакции, уравнение которой:
А. 2Н2 + О2 ↔ 2Н 2О + Q
Б. SO2 + H2O ↔ H2SO3 + Q
В. 2NO + O2 ↔ 2NO2 + Q
Г. C4Н10 ↔ С4Н8 + Н2 – Q
7.(4 балла) В какую сторону сместится химическое равновесие в реакции, уравнение которой С2Н4 + Н2 ↔С2Н6 + Q,в случае:
A. Повышения давления?
Б. Уменьшения температуры?
B. Увеличения концентрации С2Н4?
Г. Применения катализатора?
Дайте обоснованный ответ.
Вариант 2
1.(4 балла) Фактор, не влияющий на скорость химической реакции:
A. Давление.
Б. Катализатор.
B. Способ получения реагентов.
Г. Температура.
2.(4 балла) Фактор, не влияющий на смещение химического равновесия:
A. Давление.
Б. Концентрация реагирующих веществ.
B. Температура.
Г. Природа реагирующих веществ.
3.(4 балла) Для увеличения скорости химической реакции в 32 раза (температурный коэффициент γ =2) надо повысить температуру:
А. НаЗ0°С. В.На50°С.
Б. На 40 °С. Г. На 60 °С.
4.(4 балла) С увеличением концентрации SO2 равновесие обратимой химической реакции,
уравнение которой 2SO2 + О2 ↔2SO3 + Q:
A. Не изменится.
Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
5.(4 балла) Для смещения химического равновесия обратимой реакции, уравнение которой
N2 + ЗН2 ↔ 2NH3 + Q,в сторону продуктов реакции необходимо:
A. Увеличить концентрацию NH3.
Б. Понизить температуру.
B. Применить катализатор.
6.(4 балла) Понижение давления смещает химическое равновесие вправо (→) в реакции, уравнение которой:
А. СН4 + Н2О ↔ 3Н2 + СО,
Б. СО2 + Н2О ↔ Н2СО3,
В. 3Н2 + N2 ↔ 2NH3 ,
Г. 2СО + О2 ↔ СО2.
7.(4 балла) В какую сторону сместится химическое равновесие реакции, уравнение которой 4HCl + O2 ↔2H2O + 2Cl2 + Q , в случае:
A. Повышения температуры?
Б. Уменьшения давления?
B. Увеличения концентрации 02?
Г. Применения катализатора?
Дайте обоснованный ответ.
Тема «Металлы»
Вариант 1 .
ЧАСТЬ А. Тестовые задания с выбором ответа.
1 (2 балла). s-Элементу 4-го периода Периодической системы соответствует электронная формула:
A. 1s22s22p63s23p63d34s2. В. ls22s22p63s23p63d14s2.
Б. ls22s22p63s23p64s1 . Г. ls22s22p63s1.
2(2 балла). Электронная формула иона Na+:
A. 1s22s22p63s2. B. ls22s22p6.
Б. 1s22s22p63s1. Г. 1s22s22p5.
3(2 балла). Переменную степень окисления в соединениях проявляет:
А. Барий. Б. Медь. В. Кальций. Г. Цезий.
4(2 балла). Простое вещество — железо — может являться:
A. Только восстановителем. Б. Только окислителем.
B. И окислителем, и восстановителем.
5(2 балла). Схема превращений Сu+2 → Сu+1 → Сu0 представляет собой процессы:
A. Только восстановления.
Б. Только окисления.
B. Окисления (переход 1), восстановления (переход 2).
Г. Восстановления (переход 1), окисления (переход 2).
6(2 балла). Восстановительные свойства в ряду химических элементов Cs – Rb – K – Ca :
A. Изменяются периодически. В. Не изменяются.
Б. Ослабевают. Г. Усиливаются.
7(2 балла) Формула вещества X в уравнении реакции
Сu + 2Н2SО4(КОНЦ) = CuSO4 + X + 2Н2О:
A. Н2. Б.SО2. B.H2S. Г.SO3.
8(2 балла). Цинк взаимодействует с каждым веществом группы:
А. Водород, сульфат меди (II) (р-р), метаналь.
Б. Кислород, муравьиная кислота, сера.
B. Оксид углерода (IV), оксид кальция, фенол (расплав).
Г. Глюкоза, этанол, хлор.
ЧАСТЬ Б. Задания со свободным ответом
9(4 балла). Составьте формулы высшего оксида и гидроксида элемента, в ядре которого
содержится 56 протонов. Назовите эти вещества, укажите их характер.
10(8 баллов). Составьте уравнения реакций следующих превращений:
Al → Al2O3 → AlCl3 → Al(NO3)3 → Al(OH)3.
Первую реакцию рассмотрите с точки зрения окислительно-восстановительных процессов.
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1(2 балла). d-Элементу 4-го периода Периодической системы соответствует электронная формула:
A.ls22s22p63s23p63d104s24p1. В. 1s22s22р63s23р63d24s2.
Б.1s22s22p63s23p64s2. Г. 1s22s22р63s23р2.
2(2 балла). Электронная формула иона А13+:
A.1s22s22p63s23p3. В. 1s22s22p63s23pl.
Б.1s22s22p63s1. Г. 1s22s22p6.
3(2 балла). Переменную степень окисления в соединениях проявляет:
А. Алюминий. Б. Железо. В. Барий. Г. Рубидий.
4(2 балла). Простое вещество — медь — может являться:
A. Только восстановителем. Б. Только окислителем.
B. И окислителем, и восстановителем.
5(2 балла). Схема превращений Fe0 → Fe+2 → Fe+3 представляет собой процессы:
A. Только восстановления. Б. Только окисления.
B. Окисления (переход 1), восстановления (переход 2).
Г. Восстановления (переход 1), окисления (переход 2).
6(2 балла). Восстановительные свойства в ряду химических элементов Ва—Sr—Ca—Sc:
A. Изменяются периодически. В Не изменяются.
Б. Ослабевают. Г. Усиливаются.
7(2 балла). Формула вещества X в уравнении реакции
Ag + 2HNO3(KOH.) = AgNO3 + X + Н2О :
А.Н2. Б.NO2. В. N2 . Г. N2O.
8(2 балла). Магний взаимодействует с каждым веществом группы:
A. Гидроксид натрия, водород, кислород.
Б. Вода, уксусная кислота, хлор.
B. Оксид меди (II), этанол, фенол (расплав).
Г. Вода, серная кислота (раствор), гидроксид калия.
ЧАСТЬ Б. Задания со свободным ответом
9(4 балла). Составьте формулы высшего оксида и гидроксида элемента, в ядре которого содержится 11 протонов. Назовите эти вещества, укажите их характер.
10(8 баллов). Составьте уравнения реакций, следующих превращений:
Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe → FeCl3.
Первую реакцию рассмотрите с точки зрения окислительно-восстановительных процессов.
Тема «Неметаллы»
Вариант 1 .
ЧАСТЬ А. Тестовые задания с выбором ответа
1(2 балла). Электронная конфигурация атома элемента главной подгруппы VII группы,
4-го периода Периодической системы:
A….3s23p63d104s24p4. Б. ...3s23p5.
B….3s23р63d104s24р5. Г. ...3s23p63d104s24p3.
2(2 балла). Высший оксид и гидроксид элемента главной подгруппы VI группы Периодической системы соответствуют общим формулам:
А. ЭО2 и Н2ЭО3. Б. Э2О5 и Н3ЭО4.
В. Э03 и Н2ЭО4. Г. Э2О7 и НЭО4.
3(2 балла). Окислительные свойства усиливаются в ряду элементов:
А. С—N—Р—As. Б. F—О—N—С.
В. Si—С—N—О. Г. Р—Si—С—В.
4 (2 балла). Ковалентная неполярная связь образуется в соединении, формула которого:
А. СС14. Б. S8. В. КВг. Г. Н2О.
5(2 балла). Валентность и степень окисления азота в ионе аммония соответственно равны:
А. Четыре и -4. Б. Три и -3.
В. Четыре и -3. Г. Три и +3.
6(2 балла). Молекулярное строение имеет:
А. Алмаз. Б. Графит. В. Озон. Г. Кремний.
7 (2 балла). Простое вещество — углерод — взаимодействует с каждым из группы веществ, формулы которых:
А. СО, О2, С12. Б. Fe, NaOH, HC1.
В. СО2, СО, Н2О. Г. Н2, 02, Н2О.
8 (2 балла). Схеме превращения N-3 → N0 соответствует уравнение:
A. 4NH3 + 5О2 = 4NO + 6Н2О. Б. NH3 + Н2О = NH3 • Н2О.
В. 4NH3 + ЗО2 = 2N2 + 6Н2О. Г. NH3 + HC1 = NH4C1.
ЧАСТЬ Б. Задания со свободным ответом.
9 (6 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Na2S ← S → SO2 → SO3 → BaSO4.
Укажите типы реакций по всем изученным признакам классификации реакций
10(6 баллов). Расставьте коэффициенты в схеме реакции
H2S04(koh.) + С → СО2 + SO2 + Н20
методом электронного баланса. Укажите окислитель и восстановитель.
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа.
1(2 балла). Электронная формула атома элемента главной подгруппы IV группы,
3-го периода Периодической системы:
A. 1s22s22p2. Б. 1s22s22p63s23p4.
В. 1s22s22p63s23p2. Г. 1s22s22p63s23p6.
2(2 балла). Высший оксид и гидроксид элемента главной подгруппы V группы Периодической системы соответствуют общим формулам:
А. Э02 и Н2ЭО3. Б. Э03 и Н2ЭО4.
В. Э2О5 и НЭО3. Г. Э2О7 и НЭО4.
3(2 балла). Окислительные свойства ослабевают в ряду элементов:
А. Р—N—О—F. Б. С1—S—Р—As.
В. Br—C1—F—I. Г. В—С—N—Р.
4(2 балла). Ковалентная полярная связь образуется в соединении, формула которого:
А. РН3. Б. NaСl. B. 02. Г. К2S
5(2 балла). Валентность и степень окисления азота в азотной кислоте соответственно равны:
А. Пять и +5. Б. Четыре и +5.
В. Три и +5. Г. Три и + 3.
6(2 балла). Атомную кристаллическую решетку имеет:
А. Озон. Б. Алмаз. В. Кислород. Г. Водород.
7(2 балла). Простое вещество сера взаимодействует с каждым из веществ ряда:
А. НС1, Na, 02. Б. К, Zn, Na2SO4.
В. Mg, 02, Н2. Г. А1, Н20, 02.
8 (2 балла). Схеме превращения С-4 → С+4 соответствует уравнение:
А. СН4 + О2 = С + 2Н2О. Б. С + О2 = СО2.
В. СН4 + 2О2 = СО2 + 2Н2О. Г. СО2 + С = 2СО.
ЧАСТЬ Б. Задания со свободным ответом.
9 (6 баллов). Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
NH3 ← N2 → NO → NO2 → HNO3.
Укажите типы химических реакций.
10(6 баллов). Расставьте коэффициенты в схеме реакции
Р + H2SO4(KOH.) → Н3РО4 + SO2 + Н2О
методом электронного баланса. Укажите окислитель и восстановитель.
Тема «Азот и его соединения»
Вариант 1 .
ЧАСТЬ А. Тестовые задания с выбором ответа
1(3 балла). Электронная формула азота следующая:
А. 1S2 2S22P3
Б. 1S2 2S2 3S23P1
В. 1S2 2P5
2(3 балла). Отрицательная степень окисления проявляется азотом в соединении:
А. NH4Cl Б. NO2 В. NaNO3
3(3 балла). При повышении давления равновесия системы N2 + 3H2 ⇄ 2NH3 сдвигается в сторону:
А. прямой реакции
Б. обратной реакции
4(3 балла). Свойства солей аммония в значительной мере аналогичны свойствам солей щелочных металлов, так как:
А. ион аммония имеет заряд +1, как и ионы щелочных металлов
Б. ион аммония образует растворимые соли с большинством анионов кислот
В. ион аммония, как и ионы щелочных металлов, имеет малое сродство к электрону
5(3 балла). Структурная формула азотной кислоты следующая:
А. Б. В.
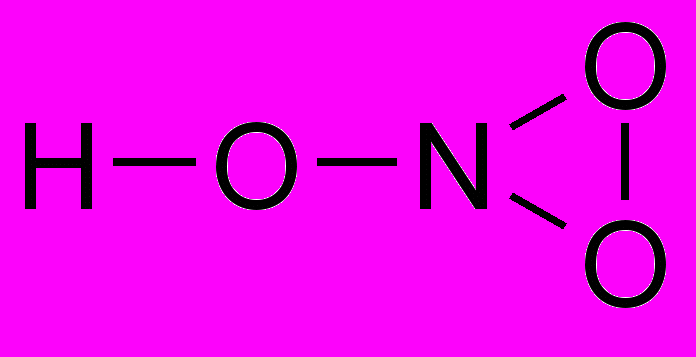


6(3 балла). Разложение нитрата кальция происходит по следующей реакции:
А. Сa(NO3)2 →Сa(NO2)2 + O2↑
Б. Сa(NO3)2 →СaO + 2NO2 + O2↑
В. Сa(NO3)2 →Сa + 2NO2 + O2↑
7(3 балла). Аммиак реагирует с водой:
А. с изменением степени окисления азота
Б. по донорно – акцепторному механизму
В. по реакции обмена
8(3 балла). В воздухе азота в свободном виде содержится:
А. 50% (по объёму)
Б. 85% (по объёму)
В. 78% (по объёму)
9(3 балла). Какое из следующих соединений называется нитридом кальция:
А. Сa(NO3)2
Б. Сa3N2
В. Сa(NO2)2
10(3 балла). При термическом разложении 1 моль Cu(NO3)2 выделяется объём газов:
А. 22,4 литра
Б. 44,8 литра
В. 56,0 литра
Вариант 2
1(3 балла). Отрицательная степень окисления проявляется азотом в соединении:
А. NH4Cl
Б. NO2
В. NaNO3
2(3 балла). Структурная формула аммиака:
А. Б. В.



3(3 балла). Выберите неверное утверждение:
А. Аммиак – активное вещество
Б. Аммиак плохо растворим в воде
В. Аммиак – газ с резким запахом
4(3 балла). В каком из соединений массовая доля азота максимальна:
А. NaNO3
Б. NH4 NO3
В. N2O3
5(3 балла). Степень окисления азота в молекуле азотной кислоты равна:
А. +5 Б. +3 В. -3
6(3 балла). Разложение нитрата цинка происходит по следующей реакции:
А. Zn(NO3)2 → Zn(NO2)2 + 2O2↑
Б. Zn(NO3)2 → ZnO + 2NO2 + 2O2↑
В. Zn(NO3)2 → Zn + 2NO2 + 2O2↑
7(3 балла). Азотная кислота пассивирует следующие металлы:
А. железо и медь
Б. железо и алюминий
В. железо и серебро
8(3 балла). Какой из предложенных нитратов не относится к селитрам:
А. NaNO3
Б. NH4 NO3
В. AgNO3
9(3 балла). Оксид азота (Ⅱ) имеет молекулярную формулу:
А. N2O
Б. N2O3
В. NO
10(3 балла). Какой объём кислорода выделится при разложении 4 моль KNO3:
А. 22,4 литра
Б. 44,8 литра
В. 11,2 литра
Тема «Электролитическая диссоциация»
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором ответа.
1 (2 балла). Вещества, которые при диссоциации образуют в качестве анионов только гидроксид-ионы, являются
А. кислотами Б. средними солями В. щелочами Г. кислыми солями
2 (2 балла). Формула сильного электролита
А. H2SO3 Б. CaCO3 В. HNO3 Г. Cu(OH)2
3 (2 балла). Сокращенное ионное уравнение реакции Al3+ + 3OH– = Al(OH)3
соответствует взаимодействию
| А. хлорида алюминия с водой Б. алюминия с водой В. хлорида алюминия со щелочью Г. алюминия со щелочью. |
4 (2 балла). Сумма коэффициентов перед формулами неэлектролитов в уравнении реакции Fe + 2HCl(р-р) = FeCl2 + H2↑
А. 2 Б. 3 В. 4 Г. 5
5 (2 балла). Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между растворами сульфата натрия и хлорида бария равны
А. 11 и 3 Б. 11 и 5 В. 9 и 3 Г. 9 и 5
6 (2 балла). Реакция ионного обмена идет до конца в результате выделения газа при взаимодействии:
А. Cu(OH)2 c H2SO4 Б. KOH c Zn(NO3)2
В. CaCO3 c HCl Г. Na2CO3 c CaCl2
7 (2 балла). С каким веществом реагирует нитрат меди согласно сокращенному уравнению реакции Cu2+ + S2- = CuS:
А.сероводородом; Б.сульфатом натрия; В.сульфитом натрия; Г.сульфидом натрия;
8 (2 балла). К реакциям ионного обмена не относится реакция
А. Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3;
Б. KOH + HCl = KCl + H2O;
В. 2KMnO4 = K2MnO4 + MnO2 + O2 ;
Г. Li2SO3 + 2HNO3 = 2LiNO3 + H2O + SO2
ЧАСТЬ Б. Задания со свободным ответом.
9 (4 балла). Пользуясь таблицей растворимости, приведите примеры трёх веществ, которые в растворах образуют нитрат-ион ( NO3- ).
10 (8 баллов). Составьте молекулярные, полные и сокращенные ионные уравнения реакций между:
а) K2SO4 и Ba(NO3)2
б) NaOH и H3PO4
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором ответа.
1 (2 балла). Вещества, которые при диссоциации образуют в качестве катионов ионы водорода и металла, являются
А. кислотами Б. средними солями В. щелочами Г. кислыми солями
2 (2 балла). Формула слабого электролита
А. H2SO3 Б. NaOH В. HNO3 Г. Ba(OH)2
3 (2 балла). Сокращенное ионное уравнение Ca2+ + CO32– CaCO3
соответствует взаимодействию
|
4 (2 балла). Лампочка прибора для испытания веществ на электропроводность загорится при погружении электродов в
А. сахар (крист.) Б. сахар (водн. р-р)
В. хлорид натрия (крист.) Г. хлорид натрия (водн. р-р)
5 (2 балла). Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между растворами сульфата меди (II) и гидроксида натрия равны
А. 12 и 4 Б. 10 и 4 В. 12 и 3 Г. 10 и 3
6 (2 балла). Реакция между ионами идет до конца в результате образования нерастворимого в воде вещества при взаимодействии:
А. Al3+ c SO4 2- Б. Ca2+ c CO32-
В. H+ c OH- Г. Ba2+ c OH-
7 (2 балла). С каким веществом реагирует хлорид меди согласно сокращенному уравнению реакции Cu2+ + S2- = CuS:
А.сероводородом; Б.сульфатом калия; В.сульфитом калия; Г.сульфидом калия
8 (2 балла). К реакциям ионного обмена не относится реакция
А. Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3;
Б. KOH + HCl = KCl + H2O;
В. 2KMnO4 = K2MnO4 + MnO2 + O2 ;
Г. Li2SO3 + 2HNO3 = 2LiNO3 + H2O + SO2
ЧАСТЬ Б. Задания со свободным ответом.
9 (4 балла). Пользуясь таблицей растворимости, приведите примеры трёх веществ, которые в растворах образуют ион натрия ( Nа+ ).
10 (8 баллов). Составьте молекулярные, полные и сокращенные ионные уравнения реакций между:
а) AgNO3 и CaCl2
б) H2SO4 и KOH
Ключ к тестовым заданиям с выбором ответа
«Электронное строение атомов химических элементов»
| № задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Вариант 1 | А | А | В | Б | А | В | Г |
| Вариант 2 | Б | В | В | В | А | В | Г |
«Виды химической связи. Кристаллические решетки»
| № Задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Вариант 1 | Б | Б | Б | В | В | А | Г |
| Вариант 2 | В | Б | А | А | А | Г | В |
«Скорость химических реакций»
| № задания | 1 | 2 | 3 | 4 | 5 | 6 |
| Вариант 1 | Г | Г | А | Б | Б | Г |
| Вариант 2 | В | Г | В | Б | Б | А |
«Металлы»
| № задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Вариант 1 | Б | В | Б | А | А | Б | Б | Б |
| Вариант 2 | В | Г | Б | А | Б | А | Б | Б |
«Неметаллы»
| № задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Вариант 1 | В | В | В | Б | В | В | Г | В |
| Вариант 2 | В | В | Б | В | А | Б | В | В |
«Азот и его соединения»
| № задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Вариант 1 | А | А | А | А | Б | А | Б | В | Б | А |
| Вариант 2 | А | Б | - | В | А | Б | Б | В | В | Б |
«Электролитическая диссоциация»
| № задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Вариант 1 | В | В | В | А | В | В | Г | В |
| Вариант 2 | Г | А | А | Г | Г | Б | Г | В |
Список используемой литературы
1. Габриелян О.С. Контрольные и проверочные работы. Химия. 8 класс. М.: Дрофа, 2004
2. Габриелян О.С. Контрольные и проверочные работы. Химия. 9 класс. М.: Дрофа, 2004
3. Глинка Н.Л. Курс общей химии. – М., 2005.
4. Суровцева Р.П., Гузей Л.С., Останний Н.И. Химия. 8-9 класс. Учебно-методическое пособие. М.: Дрофа, 2001.
5. Хомченко И.Г. Общая химия. М.: ООО “Издательство Новая Волна”, “ОНИКС”, 1999.
