Седых Ирины Юрьевны учителя химии «моу сош №8» г. Белгорода Г. Белгород 2005г урок
| Вид материала | Урок |
- Воронина Валентина Михайловна, учитель географии моу «сош №42 г. Белгорода» Рубан Ольга, 594.79kb.
- Твери Королевой Ирины Ивановны пояснительная записка, 111.24kb.
- Приказ от 2011 г № образовательная программа муниципального общеобразовательного учреждения, 4951.24kb.
- Рабочая программа педагога Салимзяновой Ирины Владимировны, Iквалификационная категория, 740.09kb.
- Рабочая программа педагога Салимзяновой Ирины Владимировны, Iквалификационная категория, 632.03kb.
- Рабочая программа педагога Салимзяновой Ирины Владимировны, Iквалификационная категория, 985.05kb.
- Рабочая программа педагога Салимзяновой Ирины Владимировны, Iквалификационная категория, 573.99kb.
- Внеклассное мероприятие по русскому языку (6 класс) учителя моу сош №40 г. Твери Королевой, 59.33kb.
- Образовательная программа моу лицей №32 г. Белгорода на 2010-2011 уч год Белгород, 1663.49kb.
- Проект посвящён 55-летию образования Белгородской области. Тема: «Истории отечественной, 134.24kb.

Разработка урока химии в VIII классе
«Вода – самое необыкновенное вещество в мире».
Из опыта работы
Седых Ирины Юрьевны
учителя химии «МОУ
СОШ № 8» г. Белгорода
Г.Белгород
2005г.
Урок-исследование по теме: Вода – самое необыкновенное вещество в мире.
ЦЕЛИ УРОКА:
- актуализировать и систематизировать знания учащихся о воде, дополнить их новыми сведениями через систему познавательных заданий, опорных сигналов, лабораторно-демонстрационного эксперимента;
- обеспечить условия для овладения приемами изучения состава и свойств веществ, их применения при решении практических задач;
- совершенствовать умения учащихся самостоятельно работать со справочно-информационной литературой по химии, биологии, географии;
- развивать эмоциональную сферу учащихся, используя энциклопедический материал по химии, биологии, литературе, экологии;
- продолжить экологическое просвещение школьников.
РЕАКТИВЫ И ОБОРУДОВАНИЕ:
- образцы природной и водопроводной воды;
- химический стакан, воронка, стеклянная палочка, бумажный фильтр, вода с примесями, универсальные индикаторные бумажки;
- технологические карты, инструктивные карты – на столах учащихся;
- справочно-информационная литература, энциклопедии по химии, биологии, экологии.
ОФОРМЛЕНИЕ ДОСКИ:
- высказывания о воде;
- плакаты: «Запасы воды на земле», «Схема водоочистительной станции», «Значение воды»;
- выставка творческих работ учащихся по теме.
«Самое лучшее – это вода,
Лучше, чем олимпийские игры,
Лучше, чем золото».
Древнегреческое изречение.
ХОД УРОКА.
I. Организационный момент. Определение целей урока, план-инструктаж работы по технологическим картам.
II. Актуализация и систематизация знаний по изученному материалу с использованием фронтального опроса, беседы, краткого монологического ответа учащихся.
- Учащиеся дают определение понятию «оксиды», называют и составляют формулы оксидов.
- Учащиеся дают определение реакциям окисления и восстановления, записывают схемы реакций на доске.
- Учащиеся работают над составлением уравнений реакций по схеме.
III. Исследование. Поисковая деятельность учащихся.
Учитель: В.И.Вернадский так писал об этом веществе: «…она стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных, геологических процессов. Нет земного вещества – минерала, горной породы, живого тела, которое ее не заключало бы. Все земное вещество ею проникнуто и охвачено». О каком веществе идет речь?
После ответов учащихся учитель формулирует тему урока и записывает на доске, учащиеся – в технологических картах.
Учитель: Вода – самое удивительное и загадочное вещество на земле. Ей посвящены многие произведения – рассказы, стихи, песни.
В кружева будто одеты
Деревья, кусты, провода.
И кажется сказкою это,
А в сущности – только вода.
Безбрежная ширь океана
И тихая заводь пруда,
Струя водопада и брызги фонтана,
И все это – только вода.
На кодоскопе записаны предложения о воде.
- Вода – одно из начал всего существующего на земле, говорили в древности.
- Вода – простое вещество, единое и неделимое, считали в средние века.
- «Вода состоит из водорода и кислорода, ее можно получить с помощью химической реакции» - утверждал французский химик Лавуазье, который в 1783 г. открыл состав воды.
- Вода обладает уникальными свойствами, определяющими ее значение для жизни на Земле.
- «Свойства воды во многом определяют свойства растворов,» - утверждал Д.И.Менделеев.
- Мировой океан – «житница» человечества – стал всемирной «свалкой», куда выбрасывается большая часть отходов человеческой деятельности.
В ходе дискуссии учащиеся формулируют основные задачи урока, которые в виде плана учитель записывает на доске.
1. Состав воды.
2. Нахождение воды в природе.
3. Значение воды для живых организмов.
4. Физические свойства воды.
5. Получение чистой воды.
6. Проблема охраны чистых вод.
Затем следует групповая работа. Каждой группе учащихся выдается карточка с соответствующим заданием в рамках поставленных задач (работают 10-12 мин.)
ЗАДАНИЯ ДЛЯ ГРУПП.
ГРУППА 1. Нахождение воды в природе.
Учащиеся работают со справочными материалами, научно-популярной литературой, которую они заранее подобрали и заполняют схему в технологических картах.
П
 редполагаемый ответ: ВОДА В ПРИРОДЕ
редполагаемый ответ: ВОДА В ПРИРОДЕ

гидросфера атмосфера живые организмы минералы подземные воды Моря, океаны-1,4 млрд км 14 тыс. км 65%
Ледники, снега-30млн км
Реки,озера-2 млн км
ГРУППА 2 . Определение качественного и количественного состава воды.
Задача. Определите химическую формулу воды по составу: W(O)=88,8%, W(H)=11,11%.
О
 пределите молекулярную массу воды.
пределите молекулярную массу воды.П
 редполагаемый ответ: ДАНО: РЕШЕНИЕ:
редполагаемый ответ: ДАНО: РЕШЕНИЕ:W(O)=88,8% Н : О = W(H) :W(O) = 11.1 : 88.8 = 2:1
W(H)=11,11% Ar(H) Ar(O)
МФ-? Mr(H2O)=18
Мr-? Ответ: Н2О
ГРУППА 3. Значение воды для живых организмов.
Учащиеся работают со справочной и научно-популярной литературой, заранее ими подобранной и решают задачу.
Предполагаемый ответ:
| Сердце Печень Глаза Мышцы Кожа Мозг Желудок Кровь Кишечник Легкие Зубы Скелет | 73,7% 70% 78% 79,5% 64,7% 75,8% 74,7% 90% 79% 78,7% 9,2% 30% | |
| | | |
В человеческом организме 35 л жидкости непрерывно осуществляют «орошение» тела. В этот объем входят 5л крови, 2л лимфы, 28л внутриклеточной жидкости. Кроме того, в организме циркулируют еще несколько жидкостей разного состава: 1,5л слюны, 2,5л желудочного сока, 1л желчи, 0,7л панкреатического сока, 0,1-0,2л спинномозговая и мозговая жидкости. Все эти жидкости – водные растворы неорганических и органических веществ. Вода – обязательный компонент каждой живой клетки. Обезвоживание организма на 12-15% приводит к нарушению обмена веществ, а потеря воды до 25% приводит к гибели организма.
Задача. Вычислите, сколько воды в вашем организме. В каких органах ее содержится больше?
ДАНО: РЕШЕНИЕ:
m=40кг m(H2O)=m(тела) x W(H2O)
W(H2O)=65%=0,65 m(H2O)=40 кг х 0,65 = 26 кг
m(H2O)-?
Ответ: m(H2O)=26кг, наиболее богаты водой кровь,
стекловидное тело глаза (99%), мышцы, легкие,
кишечник, мозг.
ГРУППА 4. Физические свойства воды.
Учащимся предлагаются отрывки из научно-популярной литературы, в которой описаны физические свойства воды. Они должны определить эти свойства и рассказать об их значении.
«От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У нее очень большая ….., нагреваясь, она поглощает тепло; остывая, отдает его. Земная вода и поглощает, и возвращает очень много тепла и тем самым выравнивает климат. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере».
«Самая замечательная роль океана в том, что он является огромным своеобразным термостатом: летом не дает Земле перегреться, а зимой постоянно снабжает континенты теплом. Страны, окруженные океаном, обладают мягким морским климатом, и перепады в температуре там не значительные. Но, постепенно удаляясь в глубь континента, можно наблюдать все большую контрастность температур».
«Известно, что если стальную иголку положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь плотность металла значительно больше плотности воды. Молекулы воды связаны силами …. Эти силы настолько велики, что две соченные водой пластинки из стекла удается разъединить, прилагая большие усилия».
Предполагаемый ответ: Физические свойства воды
- tз=0 С, tк=100 С, p=1г/мл, pmax=при 4 С.
- Растворитель.
- Большая теплоемкость, С=4200кДж/кг. С
- Между молекулами образуется водородная связь.
- Существует в 3 агрегатных состояниях.
ГРУППА 5. Получение чистой воды.
- Учащиеся изучают справочно-информационный материал по получению чистой воды, по схеме на плакате рассказывают об очистке питьевой воды.
- Учащиеся демонстрируют очистку воды в лабораторных условиях. Предполагаемый ответ:
Этапы очистки воды:
- Отстаивание.
- Фильтрование.
- Обеззараживание.
С
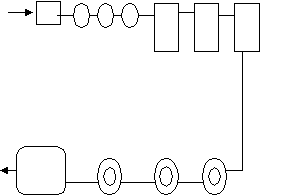 хема очистных сооружений:
хема очистных сооружений: - м
 еханическая очистка 1 2
еханическая очистка 1 2
- первичные отстойники
- первичные отстойники 3-4
- аэротенки
- вторичные отстойники 6 5
- резервуар
ГРУППА 6.Проблема охраны природных вод.
Учащиеся, используя знания по экологии и справочно-энциклопедический материал, в виде тезисов составляют сообщение по экологическим проблемам, связанными с водой и пути их решения.
Предполагаемый ответ:
- Человеку в день потребляет примерно 2,5 л воды, за 70 лет жизни примерно 65 т воды.
- В крупных городах каждый человек расходует в сутки около 300 л воды.
- Воду используют в различных отраслях промышленности: выплавка стали требует 25 т воды, для очистки 1 т нефти надо затратить 18 т воды и в сельском хозяйстве на орошение 1 га земли, занятой рисом, необходимо 10 тыс. т воды в год.
- Ежегодно речной сток выносит в Мировой океан: 1,8 млн т марганца, 6,5 млн т фосфора, 2,3 млн т свинца, з20 млн т железа, а также сульфаты, пестициды, ядохимикаты, отходы радиоактивных производств.
- В настоящее время в нашей стране основным способом защиты водоемов от загрязнения сточными водами является строительство очистных сооружений, большое распространение получили методы механической, биологической (основан на способности микроорганизмов использовать загрязняющие вещества для питания) и физико-химический очистки (сорбция – способность некоторых веществ поглощать на своей поверхности загрязняющие вещества).
- Основные направления решения проблемы дефицита воды:
- Рациональное использование водоресурсов. Это направление одно из наиболее разрабатываемых и широко внедряемых в практику от простейших насадок на водопроводные краны до сложнейших, с компьютерным управлением систем водооборота на предприятиях.
- Доставка воды из одного региона в другой различными средствами: трубопроводами (например, в Гонконг из Китая), пароходами во многие арабские страны.
- Опреснение морской воды. Используется почти во всех прибрежных районах. Наиболее мощные опреснительные установки работают в Арабских Эмиратах и в Японии. Все современные корабли снабжены мощными дистилляторами.
IV. Учитель: Еще 2500 лет назад древние персы пользовались серебряными сосудами для хранения воды во время военных походов. Египтяне покрывали поверхностную рану серебряной пластинкой, и рана заживала быстрее. Вода, взятая из колодца или проруби в религиозный праздник крещения «освящается» - помешивается серебряным крестом, такая вода может храниться очень долго.
А теперь лабораторным способом испытаем, какая вода течет из наших кранов.
Учащиеся, используя инструктивную карту «Определение пригодности воды для питья», проводят лабораторную работу, результаты фиксируют в технологической карте.
V. РЕФЛЕКСИЯ. ОЦЕНКА ДЕЯТЕЛЬНОСТИ КЛАССА. Учитель подводит итоги работы, оценивает деятельность учащихся, объясняет домашнее задание, предлагает учащимся творческие задания. Учащиеся в технологических картах проводят самооценку своей работы, отмечают настроение.
ИНСТРУКТИВНАЯ КАРТА
Лабораторная работа. Определение пригодности воды для питья.
Некоторые показатели, обеспечивающие благоприятные свойства воды.
- ЦВЕТ. Налейте в пробирку 5-7 мл исследуемой воды. Определите ее цвет. Чистая вода – бесцветная жидкость.
- МУТНОСТЬ. При попадании в воду нерастворимых частиц она становится мутной. При использовании такой воды требуется ее предварительная очистка.
- КИСЛОТНОСТЬ (рН). Смочите полоску универсальной индикаторной бумаги исследуемой водой и сравните со шкалой. Норма рН=6,5 – 8,5.
- ЗАПАХ. Запах определяется эпитетами: землистый, хлорный, рыбный, травяной, болотный, гнилостный. Силу запаха выражают по 5-бальной шкале.
1 балл – запаха нет или он очень слабый;
2 балла – запах слабый;
3 балла – запах заметный;
4 балла – запах отчетливый (вызывает воздержание от питья);
5 баллов – запах сильный (вода совершенно непригодна для питья).
Заполните таблицу. Сделайте вывод о пригодности воды для питья.
Т

 ехнологическая к а р т а
ехнологическая к а р т а У ченика_____________________________________
ченика_____________________________________
I. «Разминка для ума»
1.Выбрать оксиды: NaOH, H2SO4, K2O, ZnO, Cu(OH)2,
 Fe2O3, MgCl2, H2O, CH4, SO3.
Fe2O3, MgCl2, H2O, CH4, SO3.2.Составить формулы оксидов: оксид кальция, оксид кремния, оксид азота, оксид бария, оксид водорода.
3.Составить уравнения реакций, соответствующих схеме:
Н2 --- Н2О --- О2 --- Fe2O3 --- Fe --- Fе
КАК НАСТРОЕНИЕ?
ПЕРЕД УРОКОМ _ __
ПОСЛЕ УРОКА ___
II. УРОК-ИССЛЕДОВАНИЕ ПО ТЕМЕ:
| |
| |
| |
| |
| |
| |
Оценка активности на уроке
1. Нахождение воды в природе.
2.Определение качественного и количественного
состава воды.
3.Назначение воды для живых организмов.
4. Физические свойства воды.
5. Получение чистой воды.
6. Проблема охраны природных вод.
Лабораторная работа. Определение пригодности воды для питья.
| Свойства | Цвет | Мутность | Кислотность | Запах |
| Образец водопроводной воды | | | | |
| Образец природной воды | | | | |
Вывод:
оцени себя сам_____
ОЦЕНКА УЧИТЕЛЯ _________
