Морфология краниального шейного узла и функциональные характеристики его нейронов в постнатальном онтогенезе крысы 14. 03. 01 Анатомия человека 03. 03. 01 Физиология
| Вид материала | Автореферат |
- Промоторова Курс «Анатомия и морфология человека», 117.42kb.
- Новосельцева Г. Д. Анатомия и физиология человека, 16.83kb.
- Библиография и ссылки «Анатомия и морфология растений», 6.79kb.
- Программа проведения краевого и окружного тура Олимпиады Тестирование, 42.8kb.
- Анатомо-топографические особенности лимфоидных образований прямой кишки человека, 278.63kb.
- Методические рекомендации для организации самостоятельных работ по курсу "Анатомия, 48.13kb.
- И физиология. Лекции. Оглавление, 3129.02kb.
- «Анатомия и физиология человека», 2387.81kb.
- Этапы становления гемомикроциркуляторного русла пищевода в пренатальном онтогенезе, 214.56kb.
- Пояснительная записка примерная программа дисциплины "Анатомия и физиология", 789.89kb.
На правах рукописи
Коробкин Александр Анатольевич
МОРФОЛОГИЯ КРАНИАЛЬНОГО ШЕЙНОГО УЗЛА И ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ ЕГО НЕЙРОНОВ В ПОСТНАТАЛЬНОМ ОНТОГЕНЕЗЕ КРЫСЫ
14.03.01 – Анатомия человека
03.03.01 – Физиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Ярославль – 2011
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Ярославская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель:
доктор медицинских наук, профессор
Маслюков Петр Михайлович
Официальные оппоненты:
доктор медицинских наук, профессор
Филимонов Владимир Иванович
доктор биологических наук
Тарасова Ольга Сергеевна
Ведущая организация – Государственное образовательное учреждение высшего профессионального образования «Казанский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Защита состоится « » мая 2011 года в _________ на заседании диссертационного совета Д 208.119.02 при Государственном образовательном учреждении высшего профессионального образования «Ярославская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации, 150000, г. Ярославль, ул. Революционная, д. 5 г.
С диссертацией можно ознакомиться в библиотеке
Ярославской государственной медицинской академии
Автореферат разослан «___ » ____________ 2011 г.
Ученый секретарь
диссертационного совета Румянцева Т.А
Актуальность темы. К важнейшим структурно-функциональным элементам автономной (вегетативной) нервной системы относятся симпатические узлы, которые, по современным представлениям, являются не только пунктами переключения сигналов на пути из центральной нервной системы к рабочим органам, но и низшими интегративными центрами. Известные к настоящему времени принципы строения и функции во многом основаны на результатах работы Дж. Ленгли (Langley, 1925), зарубежных и отечественных исследователей структуры и функции ее мозговых центров, узлов, сплетений, нейронейрональных и нейротканевых взаимоотношений (В.И.Скок, 1970; Н.Г.Колосов, 1972; Gabella, 1976; А.Д.Ноздрачев, 1978, 1983; Elfvin, 1983; McLachlan, 1995; А.Д.Ноздрачев, А.В.Янцев, 1995; Тарасова О.С. с соавт., 2002).
При этом достаточно точно были установлены детали анатомического строения различных симпатических узлов, морфометрические и функциональные характеристики симпатических нейронов. Применение современных иммуногистохимических методов, а также использование методов компьютерной обработки морфологических и электрофизиологических данных позволило существенно дополнить данные о нейрохимических и функциональных особенностях нейронов, что нашло свое отражение в монографиях последних лет (А.Д.Ноздрачев, Е.И.Чумасов, 1999; А.Д.Ноздрачев, М.М.Фатеев, 2002; Jänig, 2006).
В ходе возрастного развития нейронов симпатических узлов происходят изменения, сопровождающиеся возрастанием размеров нервных клеток, изменением их нейротрансмиттерного состава, особенностей фоновой электрической активности (Rubin, 1985; В.Н.Швалев с соавт., 1992; Masliukov, 2003; Masliukov, Timmermans, 2004; П.М.Маслюков c соавт., 2006). Имеются сведения, что в ходе постнатального онтогенеза происходит запрограммированная гибель нервных клеток (Shepherd, 2004; Glebova, Ginty, 2004). Однако сведения о динамике изменения морфометрических, нейрохимических и электрофизиологических характеристик симпатических нейронов в постнатальном онтогенезе являются противоречивыми.
Цель исследования: установить закономерности возрастных изменений анатомии краниального шейного узла крыс, нейрохимического состава нейронов, характеристик фоновой активности нейронов, пре- и постганглионарных волокон.
Задачи исследования:
- Определить анатомические особенности, варианты отхождения ветвей и морфометрические характеристики нейроцитов краниального шейного узла у крыс в процессе возрастного развития.
- Установить иммуногистохимические характеристики нейронов краниального шейного узла крыс, содержащих различные нейротрансмиттеры в постнатальном онтогенезе.
- Выявить характеристики фоновой активности нейронов краниального шейного узла крыс, а также пре- и постганглионарных волокон узла у крыс в онтогенезе.
Научная новизна работы. В результате морфологических исследований установлено, что краниальный шейный узел крысы характеризуется вариабельностью форм, расположения относительно бифуркации общей сонной артерии и характером отхождения ветвей. Наиболее распространенной является веретенообразная форма, представляющая в сечении эллипс. Форма в виде песочных часов встречается у 10-суточных и более взрослых животных в меньшем проценте случаев.
Выявлены основные варианты отхождения ветвей краниального шейного узла с правой и левой стороны. Обнаружено три варианта отхождения ветвей от краниальной трети узла, имеется два варианта отхождения ветвей от средней части ганглия и выявлено два варианта начала ветвей от каудальной трети ганглия. Различий между правым и левым ганглиями не обнаружено. Доказано, что топография краниального шейного ганглия в онтогенезе не остается постоянной. В первые 10 суток после рождения узел смещается в краниальном направлении по отношению к бифуркации общей сонной артерии.
Морфометрический анализ нейроцитов показал, что в ходе онтогенеза возрастают средняя площадь сечения и максимальный диаметр. Число нейронов в краниальном шейном ганглии не меняется в онтогенезе. Процессы пролиферации и апоптоза нейронов в краниальном шейном ганглии незначительно выражены лишь у новорожденных животных
Получены новые данные о том, что уже у новорожденных животных в краниальном шейном ганглии большая часть нейроцитов содержит одновременно тирозингидроксилазу (ТГ) и нейропептид Y (НПY). В дальнейшем, в ходе возрастного развития, процент таких нейронов увеличивается, в то время как доля кальбиндин (КА)-иммунопозитивных нейронов имеет максимальное значение в первые 10 суток жизни, а затем снижается на протяжении первых двух месяцев жизни.
В работе получены новые сведения о том, что нервные связи краниального шейного ганглия с сосудами шеи сформированы и существуют с момента рождения. Все симпатические вазомоторные нейроны являются ТГ-иммунопозитивными и КА-иммунонегативными. Часть нейронов узла, проецирующихся к сосудам шеи, содержит НПY. Процент вазомоторных нейронов, содержащих НПY, увеличивается в первые 20 суток жизни.
Впервые установлено, что импульсная активность нейронов крысят ранних возрастных групп (новорожденных и 10-дневных) характеризовалась низкой частотой разрядов и наличием большого процента нейронов с апериодической активностью. В процессе возрастного развития происходит увеличение частоты импульсации и разнообразие паттерна активности. Характер нейронной фоновой активности формируется в онтогенезе у крыс уже к 20 дню жизни. Окончательное формирование амплитудно-частотных характеристик нейронной активности в краниальном шейном ганглии крысы завершается к концу 1 месяца жизни.
Получены новые данные и об особенностях возрастных изменений фоновой электрической активности отдельных ветвей. Фоновая электрическая активность в пре- и постганглионарных волокнах развивается гетерохронно. В преганглионарных она присутствует с момента рождения, в постганглионарных появляется лишь к 10 суткам жизни. В пре- и постганглионарных волокнах наибольшее значение мощности приходится на частоты, синхронные с сердечной деятельностью. Окончательно характер активности становится сопоставимым с взрослым животным в преганглионарных волокнах – с 20 суток, а в постганглионарных - с 30 суток жизни.
Научная и практическая значимость работы. Полученные результаты расширяют представление о морфологических особенностях как самого краниального шейного узла, так и составляющих его нейронов и их изменениях в процессе возрастного развития. Полученные нормативные морфо-функциональные характеристики нейроцитов и ветвей краниального шейного ганглия необходимы для оценки результатов исследования закономерностей иннервации внутренних органов грудной полости и шеи, имеют значение для сравнительной анатомии и физиологии и решения возможности экстраполяции экспериментальных данных на человека. Конкретные результаты проведенного исследования могут использоваться как новые сведения о структуре и функции краниального шейного ганглия в учебном процессе на кафедрах анатомии и физиологии.
Основные положения, выносимые на защиту:
- Краниальный шейный узел крысы характеризуется вариабельностью форм, характера отхождения ветвей и расположения относительно бифуркации общей сонной артерии.
- В постнатальном онтогенезе число нейронов краниального шейного узла крысы достоверно не меняется. При этом в краниальном шейном ганглии в первые шесть месяцев жизни отсутствуют процессы пролиферации и апоптоза нейронов.
- Нейроны краниального шейного узла с различными иммуногистохимическими характеристиками, а также пре- и постганглионарные волокна развиваются гетерохронно.
- Морфологические и функциональные характеристики нейронов краниального шейного ганглия крысят становятся сопоставимыми с характеристиками взрослого животного к концу второго месяца жизни.
Апробация работы. Основные положения диссертации доложены на X конгрессе международной ассоциации морфологов (Ярославль, 2010), X юбилейной всероссийской научной конференции с международным участием «Физиологические механизмы адаптации растущего организма» (Казань, 2010), XXI съезде физиологического общества им. И.П.Павлова (Калуга, 2010), VIII Всероссийской конференции «Нейроэндокринология-2010» (Санкт-Петербург, 2010).
Публикации. По результатам диссертации опубликовано 7 научных работ, из них 4 – в центральной печати, 3 - в журналах из Перечня периодических изданий, определенных ВАК РФ.
Объем и структура диссертации. Диссертация изложена на 130 страницах машинописного текста и состоит из введения, материалов и методов исследования, четырех глав результатов собственных исследований, заключения, выводов, указателя литературы, включающего 184 наименований, в том числе 43 отечественных и 141 иностранных. Диссертация иллюстрирована 8 таблицами и 28 рисунками.
Материал и методы исследования. Работа выполнена на 210 животных: 35 новорожденных крысятах, массой 15-20 г, 35 десятисуточных, массой 20-30 г, 35 двадцатисуточных, массой 60-80 г, 35 одномесячных, массой 100-150 г, 35 двухмесячных, массой 150-200 г, 35 шестимесячных крысятах, массой 250-300 г. Проведено четыре группы экспериментов с использованием методов: 1) анатомических, 2) гистологических, 3) иммуногистохимических, 4) электрофизиологических.
При исследовании вариантов отхождения ветвей узла эвтаназию животных осуществляли под уретановым наркозом (1 г/кг внутрибрюшинно). Препарирование осуществляли препаровальными иглами под контролем бинокулярной лупы с увеличением 24х.
При проведении морфометрического исследования под глубоким уретановым наркозом (2 г/кг, внутрибрюшинно) после препарирования узлов животных перфузировали транскардиально физиологическим раствором, а затем фиксирующей смесью 4 % параформальдегида. Забирали правый и левый узел для морфометрического исследования. Серии срезов толщиной 12 мкм изготовляли на криостате.
Для установления размеров ганглия и вычисление его объема определяли под контролем бинокулярной лупы с увеличением 24х (объектив 4х, окуляр 6х) при помощи морфометрической сетки длину, ширину и толщину узла. На основании полученных данных, объем узла вычисляли при помощи компьютерной программы SolidWorks.
Для определения нейронов, содержащих ТГ, каспазу 3, НПY, КА, протеин Ki67 применялось двойное мечение антителами. Вторичные антитела были конъюгированы с флюорохромом FITС или CY3. Для определения морфометрических характеристик нейронов краниального шейного ганглия и общего количества нейронов использовался Neurotrace 530-615 (красный флуоресцентный краситель по Нислю).
При исследовании проекций нейронов краниальных шейных ганглиев к сосудам скелетных мышц использовался ретроградный аксонный транспорт Fast Blue, который вводился под фасцию грудинно-ключично-сосцевидной мышцы с помощью микрошприца.
Анализ данных морфологических методов исследования проводился при помощи флуоресцентного микроскопа ЛОМО Микмед 2, вариант 12, снабженного соответствующим набором светофильтров и цифровой камерой. При подсчете оценивались только нейроны с четко идентифицированным ядром. Процент иммунореактивных нейроцитов рассчитывался как отношение нейронов, иммунопозитивных к данному маркеру на срезе, к общему числу нейронов на срезе. Установив площадь сечения нейронов, средний диаметр тел нейронов и их плотность распределения на 1 мм² плоскости среза ганглия, по формуле Hoff и Rhines (Г.Г. Автандилов, 1990) находили количество нейронов в 1 мм3. Количество нейронов в 1 мм3 перемножали на объем ганглия и получали общее количество нейронов в узле.
Согласно рекомендациям Г.Ф. Лакина (1980), по правилу Старджеса, все нейроны были разбиты на 5 групп по их морфометрическим параметрам. Нейроны группировались согласно их площади сечения с шагом 200 мкм2.
При изучении фоновой электрической активности отдельных нейронов краниального шейного ганглия, шейного симпатического ствола, наружного сонного нерва, выделяли правый и левый краниальный шейный ганглий ветвями. Животные находились на самостоятельном дыхании. Игольчатые электроды помещались подкожно для регистрации ЭКГ во 2-м стандартном отведении и в межреберные мышцы – для регистрации дыхания. Электрическая активность нейронов регистрировалась при помощи вольфрамовых микроэлектродов A-M Systems сопротивлением 12 Ом и присасывающих стеклянных электродов, усилителя переменного тока, соединенного через АЦП с персональным компьютером. Полоса пропускания выбиралась от 200 до 2000 Гц. Сигнал оцифровывался с частотой 5000 Гц и записывался на жесткий диск компьютера (время записи 240 с), после чего подвергался off-line анализу с использованием программы Power Graph (Россия).
Для анализа фоновой активности использовалась программа Data View (Шотландия). При этом оценивалась амплитуда импульсов, частота импульсации и длительность межимпульсных интервалов. Для анализа сердечной и дыхательной ритмичности применялись межспайковые интервальные гистограммы и автокорелляционные гистограммы.
Статистическая обработка результатов сводилась к определению средней арифметической стандартной ошибки. Для математической обработки использовали пакет прикладных компьютерных программ “Statistica 6.0”. Для оценки достоверности различий использовался дисперсионный анализ (однофакторный ANOVA), t-критерий Стьюдента и U критерий Манна-Уитни. Различия считались статистически достоверными при уровне значимости p<0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В результате проведенной работы выявлены анатомические особенности краниального шейного ганглия, морфометрические, иммуногистохимические характеристики нейронов краниального шейного ганглия и особенности их фоновой активности у крысят в постнатальном онтогенезе.
Краниальный шейный ганглий крысы характеризуется вариабельностью форм, расположения относительно бифуркации общей сонной артерии и характером отхождения ветвей. Наиболее распространенной является веретенообразная форма, представляющая в сечении эллипс. Форма в виде песочных часов встречается у 10-суточных и более взрослых животных в меньшем проценте случаев.
В постнатальном онтогенезе закономерно с увеличением длины и массы животного возрастают размеры и объем краниального шейного узла. Длина узла в ходе возрастного развития увеличивается в два раза (с 2,00,01 до 4,10,09 мм), ширина – в полтора раза (с 0,60,03 до 1,00,05 мм), толщина – в два раза (с 0,40,03 до 0,90,05 мм), в то время как длина крысы – в четыре раза (В.И. Западнюк, 1974). Объем узла возрастает восьмикратно с 0,250,01 до 1,920,08 мм3.
Тем не менее, топография краниального шейного ганглия в онтогенезе не остается постоянной. В первые 10 суток после рождения узел смещается в краниальном направлении по отношению к бифуркации общей сонной артерии.
У крысят разного возраста наблюдались вариации в числе отходящих ветвей от краниальной, каудальной и средней трети КШГ. Нами обнаружено три варианта отхождения ветвей от краниальной трети узла. При этом от краниальной трети ганглия отходит внутренний сонный нерв, а также могут быть дополнительные ветви: ветвь к подъязычному нерву и одна дополнительная ветвь, лежащая между ними, идущая в область яремного отверстия. Имеется два варианта отхождения ветвей от средней части ганглия, когда раздельно отходит наружный сонный нерв, а также вариант, когда могут раздельно начинаться наружный сонный нерв, несколько ветвей к блуждающему нерву и к глотке. От каудальной трети отходили одна или две ветви к краниальной щитовидной артерии.
В отношении вариантов ветвей, отходящих от краниальной и каудальной трети ганглия, не наблюдается возрастных различий. От средней трети ганглия у всех новорожденных крысят обнаруживался единственно отходящий наружный сонный нерв в виде тонкой ветви, расположенный более краниально, по сравнению с другими возрастными группами. У 10-суточных и более взрослых животных число ветвей, отходящих от средней трети ганглия, увеличивается до трех. Вероятно, при этом не происходит роста новых нервных волокон, а наблюдается расщепление одного нервного ствола на три ветви, т.к. нами установлено, что общее число нейронов в краниальном шейном ганглии крысы в онтогенезе не меняется. В звездчатом же ганглии кошки и крыс основные варианты отхождения ветвей, присущие взрослым животным, уже сформированы к моменту рождения (П.М. Маслюков, 1997, М.Б.Корзина, 2008).
Исследование морфометрических параметров нейроцитов краниального шейного ганглия крысы в постнатальном онтогенезе позволило установить, что размеры нейронов увеличиваются в несколько раз: площадь сечения с 1706 мкм2 у новорожденных до 51826 мкм2 у шестимесячных, соответственно. Это соответствует данным полученным на разных животных: кошке, собаке (Masliukov, 2003; Fioretto et al., 2007).
Площадь сечения нейронов после рождения возрастает, что сопровождается снижением плотности нервных клеток на центральных срезах. У новорожденных животных плотность расположения нейронов равнялась 2655251 на мм2, у шестимесячных - 61641, соответственно. Те же закономерности установлены выявлены ранее на звездчатом узле крысят и котят разных возрастов (Masliukov, 2003; М.Б.Корзина, 2008).
В ганглии новорожденного крысенка крупные клетки отсутствуют, основную массу составляют нейроны малых размеров. В процессе возрастного развития увеличивается доля средних (с площадью сечения 400-800 мкм2) и крупных клеток (с площадью сечения более 800 мкм2), и уменьшается процент мелких клеток (с площадью сечения до 400 мкм2). Крупные нейроны со средней площадью сечения 601-800 мкм2 впервые появляются у одномесячных животных. Нейроны с площадью сечения свыше 1200 мкм2 встречались только у шестимесячных животных. Сходным образом происходят изменения нейронов различных размерных групп в звездчатом ганглии крыс и кошек в постнатальном онтогенезе, однако в краниальном шейном ганглии крыс преобладают более мелкие клетки (Masliukov, 2003; М.Б.Корзина, 2008).
Согласно литературным данным, в краниальном шейном ганглии крысят наблюдается значительное уменьшение числа нервных клеток в течение первой постнатальной недели (Wright et al., 1983). Однако в настоящей работе при применении антител к ферменту апоптоза – ферменту каспазе 3 не было выявлено значимого процента клеток, подвергающихся запрограммированной гибели. В тоже время, результаты другой серии экспериментов с использованием маркера пролиферации Ki67 свидетельствуют о незначительной пролиферации нервных клеток в возрасте до 10 суток жизни. Все это хорошо согласуется с нашими расчетными данными, указывающими на то, что в онтогенезе крыс число нейронов в краниальном шейном ганглии достоверно не менялось и варьировало от 433455946 у 10-суточного и до 514297246 у 20-суточного, соответственно. Данные литературы свидетельствуют, что у новорожденных мышей процент пролиферирующих Ki67-иммунопозитивных клеток в краниальном шейном узле составляет 20, затем снижается и к концу третьей недели жизни только 0.4% клеток сохраняют способность к делению. При этом основная масса делящихся клеток представлена клетками глии, у новорожденной мыши выявляется лишь несколько процентов нейробластов, которые исчезают у более взрослых (Shi et al., 2008).
Установлено изменение иммуногистохимических характеристик нейронов в ходе онтогенеза. Это согласуется с литературными данными, указывающими на то, что параллельно с функциональным созреванием в нейронах симпатических узлов идет перестройка медиаторного состава, которая может происходить под влиянием целого ряда различных трофических факторов (Ernsberger, 2001). Также как и у взрослых, у новорожденных основная масса нервных клеток содержит фермент синтеза норадреналина - тирозингидроксилазу. Часть же норадренергических нейронов содержит и другие нейротрансмиттеры. Различий между иммуногистохимическими особенностями нейронов правого и левого ганглия не наблюдалось.
Почти все нейроны у крыс в краниальном шейном ганглии являлись ТГ-иммунопозитивными. Процентное содержание ТГ-позитивных нейронов в раннем постнатальном онтогенезе не менялось и составляло 98±0,7 % у новорожденных, 99±0,5% у 10-дневных, 98±0,6% у 20-дневных, 98±0,4% у 30-дневных и 98±0,7% у двухмесячных животных.
У новорожденных животных в краниальном шейном ганглии большая часть нейроцитов содержала одновременно ТГ и НПY. В первые 20 суток жизни процент НПY-иммунопозитивных нейронов увеличивается с 52±2,1% до 64±3,1% (Рис. 1). Это согласуется с данными, полученными на краниальном шейном узле взрослой крысы (Richardson et al., 2006). В краниальном шейном ганглии морской свинки данная группа нейроцитов также преобладает, начиная с периода раннего эмбриогенеза (Morris et al., 2001). Очевидно, это можно объяснить ангиогенным эффектом НПY на возрастающее количество сосудов микроциркуляторного русла в процессе онтогенеза (Zukowska-Grojec et al., 1998).
У новорожденных и 10-суточных крысят в краниальном шейном узле выявляется достаточно большой процент КА-иммунореактивных нейронов: 22±2,5% и 24±3,1% соответственно (Рис. 1). После первых 10 суток жизни значительно уменьшается доля КА-позитивных нейронов, достигая 8±1,4% к концу первого месяца жизни и минимальных значений к концу второго месяца жизни (1±0,2%). Это хорошо коррелирует с данными литературы, полученными при иссследовании центральной нервной системы, свидетельствующими, что в онтогенезе процентное содержание различных типов кальций-связывающих белков меняется. По последним данным, в частности, уменьшается процент нейронов, содержащих КА. Доля кальретинин- и парвальбумин-иммунореактивных нейронов остается неизменной (Choi et al., 2010). Очевидно, это связано с тем, что кальций играет важную роль в возрастных и стресс-индуцированных изменениях нервной системы. В развивающихся нейронах при участии ионов кальция происходит регуляция роста нейронов и морфологической пластичности, в частности, конуса роста и развитие дендритов (Yano et al., 1998; Simons, Pellionisz, 2006). Вероятно, КА особенно важен на ранних этапах постнатального развития нервной системы и впоследствии его роль уменьшается.
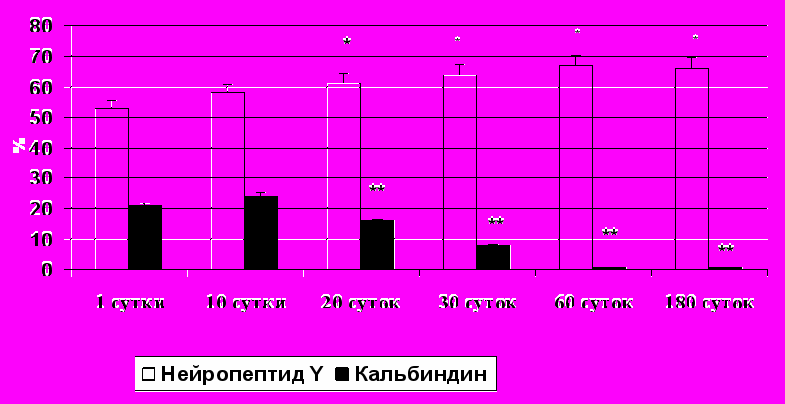
Рис. 1. Процентное содержание нейронов, иммунореактивных к нейропептиду Y и кальбиндину, в КШГ крыс разных возрастов. (*, ** р < 0.05, различия достоверны по сравнению с новорожденными и 10-суточными животными).
С возрастом животных увеличивается доля средних и крупных нейронов, содержащих ТГ, и уменьшается процент мелких, и очень мелких. Средняя площадь сечения ТГ-, НПY- и КА-иммунопозитивных нейронов в онтогенезе увеличивалась. Нейроны с различными иммуногистохимическими характеристиками имели разные морфометрические характеристики. НПY - и КА-содержащие нейроны имели меньшую среднюю площадь сечения по сравнению с ТГ-иммунопозитивными нейронами. В свою очередь, КА -иммунопозитивные нейроны в первые 10 суток жизни имеют достоверно меньшие размеры по сравнению с НПY -содержащими клетками, а у более взрослых животных средняя площадь сечения КА-содержащих нейронов достоверно превосходит аналогичный показатель НПY -иммунореактивных клеток. О меньшем размере нейронов, содержащих НПY и КА, у взрослых крыс свидетельствуют и литературные данные (Richardson et al., 2006).
Основная часть всех исследованных иммунореактивных нейронов у новорожденных крысят имели очень мелкие размеры (0-200 мкм2). У 10-суточных крысят также большинство КА-содержащих нейронов было представлено очень мелкими клетками. У 10- суточных животных среди ТГ- и НПY-иммунореактивных начинали преобладать мелкие нейроциты (201-400 мкм2) вплоть до одномесячного возраста. У двухмесячных крысят площадь сечения большинства ТГ-иммунопозитивных нейронов находилась в пределах от 401 до 600 мкм2, а у шестимесячных – от 601 до 800 мкм2. Среди НПY-иммунопозитивных нейронов у двухмесячных и шестимесячных животных преобладали более мелкие нейроны с площадью сечения 401-600 мкм2. Начиная с двухмесячного возраста, обнаруживались ТГ-иммунопозитивных нейроны с площадью сечения свыше 1001 мкм2 , а с шестимесячного – свыше 1201 мкм2. Очень крупные КА и НПY-иммунопозитивные нейроны в краниальном шейном узле у всех животных отсутствовали.
Нервные связи краниального шейного узла с сосудами шеи сформированы и существуют с момента рождения. Все симпатические вазомоторные нейроны являются ТГ-иммунопозитивными и КА-иммунонегативными. Часть нейронов краниального шейного узла, проецирующихся к сосудам шеи, содержит НПY. Процент вазомоторных нейронов, содержащих НПY, увеличивается в первые 20 суток жизни с 41±4,1% до 62±3,9%. Сходный паттерн (увеличение процентного соотношения меченых клеток между 10 и 20 днями жизни) был продемонстрирован ранее при исследовании связей нейронов звездчатого узла с органами-мишенями (П.М.Маслюков, 2000). Можно предположить, что в этом периоде орган-мишень может влиять на нейротрансмиттерные свойства нейрона.
Фоновая электрическая активность нейронов краниального шейного узла новорожденных и 10-суточных крысят отмечалась малой частотой импульсации (0,070,01 и 0,20,06 импульсов в секунду, соответственно) и большим процентом нейронов с апериодической активностью (94% и 66%, соответственно). В процессе возрастного развития средняя частота импульсации увеличивается и составляет 1,20,3 у 20-суточных, 1,60,3 у 30-суточных. У двухмесячных и шестимесячных крыс частота достоверно не отличалась и составляла 2,00,5 и 1,90,5 импульсов в секунду (p>0,05).
Средняя амплитуда импульсов в онтогенезе возрастала и составляла 336,1 мкВ у новорожденного, 475,8 мкВ у 10-суточного, 515,6 мкВ у 20-суточного, 73,58,1 мкВ у одномесячного, 81,26,6 мкВ – у двухмесячного, 77,37,6 мкВ – у шестимесячного животного.
Наибольший процент нейронов краниального шейного симпатического узла во всех исследованных возрастных группах проявлял апериодическую активность, что соответствует данным, полученным на взрослых животных (В.И.Скок, А.Я.Иванов, 1989; McLachlan, 2003; Malpas, 2004). Нейроны, имеющие сердечную ритмику импульсации, не были обнаружены у животных первых десяти суток жизни. Процент нейронов, разряды которых совпадают с частотой дыхательных движений, увеличивается в первые 10 суток жизни с 6% до 34%. В последующем онтогенезе, доля нервных клеток, разряжающихся синхронно с дыханием, остается на относительно стабильном уровне, незначительно уменьшаясь до 21-25% у двух- и шестимесячных животных. Нейроны, имеющие сердечную ритмику импульсации, впервые обнаруживались у 20-суточных животных в небольшом проценте случаев (10%), что совпадает с литературными данными, полученными на других животных на ранних этапах постнатального онтогенеза (Sica et al., 1994; 2002; М.Б.Корзина, 2009). Максимальных значений процент нейронов, имеющих сердечный ритм импульсации, достигает к 2-месячному возрасту (21%), к шестому месяцу несколько снижаясь (18%). Это может быть связано с морфологической и функциональной незрелостью нейронов, и синаптической передачи в ранних возрастных периодах.
У новорожденных в спектре мощности фоновой электрической активности преганглионарных волокон шейного симпатического ствола, амплитуда мощности частот, синхронных с деятельностью сердца и дыханием, была достоверно меньше аналогичных показателей у 10-суточных и более взрослых крысят. У 10-суточных животных частоты, связанные с деятельностью сердца и дыханием, имеют примерно равную мощность. С 20 суток жизни частоты, имеющую сердечную составляющую, преобладают в спектре мощности.
В постганглионарных волокнах наружного сонного нерва у новорожденных животных синхронные разряды отсутствуют. В частотном спектре отсутствуют пики и сам спектр, по своему характеру, близок к шуму. Отдельные пики, выделяющиеся из фона, появляются у 10-суточного крысенка, в частности, синхронные с сердечной деятельностью. Сердечная составляющая в фоновой электрической активности наибольшую амплитуду спектра мощности получает с 20 суток жизни. В целом, спектр мощности фоновой электрической активности постганглионарных нервов у крыс в возрасте 20 дней и старше, имеет те же частоты, что и в шейном симпатическом стволе. Окончательное становление характера фоновой импульсации постганглионарных волокон приходится на 30 сутки жизни, где становится более выраженной частота, связанная с дыханием, впоследствии присутствующая и у более взрослых.
Следовательно, фоновая электрическая активность в пре- и постганглионарных волокнах развивается гетерохронно. В преганглионарных она присутствует с момента рождения, в постганглионарных появляется лишь к 10 суткам жизни. Причиной асинхронии может служить незрелость синаптической передачи у новорожденных животных (В.С.Шевелева, 1977). В пре- и постганглионарных волокнах наибольшее значение мощности приходится на частоты, синхронные с сердечной деятельностью.
Таким образом, краниальный шейный ганглий крысы уже с момента рождения является функционирующим элементом симпатической нервной системы. Анатомически, у новорожденных крысят краниальный шейный ганглий является сформированным. В то же время, клеточный состав ганглия в этом возрасте является незрелым. В ходе постнатального онтогенеза происходит рост, дифференцировка нейронов, преобразование медиаторного состава, характера фоновой активности. Изменение морфо-функциональных характеристик нейронов происходит гетерохронно. Окончательное формирование характера фоновой нейронной активности завершается к концу 1 месяца жизни. Созревание набора нейротрансмиттеров в краниальном шейном узле крысы завершается к концу второго месяца жизни. Окончательно размеры нейроцитов стабилизируются к шести месяцам жизни.
ВЫВОДЫ
- В постнатальном онтогенезе происходят морфологические изменения краниального шейного ганглия, сопровождающиеся появлением формы в виде песочных часов у 10-суточных и более взрослых животных. После рождения узел смещается в краниальном направлении по отношению к бифуркации общей сонной артерии.
- Наблюдаются вариации в числе отходящих ветвей от краниальной (три варианта), каудальной (два варианта) и средней трети (два варианта) краниального шейного ганглия. В отношении вариантов ветвей, отходящих от краниальной и каудальной трети ганглия, не наблюдается возрастных различий. У 10-суточных и более взрослых животных, число ветвей, отходящих от средней трети ганглия, увеличивается по сравнению с новорожденными животными.
- Среднее число нейронов в краниальном шейном узле с момента рождения достоверно не изменяется. При этом в ганглии, в постнатальном онтогенезе, не наблюдаются процессы пролиферации и апоптоза нейронов.
- Популяция нейронов краниального шейного узла с момента рождения является гетерогенной по иммуногистохимическим характеристикам. Подавляющее большинство нейронов (свыше 98%) содержат фермент синтеза катехоламинов тирозингидроксилазу. У новорожденных крысят 52% нейронов узла содержат нейропептид Y и 22% - кальбиндин.
- Популяции нейронов краниального шейного ганглия с различными иммуногистохимическими характеристиками развиваются гетерохронно. В первые 20 суток жизни наблюдается увеличение процентного содержания нейропептид Y-иммунореактивных нейронов. После первых 10 суток жизни значительно уменьшается доля кальбиндин-позитивных нейронов, достигая минимальных значений к концу второго месяца жизни. Окончательно формирование нейрохимического состава краниального шейного ганглия крысы завершается к концу второго месяца жизни.
- Иннервация сосудов скелетных мышц осуществляется нейронами краниального шейного ганглия уже с момента рождения. Все симпатические вазомоторные нейроны являются тирозингидроксилазо-иммунопозитивными и кальбиндин-иммунонегативными. В онтогенезе, в первые 20 суток жизни, у крыс увеличивается процент нейронов, иннервирующих сосуды и содержащих нейропептид Y.
- В краниальном шейном ганглии крыс фоновая активность нейронов с момента рождения выражена слабо. В онтогенезе увеличивается частота, амплитуда импульсации, возрастает процент нейронов, разряжающихся синхронно с сердечной деятельностью, и уменьшается доля нейронов с апериодическим типом импульсации. Характер фоновой электрической активности нейронов ганглия окончательно формируется уже к 20 суткам жизни.
- Фоновая электрическая активность в пре- и постганглионарных волокнах развивается гетерохронно. В преганглионарных она присутствует с момента рождения, в постганглионарных появляется лишь к 10 суткам жизни. Окончательно характер активности становится сопоставимым с взрослым животным в преганглионарных волокнах – с 20 суток, а в постганглионарных - с 30 суток жизни.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ
ПО ТЕМЕ ДИССЕРТАЦИИ
- Коробкин А.А. Особенности симпатической иннервации сосудов шеи в постнатальном онтогенезе / Тезисы докладов X конгресса международной ассоциации морфологов // Морфология. - 2010. - Т. 137. - № 4. - С. 99.
- Коробкин А.А., Васильева О.А., Емануйлов А.И., Корзина М.Б., Маслюков П.М. Возрастные особенности фоновой электрической активности нейронов краниального шейного ганглия крысы // Российский физиологический журнал им. И.М. Сеченова. - 2010. – Т.96. - № 6. – С. 566-572.
- Корзина М.Б., Коробкин А.А., Васильева О.А., Маслюков П.М. Морфологические особенности звездчатого узла белой крысы // Морфология. – 2010. – Т. 137. - №2. – С. 23-26.
- Порсева В.В., Корзина М.Б., Коробкин А.А., Маслюков П.М. Возрастные особенности экспрессии TRPV1 и каннабиноидных рецепторов в узлах автономной нервной системы // Материалы X юбилейной всероссийской научной конференции с международным участием «Физиологические механизмы адаптации растущего организма». – Казань, - 2010. – С. 142-143.
- Маслюков П.М., Коробкин А.А., Емануйлов А.И., Корзина М.Б. Симпатическая иннервация сердца и сосудов у крыс в онтогенезе // Материалы X юбилейной всероссийской научной конференции с международным участием «Физиологические механизмы адаптации растущего организма». – Казань, - 2010. – С. 116-117.
- Коробкин А.А., Карапетян А.С., Ландо С.Ю., Маслюков П.М. Возрастные особенности фоновой электрической активности волокон краниального шейного узла крыс в постнатальном онтогенезе // Тезисы докладов XXI съезда физиологического общества им. И.П.Павлова, -Калуга, - 2010. - С. 298.
- Маслюков П.М., Коробкин А.А., Емануйлов А.И., Корзина М.Б. Возрастные особенности симпатической иннервации сердца и сосудов // Тезисы докладов XXI съезда физиологического общества им. И.П.Павлова, - Калуга, - 2010. - С. 387.
СПИСОК СОКРАЩЕНИЙ
КА – кальбиндин
НПY – нейропептид Y
ТГ – тирозингидроксилаза
