Иммунологические аспекты перинатальной патологии у недоношенных детей 14. 00. 36 аллергология и иммунология
| Вид материала | Автореферат |
- Клинико иммунологические особенности аллергодерматозов на фоне урогенитальной инфекции, 335.48kb.
- Файзуллаева Нигора Яхъяевна иммунологические изменения и иммунокоррекция герпетических, 297.14kb.
- Специалистов Перинатальной Медицины Особенности речевого развития в раннем возрасте, 561.81kb.
- Генетические и иммунологические параллели у больных раком легкого и бронхиальной астмой, 396.78kb.
- Образовательный стандарт послевузовской профессиональной подготовки специалистов Специальность:, 1035.98kb.
- Расписание занятий на элективе для студентов 6 курса «Клиническая аллергология», 41.99kb.
- Особенности развития недоношенных детей, 62.87kb.
- Диагностика и лечение респираторного дистресс-синдрома (рдс) недоношенных, 3481.6kb.
- Иммунологические аспекты туберкулиновой гиперчувствительности у детей, 158.05kb.
- Распространенность и клинические особенности течения аллергических заболеваний у детей, 571.29kb.
Иммунологическая реактивность недоношенных детей при хроническом течении внутриутробной цитомегаловирусной инфекции. Анализ полученных данных при исследовании иммунного статуса у недоношенных новорожденных с верифицированной внутриутробной цитомегаловирусной инфекцией позволил выделить две группы с разновекторным направлением иммунологических показателей: недоношенные со сниженными показателями иммунного статуса составили IIIa подгруппу; недоношенные с повышенными показателями иммунного статуса вошли в IIIb подгруппу.
Исследование спектра лимфоцитов по CD-маркерам в двух подгруппах показало: снижение CD3+(в 1,2 раза), CD4+ (в 2,6 раза), CD8+ (в 2 раза) по отношению к контролю у недоношенных IIIа подгруппы и значительное повышение количества CD3+ (в 1,3 раза), CD4+ (в 1,3 раза), CD8+ (в 2,8 раза) у недоношенных IIIb подгруппы с определением повышенного присутствия CD20+ в обеих подгруппах, но более высокое содержание, превышавшее в 1,6 раза показатели контроля определено у недоношенных IIIb подгруппы. Концентрация IgG была в 2 раза ниже у недоношенных IIIа подгруппы и соответствовала критически низкому уровню (менее 0,5 г/л), тогда как в IIIb подгруппе было выявлено увеличение в 1,2 раза уровня IgG по отношению к контролю. Очевидно, высокая концентрация IgG, связана с возможным транспортом иммуноглобулинов от матери через поврежденную гипоксией и инфекцией плаценту, а с другой стороны, это может служить показателем присоединения аутоиммунного компонента, так как уровень иммуноглобулинов прямо коррелировал с уровнем содержания цитотоксических CD8+ и CD16+ лимфоцитов (r=0,81, p<0,01) у недоношенных IIIb подгруппы. Колебание активационных и апоптических параметров с тенденцией к повышению в 1,7 раза количества CD95+ по сравнению с контролем (0,26±0,05) и снижения в 1,8 раза количества CD25+ отмечено у недоношенных IIIа подгруппы. В литературе существуют разноречивые данные о влиянии внутриутробного инфицирования на процессы дифференцировки Т-лимфоцитов, поэтому мы сочли необходимым провести анализ продукции Th1- и Th2-профильных цитокинов по определению функциональной активности хелперов. Для гипореактивного течения было характерно снижение эндогенной продукции IL-1β, IL-2 и IFN-γ (в 2,2, 1,3 и 1,2 раза соответственно), что возможно связано с влиянием таких супрессивных факторов как длительная внутриутробная персистенция цитомегаловирусов, так и негативного влияния других представителей цитокиновой сети. Это обстоятельство подтверждалось (р<0,05) высокой продукцией противовоспалительного IL-10 на фоне уменьшения количества иммунокомпетентных клеток-эффекторов наблюдаемой у недоношенных IIIа подгруппы, что видимо и является механизмом, ингибирующим активацию Th1 и фагоцитарных реакций иммунной системы, на фоне антигенной стимуляции. Подъем в 1,7 и 1,4 раза уровней IL-2 и IFN-γ - наиболее чувствительных маркеров внутриутробного инфицирования у недоношенных IIIb подгруппы - свидетельствовали об активации Th1. Исследование наличия корреляционной связи между уровнем IL-2 у недоношенных IIIb подгруппы с: оценкой по Апгар на 1 минуте жизни выявило прямую корреляционную зависимость (r=0,62; р<0,05); количеством CD4+ (r=0,76; р<0,05); содержанием CD8+ (r=0,65; р<0,05). Концентрация IFN-γ прямо коррелировала с количеством CD16+ лимфоцитов (r=0,72; р<0,05), CD8+ и с фагоцитарной активностью нейтрофилов (r=0,79 и 0,81, соответственно; р<0,05).
Высокие концентрации IL-1β, превышавшие контроль в 2,6 раза, сигнализировали о максимальной интенсивности воспалительных реакций и подтверждали Th1 направленность действия иммунной системы, потому что эти лимфоциты - основные модуляторы макрофагального звена иммунитета. Прямая корреляционная связь, установленная между концентрацией IL-1β и IgG (r=0,81, p<0,01), возможно, свидетельствовала о способности IL-1β увеличивать проницаемость гематоэнцефалического барьера, что делает доступным взаимодействие факторов иммунной системы с антигенами мозга, и как следствие этого развитие наблюдаемой нами гиперпродукции IgG. Несмотря на повышение спонтанной функционально-метаболической активности микрофагоцитов в НСТ-тесте в двух подгруппах, индуцированная была в 2 раза ниже у недоношенных IIIа подгруппы по сравнению с IIIb подгруппой, что свидетельствовало об истощении резервной способности нейтрофильных гранулоцитов продуцировать активные формы кислорода. Дисбаланс окислительного метаболизма при воспалении индуцирует запуск программы апоптоза иммуноцитов, что подтверждалось изменениями соотношения субпопуляций CD4+ и CD95+, в сторону процессов индуцирования апоптоза и ослабления иммунного ответа, на это указывало и снижение в 2,2 раза уровня IL-1β. Гипореактивный ответ у большинства детей позволяет предположить, что имеет место проявление иммунологической толерантности под воздействием антигенной нагрузки, хотя нельзя исключить и возможность непосредственного воздействия инфекционного агента на функциональную активность Thl-лимфоцитов и NK-клеток, по механизму обратной связи приведший к появлению специфических супрессорных клеток, которые препятствуют развитию иммунной реакции на соответствующий антиген. Тем не менее, установленный факт «инертности» иммунной системы при развитии воспалительного процесса имеет место быть и требует более глубокого анализа. Вместе с тем, несмотря на дефицит иммунокомпетентных клеток приводящий к уменьшению «каскада» основных регуляторных цитокинов, даже такой ответ позволяет недоношенным детям IIIа подгруппы осуществлять различные межклеточные взаимодействия.
В наших наблюдениях при проведении корреляционного анализа было установлено, что уровень IL-1β у недоношенных детей IIIа подгруппы имел прямую корреляционную связь с количеством нейтрофилов пуповинной крови (r=0,68, р<0,05), величиной спонтанного НСТ-теста (r=0,77, р<0,05), уровнем индуцированной активности нейтрофильных гранулоцитов (r=0,82; р<0,05). Сам факт низких показателей IL-1β указывал на снижение функциональных свойств нейтрофилов в крови, а соответственно пролонгирование недостаточности лимфоцитарного звена иммунитета и расценивался как проявление иммунной недостаточности у недоношенных детей IIIa подгруппы. INF-γ прямо коррелировал с абсолютным числом CD3+ лимфоцитов (r=0,79; р<0,05), CD8+ лимфоцитов (r=0,74; р<0,05), количеством CD16+ лимфоцитов (r=0,81; р<0,05), с уровнем IgG (r=0,69; р<0,05).
Таким образом, выделение двух лабораторных вариантов иммунных реакций дает возможность оценить целесообразность использования полученных данных в системе мониторинга патологического состояния недоношенных, что позволяет совершенствовать тактику ведения недоношенных новорожденных на ранних стадиях инфекционного процесса в каждом конкретном случае, избегая трудоемких, дорогостоящих обследований, сводя к минимуму в случаях с низким риском прогрессирования заболевания и более тщательный контроль в случаях высокой вероятности развития инфекции у недоношенных.
Генетический анализ полиморфизма генов IL-1Ra (rs4251961), IL-2Ra (rs12722489) и IL-10 (rs1800896) у недоношенных детей с хроническим течением ЦМВИ. Наряду с изучением иммунологического ответа у недоношенных с внутриутробной цитомегаловирусной инфекцией проводился молекулярно-генетический анализ распределения частот аллелей и генотипов полиморфных маркеров генов IL-1Ra, IL-2Ra и IL-10 с оценкой влияния на экспрессию и продукцию соответствующих белков при выявленных вариантах иммунологической реактивности.
В наблюдаемых подгруппах недоношенных детей при генетическом анализе выявлена точечная нуклеотидная замена G->A в позиции 1082 в промоторной области rs1800896 гена IL-10, что ассоциировано с уменьшением транскрипции гена и продукции белка. Сравнительный анализ распределения генотипов в основных подгруппах выявил следующее: в IIIa подгруппе преобладание гомозиготного генотипа GG и аллеля G, доля которых достигла 54% и 74% соответственно, тогда как для IIIb подгруппы было характерно преобладание гетерозиготного варианта G/А (51%) и гомозиготного А/А (9%) (таблица 7).
Таблица 7 – Частота встречаемости генотипов и аллелей полиморфного локуса rs1800896 гена IL-10 недоношенных детей с ЦМВИ
| Группы | Частота встречаемости | OR | p | ||||
| генотипов | аллеля | ||||||
| G/G | G/A | A/A | G | A | |||
| IIIa | 0,54 | 0,43 | 0,03 | 0,76 | 0,24 | 1,39[0,49-1,30]chi2=1,32 | 0,05 |
| IIIb | 0,40 | 0,51 | 0,09 | 0,66 | 0,34 | 2,19[1,75-2,98]chi2=11,77 | 0,01 |
| контроль | 0,58 | 0,41 | 0,01 | 0,78 | 0,22 | 0,97[0,52-0,98]chi2=0,15 | 0,05 |
В подгруппе IIIb установлено снижение (в 1,5 и 1,8 раза соответственно) встречаемости генотипа G/G и значительное повышение (в 9 и 3 раза соответственно) встречаемости генотипа А/А по сравнению с контролем и IIIa подгруппой.
При анализе частот аллельных вариантов в подгруппе IIIb обнаружено повышение в 1,5 раза встречаемости аллеля А по отношению к контролю и подгруппе IIIa. Согласно полученным результатам наличие гомозиготного варианта А/А rs1800896 является определяющим более низкий уровень продукции противовоспалительного цитокина IL-10, что проявлялось меньшей супрессией воспалительного ответа.
Таким образом, генотип А/А полиморфного маркера rs1800896 гена IL-10 является факторами риска развития дефицита продукции IL-10 (OR=2,195 chi2=11,77, p<0,01), что, безусловно, оказывает влияние на степень активации иммунного ответа при хроническом течении внутриутробной цитомегаловирусной инфекции.
При исследовании распределения частот аллелей и генотипов полиморфного локуса rs4251961 гена рецептора IL-2 альфа (CD25, IL-2Ra) у недоношенных IIIb подгруппы наличие гомозиготного варианта мутантного аллеля А определялось в 1,5 и 1,7 раза чаще, чем в контроле и у детей IIIa подгруппы. Тогда как аллель G в гомозиготном виде у обследованных детей IIIb подгруппы присутствовал в 1,1 раза реже, чем в контроле и IIIa подгруппе (таблица 8).
Таблица 8 - Сравнительный анализ распределения частот аллелей и генотипов полиморфного локуса rs12722489 гена IL-2Rа у недоношенных детей с ЦМВИ
| Группы | Частота встречаемости | OR | p | ||||
| генотипов | аллеля | ||||||
| G/G | G/A | A/A | G | A | |||
| IIIa | 0,79 | 0,21 | - | 0,91 | 0,09 | 0,67[0,47-0,96] | 0,05 |
| IIIb | 0,75 | 0,17 | 0,08 | 0,85 | 0,15 | 3,90[1,36-1,22]chi2=5,67 | 0,01 |
| контроль | 0,76 | 0,24 | - | 0,90 | 0,10 | 0,67[0,47-0,96] | 0,05 |
Носителями варианта G как в гомо-, так и в гетерозиготном виде являются в среднем 77% недоношенных детей всех обследуемых групп. При анализе встречаемости гетерозиготного варианта G/A установлено, что сочетание гомозиготных вариантов гена в IIIb подгруппе встречалось у 19% недоношенных детей, что в 1,4 раза реже, чем в группе контроля и в 1,2 раза, чем в IIIa подгруппе. Генотип А/А встречался только в IIIb подгруппе у 8% детей. Среди недоношенных IIIa подгруппы и контроля не было выявлено носительства гомозиготного варианта генотипа А/А гена IL-2Ra, хотя утверждать, что этот генотип вообще не встречался у данной категории не правомочно т.к. выборка (75 детей с ЦМВИ и 57 «условно» здоровых недоношенных детей) недостаточна, для суждения о встречаемости в популяции в целом. Необходимы дальнейшие исследования с расширением групп детей с различной патологией воспалительного и невоспалительного генеза. Тем не менее, иммунореактивное течение хронической внутриутробной цитомегаловирусной инфекции ассоциируется с аллелем А и гомозиготным вариантом генотипа А/А гена IL-2Rа (OR=1,49 и 3,90, p<0,01 соответственно). Проведенный корреляционный анализ уровня продукции IL-2 у недоношенных детей IIIb подгруппы с учётом распределения вариантов гена IL-2Ra выявил наличие прямой корреляционной связи продукции цитокина от мутантного аллеля гена (p<0,05).
Таким образом, полученные данные свидетельствуют об ассоциации генотипа А/А и аллеля А с повышенной рецепцией IL-2Ra и, соответственно, с более выраженной воспалительной реакцией при хроническом течении внутриутробной цитомегаловирусной инфекции у недоношенных детей.
Таблица 9 – Сравнительный анализ распределения частот аллелей и генотипов полиморфного локуса rs4251961 гена IL-1Ra у недоношенных с ЦМВИ
| Группы | Частота встречаемости | OR | p | ||||
| генотипов | аллеля | ||||||
| T/T | T/C | C/C | T | C | |||
| IIIa | 0,74 | 0,26 | - | 0,90 | 0,10 | 0,85[0,47-0,96]chi2=1,65 | 0,05 |
| IIIb | 0,73 | 0,27 | - | 0,89 | 0,11 | 0,95[0,47-0,98]chi2=1,67 | 0,05 |
| контроль | 0,79 | 0,21 | - | 0,91 | 0,09 | 0,85[0,47-0,96]chi2=1,65 | 0,05 |
Проведение типирования полиморфного локуса rs4251961 гена IL-1Ra в подгруппах IIIa и IIIb не выявило статистически достоверных различий. У недоношенных детей двух подгрупп частота встречаемости мутантного аллеля С была ниже в среднем в 1,1 раза, чем в группе контроля (таблица 9). Гомозиготных мутаций С/С не зарегистрировано ни в одной группе, возможно, это связано с недостаточным размером выборки. Гетерозиготный вариант генотипа Т/С в обеих подгруппах выявлялся в среднем в 1,2 раза чаще, чем в группе контроля. Нами не выявлено разницы в частоте встречаемости полиморфизма аллельных вариантов rs4251961 гена IL-1Ra в исследуемых группах недоношенных детей с ЦМВИ (OR=0,85, chi2=1,65).
Таким образом, проведённое исследование по влиянию полиморфизма генов цитокинов и их рецепторов IL-1Ra, IL-2Ra и IL-10 на экспрессию и продукцию соответствующих белков при выявленных вариантах разнонаправленности изменений иммунного статуса свидетельствовало о том, что:
1) гомозиготный вариант генотипа А/А полиморфного локуса rs1800896 гена IL-10 ассоциирован с низким уровнем продукции IL-10;
2) для гомозигот по аллелям А rs12722489 гена IL2Ra выявлен риск развития гиперрецепции IL-2Ra, чем для гомо- и гетерозигот по аллелям G;
3) не выявлено ассоциации полиморфного локуса rs4251961 гена IL-1Ra с повышением риска развития гиперреактивного иммунного ответа при хроническом течении внутриутробной цитомегаловирусной инфекции у недоношенных детей.
Клинико-иммунологическая характеристика состояния недоношенных детей с перинатальной патологией в течение первого года жизни. При анализе особенностей развития и состояния здоровья детей в ходе катамнестического наблюдения была избрана «условная» возрастная норма – возраст 12 месяцев, для характеристики ближайшего катамнеза недоношенных детей. Это обусловлено тем, что по данным литературы к этому возрасту происходит наиболее интенсивное становление функциональных систем.
Катамнестическое наблюдение проведено за 43 недоношенными детьми в возрасте первого года жизни в амбулаторных условиях. Недоношенные дети, рожденные на разных сроках гестации были выписаны из родильных домов, перинатального центра и отделения патологии новорожденных на сроках от 5-21 дня жизни. Мальчиков было 20, девочек - 23. Почти в 85% случаев дети родились от матерей с отягощенным преморбидным фоном: акушерско-гинекологической и соматической патологией. Из осложнений течения беременности чаще всего имелись преэклампсия, дородовое излитие околоплодных вод, УПБ и хроническая фетоплацентарная недостаточность.
Анализ данных анамнеза, объективного осмотра, клинико-функциональных оценок физического и нервно-психического развития в динамике, дает основание предполагать, что период адаптации в течение первого года жизни оказался сложным для недоношенных детей.
В течение первого жизни восстановительный период характеризовался развитием таких синдромов, как астено-вегетативный (90%), гипертензионно-гидроцефальный (25,4%), задержка психомоторного развития (22,7%), пирамидной недостаточности (18,1%), судорожный (13,6%). Запаздывание навыков и умений в зависимости от возраста отмечены в 37,1% случаев. ДЦП (9,4%) и гидроцефалия диагностированы у (9,4%) детей соответственно. Функциональные методы исследования с помощью УЗИ центральной нервной системы и КТМ у 13 детей выявили значительные изменения ЦНС. По результатам клинико-функциональных исследований 5 (22,7%) детей переведены на инвалидность с диагнозами ДЦП, гидроцефалия, травма головного мозга. Фоновая патология развивалась часто и в более ранние сроки. Так, частота железодефицитной анемии составила 40%, белково-энергетической недостаточности питания – 27,2%, рахита – 18,1%, с достаточно высоким инфекционным индексом – 41,6%, заболели респираторной патологией (ОРВИ, бронхит, пневмония) 31,1% детей, из них 12 детей с пневмонией были госпитализированы.
Таким образом, катамнестическое наблюдение за 43 недоношенными детьми с церебральной и респираторной патологией и задержкой внутриутробного развития, позволило выявить соматическую патологию, преимущественно фоновую и достаточно высокий инфекционный индекс.
Установлено, что на фоне морфофункциональной незрелости недоношенных детей, характер течения перинатальной патологии в большей мере зависит от иммунологической реактивности ребенка. При наличии доказанных критериев состояния здоровья, в том числе иммунологических, позволяющих мониторировать и прогнозировать динамику течения заболевания можно с большей уверенностью проводить дифференцированно комплексную терапию, направленную на коррекцию иммунологических нарушений.
У детей с перинатальной патологией в возрасте 6 и 12 месяцев жизни проведен мониторинг иммунного статуса (рисунок 12).
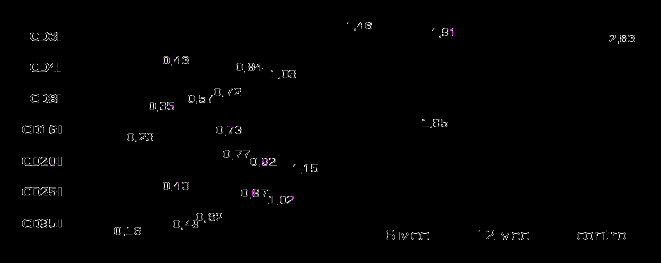
Рисунок 12 - Показатели иммунного статуса недоношенных детей в течение первого года жизни (абс.ч.)
В контрольную группу вошли 24 «условно» здоровые недоношенные дети в возрасте 1 года. Так, в возрасте 1-го года жизни прослеживалась положительная динамика в виде подъема в 1,3 и 2 раза абсолютных значений дифференцированных CD3+ и хелперных Т-лимфоцитов относительно показателей, полученных в возрасте 6 месяцев жизни (1,46±0,02 и 0,43±0,02), но так и не достигшие нормативных показателей (2,83±0,02 и 1,03±0,12 соответственно). У детей в 12 месяцев жизни содержание CD8+ лимфоцитов оставалось повышенным в 1,6 раза от контроля (0,35±0,02), хотя в сравнении с данными детей 6 месяцев жизни наблюдалось его снижение в 1,3 раза. Эта динамика отразилась и на соотношении основных регуляторных субпопуляций Т-лимфоцитов CD4/CD8 в виде снижения до 1,47±0,04 по сравнению с контролем (2,94±0,13). У детей в возрасте 12 месяцев жизни количество CD16+ существенно в 2,6 раза снижалось по отношению к показателям в 6 месяцев жизни (1,85±0,21), однако оставалось выше контроля (0,23±0,14) в среднем в 3,1 раза.
Практически у всех детей к году жизни отмечена более выраженная тенденция к активации иммунокомпетентных клеток, о чем можно судить по увеличению в 2 раза клеток, экспрессирующих маркер активации CD25+ по сравнению с показателями 6 месячных младенцев (0,43±0,06). В то же время доля CD25+ в год жизни у недоношенных с перинатальной патологией на 14,7% ниже аналогичного показателя здоровых детей этой же возрастной категории (1,02±0,04). Количество CD95+ у обследуемых детей в 1 год жизни (0,49±0,03) почти в 3 раза превышало соответствующие показатели «условно» здоровых детей (0,16±0,08). В течение всего периода наблюдения отмечена тенденция к улучшению и стабилизации показателей гуморальной защиты. Прирост в 1,2 раза количества клеток с фенотипом CD20+ наблюдалось в интервале между 6 и 12 месяцами жизни с последующей стабилизацией (0,92±0,10) на уровне нормативных значений к 12 месяцам жизни.
При исследовании секретирующей способности В-клеток по синтезу гуморальных факторов в сроки до года жизни повышение содержания IgМ у детей с перинатальной патологией не обнаружено. У годовалых детей обследуемой группы уровень IgМ (0,46±0,01) в сыворотке крови оставался сниженным в среднем в 1,8 раза по сравнению с контролем (0,81±0,06). Несмотря на повышение в 2,5 раза концентрации IgG у детей к 12 месяцам жизни по отношению к его уровню в 6 месяцев жизни (0,99±0,12), восстановления иммуноглобулинов до уровня контроля (4,24±1,42) не произошло (р<0,001). Примечательно, что у детей в 6 месяцев жизни концентрация иммуноглобулинов по сравнению с показателями при рождении были достоверно ниже (р<0,05), что, по-видимому, связано с ослаблением пассивного гуморального иммунитета в связи с катаболизмом материнских антител.
Состояние микрофагоцитарной системы у обследованных детей в возрасте 6 и 12 месяцев жизни характеризовалось истощением функциональных резервов кислородзависимых микробицидных систем (15,7±2,69 и 13,1±2,14 соответственно при контроле 23,9±3,77) в ответ на антигенную нагрузку в НСТ-тесте. Причем, разница между базальным и индуцированным уровнем активации (44,8% в контроле) составила 25,6% в 6 месяцев жизни и снизилась до 21,3% к 12 месяцам жизни, что свидетельствует о депрессии функциональной активности фагоцитарных клеток.

Рисунок 13 - Показатели цитокинового статуса недоношенных детей
в течение первого года жизни
Анализ спектра цитокинов в катамнезе наблюдения выявил значительное снижение продукции IL-2 (в 2,6 раза и 1,9 раза) к 12 месяцам жизни по отношению к показателям в 6 месяцев жизни (111,8±9,88) и «условно» здоровых детей (80,5±2,35). Отсутствие нормализации провоспалительного IL-2 может свидетельствовать как о сохранности воспалительно-реактивных изменений цитокинового статуса в 6 месяцев жизни, так и о тяжести перенесенного заболевания и глубине поражения патологических процессов к году жизни. С такой динамикой уровня IL-2 коррелировала частота перинатальной энцефалопатии, проявлявшаяся неврологическими отклонениями от нормы в возрасте 6 месяцев жизни у 87% детей и у 44,7% детей в возрасте 12 месяцев жизни.
В течение всего периода наблюдения отмечено постепенное снижение концентрации IL-1β, но все же, к 12 месяцам жизни уровень IL-1β превышал в 1,7 раза показатели контроля (2,37±0,04). Сохраняющиеся высокие значения IL-1β, видимо, косвенно отражали не завершенность процессов нейродеструктивных, катаболических нарушений. При анализе взаимосвязи IL-1β с другими показателями выявлена обратная корреляция с уровнем IL-2 в сыворотке крови (r=-0,72, р<0,05). Что касается другого медиатора воспаления IFN-γ, к 12 месяцам жизни уровень его оставался сниженным (14,4±2,99), сопоставимым с таковым в 6 месяцев жизни (13,45±2,46), что в 1,3 раза меньше уровня контроля. Сывороточный уровень IL-10 у детей в 6 месяцев жизни составил 10,08±2,74, а к 12 месяцам жизни снижался до 9,93±2,01, также превышая в среднем в 1,7 раза контрольные показатели.
Таким образом, учитывая закономерности становления иммунной реактивности в постнатальном периоде у детей, в частности в период 6 месяцев жизни, отличающихся наибольшей ранимостью организма (Стефани Д.В., Вельтищев Ю.Е., 1996), давая объективную оценку установленным естественным особенностям реагирования (не приняв за нарушения физиологические изменения иммунологических реакций), мы с осторожностью отнеслись к интерпретации выраженных сдвигов, выявленных в данном возрастном периоде. Тем не менее, суммируя представленные выше данные, можно сделать вывод о недостаточной эффективности реабилитационных мероприятий, проводимых недоношенным детям с перинатальной патологией в первый год жизни, на что указывает наличие иммунологической дизрегуляции с признаками иммунодефицита или напряжения, которые во многом предопределяют степень участия тех или иных механизмов в пролонгировании патологического процесса.
Результаты настоящего исследования подтверждают его актуальность и важность решения проблем связанных с проведением иммунологического скрининга всех недоношенных новорожденных независимо от гестационного возраста. Мониторинг иммунного статуса следует рассматривать как критерий оценки качества неонатальной помощи, оказываемой недоношенным новорожденным, целью которой на современном этапе является не только повышение выживаемости недоношенных детей, но и уменьшение неблагоприятного воздействия факторов риска развития и хронизации заболеваний у детей первого года жизни.
