Иммунологические аспекты перинатальной патологии у недоношенных детей 14. 00. 36 аллергология и иммунология
| Вид материала | Автореферат |
- Клинико иммунологические особенности аллергодерматозов на фоне урогенитальной инфекции, 335.48kb.
- Файзуллаева Нигора Яхъяевна иммунологические изменения и иммунокоррекция герпетических, 297.14kb.
- Специалистов Перинатальной Медицины Особенности речевого развития в раннем возрасте, 561.81kb.
- Генетические и иммунологические параллели у больных раком легкого и бронхиальной астмой, 396.78kb.
- Образовательный стандарт послевузовской профессиональной подготовки специалистов Специальность:, 1035.98kb.
- Расписание занятий на элективе для студентов 6 курса «Клиническая аллергология», 41.99kb.
- Особенности развития недоношенных детей, 62.87kb.
- Диагностика и лечение респираторного дистресс-синдрома (рдс) недоношенных, 3481.6kb.
- Иммунологические аспекты туберкулиновой гиперчувствительности у детей, 158.05kb.
- Распространенность и клинические особенности течения аллергических заболеваний у детей, 571.29kb.
Клинико-иммунологическая характеристика недоношенных детей II группы. Разделяя точку зрения о ведущей роли факторов антенатального развития в возникновении перинатальной патологии, проведен анализ неблагоприятных факторов анте- и интранатального периодов жизни недоношенного ребенка. Во II группе первобеременных было 37,3%, повторно (2-11) 62,7% женщин. Из них первородящих было 30,5% женщин, повторно (2-4) - 69,5%. Акушерский анамнез рожениц данной группы был отягощен самопроизвольными абортами в 43,2%, выкидышами 23,6%, неонатальной смертью предыдущих детей в 20,5% случаях. Наиболее значимыми факторами риска развития перинатальной патологии было осложненное течение беременности с угрозой прерывания у 46,8% женщин, с хронической гипоксией плода - у 43,2% на фоне кольпита у 74,1%, анемии у 54,5%, ОРЗ у 33,2% женщин, из них в 23,6% с подъемом температуры. Гестоз первой половины был отмечен у 21,8% женщин, гестоз второй половины беременности у 35% женщин, в том числе у 7,7% - средней тяжести. Во время настоящей беременности дородовое излитие околоплодных вод отмечено у 86,4% рожениц. Длительность безводного промежутка колебалась в широких пределах от 0 до 30 часов и в среднем составила 15,17±0,37 часов. Осложнения в родах отмечены у 36,0% женщин, из них обвитие пуповины - в 13,6%, много- или маловодие в 85,5% случаях. При внешнем осмотре патологические изменения в виде очагов дистрофии, обызвествления были установлены в 63,6% плацент.
Во II группу вошли недоношенные дети (n=220) с различной перинатальной патологией со сроками гестации от 22 до 36 недель включительно. Из них 54,5% девочек и 45,5% мальчиков.
 Общее состояние при рождении у 28,2% недоношенных новорожденных было удовлетворительным, у 53,2% - средней степени и у 18,6% тяжелое. Оценку по шкале Апгар 5-7 баллов на 1' минуте жизни получили 80% недоношенных новорожденных, 20% детей - 4 и менее баллов. Меры реанимации проводились 20,5% новорожденным. Признаки морфофункциональной незрелости были определены у 37,7% недоношенных. Средняя оценка по шкале Ballard составила 54,7±0,85 с размахом колебаний от 67 до 17 баллов (при средней оценке в контрольной группе 60 - 64 балла).
Общее состояние при рождении у 28,2% недоношенных новорожденных было удовлетворительным, у 53,2% - средней степени и у 18,6% тяжелое. Оценку по шкале Апгар 5-7 баллов на 1' минуте жизни получили 80% недоношенных новорожденных, 20% детей - 4 и менее баллов. Меры реанимации проводились 20,5% новорожденным. Признаки морфофункциональной незрелости были определены у 37,7% недоношенных. Средняя оценка по шкале Ballard составила 54,7±0,85 с размахом колебаний от 67 до 17 баллов (при средней оценке в контрольной группе 60 - 64 балла). В соответствие с задачами исследования нами проведена оценка клинического состояния недоношенных детей с перинатальной патологией, родившихся от матерей с осложненным течением беременности и родов с учетом гестационного возраста. Физические параметры данных недоношенных новорожденных отличались от принятых нормативов весо-ростового коэффициента в сторону уменьшения (таблица 5).
Таблица 5 - Показатели физического развития недоношенных новорожденных детей II группы с перинатальной патологией (n=220) с учетом гестационного возраста.
| Сроки гестации, (недели) | Масса тела (гр) | Длина тела(см) | Окружность головы (см) | Окружность груди (см) | Весо-ростовой коэффициент |
| 22-27 (n=26) | 713±23,1 | 28,1±0,9 | 27,3±1,7 | 24,8±1,8 | 25,37 |
| 28-33 (n=86) | 1569±110,6 | 41,2±1,1 | 29,6±0,6 | 28,2±1,8 | 38,08 |
| 34-36 (n=108) | 2164±154,9 | 44,2±0,9 | 32,1±1,3 | 29,8±1,7 | 48,96 |
Неонатальный период протекал с признаками дизадаптации у 65,0% новорожденных. В первые сутки жизни ухудшение состояния до тяжелой степени тяжести отмечалось у 55,9% недоношенных новорожденных детей. Расстройство дыхания, потребовавшее коррекции ИВЛ, наблюдалось у 81,5% новорожденных, с нарушением гемодинамики 2-3 степени у 75,9% новорожденных. У 56,8% младенцев неврологические нарушения имели характер общего угнетения. Из недоношенных новорожденных II группы 28,2% были приложены к груди сразу после рождения, в последующие дни 57,3%. С учетом тяжести состояния 13,6% новорожденных вообще не были переведены на грудное вскармливание. В течение неонатального периода 55,9% младенца были выписаны домой как клинически здоровые, 31,4% детей переданы под диспансерное наблюдение с рекомендациями для лечения и 12,7% детей были переведены на второй этап лечения.
При анализе частоты клинических синдромов у недоношенных детей IIа подгруппы с выраженной церебральной патологией в 55,2% случаев наблюдался синдром угнетения, в 44,2% гипертензионно-гидроцефальный синдром, в 33,7% вегето-висцеральные нарушения. У новорожденных IIb подгруппы в 94,6% случаев обнаружены признаки синдрома дыхательных расстройств (СДР) II типа. У 74,5% недоношенных новорожденных IIс подгруппы доминировал дистрофический процесс с задержкой внутриутробного развития.
У недоношенных с поражением центральной нервной системы установлено выраженное повышение CD8+ и CD16+ в 1,3 раза (1,07±0,09 и 0,98±0,07 соответственно) на фоне снижения количества CD3+ в 1,4 раза (1,28±0,13) и CD4+ лимфоцитов в 1,4 раза (1,13±0,12) по отношению к контрольным значениям (рисунок 3).
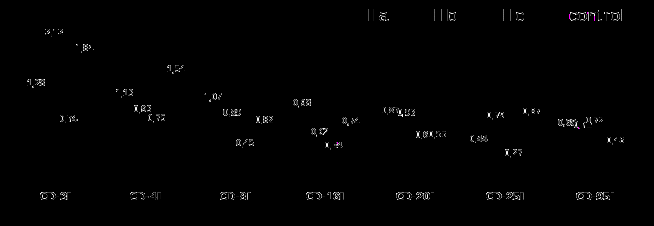
Рисунок 3 - Показатели иммунного статуса недоношенных детей
II группы с перинатальной патологией
Иммунный статус детей с поражением органов дыхания отличался максимально значимым увеличением содержания CD3+, CD95+ при низких показателях CD4+ по сравнению с контролем и IIа подгруппой (р<0,05). На напряжение гуморального звена указывали повышение количества CD20+ (0,93±0,11) и концентраций IgG (2,31±0,07), превышавшие показатели контроля (в 1,7 и 2,2 раза), IIа подгруппы (в 1,1 и 1,2 раза), IIс подгруппы (в 1,5 и 1,8 раза) соответственно.
У детей с задержкой внутриутробного развития дефицит Т-клеточного иммунитета характеризовался достоверным снижением (p<0,05) количества CD3+ в 2,5 раза (0,74±0,12), CD4+ в 2,0 раза (0,75±0,11) и CD8+ лимфоцитов в 1,8 раза (0,45±0,07); повышением (p<0,05) показателей CD95+ в 1,6 раза (0,72±0,02), CD20+ в 1,1 раза (0,61±0,08) по отношению к контрольным показателям.
Максимальное содержание CD25+ - клеток значительно превышавшее аналогичные показатели IIа и IIс подгрупп в 1,8 и 2,9 раза было зарегистрировано во IIb подгруппе (0,79±0,01), однако, по сравнению с контролем (0,87±0,02) оно было снижено в 1,1 раза. Следует отметить, что во всех основных подгруппах имел место одинаковый уровень активации Fas-индуцированного апоптоза (CD95+), в среднем в 1,5 раза превышавшие контроль (0,46±0,08). Очевидно, на фоне гемодинамических нарушений, гипоксии, гипотрофии запускаются механизмы, приводящие к нарушению репликации ДНК, что обусловливает повышенный апоптоз.
Наиболее значительный уровень провоспалительного монокина IL-1β в 1,4 раза превышавший контроль зарегистрирован во IIа подгруппе (18,4±3,07), тогда как самый низкий уровень IL-1β определен для IIb подгруппы (12,8±1,58), что было ниже в 1,1 раза уровня зафиксированного для контроля.
Анализ эндогенной продукции IFN-γ во II группе наблюдения показал неоднозначность изменений его в подгруппах. Концентрация IFN-γ у недоношенных IIа подгруппы не имела достоверных различий (р>0,05) в сравнении с контролем (11,3±2,02). Во IIb подгруппе определялось повышение в 1,3 раза содержания IFN-γ и снижение его в 1,3 раза (ρ<0,05) во IIс подгруппе по отношению к аналогичному показателю контрольной группы.

Рисунок 4 - Показатели цитокинового статуса недоношенных детей
II группы с перинатальной патологией
Повышение концентрации провоспалительного цитокина IL-2 (в 1,1 и 1,2 раза) отмечено в подгруппах с церебральной и респираторной патологией, тогда как в подгруппе недоношенных со ЗВУР наблюдалось снижение в 1,4 раза IL-2 по отношению к показателям контроля (63,8±3,01). Выявленное нами снижение IL-2 и IFN-γ у недоношенных с задержкой внутриутробного развития является следствием уменьшения количества и снижения функциональной активности иммунокомпетентных клеток. Повышение уровня IL-2 во IIа и IIb подгруппах сопровождалось снижением концентрации противовоспалительного цитокина IL-10 в 2,2 и 1,9 раза соответственно по сравнению с контролем (10,2±2,09). Во IIс подгруппе напротив, на фоне сниженного IL-2 наблюдалось повышение IL-10 в 1,1 раза по сравнению с контролем.
Адекватная реакция микрофагоцитарной системы на воспалительный процесс проявлялась повышением в 1,4 и 1,5 раза показателей спонтанного и стимулированного НСТ-теста во IIа подгруппе (18,7±2,21 и 24,4±3,05); в среднем в 1,2 раза в подгруппе IIb (19,0±2,93 и 27,4±3,11) по сравнению с контролем (16,5±2,01 и 23,5±2,37). Во IIс подгруппе полученные значения НСТ-теста (10,5±2,56 и 15,8±1,12) были в среднем в 1,5 раза ниже контрольных, что указывало на истощение бактерицидного потенциала фагоцитирующих клеток.
В подгруппе IIа была установлена корреляционная зависимость между увеличением концентрации IL-1β и количеством моноцитов (r=0,71; ρ<0,05), показателями НСТ-теста (r=0,67; ρ<0,05), свидетельствовавшее о высокой активности макрофагальных клеток, синтезирующих медиаторы воспаления. Средней силы корреляционная связь установлена между IL-2 и CD4+ (r=0,79; ρ<0,05), IL-2 и IL-10 (r=0,81; ρ<0,05). Для подгруппы IIb определены корреляционные связи между показателями: IL-2 и CD8+ (r=0,71; ρ<0,05), IL-2 и IL-10 (r=0,75; ρ<0,05), IFN-γ и IL-10 (r=0,76; ρ<0,05). В подгруппе IIс выявлена значимая обратная корреляция уровня IL-1β с показателями шкалы Апгар на 1минуте (r=-0,72; p<0,05), массо-ростовым коэффициентом (r=-0,71; p<0,05), количеством моноцитов (r=0,82; p<0,05), что не противоречило данным Дегтяревой М.Н. (2000), об участии данного цитокина в патогенезе задержки внутриутробного развития за счет их катаболической направленности в регуляции обмена веществ.
Таким образом, результаты анализа иммунологических показателей недоношенных детей с перинатальной патологией в периоде новорожденности, позволили установить наиболее значимые информативные показатели для каждого вида перинатальной патологии в виде цитокинового сдвига и лабильности содержания цитотоксических клеток при однотипности изменений со стороны некоторых клеточных параметров: снижение хелперной субпопуляции Т-лимфоцитов, CD25+, экспрессирующих рецептор к IL-2, увеличение количества В-лимфоцитов и клеток, несущих маркер апоптоза.
Для прогнозирования реализации перинатальной патологии был использован дискриминантный анализ, который позволил выделить группы риска среди недоношенных детей по выделенным показателям иммунитета. По иммунологическим и клиническим показателям при помощи универсальной статистической программы Statistica 6,0 для Windows была создана дендрограмма, определяющая группы коррелирующих параметров в выборке данных и разделяющая выборки на однородные подвыборки (рисунок 5).
По представленной дендрограмме выявлены факторные модели, описывающие влияние на прогнозируемую величину не одного, а ряда факторов, зависимость которых может быть выражена уравнением, которое является наиболее эффективной прогнозной моделью.

Рисунок 5 – Дендрограмма (иерархическое дерево) иммунологических показателей недоношенных детей с перинатальной патологией
Построение модели осуществлялось путем подстановки значений факторов и показателей иммуннограммы в уравнение, с последующим вычислением прогнозируемого значения. Признаки, включенные в дискриминантный анализ и коэффициенты линейной классификационной функции по иммунологическим параметрам приведены в таблице 6.
Таблица 6 – Прогностические канонические коэффициенты дискриминантной функции классификации недоношенных детей по группам наблюдения
| № | Наименование признака | Признаки | Коэффициенты |
| 1 | срок гестации | Х1 | 0,264 |
| 2 | лейкоциты | Х2 | 0,014 |
| 3 | моноциты | Х3 | -0,004 |
| 4 | эозинофилы | Х4 | -0,097 |
| 5 | лимфоциты | Х5 | -0,017 |
| 6 | п/я-нейтрофилы | Х6 | 0,013 |
| 7 | с/я-нейтрофилы | Х7 | 0,011 |
| 8 | NST_сонтан | Х8 | 0,001 |
| 9 | NST_индуц | Х9 | 0,002 |
| 10 | CD_3 T % | Х10 | -0,034 |
| 11 | CD_4 T % | Х11 | -0,008 |
| 12 | CD_8 T % | Х12 | 0,017 |
| 13 | CD_16 NK % | Х13 | 0,001 |
| 14 | CD_20 B % | Х14 | 0,021 |
| 15 | CD-4/CD-8 | Х15 | 0,547 |
| 16 | CD_25 % | Х16 | 0,005 |
| 17 | IG_G | Х17 | 0,269 |
| 18 | IL-10 | Х18 | 0,002 |
| 19 | ИФН-γ | Х19 | 0,009 |
| 20 | IL-2 | Х20 | -0,003 |
| 21 | IL-1β | Х21 | -0,019 |
| | | константа | -7,434 |
Линейная классификационная функция (модель) в данном случае имела следующий вид: Y = 0,264*х1 + 0,014*х2 - 0,004*х3 - 0,097*х4 - 0,017*х5 + 0,013*х6 + 0,011*х7 + 0,001*х8 + 0,002*х9 - 0,034*х10 - 0,008*х11 + 0,017*х12 + 0,001*х13 + 0,021*х14 + 0,547*х15 + 0,005*х16 + 0,269*х17 + 0,002*х18 + 0,009*х19 - 0,003*х20 - 0,019*х21 - 7,434. При внесении показателей иммунитета недоношенного ребенка в представленное уравнение (модель) и вычислении конечного результата, его можно отнести к одному из трех видов перинатальной патологии.
Таким образом, подставляя определенные значения исследуемых иммунологических показателей в уравнение (модель) можно вычислить прогнозируемые значения канонических переменных для отнесения недоношенных детей к той или иной группе по развитию перинатальной патологии и определить близость к средним значения канонических дискриминантных переменных для каждой кластерной группы недоношенных детей. Так, для группы детей с благоприятным течением неонатального периода определено среднее значение канонической переменной ≥0,677; с церебральной патологией ≤-0,374; с респираторными нарушениями ≤-0,714; с задержкой внутриутробного развития ≥0,969.
Характеристика состояния иммунного статуса у недоношенных детей с перинатальной патологией с учетом гестационного возраста. Был проведен сравнительный анализ иммунологических показателей при перинатальной патологии в зависимости от гестационного возраста. В группе недоношенных с церебральной патологией распределение по гестационному возрасту представлено следующим образом: 22-27 недели - 13,5%, 28-33 недели - 40,7% и 34-36 недели - 45,8% недоношенных.
Выраженные иммунологические изменения в виде дефицита моноцитов, снижения содержания CD3+ (в 1,5 раза от контроля), субпопуляций CD4+, CD8+ и CD20+ (в 2,3, 1,9 и 1,8 раза по отношению к контролю соответственно) на фоне низких концентраций всех изучаемых цитокинов, IgМ и IgG, определялись у глубоконедоношенных детей. Сочетание значительного снижения в 2,8 раза клеток ранней активации - CD25+ с повышенным содержанием в 1,2 раза и в 1,1 раза CD95+ и CD16+, возможно, обусловлено нейродеструктивными нарушениями на фоне морфофункциональной незрелости центральной нервной системы и может расцениваться как диагностический критерий формирования гипоксически-ишемической энцефалопатии. Снижение в 1,1 раза по отношению к контролю стимулированной функциональной активности микрофагоцитарной системы при сохранившейся на уровне нормы спонтанной активности свидетельствовала о низком резервном потенциале клеток неспецифического иммунитета. Резерв функциональной активности фагоцитирующих клеток составил 26,2%, что ниже в 1,6 раза контрольных показателей (рисунки 6 и 7).
В группе недоношенных при сроке гестации 28-33 недели с перинатальной энцефалопатией выявлено перераспределение в сторону увеличения по отношению к контролю и снижения в сравнении с Ib подгруппой следующих показателей: CD8+ (в 2 раза в сравнении с контролем и в 1,5 раза по отношению к Ib подгруппе), концентраций IFN-γ (в 1,2 и в 1,1 раза соответственно), IL-2 (в 1,1 и 1,2 раза соответственно), CD4+ (увеличение и снижение в 1,2 раза соответственно), CD20+ (увеличение и снижение в 1,3 раза соответственно).
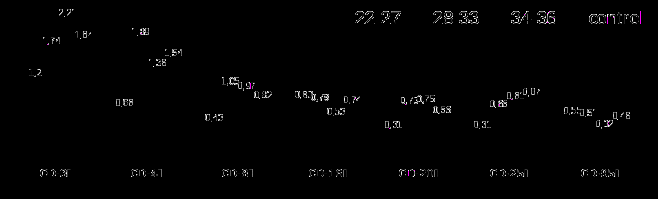
Рисунок 6 – Показатели иммунного статуса недоношенных детей
IIа подгруппы с церебральной патологией с учетом срока гестации (абс. чис.)
Значения CD3+, напротив, по отношению к контрольным показателям были умеренно снижены в 1,0 раза, а в сравнении с Ib подгруппой повышены в 1,5 раза. Снижения в 1,3 и 1,6 раза по отношению к контролю и значительные уменьшения в 2,2 и 2,0 раза в сравнении с «условно» здоровыми недоношенными детьми Ib подгруппы регистрировалось по показателям CD25+ и IL-10 соответственно. Положительный сдвиг некоторых параметров в сторону контрольных значений, очевидно, связано со снижением исходно высоких показателей клеточного и гуморального звеньев иммунитета, выявленных у «условно» здоровых недоношенных того же возрастного периода. Снижение способности фагоцитарных клеток к полноценному ответу в стимулированном НСТ-тесте на фоне повышенной спонтанной активности, подтверждалось данными литературы о низкой функциональной активности микрофагоцитарной системы новорожденных, перенесших внутриутробную гипоксию. Исследование разности между спонтанной и стимулированной показателями НСТ-теста продемонстрировало снижение в 3 раза по отношению к контролю резервной возможности фагоцитарных клеток.

Рисунок 7 – Показатели цитокинового статуса недоношенных детей
IIа подгруппы с церебральной патологией с учетом срока гестации
У недоношенных 34-36 недели гестации выявлялось снижение количества CD4+ в 1,3 раза по сравнению с контролем, уменьшение концентраций IL-10 (в 1,3 раза) и IgG (в 1,5 раза) на фоне сохраняющегося на уровне контроля синтеза IgМ в сочетании с повышенным содержанием CD3+ и CD20+ - лимфоцитов (в 1,1 раза), CD8+ (в 1,0 раза) и уровня цитокинов IL-1β и IL-2 (в 1,3 раза), и IFN-γ (в 1,1 раза). Наряду с этим прослеживалось повышение спонтанной активности (в 1,2 раза) со сниженной мобилизацией резервных возможностей (в 1,1 раза) микрофагоцитарной системы в НСТ-тесте, что также подтверждалось и показателями определения разности между базальной и индуцированной возможностью фагоцитов сниженной в 2 раза по отношению к контролю.
В группе недоношенных с респираторной патологией распределение по гестационному возрасту представлено следующим образом: 22-27 недели - 12%, 28-33 недели – 43% и 34-36 недели - 45% недоношенных новорожденных.
У глубоконедоношенных детей обнаружены низкие показатели основных субпопуляций Т-лимфоцитов (в 2-2,5 раза) и CD3+, а также всех цитокинов и в сравнении с другими возрастными подгруппами и контролем. Незначительное повышение в 1,1 раза уровня IL-1β, в 1,2 раза CD95+ клеток, в 1,2 раза CD20+, в 1,0 раза уровня IgM зарегистрировано по отношению к показателям «условно» здоровых недоношенных Ia подгруппы (рисунки 8 и 9). При сравнительном анализе активности микрофагоцитарной системы для недоношенных детей со сроком гестации 22-27 недели было характерно снижение спонтанного и стимулированного показателей НСТ-теста как по отношению к контролю, так и к показателям Ia подгруппы. Разность между стимулированной и базальной активностью, характеризующая резерв функциональной активности, в группе недоношенных детей с респираторной патологией была наименьшей у недоношенных 22-27 недели гестации (21,5%) при показателях контроля (42,4%).
Наличие дыхательных нарушений у недоношенных 28-33 недели гестации приводило к формированию иммунной недостаточности, что выражалось в значительном уменьшении в 3,3 раза количества CD25+, снижении в 1,8 раза CD4+, в 1,4 раза CD8+, уровня выработки IL-1β (в 1,3 раза) и IL-10 (1,2 раза) по сравнению с контролем.

Рисунок 8 – Показатели иммунного статуса недоношенных детей
IIb подгруппы с респираторной патологией с учетом срока гестации (абс.чис.)
В данной подгруппе недоношенных зафиксировано повышение в 1,3 раза количества CD3+ в сравнении с показателями Ib подгруппы, но по отношению к контролю отмечено его снижение в 1,1 раза. Было определено увеличение уровня продукции IL-2 (в 1,4 раза), IFN-γ (в 1,6 раза) и IgG (в 1,2 раза) на фоне повышенного в 1,6 раза количества В-лимфоцитов. Функциональная активность фагоцитарных клеток в спонтанном и индуцированном НСТ-тесте у недоношенных 28-33 недели гестации была повышена (в 1,2 и 1,1 раза соответственно) по отношению к контролю, в то время как в сравнении с недоношенными Ib подгруппы регистрировалось снижение в 1,2 раза восстановительного потенциала фагоцитов при стимуляции пирогеналом. Снижение разности между стимулированной и базальной активностью фагоцитов (27,1%) в 1,6 раза в сравнении с контролем отмечено у недоношенных детей данной подгруппы.
У недоношенных с гестационным возрастом 34-36 недели с респираторной патологией характерными и отличительными признаками от контроля были следующие изменения: значимое повышение CD3+, превышающие контрольные значения в 1,3 раза, CD4+ и CD20+ в 1,2 раза, CD16+ в 1,2 раза, сопровождающееся увеличением уровня IL-2 в 1,4 раза, IFN-γ в 1,2 раза, IL-1β в 1,3 раза и концентраций IgG в 1,3 раза.

Рисунок 9 - Показатели цитокинового статуса недоношенных детей IIb подгруппы с респираторной патологией с учетом срока гестации
Кроме того, имело место увеличение уровня CD95+ в 1,5 раза и снижение уровня IL-10 в 1,4 раза по сравнению с контрольными данными, что являлось признаком активности процессов апоптоза и прогностически неблагоприятным показателем. Формирование респираторной патологии не оказывало влияния на показатели CD8+ и CD25+, сходных с уровнем контрольных значений. У недоношенных 34-36 недели гестации наблюдалось повышение бактерицидной активности нейтрофильных гранулоцитов в спонтанном НСТ-тесте в 1,2 раза и стимулированном в 1,3 раза по отношению к контролю. Высокие резервные возможности фагоцитарных клеток, превышающие данные контроля в 1,7 раза отмечены у недоношенных с респираторной патологией в данной возрастной подгруппе.
В группе недоношенных со ЗВУР распределение по гестационному возрасту представлено следующим образом: 22-27 недели - 7% детей, 28-33 недели – 29% и 34-36 недели – 64% недоношенных новорожденных.
По данным некоторых авторов (Сундетова Р.А., 2008; Орехова В.К., 2004; Schauf B. et al., 2003), у недоношенных новорожденных со ЗВУР отмечалась повышенная супрессорная активность иммунной системы. Сравнительный анализ, проведенный между недоношенными с задержкой внутриутробного развития различного гестационного возраста выявил для недоношенных детей со сроком гестации 22-27 недели снижение количества CD3+, CD4+, CD8+, CD16+, CD20+ (в 1,4 и более раз), уровня цитокинов IFN-γ, IL-1β, IL-2 и IL-10 (ρ<0,05) по отношению к контрольным значениям и показателям Ia подгруппы (рисунок 10 и 11).
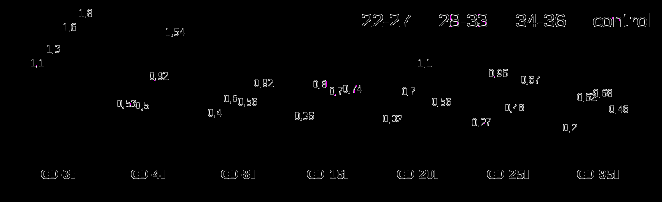
Рисунок 10 - Показатели иммунного статуса недоношенных детей IIс подгруппы со ЗВУР с учетом срока гестации (абс.чис.)
Ингибиция продукции цитокинов, имевшая место у глубоконедоношенных детей, являлось показателем несовершенства развития клеток, морфофункциональной незрелости организма, особенно у недоношенных детей со ЗВУР.
Наиболее выраженные сдвиги у недоношенных 28-33 недели гестации со ЗВУР установлены по следующим величинам: снижение в 4,2 раза в сравнении с Ib подгруппой и в 3 раза - с контролем для CD4+; уменьшение в 2,7 раза к данным Ib подгруппы, в 1,4 раза по отношению к контролю для CD8+. В сравнении со значениями Ib подгруппы наблюдалось повышение в 1,1 раза содержания CD3+, тогда как в сравнении с контролем оно было снижено в 1,1 раза. Количество CD20+ и CD25+ по сравнению с контрольной группой были повышены в 1,2 раза, хотя по отношению к данным «условно» здоровых недоношенных идентичного возраста были снижены в 1,3 и 1,4 раза. Различия по CD95+ в виде повышения в 1,3 раза определены только по отношению к контролю. Концентрации IL-1β и IL-10 превышали показатели контроля и Ib подгруппы в среднем в 1,2-1,3 раза на фоне снижения уровней IFN-γ и IL-2.
У недоношенных 34-36 недели гестации наличие ЗВУР ассоциировано с повышенным содержанием в 1,8 раза В-лимфоцитов, в 1,5 раза CD95+, со сниженным в 2 раза количеством CD25+ и в 1,6 раза CD4+ при отсутствии достоверных различий в содержании CD16+ по отношению к контролю.

Рисунок 11 – Показатели цитокинового статуса недоношенных детей
IIc подгруппы со ЗВУР с учетом срока гестации
Результаты НСТ-теста, как стимулированной, так и уровня базальной продукции активных форм кислорода, имели различия в зависимости от гестационного возраста ребенка. Оценка неспецифической резистентности выявила снижение показателей спонтанного и индуцированного НСТ-теста у глубоконедоношенных детей, тогда как в других возрастных группах регистрировалось повышение метаболической активности в спонтанном (20,1±3,09 и 17,8±2,71) и индуцированном (25,2±3,13 и 28,3±3,18) НСТ-тестах по отношению к контролю. О резервных возможностях функциональной активности фагоцитов судили по разности между данными стимулированной и базальной НСТ-теста, что выявило наименьшие показатели (25,3%) у недоношенных 28-33 недели гестации при показателях контроля (42,4%) и наибольшее значение (58,9%) в подгруппе недоношенных 34-36 недели гестации.
Таким образом, проведенные исследования показали, что в зависимости от гестационного возраста перинатальная патология у недоношенных детей проявлялась формированием трех вариантов нарушений иммунного статуса: компенсированным, субкомпенсированным и декомпенсированным. Для недоношенных детей 22-27 недели гестации было характерно развитие иммунологически «декомпенсированного» состояния, что проявлялось угнетением клеточного иммунитета сопровождавшегося незначительной активацией процессов апоптоза и гуморального иммунитета. Другой вариант иммунных нарушений в виде повышения параметров, ответственных за гуморальную защиту и неспецифическую резистентность, увеличения количества дифференцированных и хелперных Т-лимфоцитов с усилением продукции провоспалительных медиаторов, снижения количества цитотоксических клеток и уровня IL-10 зарегистрирован у недоношенных 28-33 недели гестации и характеризуется как «нарушенное компенсированное». Третий вариант - «субкомпенсированные» нарушения в виде активации хелперной субпопуляции Т-лимфоцитов при сохраняющейся на уровне нормы содержании цитотоксических клеток и увеличения количества дифференцированных лимфоцитов, бактерицидной активности микрофагоцитарной системы определялся у недоношенных детей 34-36 недели гестации.
