Пятая революция в медицине: о роли инфекций в патогенезе старения и хронических болезней человека
| Вид материала | Документы |
- План лекций по патофизиологии на 4 семестр 2011- 2012 учебного года для студентов стоматологического, 54.69kb.
- Урок по биологии и медицине по теме: «Наследственные заболевания», 400.46kb.
- План лекций по патологии на 4 семестр 2011 2012 учебного года для студентов фармацевтического, 420.97kb.
- Лекция по теме «Внешние проявления старения», 59.73kb.
- Научно-практическая конференция: «Современные методы диагностики и лечения кожных болезней, 1916.21kb.
- Лекция по микробиологии. Возбудители медленных, латентных и хронических вирусных инфекций, 66.47kb.
- Новые фундаментальные знания на службу профилактики инфекционных болезней животных, 124.52kb.
- Грипп и острые респираторные вирусные инфекции и их профилактика, 26.29kb.
- «Медицинский вестник», 134.56kb.
- Тематическое планирование по литературе 9 класс, 370.4kb.
ПЯТАЯ РЕВОЛЮЦИЯ В МЕДИЦИНЕ: О РОЛИ ИНФЕКЦИЙ В ПАТОГЕНЕЗЕ СТАРЕНИЯ И ХРОНИЧЕСКИХ БОЛЕЗНЕЙ ЧЕЛОВЕКА
К. АЛИБЕК, Л. ГРЕЧАНЫЙ, Т. КЛИМЕНКО, А. ПАШКОВА
В XX ст. существенно увеличилась средняя продолжительность жизни человека. Основными факторами, внесшими вклад в этот процесс, стали четыре революции в медицине: 1) формирование представлений о гигиене и санитарии, оснащение городов системами централизованного водоснабжения и канализации, внедрение практики утилизации отходов, что в совокупности привело к резкому снижению уровня инфекционных заболеваний; 2) признание научной общественностью микробной теории инфекционных заболеваний Л. Пастера и введение понятий асептики и антисептики; 3) открытие и повсеместное внедрение в медицинскую практику метода вакцинации, что привело к существенному снижению уровня детской смертности от инфекционных заболеваний; 4) открытие и внедрение в клиническую практику антибиотиков. Результатом указанных изменений стал эпидемиологический переход, и первое место среди основных причин болезней и смерти вместо инфекционных заболеваний заняли хронические дегенеративные заболевания, которые принято считать неинфещионными. Однако экспериментальные данные показывают, что многие микроорганизмы — вирусы (герпетические вирусы, вирусы гепатитов, аденовирусы и др.), бактерии (хламидии, хеликобактерии, патогенные бактерии полости рта и др.), а также грибки и паразиты — могут являться этиологическим фактором хронических дегенеративных заболеваний, таких как атеросклероз, некоторые виды рака, сахарный диабет, нейродегенеративные и психические заболевания, остеопороз, аутоиммунные болезни и др. Вместе с тем многие из этих заболеваний традиционно рассматривали как связанные с возрастом наряду с другими так называемыми возрастными нарушениями, в частности снижение эффективности иммунной системы, инволюция вилочковой железы, патологическая кальцификация и др. Рассмотренные в совокупности перечисленные факты свидетельствуют о том, что старение имеет и инфекционные корни и некоторые инфекции, особенно их сочетание, могут приводить к ускоренному старению и ранней смерти. Таким образом, инфекции могут служить триггером (пусковым, механизмом) старения, предположительно посредством механизмов хронического оксидативного стресса, вялотекущего хронического воспалительного процесса, укорочения теломер и аутоиммунных процессов вследствие молекулярной мимикрии. Мы полагаем, что следующим этапом в решении задачи увеличения продолжительности жизни должно стать понимание роли инфекций как основного триггера возрастзависимых заболеваний и нарушений, а также разработка и внедрение методов терапии, направленных на излечение от данных инфекций или их эрадикацию.
Ключевые слова: старение, возрастные заболевания, инфекционные заболевания, хронические дегенеративные заболевания, старение иммунной системы, продолжительность жизни, вирусные инфекции, герпетические вирусы, бактериальные инфекции, вялотекущее хроническое воспаление.
Введение
Н
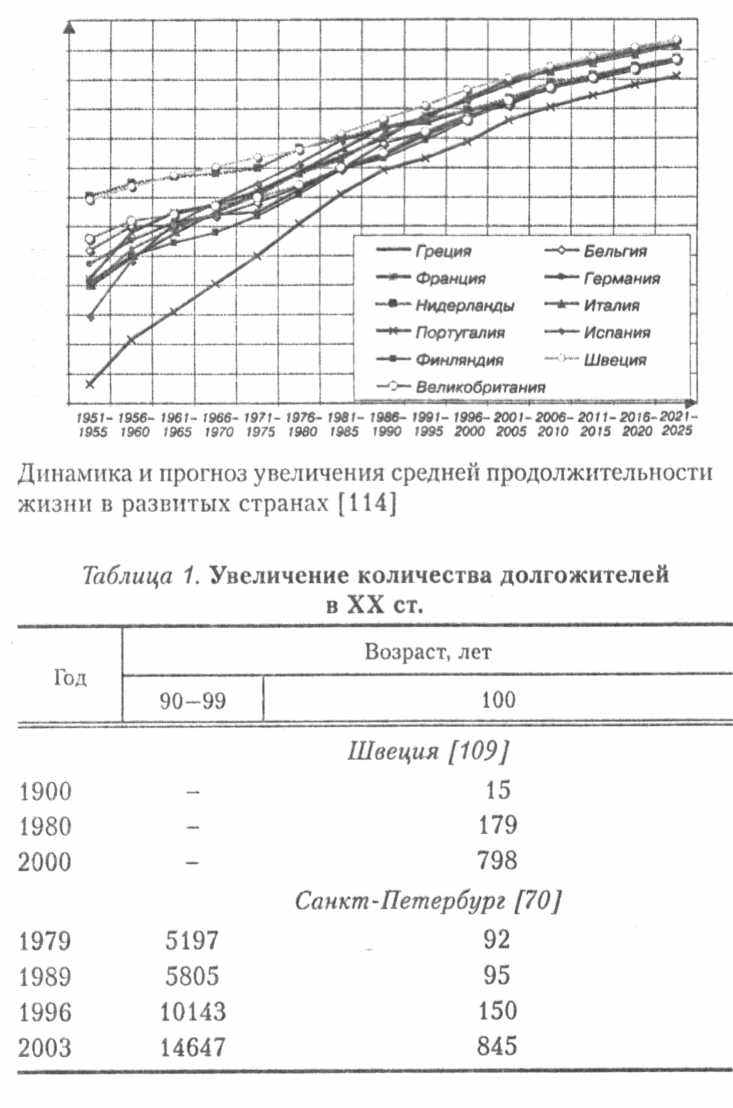 а протяжении истории человечества продолжительность жизни людей неуклонно увеличивалась. В эпоху Римской империи средняя продолжительность жизни была короткой и составляла около 22 лет. Данные о продолжительности жизни в Европе неполны и разрознены, вплоть до появления демографической статистики и выделения общественной гигиены как социально важного научного направления в XVIII-XIX вв. [12]. Согласно имеющимся демографическим данным, в начале XX в. в индустриально развитых странах продолжительность жизни составляла 35—55 лет, в настоящее время этот показатель достиг 73—80 лет и продолжает увеличиваться (рисунок) [145]. В Украине средняя продолжительность жизни составляет 68 лет при средней продолжительности жизни мужского населения 62 года.
а протяжении истории человечества продолжительность жизни людей неуклонно увеличивалась. В эпоху Римской империи средняя продолжительность жизни была короткой и составляла около 22 лет. Данные о продолжительности жизни в Европе неполны и разрознены, вплоть до появления демографической статистики и выделения общественной гигиены как социально важного научного направления в XVIII-XIX вв. [12]. Согласно имеющимся демографическим данным, в начале XX в. в индустриально развитых странах продолжительность жизни составляла 35—55 лет, в настоящее время этот показатель достиг 73—80 лет и продолжает увеличиваться (рисунок) [145]. В Украине средняя продолжительность жизни составляет 68 лет при средней продолжительности жизни мужского населения 62 года.Следует отметить, что во все времена были долгожители, возраст которых достигал 120 лет [82]. Случаи продолжительности жизни более 100 лет не единичны, в настоящее время количество таких людей во всём мире также увеличивается (табл. 1). Согласно данным New England Centennarian Study (Harvard Medical School, Boston, MA, USA), количество людей в возрасте 100 лет и старше к 2000 г. на планете составляло около 100 тыс. и с 1960 г. этот показатель во многих странах увеличился почти в 10 раз [82]. Эти данные свидетельствуют о том, что теоретически продолжительность жизни человека существенно выше, чем нынешние средние показатели. Однако, несмотря на существенные достижения последних лет в биологии и медицине, до сих пор нет однозначного мнения о том, какие именно рекомендации могут способствовать ощутимому увеличению продолжительности жизни, а предлагаемые методы и средства пока не подтвердили желаемой эффективности.
Исходя из приведенных данных, мы хотели бы кратко проанализировать историю медицины с точки зрения того, какие открытия в этой области сделали наибольший вклад в изменение продолжительности жизни людей. Эти открытия можно назвать революциями в медицине, так как они позволили существенно увеличить продолжительность жизни не каких-либо отдельных групп населения, а человечества в целом. Парадоксально, но факт, что все упомянутые открытия прямо касались взаимоотношений человек—микроорганизм.
Четыре революции в медицине
Первая революция, начавшаяся в Европе примерно в XVII-XIX вв., привела к серьёзному изменению представлений о гигиене, санитарии, появлению эпидемиологии, введению санитарно-гигиенических и противоэпидемических мероприятий. Повсеместное внедрение практики удаления отходов, оснащения городов системами централизованного водоснабжения и канализации, наряду с просвещением населения и привитием правил личной гигиены, привели к резкому снижению распространения эпидемий и инфекционных болезней, которые в средние века уносили десятки миллионов жизней. И хотя общественные бани, водопровод и канализация известны со времён древних цивилизаций, а такое противоэпидемическое мероприятие, как карантин, впервые упоминалось в Европе в XIII-XIV вв., только после научного обоснования Л. Пастером микробной теории болезней в 60-е годы XIX в. санитарно-гигиенические нормы в странах Европы стали вводить систематически в соответствии с научными принципами [12].
Вторая революция произошла в середине XIX в. и хронологически её можно отнести к признанию научной общественностью микробной теории инфекционных заболеваний Л. Пастера. Вскоре после этого в медицину были введены понятия асептики (Дж. Листер, 1867; Великобритания) и антисептики (Э. Бергманн, К. Шиммельбуш, 1890; Германия). Эффект от внедрения мероприятий, обеспечивающих предотвращение заражения людей инфекционными агентами, а также введение в медицинскую практику процедур обеззараживания контаминированных поверхностей, инструментария и материалов привели к резкому снижению смертности новорождённых и рожениц от сепсиса и других инфекционных осложнений, а также существенному снижению количества инфекционных осложнений и связанной с ними смертности после хирургических вмешательств. Открытия Л. Пастера, Р. Коха их учеников положили начало этиологическому направлению в медицине, привели к зарождению микробиологии и эпидемиологии, что существенно повысило эффективность борьбы с инфекциями и снизило смертность от них [12].
Третья революция также началась в XIX в., набрала силу в XX в. и продолжается по настоящее время. Эта революция связана с применением вакцинации для зашиты от многих (в том числе детских) инфекционных болезней. Повсеместное внедрение в медицинскую практику вакцинации, наряду с нормами гигиены и санитарии, привело к резкому снижению детской смертности, особенно в первый год жизни, а также позволило полностью ликвидировать или значительно снизить смертность от многих ранее неизлечимых эпидемических инфекционных заболеваний (например, натуральная оспа, полиомиелит, дифтерия и др.).
Четвертая революция началась в первой половине XX в., когда были заложены основы антимикробной химиотерапии (работы П. Эрлиха, открытие стрептоцида и сульфаниламидов; открытие пенициллина А. Флемингом в 1929 г.). Внедрение антибиотиков в медицинскую практику в 40-50-х годах XX в. полностью изменило подход к лечению и профилактике ранее неизлечимых или трудно поддававшихся лечению инфекционных заболеваний, таких как туберкулёз, чума, лепра, сифилис, токсическая дизентерия, холера, сибирская язва и др.
Если до XX в. основной причиной смертности были инфекционные болезни, то с их ликвидацией произошёл эпидемиологический переход, и первые места заняли дегенеративные болезни без выраженной инфекционной компоненты, такие как атеросклероз, рак, диабет и др. [143]. В XXI в. будущее медицины специалисты связывают в первую очередь с достижениями молекулярной биологии и генной инженерии. Значительные успехи в области биологических наук — расшифровка генома человека (а также многих животных, растений и микроорганизмов), мегапроекты постгеномной эры (эпигенетика — изучение наследуемых изменений, происходящих без изменений в последовательности ДНК; протеомика — изучение соотношения и посттрансляционных модификаций белков, экспрессированных клеткой в разных условиях; метаболомика — изучение малых молекул и метаболитов клетки и т.д.) в будущем, несомненно, приведут к созданию новых лекарственных средств — более совершенных, индивидуализированных, обладающих менее выраженными побочными действиями. Однако вряд ли это приведёт к ощутимому увеличению средней продолжительности жизни населения планеты. Даже если не учитывать фактора доступности дорогостоящих лекарственных средств, разработанных на основании данных геном- и протеомики, ощутимого увеличения продолжительности жизни не стоит ожидать прежде всего потому, что новые лекарственные средства направлены на лечение уже существующих хронических заболеваний или на улучшение качества и продление жизни больных. Не умаляя и не отрицая важности этих задач, мы тем не менее считаем, что основной задачей, стоящей перед медициной, должно стать изучение этиологии хронических заболеваний с целью профилактики развития тяжёлых патологий, приводящих к инвалидности, максимального увеличения среднего возраста лиц без хронических заболеваний и поддержания здоровой и активной жизни людей до глубокой старости.
Мы считаем, что следующая революция, которая может дать новый толчок к увеличению продолжительности и улучшению качества жизни человека, также будет касаться взаимоотношений человек—микроорганизм и приведёт к пониманию того, что микроорганизмы являются первопричиной заболеваемости и смертности людей от многих неинфекционных заболеваний. Мы предполагаем, что возбудители острых, хронических, персистирующих и латентных инфекций за счёт индуцирования различных патологических процессов являются основной причиной системного повреждения органов и тканей, развития хронических неинфекционных патологий и вследствие этого значительного сокращения продолжительности жизни.
Два основных взгляда на процесс старения
Старение — прогрессирующий разрушительный процесс, который приводит к недостаточности физиологических функций организма, ограничению его адаптационных возможностей, развитию возрастной патологии и повышению вероятности смерти.
В настоящее время существуют две группы теорий о механизмах старения. Согласно первой, старение является результатом случайных, или "стохастических", событий, таких как непредсказуемые внешние факторы или каждодневные обменные процессы. Согласно второй, старение — результат естественных процессов, так или иначе запрограммированных на генетическом уровне [13, 68]. Однако! большинство исследователей полагают, что старение — комплексный процесс, являющийся результатом действия не одного базового механизма, а нескольких, вызывающих, в конечном итоге, накопление патологических изменений, приводящих к болезням и последующей смерти. В настоящее время нет объединяющей теории, которая учитывала бы все известные механизмы старения, как и общей первопричины, триггера процесса старения.
Группа "стохастических" теорий рассматривает старение как результат случайных событий. К ней относятся следующие теории.
Вероятностная теория изнашивания в первоначальном виде была предложена ещё А. Вейцманом в 1882 г. и исторически является одной из первых теорий старения. Она объясняет старение как процесс кумулятивных повреждений жизненно важных молекул и метаболических путей, что приводит к смерти клеток, тканей, органов и, в конечном итоге, организма в целом. Например, ДНК повреждается постоянно на протяжении всей жизни, а старение определённых организмов связано с утратой участков ДНК на концах хромосом (теломер). Если репарация ДНК оказывается неполной или же возникают возрастные изменения механизмов репарации, то клеточная функция прогрессивно нарушается. Согласно этой теории, продолжительность жизни строго коррелирует со способностью ДНК к репарации, т. е. эффективность репарации ДНК предопределяет продолжительность жизни человека [58]. Вместе с тем данный механизм не является всеобъемлющим, так как в некоторых исследованиях не была доказана прямая зависимость между способностью к репарации и продолжительностью жизни.
Теория соматических мутаций (первоначальный вариант — Л. Оргел, 1963 г. [97]) связывает старение с накоплением мутаций ДНК и ошибок в транскрипции последовательности РНК, с последующей трансляцией этих ошибок в белковые последовательности [93,132]. Эта теория построена на предположении, что ошибки в транскрипции и трансляции могут приводить к нарушениям в структуре и функциях белков, что обусловливает нарушение клеточных функций и, в конечном итоге, гибель всего организма. К этой же группе относится теория, связывающая старение с мутациями в митохондриальной ДНК [76].
Теория свободных радикалов (Д. Харман, 1954 г. [56]) — одна из наиболее хорошо разработанных теорий, позволяющая объяснить не только механизм старения, но и патогенез многих болезней, связанных со старением (сердечно-сосудистые заболевания, сахарный диабет, рак и др.). Согласно этой теории, радикалы — активные формы кислорода — АФК (reactive oxygen species — ROS) — образуются в митохондриях при различных метаболических процессах, а также под воздействием ионизирующего излучения. Кислородсодержащие радикалы (супероксид-анионы, гидроксильный и пероксидный радикалы), высокоактивные нерадикальные соединения кислорода (пероксид водорода и синглетный кислород), а также углерод-, азот- и серосодержащие радикалы оказывают разрушительное воздействие на ДНК, белки, мембраны, коллаген и вызывают микроповреждения тканей. Эти повреждения накапливаются (оксидативный стресс), что в итоге приводит к последствиям, ассоциирующимся со старением [94]. Применение антиоксидантов позволяет существенно снизить вредное воздействие свободнорадикальных процессов [43]. В настоящее время имеется достаточно много данных, свидетельствующих о том, что угнетение свободнорадикальных процессов в клетке может приводить к значительному увеличению продолжительности жизни некоторых видов [4].
Теория поперечных сшивок (И. Бёркстен, 1942 г. [22]), согласно которой поперечные сшивки белков и других клеточных макромолекул (посредством гликозилирования, образования Шиффовых оснований и др.) приводят к возрастным нарушениям и заболеваниям. Данная теория описывает ограниченное количество феноменов, связанных со старением. Известно, что у человека и животных внеклеточный коллаген с течением времени начинает образовывать поперечные "сшивки". Помимо этого, образование поперечных сшивок играет существенную роль в формировании морщин, возрастном помутнении хрусталика, развитии возрастных сосудистых заболеваний, заболевании клубочкового аппарата почек и др.
Теломерная теория старения. Хотя систематическое сокращение длины теломер в некоторм роде является "запрограммированным процессом", автор данной теории А. М. Оловников относит её к теориям повреждения ДНК [10]. Теломеры — некодирующие участки ДНК, находящиеся на концах хромосом, с последовательностью (TTAGGG)n у человека и млекопитающих и длиной 7-15 тыс. пар нуклеотидов (у человека). В нормальных соматических клетках млекопитающих эти концевые участки, обеспечивающие стабильность хромосом, укорачиваются с каждым делением клетки (на длину 25-200 пар оснований), что происходит из-за неспособности ДНК-полимераз полностью реплицировать концы линейных молекул ДНК. Теломеры выполняют функции "митотических часов", которые определяют продолжительность жизни клетки: когда теломеры достигают критически короткой длины (примерно через 100 клеточных делений), клетки стареют и становятся неспособными к дальнейшему делению. Теломерная теория позволила объяснить открытый Л. Хейфликом феномен, согласно которому клетки многоклеточного организма способны делиться ограниченное количество раз [59].
К теориям запрограммированного старения можно отнести иммунологическую и элевационную, теорию генетически запрограммированного старения, а также недавно предложенную редусомную теорию. Эти теории объединяет существование внутреннего регуляторного механизма ритмоводителя, который "включает" механизмы старения в определённый момент жизни и предопределяет продолжительность жизни индивидуума. Ритмоводителем выступают определённые органы или системы органов (например, иммунная и нейроэндокринная системы: вилочковая железа, гипоталамус, эпифиз), гены или особенные ДНК-структуры.
Согласно теории генетически запрограммированного старения, продолжительность жизни индивидуума определяется генетическими факторами. В настоящее время идентифицировано множество генов, ассоциированных со старением или долголетием [86]. Мутации или полиморфизм некоторых генов приводят к образованию фенотипов с синдромом ускоренного старения (прогерии) или подверженности болезням, связанным со старостью. Например, известно, что аполипопротеин Е (апоЕ), играющий важную роль в липидном метаболизме, имеет четыре изоформы, одна из которых (Е4) ассоциирована с высоким уровнем холестерина в крови и, следовательно, с повышенным риском ишемической болезни сердца, а также вовлечена в патогенез болезни Альцгеймера [4]. И наоборот, было обнаружено, что у долгожителей преобладает относительно редкая изоформа Е2, которая способствует поддержанию сниженного уровня холестерина. В эксперименте на трансгенных животных было показано, что с помощью манипуляций с определёнными генами можно увеличить продолжительность жизни некоторых видов на десятки процентов. За исключением генов, мутации которых приводят к нежизнеспособным фенотипам, большинство генов, связанных со старением, обусловливают только предрасположенность к определенным заболеваниям. Отрицательное влияние таких генов на продолжительность жизни может быть в значительной степени корректировано питанием и образом жизни. Это свидетельствует о том, что эпигенетические факторы оказывают решающее влияние на продолжительность жизни особи или индивидуума. Более подробно генетическая компонента старения и долголетия описана в разделе "Старение".
Иммунологическая теория старения основана на данных о возрастзависимой инволюции вилочковой железы (тимуса) и связанном с этим угасании иммунной системы, что выражается в уменьшении количества наивных Т-клеток, ослаблении клеточного иммунитета и ухудшении иммунного ответа на новые антигены (в частности, при вакцинации) и другим функциональным нарушениям [30]. В конечном итоге эти факторы приводят к повышенной подверженности инфекционным, аутоиммунным и онкологическим заболеваниям [17].
Иммунная система тесно связана с нейроэндокринной через цитокины, нейромедиаторы, гормоны, их рецепторы и лиганды и другие гуморальные факторы, причём эти взаимодействия двухсторонние [52]. Со стороны эндокринной системы в них участвуют гормоны гипоталамо-гипофизарно-надпочечниковой системы, такие как пролактин, адренокортикотропный гормон (через кортизол надпочечников), тиреоидстимулирующий гормон (через тиреоидный гормон щитовидной железы) и другие гормоны, в том числе половые. Уровень этих гормонов, а также гормонов вилочковой железы (тимозина-альфа 1, тимулина и тимопоэтина) снижается с возрастом, что приводит к уменьшению активности функций вилочковой железы, старению иммунной системы и способствует развитию болезней, связанных со старением [53].
В элевационной теории старения (В. М. Дильман, 1950-1980 гг. [6]) основное значение в процессе старения имеет возрастное повышение порога чувствительности гипоталамуса к гомеостатическим сигналам. Согласно этой теории, старение (и связанные с ним болезни) не запрограммировано как таковое, а является побочным продуктом реализации генетической программы развития организма.
Накоплено много данных о роли эпифиза (шишковидной железы) как основного ритмоводителя физиологических процессов [4]. При старении нарушается ритм и снижается уровень секреции мелатонина, что приводит к нарушению цикличности работы всех систем организма и как следствие — к болезням и старению.
Несмотря на множество исследований, на которые опираются теории ритмоводителей, они не могут объяснить первопричину изменений в самой системе ритмоводителя. Кроме того, эти теории не учитывают того, что не у всех организмов хорошо развита иммунная или нейроэндокринная система.
Редусомную теорию старения (А. М. Оловников, 2003 г. [11]), очевидно, можно считать первой попыткой ввести фактор, отвечающий за контроль биологического времени и "включающий" различные этапы онтогенеза, в том числе и старение. В качестве такого фактора предлагается еще один тип молекул ДНК — редумеры, прикреплённые к хромосомам короткие молекулы ДНК, содержащие копии регуляторных генов. Согласно этой теории, главным "счётчиком времени" в организме является разновидность редумер — хрономеры, а основным ритмоводителем процесса старения — эпифиз. Отдавая должное оригинальности данной теории, необходимо отметить, что в настоящее время она является лишь гипотезой, нуждающейся в экспериментальном подтверждении, поэтому мы не будем рассматривать её в данной работе.
Старение: триггер и мишени
Как указывалось выше, существует общая проблема, связанная со всеми предложенными теориями старения: они не идентифицируют причинный фактор связанных с возрастом изменений, а в основном объясняют их механизм. Это касается в первую очередь теорий запрограммированного старения. Так, иммунная теория не объясняет, почему в определенном возрасте начинается инволюция вилочковой железы; различные нейроэндокринные теории — почему снижается уровень продуцирования гормонов железами внутренней секреции с возрастом и т. д. Генетическая теория позволила идентифицировать многие гены предрасположенности к болезням, ускоряющим старение организма, из-за чего одни люди начинают болеть и стареть раньше других, однако не ответила на вопрос, почему развиваются патологические изменения. Стохастические же теории не объясняют того факта, что темп старения людей разный, они начинают болеть и умирают в разном возрасте, даже если подвержены сходным факторам социоэкономическим и окружающей среды. Даже сочетание теорий обеих групп, или учёт и внутренних (например, генетической предрасположенности), и внешних (социоэкономических и окружающей среды) факторов, не даёт исчерпывающего ответа на вопрос о продолжительности жизни. Так, расчёт коэффициентов корреляции между продолжительностью жизни родителей и детей показал очень низкую наследуемость по этому признаку даже с учётом внешних и случайных факторов; подобные результаты были получены на моделях животных [4].
Несомненно, в результате новых исследований в области геронтологии будет выявлено ещё больше механизмов и факторов старения на молекулярном и клеточном уровнях, а также на уровне органов, систем и организма в целом. Однако вопрос о первопричине, т.е. о действительном пусковом механизме этих изменений, пока не решён. По нашему мнению, должен существовать универсальный триггер, запускающий процессы старения и возникновения патологии, а описанные в различных теориях органы и молекулы, участвующие в процессах старения, являются мишенями для этого триггера. И если такой триггер будет выявлен, это может помочь определить принципы и подходы к торможению процессов старения.
Мы считаем, что одним из наиболее важных, если не самым важным триггером, запускающим многие механизмы, ассоциированные со старением, является микробный фактор, который предопределяет продолжительность жизни людей. Мы предлагаем назвать этот фактор "микробными часами" биологической жизни индивидуума. Наша теория построена на том, что ключевой (хотя не единственной) причиной старения и, в конечном итоге, смерти являются различные микроорганизмы (в том числе вирусы, бактерии, грибки, паразиты и др.), которые кратковременно или длительно инфицируют клетки и органы человека, вызывая различные патологические изменения. Механизмы патогенного действия микроорганизмов могут быть самыми различными, и самые распространённые из них будут рассмотрены в следующем разделе (с. 10).
Мы предлагаем новое понимание старения, которое, являясь естественным этапом в жизни человека, в то же время имеет все признаки системного хронического заболевания. Согласно известной эпидемиологической триаде, для возникновения заболевания необходимы три основных фактора: 1) восприимчивый организм; 2) этиологический (точнее сказать, этиопатогенетический); 3) факторы внешней среды, способствующие появлению конкретного заболевания. При старении имеет место восприимчивый организм (например, человеческий), множество факторов внешней среды (социальные факторы, питание, климатические условия, в том числе загрязнение воздуха, солнечная радиация и т. д.). Этиологическим и патогенетическим факторами, по нашему мнению, являются сотни и тысячи видов микроорганизмов, которым организм подвержен с момента рождения (выхода в нестерильную среду), а в ряде случаев и до рождения (например, в случае внутриутробного инфицирования). Микроорганизмы, в том числе и патогенные, заселяют внешнюю и внутреннюю среду человека, накапливаясь с возрастом в его внутренней экосистеме, участвуя в различных физиологических и патофизиологических процессах. Когда кумулятивный эффект воздействия микроорганизмов достигает предела адаптационных возможностей организма, в органах и системах, подвергшихся патогенному воздействию, развиваются хронические заболевания, ускоряющие процесс старения.
Мы не ставим под сомнение влияние других важных факторов, таких как генетическая предрасположенность, социальная среда, полноценное питание, стресс, а также различные факторы внешней среды и др., на продолжительность и качество жизни человека. В то же время мы выделяем микроорганизмы из общего понятия "внешняя середа", так как считаем роль микробного фактора настолько важной, что её следует рассматривать отдельно.
