«роль липидных нарушений и провоспалительных цитокинов в патогенезе псориаза и их коррекция» 14. 00. 11 кожные и венерические болезни
| Вид материала | Автореферат |
- Усовершенствование метода терапии угревой болезни на основе коррекции дисфункциональных, 338.75kb.
- Фотодинамическая терапия псориаза препаратами тетрасульфофталоцианинового ряда 14., 335.98kb.
- Комплексная фармакотерапия тяжелых форм псориаза с учетом биохимических и иммунологических, 211.59kb.
- Комплексная фармакотерапия тяжелых форм псориаза с учетом биохимических и иммунологических, 218.32kb.
- Задачи по оказанию доврачебной помощи при неотложных состояниях 43 акушерство, 1884.21kb.
- Диагностика и терапевтическая коррекция специфических изменений предстательной железы, 362.04kb.
- Комплексная терапия акне у женщин с метаболическими нарушениями 14. 01. 10 Кожные, 395.48kb.
- Консервативного и хирургического лечения, 693.1kb.
- Выбор лечебной тактики у больных различными формами акне 14. 00. 11 кожные и венерические, 441.88kb.
- Практикум для студентов лечебного и педиатрического факультетов, 2007. П. Д. Гуляй, 16.95kb.
Уровень ОХ коррелировал с возрастом пациентов (R=0,68), возрастом манифестации (R=0,47), длительностью заболевания (R=0,39), ИМТ (R=0,62), р<0,01, т.е. с увеличением возраста больных, длительности заболевания, ИМТ и при более позднем начале псориаза, уровень холестерина в сыворотке крови повышался. При анализе биохимических параметров корреляция ОХ прослеживалась с β2-глобулинами (R=0,57), СРБ (R=0,57), ферментами АлАт (R=0,45) и ГГТ (R=0,57) сыворотки крови (р<0,01), свидетельствуя о глубоких метаболических связях между липидными нарушениями печеночными и иммунными механизмами при псориазе.
При ретроспективном анализе историй болезни 34 молодых пациентов выявлено, что до начала заболевания и в момент манифестации псориаза липидные изменения не выявлялись. Формирование дислипидемии начиналось на 1-2 году болезни с гиперхолестеринемии и увеличения ЛНП у 11 (32,4%), понижения соотношения АпоА1/АпоВ у 10 (29,4%), снижения уровня ЛВП у 8 (23,5%), повышения ЛОНП и ТГ у 3 (8,8%), КА у 2 (5,9%). Таким образом, наиболее часто регистрировалось повышение уровня общего холестерина за счет ЛНП, что может говорить о повышенной потребности тканей в эстерифицированных холестерином полиненасыщенных жирных кислотах (в частности, для синтеза мембран кератиноцитов, находящихся в фазе пролиферации), несостоятельности рецепторов к ЛНП на поверхности эффекторных клеток, либо других механизмов эвакуации ЛНП из крови. Снижение АпоА1 или повышение АпоВ отражает дисбаланс белковых компонентов в составе липопротеинов. Первоначальное снижение уровня ЛВП может свидетельствовать о недостатке фосфолипидов – одного из главных компонентов этих липопротеинов.
При исследовании биохимических параметров ЩФ, ГГТ, АлАт, АсАт, общего белка и белковых фракций выявлена ферментопатия у 37,7% пациентов, диспротеинемия – у 16,9%. У пациентов с псориазом был достоверно повышен уровень АлАт (31,4±26,4 Ед/л), ЩФ (99,1±40 Ед/л) и ГГТ (34,7±30,8 Ед/л) по сравнению со здоровыми лицами, что говорит о формирующейся патологии гепатобилиарной системы вследствие псориатического процесса и согласуется с данными других авторов (Балтабаев М.К. с соавт., 2004, Бутов Ю.С. с соавт., 2006). Содержание С-реактивного белка (повышен у 27,7% больных) было достоверно выше (4,47±7,53 мг/л), чем у здоровых лиц (0,95±1,19 мг/л).
Особый интерес представляет оценка уровня эпидермального холестерина (ЭХ), доля которого в мембранах в норме составляет до 16%. Мембранный холестерин регулирует процессы пролиферации, взаимодействие клеток с внеклеточными белками, системой свертывания крови и активации комплемента, различными транспортными системами, отражая функциональное состояние мембран (Strott C.A. et all., 2003).
Мы проанализировали уровень холестерина в эпидермисе у 26 больных псориазом в зависимости от длительности, формы и тяжести заболевания. В группу контроля вошли 18 условно здоровых лиц в возрасте от 16 до 58 лет. Результаты представлены в таблице №3.
Табл. №3. Показатель ЭХ до лечения в зависимости от клинических показателей.
| Распределение больных | n | | эпидермальный холестерин, мкг/см² | |
| PASI | Интактная кожа | Очаг поражения | ||
| Мужчины | 16 | 11,3±7,6 | 4,5±3,4* | 6,4±3,6* |
| Женщины | 10 | 11,4±7,7 | 5,1±3,9* | 6,9±3,2* |
| Прогрессирующая | 20 | 23,3±4,9 | 5,6±2,1*# | 8,7±2,7*# |
| Стационарная | 6 | 11,5±4,4 | 2,8±0,4*# | 3,6±1,8*# |
| Легкая | 6 | 3,9±1,7 | 3,2±1,5* | 4,8±3,0* |
| Средняя | 10 | 10,1±1,6 | 4,9±2,7* | 6,3±4,1* |
| Тяжелая | 10 | 20,2±8,7 | 5,1±2,1*# | 8,7±1,8*# |
| Вульгарный | 4 | 14,2±5,4 | 3,5±1,7* | 4,3±2,2* |
| Каплевидный | 4 | 19,5±3,6 | 1,9±0,5 # | 3,5±1,2*# |
| Застарелый | 4 | 12,6±4,7 | 5,8±3,0*# | 8,9±1,9*# |
| Ладонно-подошвенный | 4 | 4,5±0,6 | 4,8±2,3* | 8,3±2,7* |
| Всего | 26 | 12,7±6,3 | 4,8±3,1* | 6,6±3,9* |
| Контроль | 18 | 0 | 1,8 ±0,5 | |
* отличия достоверны относительно контроля, p<0,05
# отличия достоверны между показателями ЭХ в пораженной и интактной коже, p<0,05
У больных псориазом мы обнаружили достоверное повышение уровня эпидермального холестерина в интактной коже (4,8±3,1 мкг/см2) и в очаге поражения (6,6±3,9 мкг/см2) по сравнению со здоровыми лицами (1,8±0,5 мкг/см2). Наблюдается тенденция к возрастанию уровня ЭХ с увеличением тяжести заболевания. Так, при легком течении в интактной коже уровень ЭХ составил 3,2±1,5, в очаге поражения – 4,8±3,0 мкг/см2, при среднетяжелом – 4,9±2,7 и 6,3±4,1, при тяжелом – 5,1±2,1 и 8,7±1,8 мкг/см2 соответственно. В прогрессирующей стадии, когда идет активная десквамация эпидермиса, отмечается увеличение уровня ЭХ в интактной коже в 1,5-3 раза (5,6±2,1 мкг/см2) и 3-5-кратное в очаге поражения (8,7±2,7 мкг/см2), что достоверно выше, чем в стационарной стадии (2,8±0,4 и 3,6±1,8 мкг/см2 соответственно). Это говорит о клинико-лабораторной корреляции и подтверждает нестабильность мембран кератиноцитов. Оценка содержания ЭХ в зависимости от тяжести процесса показала, что при тяжелом псориазе было выявлено максимально высокое содержание ЭХ, вызывающего, по-видимому, выраженную дестабилизацию мембран и нарушение рецепторных взаимодействий в кератиноцитах, что обуславливало значительную воспалительную реакцию, активацию иммунных механизмов.
Наибольшие уровни ЭХ выявлены при застарелом (5,8±3,0 в интактной и 8,9±1,9 мкг/см2 в пораженной коже) и ладонно-подошвенном псориазе (4,8±2,3 и 8,3±2,7 мкг/см2), наименьшие – при каплевидном (1,9±0,5 и 3,5±1,2 мкг/см2 соответственно), т.е. уровень ЭХ в свежих очагах ниже, чем в длительно существующих. Самый высокий уровень ЭХ в очаге поражения выявлен при застарелом псориазе, что отражает наличие выраженной гипертрофии, инфильтрации и длительность воспалительной реакции у этих больных. Таким образом, анализ этих данных свидетельствует о нарушении транспорта холестерина в коже и дает возможность рассматривать уровень ЭХ как маркер активности псориаза.
Мы установили, что корреляция между уровнем ЭХ в интактной коже и ОХ сыворотки прослеживалась только при уровне ЭХ выше 6,0 мкг/см2. При этом липидные нарушения сыворотки крови соответствовали IIб типу дислипидемии, уровень ОХ составил 5,71±0,4 мМ/л, ТГ – 1,92±0,7 мМ/л, ЛНП – 3,14±0,6 мМ/л, ЛОНП – 0,77±0,5 мМ/л, КА – 3,28±1,5, АпоВ – 1,23±0,3 мМ/л, содержание ЛВП, соотношения АпоА1/АпоВ были наименьшими – 1,32±0,4 мМ/л и 1,11±0,3 соответственно. Таким образом, высокий уровень ЭХ вызывает дестабилизацию мембран, формирование дислипидемии, что обуславливает значительный риск развития атеросклероза, сердечно-сосудистой и печеночной патологии у больных псориазом, еще больше утяжеляющих течение псориаза.
Показатель ЭХ в видимо неизмененной коже коррелировал с длительностью заболевания. Так, уровень ЭХ в непораженной коже при длительности заболевания до 2 лет составил 2,4±1,0 мкг/см2, при длительности 2-4 года – 4,9±3,5 мкг/см2, при продолжительности псориаза более 5 лет – 5,2±2,7 мкг/см2. Достоверной корреляции уровня ЭХ в пораженной коже с длительностью заболевания не выявлено.
Мы исследовали уровни IL-17 – провоспалительного цитокина, вырабатываемого недавно открытой субпопуляцией Т хелперов 17 типа и запускающего каскад эффекторных цитокинов, таких как TNFα, IL-6, IL-8, действующих непосредственно в очаге (Schottelius A.J., 2004). С действием IL-17 связывают образование нейтрофильных инфильтратов, активацию ангиогенеза и антибактериальных пептидов (Alexa B., 2008). Цитокины Т хелперов 17 типа участвуют в формировании акантоза, воспалительной реакции в дерме (Zheng Y., 2007) и являются маркерами аутоиммунного процесса. Активация Т хелперов 17 типа наряду с Т хелперами 1 типа (действующих через TNFα, IFNγ и другие цитокины), выступает дополнительным путем формирования воспалительной реакции при псориазе.
Уровень цитокинов исследовали у 40 больных псориазом и 12 лиц из группы контроля. Установлена тенденция к увеличению уровня IL-17 при легком течении псориаза (0,7±1,6 пг/мл) и достоверное его повышение при среднетяжелом (1,2±1,3 пг/мл) и тяжелом течении (5,7±6,8 пг/мл) относительно контроля (0,2±0,4 пг/мл). Значительное повышение уровня IL-17 в сыворотке крови констатировано у пациентов старшей возрастной группы, с поздним началом псориаза, повышенной массой тела.
Уровень IFNγ оказался достоверно повышен при среднетяжелом и тяжелом течении (3,9±2,5 и 3,7±2,6 пг/мл), а при легком (1,4±1,3 пг/мл) не отличался от контроля (1,5±0,7 пг/мл). Показатели уровней IL-17 и IFNγ в сыворотке крови с учетом клинической формы псориаза представлены в табл. №4.
Табл. №4. Показатели уровней IL-17 и IFNγ в сыворотке крови с учетом клинической формы псориаза.
| Форма (вид) псориаза | Количество больных | Уровни цитокинов, пг/мл | |
| IL-17 | IFNγ | ||
| Каплевидный | 5 | 0 | 3,0±1,3* |
| Ладонно-подошвенный | 3 | 0 | 1,3±1,8 |
| Интертригинозный | 4 | 2,1±2,7 | 1,5±0,9 |
| Экссудативный | 4 | 8,2±6,4* | 3,0±1,9* |
| Застарелый | 6 | 10,8±5,3* | 0,2±0,4* |
| Вульгарный локализованный | 6 | 0,3±0,2 | 3,6±1,7* |
| Вульгарный распространенный | 12 | 7,5±3,9* | 5,6±2,5* |
| Всего | 40 | 5,9±6,2* | 3,6±2,7* |
| Контроль | 12 | 0,2±0,4 | 1,5±0,7 |
* отличия достоверны относительно контроля, p<0,05
Анализируя содержание цитокинов в сыворотке крови с учетом формы псориаза, мы выявили значительное повышение уровня IL-17 при застарелом (10,8±5,3 пг/мл), экссудативном (8,2±6,4 пг/мл) и распространенном вульгарном (7,5±3,9 пг/мл) псориазе. При интертригинозной форме его уровень в сыворотке крови оказался увеличенным (2,1±2,7 пг/мл). При каплевидной, ладонно-подошвенной формах дерматоза IL-17 не определялся, при очаговом псориазе его содержание достоверно не отличалось от нормы. Наибольшее увеличение содержания IFNγ в сыворотке крови выявлено при распространенной форме вульгарного псориаза (5,6±2,5 пг/мл). Высокие уровни IFNγ диагностированы при локализованной, каплевидной, экссудативной формах. При ладонно-подошвенном, интертригинозном псориазе содержание IFNγ достоверно не отличалось от нормы.
Таким образом, при каплевидном и ладонно-подошвенном псориазе на первый план выходит активация интерфероногенеза и подавление продукции IL-17, что может говорить о преимущественном вовлечении Т-хелперов 1 типа в иммунопатогенез при этих формах псориаза. Напротив, при застарелом псориазе продукция IFNγ снижена и значительно активированы Т хелперы 17 типа, что подтверждается значительным увеличением уровня IL-17 у этих больных. При остальных формах наблюдается вовлечение в иммунопатогенез Т хелперов 1 и 17 типа в различной степени выраженности. Следует отметить, что при одновременном увеличении уровней IL-17 и IFNγ клинически диагностированы наиболее тяжело протекающие формы распространенного и экссудативного псориаза. Повышенное содержание провоспалительных цитокинов IL-17 и IFNγ в сыворотке крови при псориазе свидетельствует об их активации и участии в формировании воспалительного процесса.
Резюмируя вышеизложенное, можно полагать, что в патогенезе псориаза определенное значение имеют нарушения функционирования Т-клеточного звена иммунитета. При различных клинических формах псориаза формируется преимущественная активация Т хелперов 1 либо 17 типа, однако в ряде случаев, чаще при распространенных и тяжелых формах заболевания, отмечается одновременная активация обоих типов, свидетельствуя о сложных взаимодействиях в системе Т клеточного звена иммунитета.
С целью поиска связи между показателями липопротеинов сыворотки, уровнями ЭХ и цитокинов IFNγ и IL-17, мы применили метод кластерного анализа. Данные представлены на рисунке № 2.
Рис. №2. Схема взаимосвязи между показателями липопротеинов, ЭХ и цитокинов IL-17 и IFNγ у больных псориазом (дендограмма).
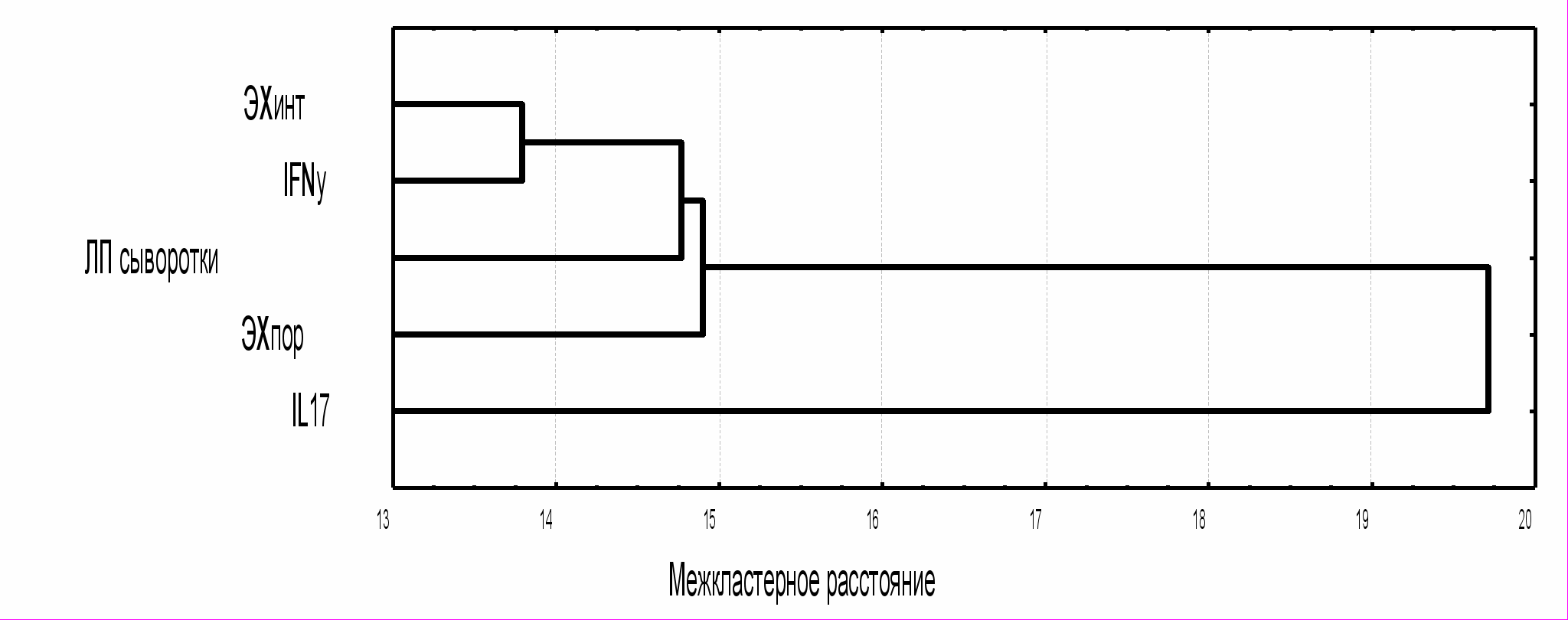
Анализ рисунка показал, что наиболее близкая взаимосвязь зарегистрирована между уровнями ЭХ в интактной коже и IFNγ. Этот факт может свидетельствовать, что воспаление при псориазе обусловлено активацией провоспалительных цитокинов на фоне нестабильности мембран кератиноцитов. Уровни ЭХ и IFNγ влияют на выраженность дислипидемии, в частности, чем больше уровень ЭХ в интактной коже и выше уровень IFNγ в сыворотке крови, тем более выражена атерогенная направленность метаболизма сывороточных липидов. В свою очередь, содержание ЭХ в пораженной коже зависит от степени выраженности дислипидемии. Самая дальняя связь зарегистрирована между вышеуказанными показателями и уровнем IL-17, что возможно свидетельствует о его вовлечении в патологический процесс на более поздних стадиях псориаза. На фоне липидных нарушений и сформировавшегося иммунного ответа активация IL-17 модулирует течение дерматоза, обуславливая развитие экссудации, инфильтрации и способствуя дессиминации высыпаний.
Опираясь на вышеизложенное и данные литературы, мы представляем алгоритм формирования воспаления при псориазе следующим образом (рис. №2).
Рис. №2. Алгоритм формирования воспаления при псориазе.

У больных псориазом формируется иммунный ответ на неопознанный антиген кожи. Антигенпрезентирующие клетки (АПК) эпидермиса фиксируют антиген и мигрируют в лимфоузлы, где активируют наивные T клетки, превращая их в клетки памяти, ответственных за пролиферацию лимфоцитов. Образовавшиеся Т хелперы 1 и 17 типа, мигрируя в эпидермис, продуцируют провоспалительные цитокины, которые разрушают базальную мембрану и десмосомы между кератиноцитами, вызывая воспаление. С действием цитокинов связана пролиферация кератиноцитов, акантоз, паракератоз, нарушение микроциркуляции.
Асептическое воспаление также стимулирует гиперпродукцию холестерина, что вызывает нестабильность клеточных мембран эпидермиса, активацию процессов перекисного окисления с образованием окисленных форм липидов и приобретение ими токсических свойств. Накопление холестерина в клетках способно инициировать процесс пролиферации. Кроме того, токсигенные продукты вызывают возникновение дислипидемии, эндоваскулита, гипоксии с усилением выброса провоспалительных цитокинов и образованием воспалительной реакции со стороны дермы и кератиноцитов эпидермиса и активируют иммунные реакции, замыкая порочный круг патологического процесса. Вышеизложенное подтверждает тот факт, что, при манифестации псориаза наблюдается активация Т-клеточного звена иммунитета, повышение уровня холестерина в эпидермисе, а дислипидемия начинает формироваться на 1-2 году заболевания.
Выявленные дислипидемические и иммунные нарушения, нестабильность мембран явились основанием для включения в терапию больных псориазом препарата фосфоглив, обладающего противовоспалительным, липид- и мембранстабилизирующим, гепатопротекторным и иммуномодулирующим действием.
Терапия проводилась 104 больным. Пациенты были распределены на контрольную (I) и основную (II) группу по 52 человека. Больные контрольной группы в течение месяца получали базовую терапию, пациенты основной группы – комплексную с включением фосфоглива в инъекционной и капсульной форме.
Данные индекса PASI до и после лечения представлены в таблице №5.
Табл. №5. Динамика индекса PASI до и после лечения в I и II группах.
| Течение заболевания | Группы | Индекс PASI | ||
| До лечения | Через 1 месяц | Через 4 месяца | ||
| Легкое, n=24 | контрольная | 4,4±1,7 | 3,1±0,9*# | 3,6±1,8*# |
| основная | 4,9±1,6 | 1,6±0,8*# | 0,6±0,4*# | |
| Среднетяжелое, n=40 | контрольная | 9,5±1,9 | 6,9±2,2*# | 7,8±2,5*# |
| основная | 9,8±2,1 | 4,1±1,8*# | 3,0±1,6*# | |
| Тяжелое, n=40 | контрольная | 19,3±7,1 | 12,2±4,5*# | 15,1±6,2*# |
| основная | 20,1±8,4 | 9,3±3,6*# | 6,1±2,4*# | |
| Всего, n=104 | контрольная | 11,2±7,4 | 7,4±4,7*# | 8,2±6,3*# |
| основная | 11,9±7,8 | 5,0±3,9*# | 2,7±1,6*# | |
*различия достоверны относительно показателя до лечения, р<0,05
# различия достоверны между терапевтическими группами
Через месяц терапии индекс PASI оказался достоверно снижен в обеих группах относительно значений до лечения, в контрольной группе в среднем на 25-35%, в основной – на 45-65%, а через 4 месяца – на 70-80%.
Качественная оценка клинической динамики до и после лечения представлена на рисунке №3.
Р
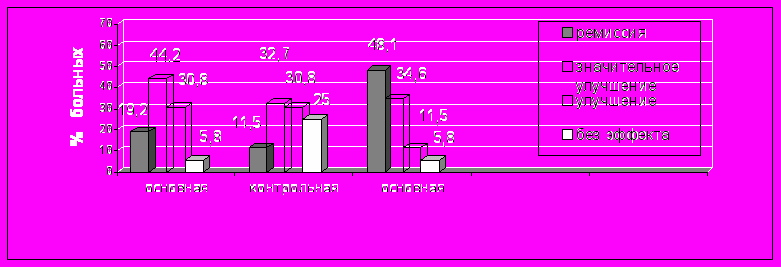 ис. №3. Сравнительная характеристика клинической динамики высыпаний пациентов I и II групп после лечения.
ис. №3. Сравнительная характеристика клинической динамики высыпаний пациентов I и II групп после лечения.После 1-го месяца
После 4-го месяца
После 1 месяца терапии в основной группе ремиссия была отмечена у 10 (19,2%) больных, значительное улучшение – у 23 (44,2%), улучшение – у 16 (30,8%) больных, отсутствие эффекта – у 3 (5,8%). В контрольной группе ремиссия констатирована у 6 (11,5%) пациентов, значительное улучшение – у 17 (32,7%), улучшение – у 16 (30,8%), отсутствие эффекта – у 13 (25,0%) пациентов. Отсутствие клинического эффекта регистрировалось преимущественно у длительно болеющих лиц. Снижение эффективности лечения, как в контрольной, так и в основной группе, чаще выявлялось у тучных пациентов (ИМТ 26,4±3,9 и 26,2±3,1 соответственно) не соблюдавших рекомендуемый режим. После 4 месяцев лечения в основной группе клиническая ремиссия была получена у 25 (48,1%), значительное улучшение – у 18 (34,6%), улучшение – у 6 (11,5%), отсутствие эффекта – у 3 (5,8%) больных.
Продолжительность ремиссии в основной группе составила 6,8±2,3 месяцев, в контрольной – 3,6±2,5 месяцев.
Оценивая влияние терапии на биохимические показатели после 1 месяца лечения, мы выявили, что в контрольной группе нормализации липидного профиля сыворотки не наблюдалось. В основной группе нормализация липидного профиля прослеживается у всех пациентов, более значительно у больных с клиническим эффектом. У пациентов с ремиссией и улучшением кожного процесса содержание ОХ (4,71±0,8 и 4,87±0,8 мМ/л), ЛВП (1,63±0,5 и 1,62±0,5 мМ/л соответственно) достигают нормальных значений на фоне увеличения содержания АпоА1, уровни ТГ, ЛОНП, ЛНП и КА значительно уменьшаются.
Мы исследовали динамику уровня ЭХ в здоровой и пораженной коже у больных псориазом после лечения. Данные представлены на рисунке №4.
Рис. №4. Содержание ЭХ у больных псориазом до и после лечения.
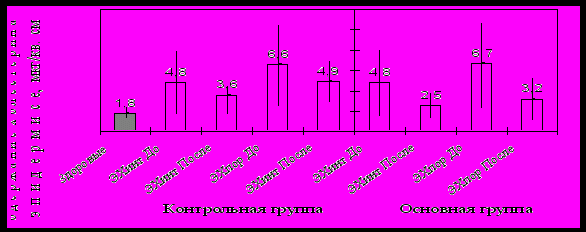
ЭХинт и ЭХпор – эпидермальный холестерин в интактной и пораженной коже
После 1 месяца терапии в контрольной группе уровень ЭХ в видимо непораженной коже составил 3,6±1,8 мкг/см2, в пораженной 4,9±2,0 мкг/см2 . В основной группе с комплексной терапией – 2,5±0,9 и 3,2±1,7 мкг/см2 соответственно, что достоверно ниже относительно показателей в контрольной группе и до лечения (4,8±3,1 и 6,6±3,9 мкг/см2). В очаге поражения уровень ЭХ во II группе уменьшился более чем в 2 раза, что подтверждает мембранстабилизирующую направленность терапии.
Мы проанализировали длительность ремиссии в зависимости от содержания ЭХ в интактной коже после терапии. Данные представлены в таблице № 6.
Табл. №6. Длительность ремиссии с учетом содержания ЭХ в интактной коже
-
Содержание ЭХ в интактной коже, мкг/см²
Продолжительность клинической ремиссии, месяцев
1-2
3-6
более 6
4,2±0,8*
3,0±0,7*
1,9±0,5*
*отличия достоверны между группами, р<0,05
Анализ показал, что прослеживается корреляционная связь между содержанием ЭХ в интактной коже и продолжительностью ремиссии, следовательно, уровень ЭХ может являться прогностическим маркером течения заболевания после лечения и активности процесса.
После терапии концентрация IL-17 в сыворотке крови пациентов I группы снизилась до 4,1±3,4 пг/мл, у больных II группы – до 3,8±3,2 пг/мл, уровень IFNγ понижался в контрольной группе до 3,0±2,1 пг/мл и достигал нормальных значений (2,1±1,1 пг/мл) в основной группе.
Анализируя эффективность терапии с учетом клинических форм, мы выявили, что у больных с каплевидной формой псориаза ремиссия в основной группе наступала через 16-18 дней, а в контрольной группе через 29-30 дней. Уже к концу месяца терапии в основной группе наблюдается нормализация уровня IFNγ. При ладонно-подошвенном псориазе наблюдалось улучшение или слабовыраженный эффект у больных основной и контрольной групп, в основной группе наблюдалось положительное влияние на липидный профиль сыворотки и снижение уровня ЭХ. При остальных формах псориаза в основной группе наблюдалось снижении индекса PASI, сопровождающееся значительным липидстабилизирующим эффектом, нормализацией уровня IFNγ и тенденцией к снижению IL-17 к концу терапии.
Таким образом, разработанный нами комплексный метод лечения псориаза с включением инъекционной и капсульной форм фосфоглива, является более эффективным по сравнению с традиционной терапией. Улучшение клинической картины и положительная динамика показателей липидов сыворотки, уровней эпидермального холестерина и цитокинов позволяют считать разработанный метод лечения патогенетически обоснованным.
Эффективность фосфоглива при псориазе можно объяснить свойством фосфолипидов ингибировать пролиферативные процессы, нормализовывать соотношение фосфолипиды/холестерин, способствуя стабилизации клеточных мембран и восстановлению структуры липопротеидов, а также противовоспалительным антиоксидантным и иммуномодулирующим действием глицирризиновой кислоты.
