Практическое пособие Москва 1998 Оглавление Оглавление 3 устройство современных аппаратов искусственного кровообращения 4 регуляция свертывающей системы крови во время искусственного кровообращения 22
| Вид материала | Документы |
Содержание3. Кислотно-щелочное состояние и электролитный баланс крови Кислородный баланс Кислотно-основное равновесие крови Стратегия alfa-state. Водно-электролитный баланс |
- Автоматическая детекция эмболии при операциях на сердце в условиях искусственного кровообращения, 168.16kb.
- Прогностическое значение маркеров воспаления у больных ибс, оперированных в условиях, 339.25kb.
- Медицинские показания и противопоказания для направления на санаторно-курортное лечение., 70.77kb.
- Патофизиология регионарного кровообращения и микроциркуляции, 124.19kb.
- Тематический план практических занятий на 3-й кафедре внутренних болезней для субординаторов, 35.73kb.
- Башкирский государственный медицинский университет гизатуллин а. Г. Краткая патофизиология, 1816.16kb.
- Задачи искусственного интеллекта 6 Тест по теме «История развития искусственного интеллекта», 1504.97kb.
- В. К. Финн к структурной когнитологии: феноменология сознания с точки зрения искусственного, 366.95kb.
- Реферат по физкультуре Тема: Влияние физических упражнений на кровь и органы кровообращения, 159.42kb.
- Системы искусственного интеллекта и нейронные сети, 208.41kb.
3. КИСЛОТНО-ЩЕЛОЧНОЕ СОСТОЯНИЕ И ЭЛЕКТРОЛИТНЫЙ БАЛАНС КРОВИ
Основной целью искусственного кровообращения (ИК), призванного временно заменить насосную функцию сердца и газообменную функцию легких, является адекватное снабжение тканей кислородом. Вместе с тем, даже при самой совершенной (по общепринятым критериям) методике проведения перфузии отмечаются изменения метаболизма, обусловленные нарушением кислородного гомеостаза. Данное обстоятельство наиболее часто связано с дисбалансом между потреблением кислорода и истинной потребностью в нем органов и тканей, что проявляется накоплением недоокисленных продуктов метаболизма, нарушением водно-электролитного обмена и т.п., даже в условиях, когда обьемная скорость перфузии (ОС) равна или превышает исходный минутный обьем сердца (МОС).
КИСЛОРОДНЫЙ БАЛАНС
Доставка (ДОг) и потребление (ПО2) кислорода являются основными показателями, определяющими кислородный статус организма, однако во время ИК они могут меняться в достаточно широких пределах, что часто затрудняет адекватную оценку количества кислорода (Ог) в организме на момент исследования. Основными причинами, снижающими указанные показатели во время ИК, являются, изменение ОС перфузии, состояние сосудистого тонуса, централизация кровообращения, степень гипотермии (снижение Т на 1°С уменьшает потребность в Ог на 5-7%),влйяние анестетиков (снижение потребности в Ог на 5-20%)и т.п.. В этой связи возникают следующие вопросы. Как правильно оценить являются ли сниженные значения ДОг и ПОг действительно следствием уменьшения потребности в кислороде или обусловлены неадекватным кровотоком на фоне низкой кислород* ной емкости крови? Какова критическая величина ДОг, которая оказывает непосредственное влияние на снижение ПОг, приводящее в конечном итоге к развитию тканевой гипоксии?
Наш многолетний опыт показал, что при ОС перфузии 2.5±0.1 л/мин/м2, на фоне умеренной гипотермии (минимальная температура 28°С) и гемоднлюции (не превышающей 30%) -критические величины ДОг и ПОг составляют, соответственно, 410 и 100 мл/мин/м2. В этих условиях снижение ДОг менее 410 мл/мин/м2 оказывает прямое влияние на уменьшение ПОг, приводящее к выраженному дефициту кислорода. При ДОг более 410 мл/мин/м2 корреляционная связь между этими показателями весьма слабая и уровень ПОг может быть нормальным или даже повышенным, что свидетельствует об эффективной тканевой экстракции кислорода. При изменении ОС ' перфузии, более глубокой степени гипотермии и ге-модилюции, оценить реальные критические величины ДОг и ПОг практически невозможно. В этих усло-*иях более четким критерием оценки кислородного Статуса является соЧтюшение между этими показателями. Так, если коэффициент ДО2/ПО2 равен 3.5-4.0, ' то это свидетельствует об адекватном снабжении тканей кислородом, ДОг/ПСЬ равное 3.4-3.0 указывает на преобладание в клетках анаэробного обмена над аэробным и, наконец, при ДО2/ПО2 менее 3.0 развивается циркуляторная гипоксия вследствие дисбаланса между потреблением и потребностями тканей в кислороде. Степень насыщения артериальной крови кислородом (SaCh) и парциальное напряжение кислорода (РаСЬ) во время ИК определяются эффективностью работы оксигенатора. Используемые в настоящее время мембранные оксигенаторы, позволяют поддерживать РаСЬ в пределах близких к "норме" (150-250 мм рт.ст.), что дает возможность избежать нежелательного влияния "нормобарической гиперок-сии", которое может выражаться в вазоконстриктор-ном эффекте избытка О? и активизации процессов перекисного окисления липидов.
Наиболее достоверными экспресс-показателями адекватности производительности АИК по-прежнему остаются степень насыщения смешанной венозной крови кислородом (SvCh) и парциальное напряжение кислорода (PvCb). Данные показатели отражают зависимость только двух величин - потребления кислорода и минутного обьема кровообращения больного. Поддерживая их на должном уровне, можно обеспечить постоянное соответствие кровотока кислородному запросу организма независимо от других параметров. Однако как определить должный их уровень при ИК? Очевидно, что в условиях нормотермиче-ской перфузии данные показатели должны соответствовать оптимальным "нормальным" величинам смешанной венозной крови здоровых людей, т.е. SvOr1 65-75%, PvO2= 35-40 мм рт.ст.. Более сложно оценивать их при гипотермической перфузии, поскольку снижение температуры вызывает ряд биохимических и биофизических сдвигов, которые существенным образом изменяют многие физиологические- константы организма. Одно из основных следствий этих сдвигов - снижение метаболизма тканей - является той целью, ради которой фактор охлаждения используется в клинике. В этих условиях при одной и той же дистанции диффузии сниженная потребность тканей в кислороде во время гипотермии обеспечена при меньшем капиллярно-тканевом градиенте рОг Если при этом принять во внимание также тот факт, что со снижением температуры растворимость кислорода, а следовательно, и скорость его диффузии в жидкости увеличиваются, то становится очевидным, что во время гипотермической перфузии адекватное снабжение организма кислородом может быть обеспечено при более низком рОг в оттекающей от тканей венозной крови.
Наше многолетнее клиническое применение метода ИК показало, что в условиях искусственной гипотермии использовать для оценки адекватности перфузии определение PvO2 можно только с учетом холо-дового сдвига кривой диссоциации оксигемоглобина (КДО). Значения PvO2 равные величине температуры больного на момент исследования не сопровождаются накоплением гипоксических метаболитов в организме, что свидетельствует об адекватной производительности АИК и достаточном снабжении тканей кислородом.
Принимая во внимание то обстоятельство, что на положение КДО во время перфузии (помимо гипотермии) влияют и другие многочисленные факторы, определять величину SvO2 по измерению Р\Ог в газоанализаторе в этих условиях невозможно, поскольку в основу расчета заложено нормальное положение КДО. Для правильной оценки необходимо проводить прямое измерение SvO2 в гемооксиметрах или в тех анализаторах, которые не рассчитывают, а непосредственно определяют данный показатель.
При правильной технике охлаждения и согревания гипотермическая перфузия любой глубины и продолжительности оказывается вполне адекватной, когда SvCb поддерживают на уровне 65-75%. При этом следует учитывать, что если гипотермическая перфузия проводится в условиях гемодилюции, то величина SvCh должна быть выше ( порядка 70-75% ), поскольку разведение может занижать истинные значения данного показателя.
Вместе с тем необходимо помнить, что показатели кислородного статуса являются критериями адекватности перфузии только с точки зрения требований, предъявляемых к ИК как к способу временной замены газообменной функции легких и насосной функции сердца. ИК не призвано (да и не может, учитывая многогранность компенсаторных реакций организма) полностью заменить функцию биологического дыхания в организме, окончательное суждение о котором можно получить, только исследуя показатели тканевого метаболизма.
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ КРОВИ
При нормотермической перфузии кислотно-основное равновесие (КОР) артериальной крови должно соответствовать "нормальным" параметрам здоровых людей: рН =7.37-7.40, рСО2~35-40 мм рт.ст. и ВЕ=±1.5 ммоль/л. В условиях гипотермиче-ской перфузии для регуляции КОР используют одну из двух стратегий: pH-state или Alfa-stat© (a-state). Основа этих стратегий заключается в следующем.
Стратегия pH-state. Основная цель методики регуляции КОР крови в режиме pH-state состоит в том, чтобы в условиях гипотермии поддерживать актуальные значения рН и рСОг на уровнях, которые считаются нормальными при нормотермии. Отсюда и название метода pH-state. т.е. поддержание постоянным рН вне зависимости от температуры тела больного. Поскольку при гипотермии растворимость газов увеличивается, для достижения указанной цели необходима подача в аппарат ИК углекислого газа. Для оценки состояния КОР крови по данной методике пользуются актуальными значениями рН и рСОх Поскольку измерения в газоанализаторах проводят при температуре 37°С, полученные величины необходимо скоррегировать на температуру больного. При этом считается, что для всех значений температуры величина рНа должна быть равна 7.40 ед.
Стратегия alfa-state. В начале 80-х годов в практику ИК был внедрен метод регуляции КОР крови, получивший название a-state. Было доказано, что основная бикарбонатная буферная система не работает при t < 28°С. В этих условиях ведущую роль буфера берет на себя белковая система (главным образом, имидазольная часть гистидина), степень диссоциации которой выражается величиной"альфа". Методикой a-state называют такую регуляцию КОР крови в условиях гипотермии, при котррой постоянным поддерживается общее содержание СОг (ТСОз). При этом, по мере уменьшения температуры рСОг в связи с увеличением растворимости СОг снижается, сохраняя величину "альфа" неизменной.
В литературе авторы часто не уточняют, какой стратегии регуляции КОР крови во время ИК они придерживаются, но, как правило, указывают, использовались ли значения рН и рСОг с коррекцией на температуру или без нее, тем самым, считая, что читатель сам может решить какая из них использовалась.
Вместе с тем, подобная оценка требует определенного навыка, поэтому мы посчитали необходимым привести пример, который может помочь клиницисту быстро разобраться в типе коррекции КОР, использованном при гипотермической перфузии.
Значения рН и рСОз артериальной крови при использовании двух стратегий регуляции КОР крови при гипо-тсрмическом ИК
| Стратегия | Температура |
| Кровь бол-го, в газоанализаторе, 27° 37° рН рСО2 рН рСО; мм рт.ст. мм рт.ст рН-state 7,40 40 7,25 65 a-state 7,55 25 7,40 40 |
Таким образом, при регуляции параметров КОР крови в режиме pH-state корригированные на температуру крови больного значения для рН должны быть 7.40, для рСОг - 40 мм рт.ст.. Если перфузию проводят в режиме a-state, то некоррегированные (непо* средственно измеренные в газоанализаторе) значения также должны составлять для рН около 7.40, для рСОг - 40 мм рт.ст. Наш опыт показал, что использование стратегии a-state более предпочтительно в клинической практике. Так, при снятии зажима с аорты, реперфузия ишемизированного миокарда "щелочным" рН сопровождалась большей частотой спонтанного восстановления сердечной деятельности, увеличением коронарного кровотока, достаточно быстрой нормализацией метаболизма миокарда и стабилизацией электрического порога сердца Кроме того, при использовании данного метода, показатели КОР крови можно не пересчитывать на истинную температуру больного, что достаточно удобно для перфу-зиолога, поскольку позволяет более быстро получить анализ крови и (при необходимости) внести необходимую коррекцию.
Анализ КОР крови включает количественное измерение главной буферной системы/ организма -бнкарбонатной, Она ответственна за(буферирование 75-80% избыточных ионов водорода экстрацеллю-лярной жидкости. При нормальных величинах рН и рСОг, концентрация стандартного бикарбоната (НСОз-ст.) в артериальной крови составляет 24.0, в венозной - 26.0 ммоль/л. Изменения бикарбонатной системы отражены показателем BE (ммоль/л), который при знаке (+) указывает на избыток, а при знаке (-) на дефицит оснований. Именно по показателю BE проводится коррекция метаболического ацидоза, когда снижение рН обусловлено дефицитом ионов бикарбоната. . Основными причинами возникновения метаболического ацидоза во, время ИК являются: снижение ионов НСОз (в результате разведения или переливания растворов с высоким содержанием хлора) и избыточная концентрация ионов Н (вследствие накопления недоокисленных продуктов обмена в организме).
Коррекцию дефицита оснований во время перфузии проводят внеклеточным раствором бикарбоната натрия по формуле:
ДoзaNaHCOЗ(ммoль)=20%вeeaб-нoгo(кг>ч)бъeмAИK(л)xBE(ммoл/л),
где 20% или 0.2 кг/л- обьем внеклеточной жидкости в организме от общегоявеса тела.
Пример расчета; вес б-ного=70кг,первичный
обьем АИК=2л,
BE крови = -5.0 ммоль/л
(0.2 л/кг х 70 кг) + 2 л = 16 л внеклеточной жидкости (а)
16 л х 5 ммоль/л=80 ммоль (коррегирующая доза NaHCO?) (б)
Зная, что первичный обьем заполнения АИК рассчитывают по поверхности тела больного, air NaHCO? содержит 12 ммоль ионов НСОЗ, легко определить (в" зависимости от концентрации бикарбоната) необходимое количество вводимого раствора в миллилитрах, что более удобно для работы перфузиолога. В своей практике для коррекции метаболического ацидоза мы используем 7% раствор бикарбоната натрия. Расчет его количества во время перфузии осуществляется по следующей формуле:
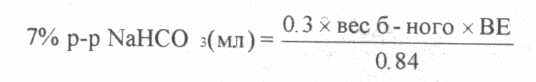
Для коррекции метаболического ацидоза, обусловленной} накоплением недоокисленных продуктов обмена, используют также 3.6% раствор Троме-тамина (ТНАМ-Е, трис [гидроксиметил]амино-метан, трис, трис-буффер, трисамин). Формула ТНАМ-E:[(CH2OH)3C-NH2];
раствор содержит: 5 ммоль К+, 30 ммоль Na+ 3.5 ммоль СГ и 300 ммоль НСОз" Его преимущество состоит в том, что он нейтрализует как внеклеточный, так и внутриклеточный избыток ионов водорода. Необходимое количество раствора рассчитывают на общий вес больного. Формула расчета.
3.6% р-р ТНАМ-Е (мл) - вес б-ного хВЕ
Количественную оценку избытка ионов Н+ мы осуществляем по показателю потери оснований (ПО), который рассчитываем по разнице изменения BE в начале и в конце ИК с учетом должного (обусловленного дополнительным введением 7% раствора NaHCOs) увеличения BE. Данный показатель позволяет с определенной долей вероятности оценить концентрацию ионов Н+, образующихся вследствие диссоциации органических кислот (главным образом, молочной).
Пример расчета: вес б-ногорбО кг, BE в начале перфузии - +1.0 ммоль/л, за время ИК введено 200 мл 7% NaHCOs» в конце ИК ВЕ=-3.0 ммоль/л
Ход расчета:
f Разница BE = 1.0 - (-3.0) = 4.0 ммоль/л 2. Объем экстрацеллюлярной жидкости = 60 кг х 0.2 л/кг= 12 л
3 Введено 200 мл ТА р-ра NaHCGs, т.е. 168 ммоль НСО?"
- Бикарбонат натрия распределяется только в экстрацеллюлярной жидкости, следовательно введение 168 мэкв HCOj- должно увеличить BE крови на 14.0 ммоль/л
- В конце ИК BE было равно -3.0 ммоль/л
- Поскольку разница BE за перфузию составила 4.0 ммоль/л, можно предположить, что 14.0 ммоль/л ионов HCOj, на которое должно было бы увеличиться BE крови, были израсходованы на нейтрализацию избыточных ионов водорода
- Следовательно, в действительности, потеря оснований (другими словами, эквивалентное количество образовавшихся за время ИК ионов Н) составила:
ПО (разница ВЕ.+ кол-во НСО?->= 4.0 + 14.0 = 18.0 ммоль/л
Накопление и последующая диссоциация молочной кислоты является основной причиной дефицита оснований и увеличения концентрации лактата (Л) во время ИК. Именно величина лактата позволяет оценить наличие ( Л > 3.0 ммоль/л) или отсутствие (Л илй•< 3.0 ммоль/л) гипоксических метаболических сдвигов.
Наши исследования позволили определить три основные причины накопления негипоксического лактата во время перфузии:
- переливание донорской крови (у = 0.001 мл дон.крови + 2.05), согласно уравнению регрессии 1 ампула крови увеличивает Л на 0.25 ммоль/л. Следовательно, даже при переливании 10 ампул крови (что практически не делается в настоящее время) Л может
максимально увеличиться на 2.5 ммоль/л;
- введение бикарбоната натрия (у ?= 0.002 мл 7% NaHCO? + 1.76), уравнение регрессии показывает, что введение 100 мл 7% р-ра NaHCO? увеличивает Л на 0.2 ммоль/л, т.е. при переливание до 500 мл раствора концентрация Л будет не выше 1.0 ммоль/л;
- гипервентиляция (рСОгаЗО мм рт.ст.), дальнейшее снижение рСОга на каждые 5 мм рт.ст. увеличивает Л на 0.3 ммоль/л.
Таким образом, при наличии перечисленных условий концентрация Л не должна превышать 3.0 ммоль/л - именно эту величину мы считаем "нормой" для диагностики негипоксических метаболических сдвигов при ИК. Однако необходимо помнить, что при отсутствии указанных выше причин, увеличение лактата также может быть обусловлено дефицитом кислорода в организме.
Концентрация Л выше 3.0 ммоль/л практически всегда связана с нарушением крово- и кислородо-снабжения тканей, иными словами с наличием цир-куляторной гипоксии. Основными причинами увеличения гипоксического лактата во время ИК являются:
- исходное состояние кровообращения;
- величина среднего АД менее 50 мм рт.ст.;
- снижение температуры больного менее 30°С;
- гемодилюция более 35%;
- длительность И К более 60 мин.
Исходное состояние кровообращения оказывает непосредственное влияние на изменение гемодинамики и метаболизма во время ИК: чем выше (по отношению к исходному СИ) перфузионный ин-декс(ПИ), тем ниже величина ОПС (т=-0.92, р<0.05), аналогичная связь отмечена между исходным и пер-фузионным ОПС (г=-0.89, р<0.05). Иными словами, чем выше вазомоторный тонус сосудов до операции, тем выраженнее степень их расслабления при ИК.
Величина АД во время ИК есть конечный результат только двух величин - ОС и ОПС, поскольку первая в наших исследованиях практически не менялась, составляя 2.5 л/мин/м2, величина АД главным образом зависела от ОПС (г=0.92, р<0.05). Практически такую же по величине, однако, обратную связь, отмечали между ОПС и Л (г=-0.90, р<0.05). При этом снижение АД сопровождалась накоплением гипоксического лактата (г-ОО р<0.05) и увеличением ПОг (г=-0.75, р<0.05). На этом фоне связь ПО2 во время ИК с дооперационной (г=0.85, р<0.05) и перфузионной (г=0.84, р<0.05) концентрацией Л свидетельствовала о "попытке" организма скомпенсировать исходную и вновь возникающую кислородную задолженность.
Указанные зависимости наиболее четко проявляются у больных с исходным СИ равном или менее 2.0 л/мин/м2, у которых выраженная вазодилятация во время ИК обусловливает снижение АД менее 50 мм рт.ст. и накопление гипоксического Л, даже при адекватно (по общепринятым параметрам) проведенной перфузии. Данный факт объясняется тем, что ИК "устраняет" низкую насосную функцию сердца, однако не может нормализовать исходные нарушения периферического кровообращения. Более того, в силу своих патофизиологических воздействий на организм, ИК скорее углубляет последние и т.о., даже при высоких ОС перфузии и ПОг нет гарантии адекватного крово- и кислородоснабжения тканей, предотвращающих развитие циркуляторной гипоксии.
В такой ситуации вновь возникает вопрос - какую ОС перфузии можно считать адекватной у пациентов с низкими резервными возможностями миокарда? В настоящее время величина ОС равная 2.5-2.7 л/мин/м2 считается вполне адекватной для предупреждения развития циркуляторной гипоксии. Если на, этом фоне наблюдается накопление гипоксического Л и прогрессирование метаболического ацидоза, то дальнейшее увеличение ОС может еще более усугубить нарушение тканевого кровотока, поэтому в данном случае клиницисту необходимо обратить внимание на другие факторы, которые могут быть ответственны за нарушение кислородного баланса. Одним из таких факторов является гипотермия, при которой накопление лактата может быть обусловлено не столько снижением скорости его потребления печенью, сколько наличием температурного градиента между "центральными" и "периферическими" тканями. Несмотря на общепринятые понятия, что при гипотермии потребность тканей в кислороде снижается, величина температурного градиента между кожными покровами, внутренними органами и тканями (особенно при Т менее 30°С) определяла степень накопления гипоксического Л (р=0.58, р<0.05), особенно у больных с низкими резервными возможностями миокарда.
Представляется, что при гипотермической перфузии вследствие холодового торможения вазомотор' ного центра, происходит ослабление констрикторной ймпульсации, что способствует снижению ОПС, а, следовательно, и АД, наряду с выраженной централизацией кровообращения. Последнее обусловливает нарушение периферического кровообращения, усугубляющееся увеличением вязкости крови и внутри-сосудистой агрегацией эритроцитов, которые отмечаются даже в условиях гемодилюции. Иными словами, в условиях гипотермического ИК адекватная (по общепризнанным параметрам) ОС перфузии не гарантирует достаточного тканевого кровотока, т.е. не предотвращает развития (усугубления степени уже имеющейся) циркуляторной гипоксии. Искусственное кровообращение существенно отличает от естественного, т.е. все патологические факторы, которые ему свойственны (гипотермия, гемодилюция, перераспре-делениеь кровотока, переливание донорской крови или эритроцитов и т.п.),углубляют свое влияние на организм при удлинении перфузии. Естественно, что на этом фоне и метаболический ответ, в частности гипоксия и ее последствие -лактатацидоз, будут более значительны, чем в коротких перфузиях (г=0.71, р<0.05). Нам представляется, что клиницист должен принимать во внимание тот факт, что при длительности ИК более 60-80 минут, даже в условиях "идеальной" перфузии отмечается тканевая гипоксия, адекватная компенсация которой возможна лишь при нормальной работе сердца после включения его в кровоток и в раннем постперфузионном периоде.
Гемодилюция также может явиться одной из причин кислородного дисбаланса во время ИК, особенно при длительных перфузиях. Так, если при ИК от 60 до 80 мин, снижение гематокрита до 23% не приводит к накоплению недоокисленных продуктов распада, то в условиях более длительных перфузии снижение кислородной емкости крови (гемодилюция более 30%) сопровождается увеличением гипоксического лактата (r-O.ei, р<0.05), даже при высокой ОС перфузии. Нам представляется, что данный факт необходимо учитывать не только при ИК более 80 мин, но и в тех ситуациях, когда уровень АД не превышает 50 мм рт.ст.. Поскольку в последнем случае неадекватное крово- и кислородоснабжение тканей, обусловленное нарушением периферического кровообращения, может усугубляться недостаточной доставкой кислорода. При данной ситуации гематокрит во время ИК необходимо поддерживать в пределах не ниже 26-28%. Циркуляторная гипоксия (выявляемая по определению лактата)достаточно четко коррелировала с частотой развития сердечной недостаточности в раннем постперфузионном периоде. Так, развитие последней наблюдали у 5.7% больных при величине Л до 3.0 ммоль/л, у 37% - при Л до 5.0, у 64% - при Л до 7.0 и у всех больных с Л более 7.0 ммоль/л. Поскольку лактатацидоз может сам по себе оказывать отрицательное влияние на ослабленный миокард, представляется, что действия клинициста в этих условиях Должны быть направлены на изменение сосудистого' бонуса в сторону улучшения периферического крово-°®ращения во время ИК, особенно при длительных гипотермических перфузиях у больных с исходно низкими резервными возможностями миокарда.
ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС
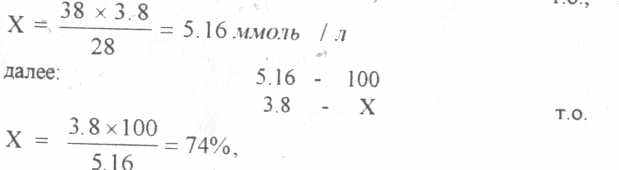
Для правильной диагностики и коррекции водно-электролитного баланса во время ИК необходимо знать нормальные значения водных объемов и электролитов в организме.
Содержание внеклеточной воды (плазма и интер-стиций) равно 20%, а внутриклеточной - 40% от веса тела. Иными словами, при весе 70 кг у мужчины-объем внеклеточной воды равен 14 литрам, а внутриклеточной - 28 литрам. Общий объем воды при этом составит 60% или 42 литра, у женщин он несколько ниже, соответственно 50% или 35 литров
Концентрация основных электролитов в плазме составляет:
-калий: 4.5 - 5.5 ммоль/л
- натрий: 138.0 -146.0 ммоль/л
- хлор: 98.0 -106.0 ммоль/л
- кальций (общий): 2.18 - 2.64 ммоль/л
- кальций (ионизированный): 1.05 - 1.27 ммоль/л
- магний (общий): 0.70 - 1.0 ммоль/л
- магний (ионизированный): 0.34 - 0.45 ммоль/л
Содержание ионов в наиболее часто используемы;
для инфузии корригирующих растворах:
- 1 г NaCl = 17.0 ммоль Na
- 1 г NaHCO? = 12.0 ммоль Na
- 1 rNa-лактата = 9.0 ммоль Na
-lrKCL =13.9 ммоль К
- 1 г К-ацитат =10.0 ммоль К
85 -1 г К-цитрат =8.3 ммоль К
-1 г СаСl2 =10.0 ммоль Са -1 гСа-глюконат = 2.5 ммоль Са - 1 г MgSO4 =4.2 ммоль Mg
Одной из основных причин нарушения водно-электролитного баланса во время ИК является гемо-дилюция, обусловливающая увеличение объема внеклеточной жидкости с соответствующем снижением концентрации основных электролитов вследствие разведения. Определение доли гемодилюции в изменении концентрации любого иона легко высчитать по обычным процентным соотношениям к исходному гематокриту (Hct).
Пример расчета: исходный Hct= 38%,.. в момент исследования при ИК величина Hct=28%, a
К~=3.8 ммоль/л.
составляем пропорцию: 28 - 3.8
38 . - X,
таким образом вследствие гемодилюции калий снижен на 26% (100%-74%=26%) Аналогичный расчет можно проводить и по другим
ионам. Помимо гемодилюции, на изменение электролитного баланса оказывают влияние и другие причины, такие как количество используемой донорской крови, желатиноля, состав растворов для проведения холодовой кардиоплегии, степень гипотермии и т!п..
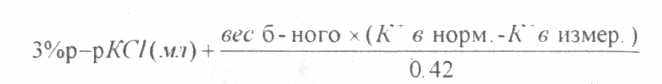
Однако необходимо отметить, что среди всех исследуемых ионов наиболее частые и значительные изменения во время ИК отмечаются в отношении концентрации иона калия. Постоянную коррекцию дефицита этого иона мы проводим 3% раствором KCL (содержащим в 100 мл 42 ммоль К) по следующей формуле:
Наиболее значимые изменения водно-электролитного баланса отмечаются на фоне цирку-ляторной гипоксии, что последовательно проявляется следующими процессами:
1. С каждым ммоль Na~ в клетку входят 7 мл воды - развивается "искусственная гипоксическая гипово-лемия"
2. Снижение внеклеточного объема жидкости приводит к увеличению осмоляльностн плазмы, что в свою очередь стимулирует секрецию АДГ. уменьшающего диурез
3. Уменьшение ОЦК сопровождается увеличением секреции альдостерона, который задерживает Na и жидкость в организме.
Такая ситуация особенно опасна во время ИК. поскольку для поддержания необходимого уровня в АИКе перфузиолог должен вводить дополнительный объем жидкости.
Иными словами, возникает порочный круг, когда на фоне внутриклеточного отека состояние «гипоксической гиповолемии» щрепятствуя выведению жидкости из организма и, снижая ОЦК), обязывает клинициста увеличивать последний, что главным образом осуществляется введением кристаллоидных растворов. Таким образом, усугубляется внутриорганный и клеточный отек, что вызывает рцкие нарушения не только водно-электролитного баланса, но и газооб* мена, и КОР крови.
В связи с вышеизложенным, нам хотелось бы обратить внимание клиницистов на следующее обстоятельство. Хотя накопление лактата является четким диагностическим признаком наличия гипоксии, его исследование могут осуществлять не в каждой клинике. В то же время есть показатель, который также увеличивается при дефиците Ог - остаточные (резиду-альные) анионы (R),ero связь с лактатом в этих условиях весьма высока (г=0.92, р<0.05), т.е. он с достаточной долей достоверности может использоваться для диагностики лактат-аиидоза (особенно у больных в отсутствии диабета и хронической почечной недостаточности). В состав показателя R входят органические и неорганические кислоты: кето - и молочная составляют 6.0 ммоль/л, ионы РО| - 4.0 ммоль/л, ионы SO4 - 2.0 ммоль/л; в норме общая концентрация R равна 12-16 ммоль/л. Данный показатель может быть легко рассчитан в любой лаборатории, определяющей КОР крови и электролитный баланс по следующей формуле: R (ммоль/л )= (Na+ + К+) - (НСО?-акт. + CL-). Имея одновременно данные КОР крови и величину остаточных анионов, довольно легко определить, вызваны ли метаболические нарушения накоплением недоокисленных продуктов обмена вследствие гипоксии или обусловлены другими причинами. Однако, необходимо помнить, что использование показателя R во время ИК может быть целесообраз ным для диагностики лишь при величине гематокри-та не менее 28%.
Основная оценка состояния водного баланса проводится по измерению осмоляльности на приборах осмометрах, как отечественного (МТ-2, "НПП Буревестник" Санкт-Петербург), так и иностранного производства. Осмоляльность плазмы (норма 286,0±0,2 мосмоль/кг) является весьма стабильным показателем, равнозначным во всех водных секторах организма. Увеличение или снижение этого параметра даже на 2 мосмоль/кг вызывает резкие изменения вне- и внутриклеточных перемещений воды. В свою очередь стремление уравновесить в водных секторах измененную величину осмоляльности сопровождается активизацией гормонов, таких как АДГ и альдо-стерон, что может приводить нарушениям важных параметров гемодинамики и гомеостаза. Основными компонентами, определяющими осмоляльность плазмы, являются натрий и хлор, вторыми по значимости - кислоты и белок, меньшее влияние оказывают глюкоза и электролиты.
Влияние различных растворов, увеличение концентрации глюкозы, снижение белка и умеренное накопление кислот, обычно способствуют тому, что осмоляльность плазмы во время ИК колеблется от 276 до 305 мосмоль/кг, Данные значения мы не считаем патологическими, поскольку (в отсутствии острых нарушений кровообращения и i при увеличении Hct более 28%) в раннем постперфузионном периоде осмоляльность быстро возвращается к норме. Вместе с тем, ее увеличение более 305-310 мосмоль/кг практически всегда связано с нарушением водно-электролитного баланса, обусловленного гипоксией (Л/Осм. г=0.91, р <0.05). В этих условиях накопление осмотически активных веществ превышает увеличение натрия и отношения между этими показателями снижается Ча+пл./Осм.пл.= 0.40-0.38, при норме 0.43-0.48).
В противоположность плазме, осмоляльность мочи в основном определяется содержанием мочевины и в меньшей степени - электролитов. Данная величина колеблется в довольно широких пределах от 550 до 850 мосмоль/кг и в связи с этим, для диагностики изменений водного баланса главным образом исполь* зуют ее соотношение с осмоляльностью плазмы (Осм. мочи/Осм. плазмы), которое в норме составляет 1.8-2.0. Данное соотношение наряду с учетом диуреза позволяет определять концентрацию осмотически активных веществ и клиренс свободной воды, выделяемых почками и свидетельствующий об их функциональной активности.
Оценка концентрационной функции почек по выведению осмотически активных веществ с мочей проводится по концентрационному клиренсу (Косм):
т, . , . ОсммхОбъемм
Косщмл/мин)=
Осм плазмы
норма (выше 1.0), по клиренсу свободной воды (КСВ):
КСВ (мл/мин)= Объем мочи - Косм.
норма (от-0.1 до-1.7)
Стремление к нулю или положительным значениям указанных показателей (особенно на фоне усиленного или сниженного диуреза) будет свидетельствовать о нарушении функциональной способности почек адекватно выводить продукты распада (уремические метаболиты) и электролиты:
Весьма интересным для клиницистов представляется возможность дифференциальной диагностики олигурии по коэффициенту осмоляльность моча/плазма:
Этиология Коэффициент
- Дегидратация 2.7-4.0
- Сниженный кровоток 2.0 -1.3
- Острая почечная недостаточность < 1.2
Еще одним важным показателем водного гомео-стаза является коллоидно-осмотическое (онкотиче-ское) давление (КОД) плазмы. В норме этот показатель равен 26.0±0.05 мм рт.ст., основу его составляют: белки - 98% (главным образом альбумин) и фибриноген - 2%. Градиент осмотического/гидростатического давления является основным механизмом перемещение жидкости через мембрану клетки и составляет в норме 8-10 мм рт.ст.. Совершенно очевидно, что при снижении концентрации белка, которое достаточно часто наблюдается во время ИК в результате избыточного поступления в сосудистое русло кристаллоидов, значения КОД плазмы также будут уменьшаться. Это в свою очередь вызывает снижение градиента онкотическо-го/гидростатического давления, последствием чего является отек клеточных мембран, что особенно часто проявляется в отношении миокарда и легких.
К сожалению в настоящее время не выпускают приборов, позволяющих напрямую определять онко-тическое давление плазмы, хотя ранее такие приборы производили на фирме "Instrumentation Laboratory" (США). Поскольку мы имели в наличии данный прибор, было проведено сопоставление измеренного напрямую и рассчитанного по содержанию белка значения КОД.
Высокий коэффициент корреляции (1*0.87, р <0.05), между этими двумя методами, позволил нам сделать вывод, что расчетные по белку значения КОД могут с высокой долей достоверности использоваться в клинической практике (особенно на фоне гематокрита менее 26%) для оценки онкотического давления плазмы. Расчет проводится по следующей формуле:
КОД (мм рт.ст.)= Общ.белок г/л х 0.4 Необходимо помнить, для исключения ошибок при определении концентрации белка (особенно на фоне переливания растворов гидррксиэтилкрахмала [HES] или желатиноля), его измерение должно проводиться с использованием химического, а не оптического метода.
Нарушения белкового и водного баланса при длительной, гипотермической перфузии в значительной степени могут быть обусловлены увеличением сосудистой (капиллярной) проницаемости. Данное состояние можно определить на основании разницы в величинах белка и гематокрита между артериальной и смешанной венозной кровью.
Количество фильтрационной жидкости - потеря воды в ткани или ее поступление в сосудистое русло на каждые 100 мл артериальной крови за время ее прохождения через микроциркуляторное русло - определяется по следующей формуле:
±Вф (мл /100мл крови )=-HHLx loo-100, (а)
HctB
Количество фильтрационного белка, т.е. количество белка, поступающего из крови в ткани или из тканей в системный кровоток на каждые 100 мл артериальной крови за время прохождения ее через обменные микрососуды рассчитывается по формуле: острых нарушений кровообращения в раннем постперфузионном периоде.
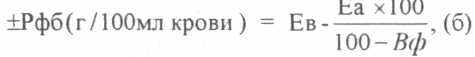
где Еа и Ев - количество белка в 100 мл артериальной и смешанной венозной крови, определяемое как:
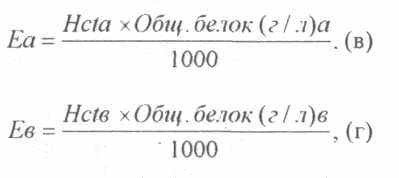
Принципиальное значение в трактовке величин Вф и Рфб имеет знак получаемого результата: положительный (+) - свидетельствует о транспорте в направлении из тканей в кровь; отрицательный (-) отражает переход воды и белков из крови в ткани.
В заключение хотелось бы отметить следующее. Представленные в настоящем разделе данные легли в основу методов контроля и коррекции состояния свертывающей системы крови, кислородного, кислотно-основного и водно-электролитного баланса у кардиохирургических больных во время и после искусственного кровообращения. Выявленные зависимости постоянно используются для контроля адекватности перфузии, диагностики и прогноза развития
