Урок упражнение по теме: «Металлы»
| Вид материала | Урок |
СодержаниеТип урока II. Актуализация опорных знаний. Шуточный рассказ. III. Закрепление. |
- Урок по теме: «Металлы и война», 237.99kb.
- Урок- расследование по теме «Металлы», 115.97kb.
- Урок по теме: «металлы, самый, самый…и его роль в организме человека», 145.15kb.
- Урок в 8-м классе по теме: "Тепловой баланс. Решение задач", 94.3kb.
- Правописание сложных имён существительных Упражнение, 191.24kb.
- Урок в 9 классе по теме «Бериллий, магний и щелочноземельные металлы.», 43.76kb.
- Урок геометрии в 8 классе по теме «Площади многоугольников», 52.25kb.
- Придаточные определительные Упражнение, 103.11kb.
- Дидактические материалы к программе Занятие Разминка. Упражнение, 676.87kb.
- План урока Вступление Закрепление и обобщение изученного материала. Составление плана, 86.07kb.
Урок – упражнение по теме: « Металлы».
Цели:
1. Повторить с учащимися положение металлов в ПСХЭ, особенности строения их атомов и кристаллов, металлическую химическую связь и кристаллическую металлическую решетку.
2. Обобщить знания учащихся, полученные ранее при рассмотрении общих химических свойств металлов; способах получения металлов
( пирометаллургии, гидрометаллургии, электрометаллургии); о коррозии металлов, классификации коррозионных процессов и способах защиты от коррозии.
3. Развивать логические операции мышления при обобщении знаний и конкретизации общих свойств металлов для отдельных представителей этого класса простых веществ.
Оборудование: таблицы «Коррозия металлов», «Способы защиты от коррозии», карточки – схемы, карточки с индивидуальными заданиями, интерактивная доска, мультимедиа.
Тип урока: повторительно – обобщающий.
Ход урока.
I. Организационный момент.
Здравствуйте, ребята! Сегодня наш урок – упражнение пройдет в виде аукциона знаний по теме «Металлы». На уроке, выполняя задания, мы повторим и систематизируем все свойства металлов и их соединений.
II. Актуализация опорных знаний.
1) Фронтальный опрос.
Периодическая система химических элементов Д. И. Менделеева поможет нам обобщить свойства металлов как химических элементов.
- Какие элементы называют металлами? Дайте определение.
(Металлы – это химические элементы, атомы которых отдают электроны внешнего, а некоторые – и предвнешнего электронного слоя, превращаясь в положительные ионы).
- Укажите положение металлов в ПСХЭ.
(Левый нижний угол от диагонали бор – астат).
- Что происходит со свойствами металлов в главных подгруппах? В периодах?
(Работа с ПСХЭ).
- Чем являются металлы в соединениях?
(Восстановители).
- Какова роль металлов как простых веществ?
(Выступления учащихся).
- Какой вид химической связи характерен для металлов?
(Металлическая).
- Какая кристаллическая решетка присуща металлам?
(Металлическая).
- Какие физические свойства характерны для металлов?
(Металлический блеск, пластичность, высокая теплопроводность, электропроводимость, твердость, прочность, магнитные свойства).
2)Индивидуальные письменные задания.
1. Металлы как восстановители очень активные, поэтому, используя опорную схему в общем виде, вспомним химические свойства металлов.
 Неметалл
Неметалл  О2
О2 Металл + Н2 О
Металл + Н2 О  Оксид Металла
Оксид Металла  Кислота
Кислота Соль
СольЗапишите химические свойства для элемента кальций и укажите условия протекания реакций.
Проверка задания.
t
Са + Н2 = СаН2
t
2Са + О2 = 2СаО
Са + 2Н2О = Са(ОН) + Н2
t
Са + СuО = СаО + Сu
Са + 2НСI = СаСI2 + Н2
Fe + СuSO4 = FeSO4 + Сu
Последнее свойство основано на положении металлов в электрохимическом ряду напряжений металлов.
Каждый металл способен вытеснить из растворов солей те металлы, которые стоят в ряду напряжений после него.
2. Металлы входят в состав соединений, составьте схему, используя только ключевое слово.
 Вещества
Вещества

3. Запишите формулы веществ, расставив их на соответствующие места в схеме, отражающей классификацию неорганических веществ.
(Na, СаО, КОН, S, HCI, СаSO4)
4. Перед вами таблица с формулами веществ. Пройдите, составив схему реакций, от одного вещества в задании к другому. Покажите различные пути:
а) от Na до NaOH; б) от Na2O до Na2SO4.
| Na2O | Na | Na2SO4 |
| Na2O2 | NaOH | NaCI |
а)I) 2Na + 2H2O = 2NaOH + H2
 II) Na Na2O2 Na2O NaOH
II) Na Na2O2 Na2O NaOH1) 2Na + O2 = Na2O2
2) Na2O2 + 2Na = 2Na2O
3) Na2O + H2O = 2NaOH
б
 ) I) Na2O NaOH Na2SO4
) I) Na2O NaOH Na2SO41) Na2O + H2O = NaOH или Na2O + H2SO4 = Na2SO4 + H2O
2) 2NaOH + H2SO4 = Na2SO4 + 2H2O
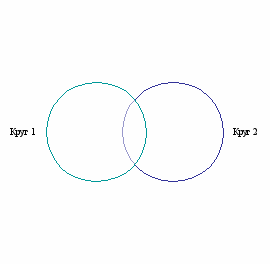
5. На рисунке изображены пересекающиеся понятия. В круг 1 входят вещества, проявляющие основные свойства, а в круг 2 – вещества, проявляющие кислотные свойства. Разместите в этих кругах формулы:
Na2O, AI(OH)3, KOH, ZnO, SO3, AI2O3, CaO, N2O5, Mg(OH)2, H2SO4.
Какую область на данном рисунке могут занять оставшиеся формулы, объясните их свойства.
(Амфотерные оксиды и гидроксиды – область пересечения).
6. Задание «Продолжи фразу».
Пирометаллургия – это…..
Гидрометаллургия – это…..
Электрометаллургия – это….
Однако, говоря о свойствах металлов, нельзя забывать о способности металлов реагировать с веществами окружающей среды и образовывать на поверхности особые соединения, обладающие совершенно особыми свойствами, чем сами металлы.
- О каком процессе идет речь?
(Коррозия металлов).
Коррозия металлов

 По месту образования По характеру
По месту образования По характеру
Сплошная местная химическая электрохимическая
- Каковы способы защиты от коррозии?
(шлифование, применение легированных сплавов, нанесение защитных покрытий, электрохимическая защита (анодная, катодная), применение ингибиторов).
Шуточный рассказ.
… Пришла жалоба от уважаемого нами семейства железа на какую-то коррозию. Было это так. Как-то вечером в дом постучали. Железо пошел открывать. Ворвалась нахалка коррозия и её сообщники – кислород, ионы водорода, электролит. Тут железо, конечно, вышел из себя. И чем он больше накалялся, тем быстрее коррозия делала своё дело – железо покрывалось слоем окалины.
И не только семейство железа, но и другие важные семейства страдают от коррозии, спастись удаётся тем, кто имеет «чудо-кафтан».
- Но ведь у железа был такой кафтан из окалины?
- Нет, какой бы ни был слой окалины, он не способен защитить железо, так как через поры и трещины кислород проникает к металлу.
А вот у алюминия, цинка, никеля, хрома и некоторых других металлов всё иначе.
- Объясните причину.
Дополнительные сведения.
Изделия из металлов подвергаются коррозии. Не щадит она и памятники архитектуры, так например, Эйфелева башня – символ Парижа, изготовлена из обычной стали и неотвратимо ржавеет и разрушается и только постоянная химиотерапия (лечение химическими веществами) помогают её сохранять. Башню красили уже 18 раз, отчего её масса (9 000 т) каждый раз увеличивалась на 70 тонн.
III. Закрепление.
Вопросы – задания:
- С какой целью поверхность цистерн для хранения нефтепродуктов (бензина, керосина) окрашивают «серебрином» - смесью алюминиевой пудры с одним из растительных масел?
- Почему человек, имея во рту зубные коронки, изготовленные из разных металлов, например золота и железа (стали), испытывает зубную боль?
- Как защитить автомобиль от коррозии ?
IV. Итог. Домашнее задание.
§18 №6 ( Химия 11 класс. Габриелян О. С.); из формулы соли сульфата железа (III) составить формулы других соединений.
