Первая отечественная кандидатная анти-вич/спид-вакцина: иммунологический мониторинг и испытания «14. 00. 36 аллергология и иммунология»
| Вид материала | Диссертация |
- Краевая целевая программа "анти-вич/спид" на 2007 2008 годы паспорт, 478.38kb.
- Алтайская краевая общественная организация «Анти спид-сибирь» учебный модуль, 526.43kb.
- Об утверждении районной программы «Предупреждение распространения заболевания, вызываемого, 393.03kb.
- Семинар тема: Проблемы, связанные с вич/спид, профилактика вич-инфекции, 180.77kb.
- Психологические аспекты вич/спид, 58.7kb.
- Целевая программа анти-вич/спид на 2011 год Паспорт Программы, 83.39kb.
- Цель: ознакомить с проблемой вич/спид, дать знания о путях, 682.12kb.
- Образовательный стандарт послевузовской профессиональной подготовки специалистов Специальность:, 1035.98kb.
- План мероприятий Пинского колледжа уо «Бр. Гу им. А. С. Пушкина» по профилактике спид, 36.68kb.
- Реферат на тему: вич – спид! Спид, 39.96kb.
Определение CD4+- и CD8+-Т-лимфоцитов и соотношения CD4+/CD8+. Кровь для определения CD4+- и CD8+-лимфоцитов забирали из кубитальной вены пациента в 9-10 ч утра, натощак, в гепаринизированную пробирку из расчёта 20 МЕ гепарина на 1 мл крови. Кровь разводили средой 199 в соотношении 1:3 и наслаивали на фиколл-пак (ρ=1,077 г/мл). Центрифугировали пробирки 40 мин при 400g. Собирали интерфазное кольцо, содержащее мононуклеарные клетки (МНК). Дважды отмывали МНК средой 199 при 200g 10 мин и доводили до концентрации 5 х106/мл. МНК вносили в лунки круглодонного планшета в количестве 50 мкл на лунку, по 3 лунки на каждого пациента (№1 – контроль, №2 – CD4, №3 – CD8). В лунки №2 и №3 вносили по 5 мкл мышиных моноклональных антител против CD4 и CD8 человека, соответственно («Сорбент», Москва). Пробы инкубировали 30 мин при +40С. Для отмывки в лунки вносили по 150 мкл среды 199 и осаждали клетки центрифугированием в течение 5 мин при 200g. Отмывку повторяли. Во все лунки (№№1-3) вносили вторичные антитела (овечьи антитела против иммуноглобулинов мыши), меченые ФИТЦ, по 0,5 мкл на лунку (50 мкл раствора антител, разведённых в 100 раз). Инкубировали 30 мин при +40С. Пробы двукратно отмывали, фиксировали 1% р-ром параформальдегида в ФСБ и хранили до исследования при +40С не более 72 ч. Анализ образцов проводили на проточном цитометре FACSCalibur («Becton Dickinson», США), оснащённым аргоновым лазером с длиной волны излучения 488 нм, с использованием программного обеспечения CellQUEST. Определяли количество CD4+- и CD8+-Т-клеток, а также соотношение CD4+/CD8+.
В настоящем исследовании в качестве диапазона нормальных значений были приняты: абсолютное количество CD4+-лимфоцитов – 600-1600; абсолютное количество CD8+-лимфоцитов – 300-800; соотношение CD4+/CD8+ – 1,0-2,5 [Пинегин Б.В. и соавт., 2001].
Следует учитывать, что результаты количественной оценки субпопуляций лимфоцитов, не соответствующие нормативным показателям, еще не свидетельствуют о наличии патологии, и наоборот, нормальные показатели субпопуляций лимфоцитов могут наблюдаться у пациентов с отклонениями в функционировании иммунной системы. Поэтому в первую очередь следует обращать внимание не на отклонение показателей относительно нормальных значений, а на соответствие характера отклонения показателя клинической картине заболевания [Пинегин Б.В. и соавт., 2001].
Исследование антиген-специфической продукции интерферона-γ лимфоцитами периферической крови (ELISPOT-анализ с применением набора BD № 551849, «Becton Dickinson», США). Для исследования использовали замороженные лимфоциты. Накануне проведения реакции лимфоциты, находящиеся в среде для замораживания, размораживали в водяной бане при 37 ºС. Быстро переносили в ППС и ценрифугировали 20 мин при 1000 об/мин. Сливали надосадочную жидкость, осадок ресуспендировали в ППС, центрифугировали 20 мин при 1000 об/мин. Сливали надосадочную жидкость, лимфоциты разводили ППС до концентрации 1 млн/мл. Оставляли на ночь в 5% атмосфере СО2 при 37ºС. Выживаемость лимфоцитов определяли по включению красителя трипанового синего. Содержание живых клеток определяли в гемацитометре. Реакцию проводили с применением коммерческих тест-систем BD № 551849 («Becton Dickinson», США) согласно инструкции предприятия-изготовителя, приложенной к набору. Результаты учитывали на анализаторе ELISPOT («AELVIS», EC).
Постановка реакции нейтрализации. В исследованиях нейтрализационных свойств образцов сывороток иммунизированных добровольцев в качестве методической основы использовали стандартные протоколы, утвержденные ВОЗ [End Point Neutralization Assay. WHO Guidelines for Standart HIV Isolation Procedures 1994, 1998 update] с небольшими модификациями. Испытания проводили в вирус-клеточной системе МТ4 - HIV-1IIIB.
Сыворотки, полученные в стерильных условиях стандартным методом, подвергали тепловой обработке при +56 оС в течение 30 мин для инактивации вирионов ВИЧ-1 и белков системы комплемента. Условия хранения сывороток: –80oC при однократном размораживании.
Перевиваемая клеточная линия МТ4 является клонированным вариантом, широко используемым для моделирования ВИЧ-инфекции. Линия была получена из коллекции NIH (National Institutes of Health, Bethesda, Maryland) и культивировалась согласно рекомендациям в пластиковых флаконах 25 см3 («Costar», США) при 370C и 5% CO2, в ростовой среде следующего состава: RPMI-1640 с 10% FCS («Bioclot», Германия), 2мМ L-глютамина («Sigma», США).
Вирусы. В работе использовали ВИЧ-1IIIB – референс-штамм, активно реплицирующийся в лимфобластоидных Т-клеточных линиях.
Вирусные стоки получали в результате острой инфекции клеток МТ4 вирус-содержащими супернатантами. Полученную вирус-содержащую культуральную жидкость освобождали от клеток низкоскоростным центрифугированием, аликвотировали и хранили при температуре –70оС. Биологическую активность вирусных стоков оценивали путем титрования TCID50. По результатам титрования активность использованного вирус-содержащего материала составляла 5,5 х 105 TCID50.
Тест нейтрализации. Использовали модифицированную методику, позволяющую проводить более масштабный поиск ВИЧ-позитивных сывороток с подходящими нейтрализующими свойствами. При этом использовали 2 дозы заражения вирусом – 10 и 50 TCID50 и 2 разведения сывороток – 1:10 и 1:50.
После 1 часа инкубации при 37°С 75 мкл предварительно прогретой и разведенной сыворотки с 75 мкл вируса в 96-луночный планшет добавляли 75 мкл суспензии клеток МТ4 в концентрации 1,5х 106 кл/мл.
На 2-й, 3-й и 4-й дни проводили отмывание несвязавшегося вируса, удаляя 175 мкл среды и добавляя 175 мкл свежей.
Результаты учитывали на 7 сутки инфекции путем определения содержания р24-антигена ВИЧ в культуральной жидкости с помощью ИФА. Использовали коммерческую тест-систему «ВектоВИЧ-1 р24-антиген-подтверждающий тест» (ЗАО «Вектор-Бест», Новосибирск). Нейтрализующую активность сывороток оценивали по снижению значения оптической плотности, определяемой с помощью ИФА, в пробах культурального супернатанта, отобранного из лунок с тестируемой иммунной сывороткой по сравнению с контрольными пробами, содержащими неиммунную сыворотку.
Индекс нейтрализации (NI) рассчитывали по формуле:
NI=(ODNegSer - ODTestedSer)/(ODNegSer - ODCellControl) х 100%
где ODnegSer - средняя (из трех повторов) оптическая плотность контроля инфекции с негативной сывороткой в ИФА; ODTestSer - средняя (из трех повторов) оптическая плотность проб с исследуемой сывороткой; ODСellControl - средняя оптическая плотность контроля клеток [Burton et al., 2004].
Статистическая обработка данных. При статистическом анализе полученных результатов определяли среднее арифметическое и стандартную ошибку среднего арифметического. Достоверность различий оценивали по t-критерию Стьюдента [Гланц C. Медико-биологическая статистика. 1998 г.].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клинические испытания вакцины “ВИЧРЕПОЛ» представляют собой очередной этап исследований по разработке анти-ВИЧ/СПИД, начатых в нашей стране в рамках МНТП «Вакцины нового поколения и медицинские диагностические системы будущего». Научный план программы предусматривал формирование единой системы, включающей разработку, доклинические испытания и клинические испытания кандидатных вакцинных препаратов против ВИЧ-инфекции/СПИДа. Вакцина «ВИЧРЕПОЛ» стала первой российской кандидатной анти-ВИЧ/СПИД-вакциной, которая была включена в клинические испытания, а сами эти испытания стали первым в нашей стране клиническим исследованием вакцин этой группы. Фактически они стали основой формирования инфраструктуры клинических испытаний анти-ВИЧ/СПИД-вакцин в России. Эта инфраструктура включает научные институты – разработчики вакцинных препаратов; когорты добровольцев, привлекаемых к участию в клинических испытаниях; центры клинических испытаний, которые имеют соответствующее оснащение и квалифицированный персонал, осуществляют набор и медицинское сопровождение добровольцев, их иммунизацию, проведение необходимых анализов и обработку полученных образцов. Принципиальной частью инфраструктуры клинических испытаний являются контролирующие и экспертные органы, которые осуществляют экспертизу всех этапов клинического исследования – от создания протокола клинических испытаний до приема заключительного отчета о проведенном клиническом исследовании.
В России накоплен большой опыт испытаний вакцинных препаратов, существуют соответствующие учреждения и службы, имеется нормативно-правовая база. Однако клинических испытаний вакцин против ВИЧ-инфекции/СПИДа в нашей стране ранее не проводилось. В связи с этим, важной задачей организации клинических испытаний вакцины «ВИЧРЕПОЛ» стала разработка программы испытаний, необходимой документации и методических приемов, адаптированных именно для анти-ВИЧ/СПИД-вакцин.
Это было тем более важно потому, что вакцина «ВИЧРЕПОЛ» относится к конъюгированным полимер-белковым вакцинам – новому оригинальному классу вакцинных препаратов, не имеющих аналогов в мировой практике. В процессе решения этой задачи была проведена отработка методических приемов информативного контроля экспериментальных вакцин против ВИЧ-инфекции/СПИДа, пригодных как для клинических испытаний соответствующих кандидатных препаратов, так и для их лабораторных исследований (доклинических испытаний).
Был подготовлен комплект документации, полностью соответствующий нормативным требованиям «Надлежащей клинической практики (GCP)», которая принята в Российской Федерации в качестве государственного стандарта. В комплект вошли: «Протокол клинических испытаний», «Брошюра исследователя», «Информация для добровольца», «Форма информированного согласия», «Индивидуальная карта добровольца», «CV главного исследователя», страховой полис. Документы успешно прошли экспертизу в ГИСК им. Л.А.Тарасевича Роспотребнадзора, Комитете по медицинским иммунобиологическим препаратам, Комитете по этике при Федеральном органе контроля качества лекарственных средств и были утверждены. На основании положительных решений перечисленных инстанций Федеральной службой по надзору в сфере здравоохранения и социального развития было выдано разрешение на проведение I фазы клинических испытаний вакцины «ВИЧРЕПОЛ».
В соответствии с Российскими и международными нормативными требованиями к проведению клинических исследований с участием человека в качестве субъекта исследования, в протоколе клинических испытаний был предусмотрен полный комплекс мероприятий по защите прав добровольцев, в том числе вопросы конфиденциальности участия в клинических испытаниях и медицинское страхование исследования. Особое внимание было уделено вопросу защиты добровольцев от возможных неблагоприятных последствий, связанных с временной ложной ВИЧ-положительностью (наличие антител против ВИЧ), обусловленной действием исследуемой вакцины. С этой целью в протокол клинических испытаний был включен алгоритм дифференциальной диагностики, позволяющий отличить иммунный ответ, вызываемый вакцинацией, от иммунного ответа, вызываемого ВИЧ-инфекцией. Добровольцу выдавалась справка, в которой подтверждалось его участие в клинических испытаниях, проводимых в соответствии с официальным разрешением Росздравнадзора, а также подтверждалось отсутствие у него ВИЧ-инфекции, несмотря на наличие анти-ВИЧ-антител.
Формирование когорты добровольцев
Формирование когорт добровольцев является одним из наиболее трудных и ответственных аспектов организации клинических испытаний анти-ВИЧ/СПИД-вакцин. На этапе I фазы клинических испытаний задача привлечения добровольцев осложняется низкой мотивацией здоровых ВИЧ-неинфицированных людей для участия в испытаниях анти-ВИЧ/СПИД-вакцин, а также бытующим среди подавляющего большинства населения настороженного или отрицательного отношением ко всему, что связано с ВИЧ-инфекцией, в том числе и к участию в клинических испытаниях. В связи с этим приобретала особую важность объективная информация об исследуемом препарате, положении дел в области исследования анти-ВИЧ/СПИД-вакцин, отсутствии опасности инфицирования через вакцину, а также о важности разработки вакцин для борьбы с эпидемией ВИЧ-инфекции/СПИДа. Кроме того, одним из необходимых условий включения добровольца в клинические испытания является возможность выполнения им протокола исследования, то есть регулярного посещения центра клинических испытаний в течение длительного времени (13 месяцев, 12 визитов в соответствии с «Протоколом клинических испытаний вакцины «ВИЧРЕПОЛ»).
В Российской Федерации уже была попытка формирования когорты добровольцев в связи с исследованиями в области ВИЧ-инфекции. Такая когорта была собрана в Санкт-Петербурге для эпидемиологических исследований. Однако важно отметить, что при организации клинических исследований анти-ВИЧ/СПИД-вакцин характерной и принципиально важной особенностью формирования когорт является мотивация добровольцев к участию в клинических испытаниях. Как показали зарубежные исследования и наш опыт, этот фактор существенно затрудняет привлечение добровольцев.
298 обращений
65
Отобраны как потенциальные добровольцы
18
Отказ на этапе собеседования



30
Не отказались, но по объективным причинам отложили участие в клинических испытаниях
233
ВИЧ-инфицированные, иногородние, жители стран СНГ, отказ после собеседования
17
Включены в клиническое исследование
15
Полностью завершили протокол клинических исспытаний
2
Вышли из клинических исспытаний по собственному желанию без объяснения причин

72
Согласились участвовать в клинических испытаниях терапевтической вакцины
Рис. 1. Формирование когорты добровольцев для участия в клинических испытаниях вакцины «ВИЧРЕПОЛ» (I фаза).
При формировании когорты добровольцев для клинических испытаний вакцины «ВИЧРЕПОЛ» (рис.1) только около 20% (65 человек) от общего числа обратившихся лиц (298 человек) были приглашены на собеседование. Остальные либо отказались, либо не подходили по критериям включения/исключения (например, были ВИЧ-инфицированными или по каким-либо причинам не могли выполнять протокол исследования). После личного собеседования были отобраны 17 добровольцев, которые после соответствующего медицинского обследования и подписания информированного согласия были включены в клиническое исследование. Двое участников впоследствии (после 3-го визита) вышли из исследования по собственному желанию без объяснения причин. Остальные 15 добровольцев полностью завершили протокол клинических испытаний. Таким образом, стабильность когорты составила 87%, что является высоким показателем.
30 человек, которые принципиально были готовы к участию в I фазе клинических испытаниях вакцины «ВИЧРЕПОЛ», отложили свое участие в них по объективным причинам и выразили желение принять участие в последующих клинических испытаниях. Тем самым были заложены основы формирования когорты добровольцев на перспективу – для проведения II фазы клинических испытаний вакцины «ВИЧРЕПОЛ» (разумеется, следует понимать, что к моменту набора добровольцев в клиническое исследование желание участвовать может и измениться). Наиболее эффективным оказалось привлечение добровольцев из дискордантных пар (один партнер инфицирован ВИЧ, другой – нет).
Важным аспектом формирования когорты стало исследование мотивов участия и отказа от участия в клинических испытаниях. Основной причиной (мотивом) для участия добровольцев в клинических испытаниях было стремление помочь ВИЧ-инфицированным людям (65%), в том числе из близкого окружения (41%). Далее следовало желание внести вклад в научные исследования по созданию анти-ВИЧ/СПИД-вакцин (35%). Возможность получить иммунную защиту против ВИЧ-инфекции была отмечена как основной мотив в 18% случаев. Бесплатная страховка и медицинское обследование, а также получение вознаграждения не были определяющим причинами для участия в клинических испытаниях (4%) (табл. 3).
20% (13 из 65) отказались от участия в клинических испытаниях на этапе отбора. В качестве причин отказа названы (в порядке убывания): сомнение в безопасности вакцины и опасение получить ВИЧ-инфекцию (61%), боязнь побочных эффектов (30%), опасение ложной ВИЧ-позитивности в результате вакцинации (15%), невозможность выполнять протокол испытаний (7%), низкое вознаграждение (2%). В 15% случаев причины отказа не объяснялись. 30 человек не отказались от участия в клинических испытаниях, но приняли решение включиться в них в будущем (II фаза клинических испытаний вакцины «ВИЧРЕПОЛ» или I фаза испытаний других кандидатных вакцин против ВИЧ-инфекции/СПИДа). Преимущественными причинами такого решения были планируемая беременность или временная невозможность выполнять протокол испытаний.
Табл.3. Мотивы участия и отказа от участия в клинических испытания вакцины «ВИЧРЕПОЛ».
| Мотивы участия: | Мотивы отказа: |
|
|
Некоторые ВИЧ-инфицированные добровольцы, которые не могли быть включены в клинические испытания I фазы, высказали желание принять участие в испытаниях терапевтических свойств вакцины «ВИЧРЕПОЛ». Таким образом, создается основа когорты для клинических исследований в области терапевтической вакцинации. Однако необходимо отметить, что для подобных исследований потребуется тщательная проработка критериев включения/исключения, связанная, в частности, с такими параметрами, как динамика вирусной нагрузки, состояние иммунной системы, прием антиретровирусных препаратов.
Таким образом, в процессе проведения I фазы клинических испытаний вакцины «ВИЧРЕПОЛ» была создана первая в России стабильная когорта добровольцев для клинических испытаний анти-ВИЧ/СПИД-вакцин, а также заложены основы формирования когорт добровольцев для участия в дальнейших клинических исследованиях как вакцины «ВИЧРЕПОЛ», так и других кандидатных анти-ВИЧ/СПИД-вакцин и микробицидов.
Безопасность и переносимость вакцины «ВИЧРЕПОЛ»
Основным результатом I фазы клинических испытаний вакцины «ВИЧРЕПОЛ» следует считать достижение первичной конечной точки исследования: была продемонстрирована безопасность и хорошая переносимость исследуемого препарата для человека.
В процессе проведения испытаний ни у одного добровольца не было зарегистрировано кратковременных и отсроченных неблагоприятных явлений, которые могли бы быть связаны с иммунизацией и послужить причиной вывода добровольца из клинического исследования.
Все добровольцы отмечали хорошую переносимость вакцины. Неприятных субъективных ощущений в результате вакцинации не отмечалось, за исключением небольшой болезненности в момент инъекции. Также не были отмечены такие неблагоприятные явления, как боль в месте введения вакцины, покраснение в месте введения вакцины; затвердение в месте введения вакцины, повышение температуры, озноб, тошнота, недомогание, миалгия, артралгия, головная боль, сыпь, лихорадка и др. (перечень включен в Протокол клинических испытаний).
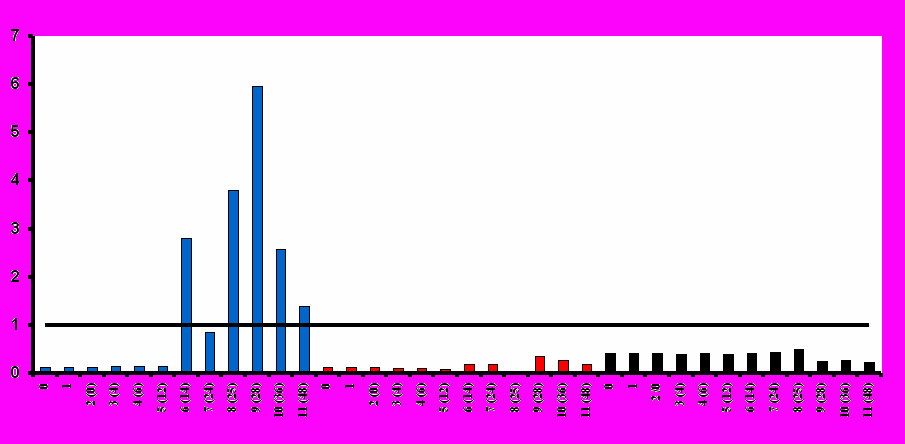
На протяжении всего срока исследования отклонения клинических лабораторных показателей от нормы обнаруживались достаточно редко (табл.4). При клиническом анализе мочи отмечено 4 случая появления оксалатов (у 2 добровольцев) и фосфатов (у 4 добровольцев). При биохимическом анализе крови у некоторых добровольцев были зафиксированы случаи транзиторного повышения уровня трансаминаз (повышение уровня АлАТ - 16 случаев у 7 добровольцев; повышение уровня АсАТ – 16 случаев у 4 добровольцев).
Выявленные отклонения не имели связи с вакцинацией, не нарастали прогрессивно в течение вакцинации и не потребовали исключения добровольцев из исследования. Важно отметить, что средние значения основных биохимических показателей безопасности (уровни креатинина в сыворотке крови, уровни трансаминаз) в каждой группе во время каждого визита соответствовали диапазону нормальных величин или же были близки к ним (рис. 2).
Табл.4. Частота зафиксированных отклонений общеклинических показателей от нормы при иммунизации добровольцев вакциной «ВИЧРЕПОЛ».
| Выявленные отклонения в общеклинических анализах | Количество отклонений от нормы / количество визитов | Процент от общего количества визитов | Число добровольцев | Процент от общего числа добровольцев |
| Повышение уровня АлАТ | 16 / 188 | 8,51% | 7 | 41,1% |
| Повышение уровня AсАT | 16 / 188 | 8,51% | 4 | 23,5% |
| Оксалатурия | 4 / 188 | 2,13% | 2 | 11,7% |
| Фосфатурия | 4 / 188 | 2,13% | 4 | 23,5% |
(а) Средние уровни креатинина
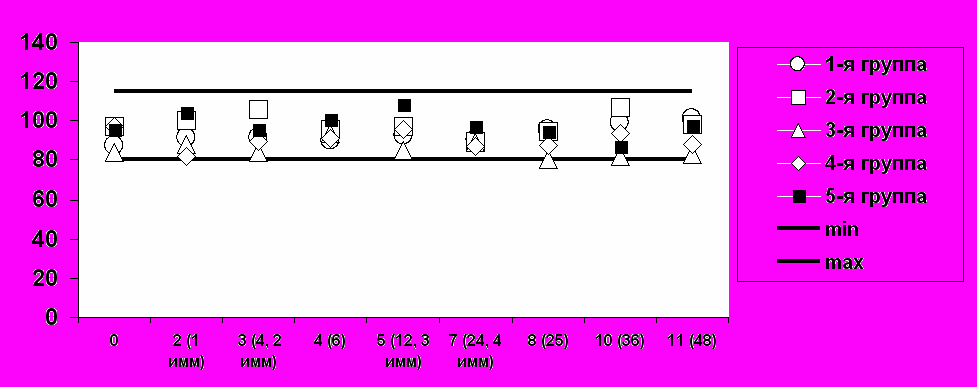
визиты / недели / иммунизация
Ммоль/л
(б) Средние уровни АлАТ
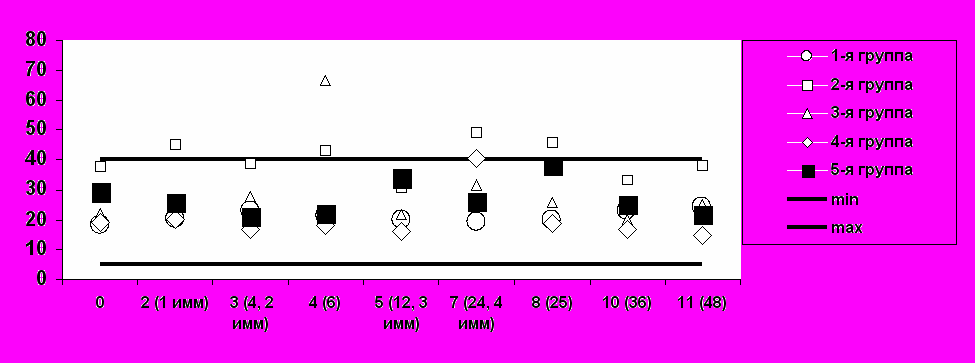
визиты / недели / иммунизация
Е/л
(в) Средние уровни АсАТ
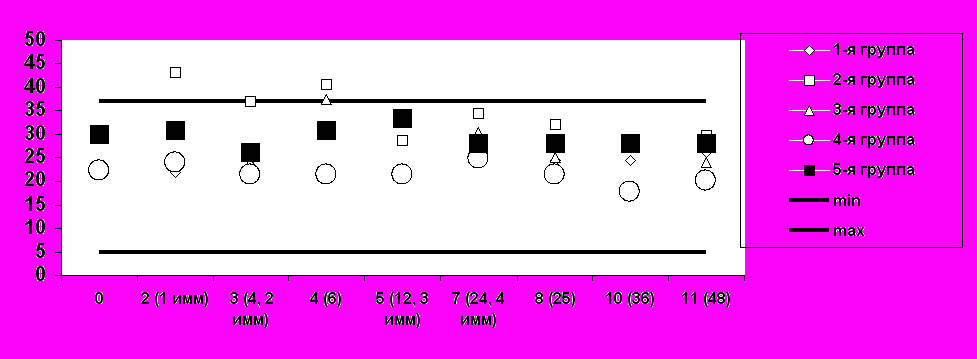
визиты / недели / иммунизация
Е/л
Рис. 2. Средние значения основных биохимических показателей безопасности при иммунизации добровольцев вакциной «ВИЧРЕПОЛ».Таким образом, вакцина «ВИЧРЕПОЛ», вводимая в дозах 2,5, 5, 10, 25 и 50 мкг по белку, обладает высоким профилем безопасности, хорошо переносится добровольцами, и ее можно характеризовать как безопасную и переносимую.
Вопросы безопасности являются первостепенно важными для вакцинных препаратов. Требования безопасности находятся в числе приоритетных и применительно к кандидатным анти-ВИЧ/СПИД-вакцинам. В этом случае подтверждение безопасности важно не только как необходимый этап клинических испытаний кандидатного препарата, но также имеет особое значение для организации клинических исследований анти-ВИЧ/СПИД-вакцин как таковых. Это связано с существующим стойким массовым представлением о том, что в состав вакцин входит ВИЧ или его компоненты, и, следовательно, существует опасность заражения добровольца через вакцину. Международные исследования показали, что причиной около 60% случаев отказа от участия в клинических испытаниях является боязнь получить ВИЧ-инфекцию через вакцинацию. В настоящем клиническом исследовании при формировании когорты добровольцев 61% случаев отказа были обусловлены этой причиной.
Демонстрация безопасности вакцины «ВИЧРЕПОЛ» была вполне ожидаемым результатом. Безопасность полиоксидония в качестве иммуностимулятора-носителя вакцинных антигенов была ранее подтверждена как в клинических исследованиях, так и многолетней практикой его медицинского применения. Безопасность этого соединения в составе вакцины была подтверждена клиническими испытаниями и практикой применения вакцины «Гриппол», которой вакцинировано уже более 80 миллионов человек. Безопасность рекомбинантных белков ВИЧ как вида антигенов, которые используются при конструировании субъединичных анти-ВИЧ/СПИД-вакцин, также была продемонстрирована в многочисленных клинических исследованиях. Безопасность и ареактогенность вакцины «ВИЧРЕПОЛ» была показана в доклинических испытаниях и подтвердилась в клинических исследованиях.
Наблюдаемая в клинических испытаниях безопасность и хорошая переносимость вакцины «ВИЧРЕПОЛ» является основой для планирования дальнейших клинических исследований этого препарата.
Иммуногенность (антигенная активность) вакцины «ВИЧРЕПОЛ»
Также важным итогом I фазы клинических испытаний является достижение вторичной конечной точки исследования: получены данные, указывающие на иммуногенность вакцины «ВИЧРЕПОЛ» у человека.
Гуморальный иммунный ответ
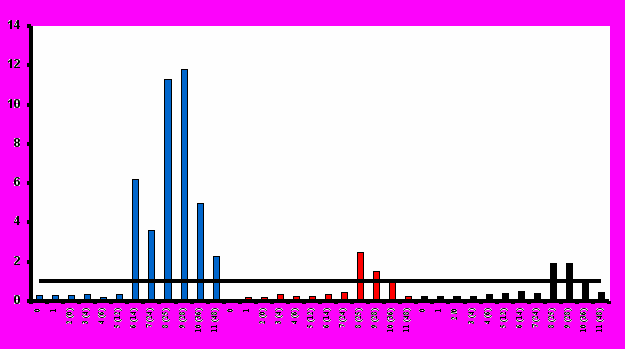
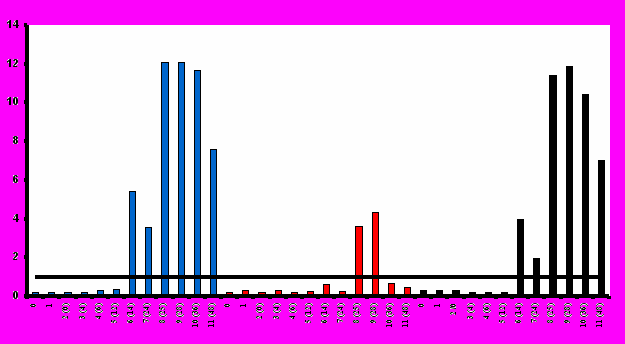
Образование антител в ответ на иммунизацию вакциной «ВИЧРЕПОЛ» в различной степени было отмечено во всех исследуемых группах (рис.3). По мере повышения дозы вакцины возрастал титр антител и увеличивалось количество добровольцев со специфическим иммунным ответом. Наиболее выраженный гуморальный иммунный ответ наблюдался после иммунизации высокими дозами вакцины (25 и 50 мкг по белку). При этом важно отметить, что значимые уровни антител были выявлены после иммунизации даже низкими дозами вакцины (2,5 и 5 мкг по белку). В ряде случаев иммунореактивность в иммуноблоте регистрировалась даже тогда, когда антитела не выявлялись в ИФА.
Иммунизация вакциной «ВИЧРЕПОЛ» приводила к индукции антител, которые были специфичны к рекомбинантным антигенам (rec(24-41), rec p24, rec gp41). Кроме того, индуцированные вакциной антитела специфически взаимодействовали с соответствующими антигенами ВИЧ (p24, p55, gp41). Максимальный уровень образования антител наблюдался после 4-й иммунизации. Антительный ответ был достаточно продолжительным и наблюдался в течение 6 месяцев после последней иммунизации.
При создании протокола иммунизации вакциной «ВИЧРЕПОЛ» был использован накопленный опыт международных клинических испытаний кандидатных анти-ВИЧ/СПИД-вакцин. В частности, как было показано ранее [Belshe et al., 1994; Gorse et, al., 1995; Graham et al., 1996, 2001], увеличивающиеся промежутки между иммунизациями приводят к более выраженному эффекту, чем частые (ежемесячные) иммунизации. При этом, если 4 последовательные иммунизации приводили к усилению иммунного ответа, 5-я иммунизация иммунный ответ не усиливала. В схеме иммунизации вакциной «ВИЧРЕПОЛ» промежуток между 1-й и 2-й иммунизациями составлял 4 недели, между 2-й и 3-й иммунизациями – 8 недель, между 3-й и 4 й иммунизациями – 12 недель.
Рис. 3. Динамика образования антител при иммунизации добровольцев различными дозами вакцины «ВИЧРЕПОЛ».
а). Группа 1 (2,5 мкг)
2.1.1
3.1.1
5.1.1
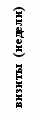
cut-off
Иммунизация
Иммунизация
Иммунизация












б). Группа 2 (5,0 мкг)
6.1.2
9.1.2
14.1.2
cut-off












Иммунизация
Иммунизация
Иммунизация
в). Группа 3 (10 мкг)
13.1.3
15.1.3
21.2.3
cut-off
Иммунизация
Иммунизация
Иммунизация












Рис. 3 (продолжение). Динамика образования антител при иммунизации добровольцев различными дозами вакцины «ВИЧРЕПОЛ».
г). Группа 4 (25 мкг)
30.1.4
20.1.4
18.1.4
cut-off












Иммунизация
Иммунизация
Иммунизация
д). Группа 5 (50 мкг)
29.1.5
26.1.5
24.1.5
cut-off
Иммунизация
Иммунизация
Иммунизация












Титры антител, индуцированных при иммунизации добровольцев вакциной «ВИЧРЕПОЛ» (среднее геометрическое титра антител, GMT, составляло 10 – 100,8) (табл.5), превышали таковые, обнаруженные в зарубежных клинических исследованиях кандидатных субъединичных анти-ВИЧ/СПИД-вакцин на основе рекомбинантных антигенов ВИЧ-1 (значение GMT составляло 11 – 32) [Keefer et al., 1996; Graham et al., 1996, 2001], или соответствовали им. Важно отметить, что наличие в составе вакцины «ВИЧРЕПОЛ» иммуностимулятора полиоксидония, химически связанного с белком-антигеном, позволяет использовать для иммунизации низкие дозы вакцины. Максимальная доза вакцины, используемая в настоящем клиническом исследовании, составляла 50 мкг по белку. Эта доза в 5-10 раз ниже тех, которые применялись в зарубежных исследованиях при иммунизации субъединичными анти-ВИЧ/СПИД-вакцинами. В частности, в III фазе клинических испытаний кандидатной вакцины AIDSVAX доза препарата составила 600 мкг (по 300 мкг каждого рекомбинантного белка), а в ряде других клинических исследований были применены дозы 500 и даже 1000 мкг [Graham, 2000]. При этом в состав кандидатных вакцин входили различные адъюванты (гидроокись алюминия, MF59 – сквален в виде водной эмульсии, QS21 – cоединение из группы сапонинов, интерлейкины, факторы роста), но ни в одном препарате адъювант не был химически соединен с антигеном.
Табл. 5. Минимальный и максимальный титры антител, индуцированных при иммунизации добровольцев вакциной “ВИЧРЕПОЛ» в ИФА для антигенов rec(24-41), rec p24 и rec gp41.
| Антиген | Титры антител (min – max) | Среднее геометрическое титра антител (GMT) (min – max) |
| rec(24-41) | 1:10 – 1:320 | 10 – 100,8 |
| rec р24 | 1:10 – 1:160 | 10 – 80 |
| rec gp41 | 1:10 | 10 |
Таким образом, вакцина «ВИЧРЕПОЛ» индуцировала образование специфических антител, взаимодействующих как с антигенами вакцины, так и с антигенами ВИЧ. Так как при этом практически не наблюдалось образования антител против антигенов ВИЧ, не входящих в состав вакцины, спектр индуцируемых антител легко позволял отдифференцировать эффект вакцинации от антителообразования, индуцируемого ВИЧ-инфекцией.
В процессе исследования образцов сывороток иммунизированных добровольцев были выявлены в основном антитела, которые связывали рекомбинантные белки rec(24-41), rec p24 (в ИФА), а также белки культурального вируса – p24 и его предшественник p55 (в иммуноблоте). Одной из задач последующих клинических исследований будет совершенствование протокола иммунизации с целью усиления образования антител против gp41.
Индукция образования антител против р24 при иммунизации вакциной «ВИЧРЕПОЛ» заслуживает специального внимания. р24-специфическому иммунному ответу придается особое значение при разработке терапевтических вакцин против ВИЧ-инфекции. Терапевтическая вакцинация представляет собой важное направление в исследованиях анти-ВИЧ/СПИД-вакцин. Основной целью терапевтической вакцинации является элиминация ВИЧ-инфицированных клеток, что приводит к уничтожению вируса в резервуарах, которые недоступны для действия антиретровирусных препаратов. Несмотря на ряд первоначальных неудач, исследования в этой области значительно расширились. В качестве терапевтических вакцинных препаратов исследуются кандидатные вакцины на основе рекомбинантных белков и пептидов, вирусные векторы и ДНК-вакцины, вакцины на основе дендритных клеток, а также препараты, содержащие инактивированный ВИЧ (например, Remune). В частности, было обнаружено, что индукция р24-специфических CD8+-Т-клеток при терапевтической иммунизации ВИЧ-инфицированных пациентов рекомбинантной анти-ВИЧ-вакциной на основе вируса оспы канареек (vCP1433) могла приводить к продолжительному сохранению низкой вирусной нагрузки после планового прерывания АРТ и существенному увеличению периода времени между курсами АРТ [Tubian et al., 2005]. Важность и перспективность исследований терапевтической вакцинации против ВИЧ-инфекции/СПИДа подчеркнул лауреат Нобелевской премии Л.Монтанье [Montagnier L., 2008].
Индукция иммунного ответа против антигена р24 свидетельствует о потенциальной возможности применения вакцины «ВИЧРЕПОЛ» в качестве иммунотерапевтического средства у ВИЧ-инфицированных пациентов. В пользу этого говорит также успешное использование полиоксидония для превенции ВИЧ-инфекции в дискордантных парах [Кузина Т.Н. и соавт., 2002, 2008; Сизякина Л.П. и соавт., 2004].
Исследование нейтрализующей активности антител, индуцированных вакциной «ВИЧРЕПОЛ»
Нейтрализующая активность образцов сывороток добровольцев, иммунизированных вакциной «ВИЧРЕПОЛ», была проверена выборочно – в 4 й и 5-й группах. В образцах сывороток добровольцев 20.1.4, 24.1.5, 26.1.5, 29.1.5 была выявлена нейтрализующая активность, которая составляла соответственно 44,4%, 26,4%, 26,0%, 29,7% при разведении сыворотки 1:10. Ранее, в доклинических исследованиях вакцины «ВИЧРЕПОЛ» было обнаружено, что сыворотки иммунизированных животных были способны нейтрализовать ВИЧ в культуре in vitro (индекс нейтрализации составил 54,9%). Одной из задач последующих клинических исследований будет совершенствование протокола иммунизации с целью усиления образования антител против gp41.
Клеточный иммунный ответ
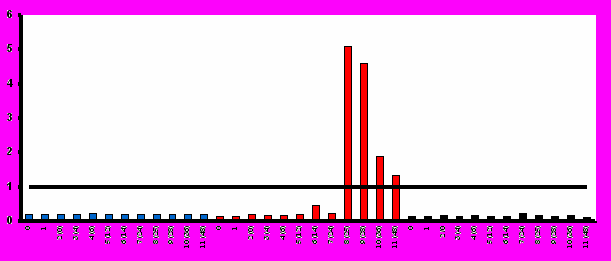
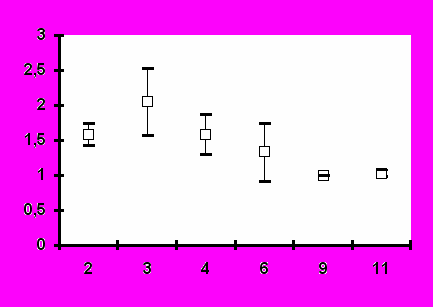
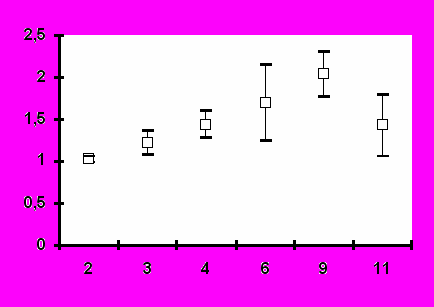
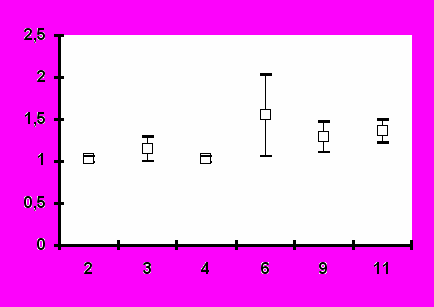
Иммунизация всеми исследованными дозами вакцины «ВИЧРЕПОЛ» не сопровождалась достоверным изменением индекса антиген-специфической пролиферации лимфоцитов периферической крови у вакцинированных добровольцев. Хотя в отдельных случаях и были выявлены относительно высокие значения индекса лимфопролиферации (3,2-3,5), в целом его значения до и после иммунизации не отличались достоверно (рис.4). Это наблюдение является важным свидетельством в пользу безопасности вакцины «ВИЧРЕПОЛ», так как чрезмерная активация пролиферации существенно увеличивает вероятность инфицирования лимфоцитов ВИЧ.
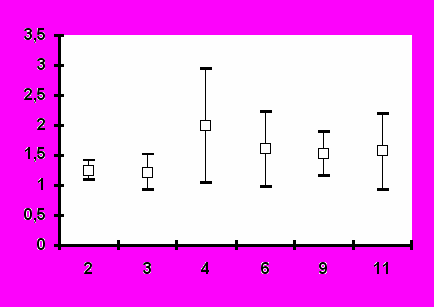
а). Группа 1 (2,5 мкг)
б). Группа 2 (5 мкг)
Визиты
Визиты
в). Группа 3 (10 мкг)
г). Группа 4 (25 мкг)
Визиты
Визиты
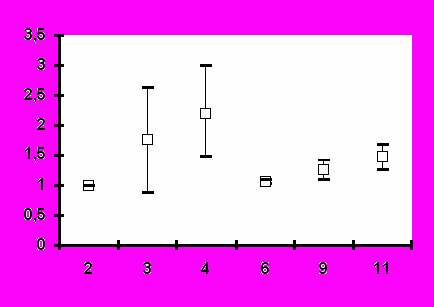
д). Группа 5 (50 мкг)
Визиты
Рис.4. Антиген-специфический лимфопролиферативный ответ при иммунизации добровольцев вакциной «ВИЧРЕПОЛ» (индекс пролиферации, M±m).
а). Группа 1 (2,5 мкг).
б). Группа 1 (2,5 мкг).
Визиты
Визиты
в). Группа 2 (5,0 мкг).
г). Группа 2 (5,0 мкг).
Визиты
Визиты
д). Группа 3 (10,0 мкг).
е). Группа 3 (10,0 мкг).
Визиты
Визиты
ж). Группа 4 (25 мкг).
з). Группа 4 (25 мкг).
Визиты
Визиты
и). Группа 5 (50 мкг).
к). Группа 5 (50 мкг).
Визиты
Визиты
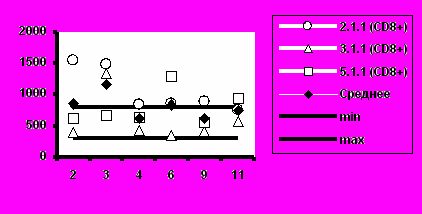
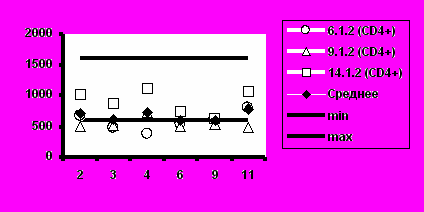
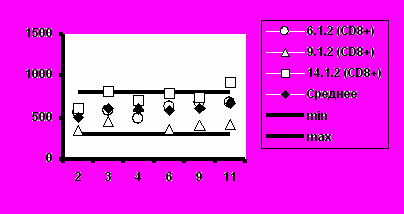
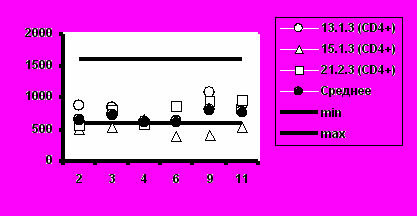
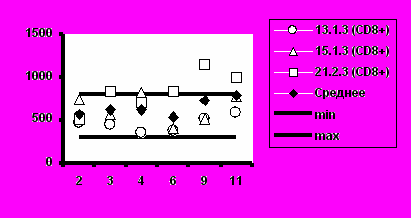
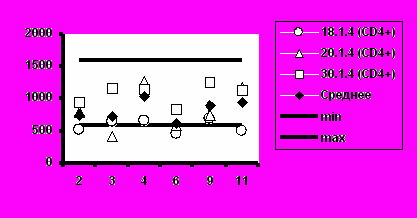
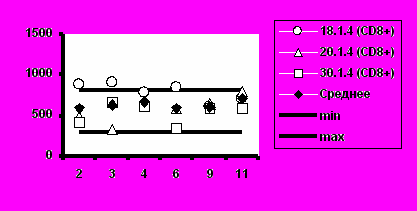
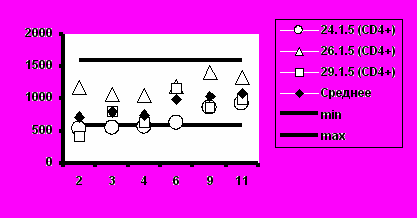
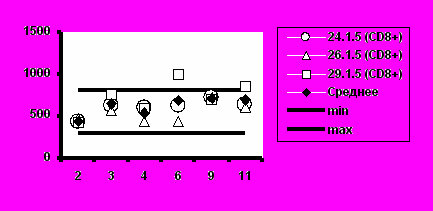
Рис. 5. Динамика абсолютного количества CD4+-Т-клеток и CD8+-Т-клеток при иммунизации добровольцев вакциной «ВИЧРЕПОЛ».
а) Группа 1 (2,5 мкг)
б) Группа 2 (5,0 мкг)
Визиты
Визиты
в) Группа 3 (10 мкг)
г) Группа 4 (25 мкг)
Визиты
Визиты
д) Группа 5 (50 мкг)
Визиты
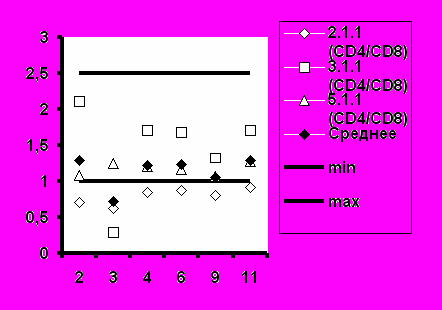
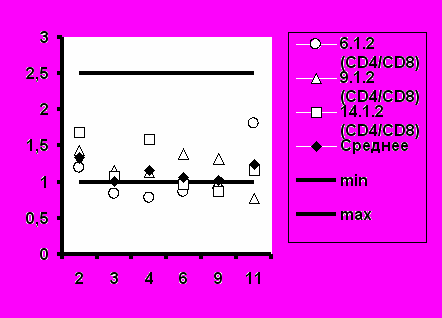
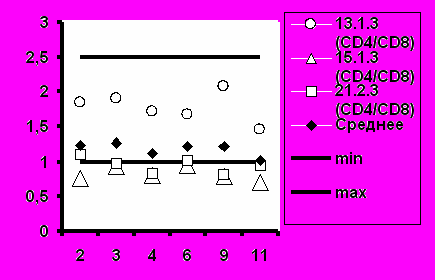
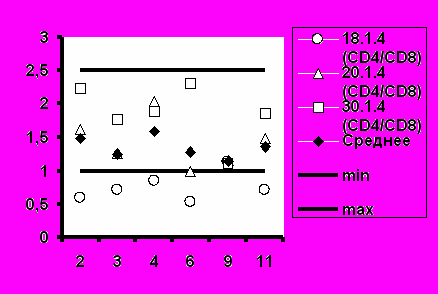
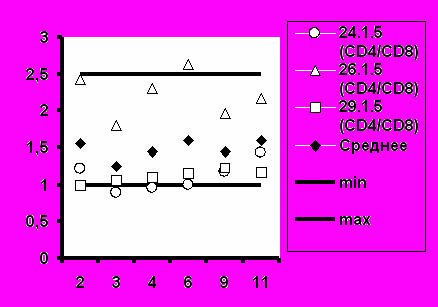
Рис.6. Соотношение CD4+/CD8+ при иммунизации добровольцев вакциной «ВИЧРЕПОЛ».
Иммунизация вакциной «ВИЧРЕПОЛ» не приводила в значимым изменениям показателей Т-клеточного иммунного ответа.
Несмотря на то, что в отдельных случаях у индивидуальных добровольцев обнаруживались отклонения абсолютного количества CD4+-Т-клеток и CD8+-Т-клеток от нормальных значений, средние уровни CD4+-Т-клеток и CD8+-Т-клеток в каждой группе соответствовали норме (рис.5).
Среднее значение иммунорегуляторного индекса (соотношение CD4+/CD8+) также соответствовало диапазону нормальных значений во всех группах добровольцев (рис.6).
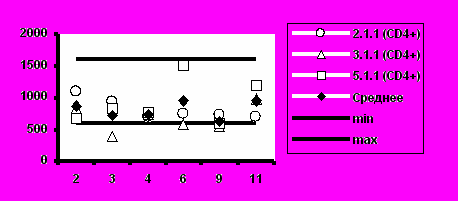
В периферической крови иммунизированных добровольцев не было выявлено антиген-специфических ИФН-γ-продуцирующих клеток.
Оценка количества CD4+-Т-клеток является стандартным тестом для прогнозирования прогрессии ВИЧ-инфекции в СПИД, для формулировки дифференциального диагноза у симптоматического пациента, а также для принятия решения о применении антиретровирусной терапии и профилактике оппортунистических инфекций (патогенов). Этот параметр считается наиболее надежным индикатором для прогноза развития заболевания. Определение количества CD4+-Т-клеток и CD8+-Т-клеток также важно для оценки иммунного ответа, индуцируемого кандидатными вакцинами.
Опыт клинических испытаний кандидатных анти-ВИЧ/СПИД-вакцин, стимулирующих Т-клеточный иммунный ответ, показал, что индуцированное вакциной возрастание количества Т-клеток, в том числе и CD4+-Т-клеток, может являться серьезным фактором риска ВИЧ-инфекции у вакцинированных добровольцев, так как создается потенциальный резервуар для вируса. Как было обнаружено в клиническом исследовании HVTN 502/Merck 023 («STEP»), количество ВИЧ-инфицированных в группе реципиентов кандидатной вакцины MRK-Ad5 было выше, чем в группе реципиентов плацебо. В качестве одной из причин такого результата эксперты рассматривают повышение уровня CD4+-Т-клеток у иммунизированных добровольцев, которые имели предсуществующий иммунитет против аденовируса (рекомбинантный аденовирус серотипа 5 является вектором в кандидатной вакцине MRK-Ad5). По мере анализа материалов, собранных в процессе клинического исследования «STEP», накапливаются все новые данные в пользу этого предположения.
Вслед за остановкой клинических испытаний кандидатной вакцины MRK Ad5 было остановлено еще несколько действующих и запланированных испытаний кандидатных вакцин, предназначенных для индукции клеточноопосредованного иммунного ответа, в том числе клиническое исследование PAVE 100 (фаза II b), к участию в котором предполагалось привлечь 8500 добровольцев.
На международной конференции «AIDS Vaccine 2008» (13-17 октября 2008 г., Кейптаун, ЮАР), которая была организована под эгидой Global HIV Vaccine Enterprise, активно обсуждался вопрос о необходимости с особой осторожностью подходить к клиническим испытаниям анти-ВИЧ/СПИД-вакцин, ожидаемым эффектом которых является системная индукция ВИЧ-специфических Т-клеток. Некоторые исследователи даже ставили под сомнение целесообразность дальнейшей разработки таких кандидатных вакцин. В этой связи данные о том, что вакцина «ВИЧРЕПОЛ» не вызывала существенных изменений показателей клеточного иммунитета, могут являться важной дополнительной характеристикой безопасности этого препарата с точки зрения отсутствия риска повышения восприимчивости иммунизированных добровольцев к ВИЧ-инфекции.
