Желудочно кишечного тракта
| Вид материала | Автореферат |
- Классификация заболеваний желудочно – кишечного тракта, 81.44kb.
- Возможности эндоскопических методов исследования в ранней диагностике онкологических, 42.3kb.
- Исследование микробиоценоза желудочно-кишечного тракта перепелов на фоне применения, 56.33kb.
- Клиническая эффективность препарата лактофильтрум у больных с хроническими заболеваниями, 106.11kb.
- Клиническое значение оценки цитокинового статуса у больных функциональными заболеваниями, 297.09kb.
- - синдромы общего свойства, 558.6kb.
- С. С. Шестопалов, О. Ю. Кушниренко kushn@rambler, 1030.51kb.
- Зубарев Ю. Г. Психология больного, 48.36kb.
- Заболеванием 50% всех заболеваний, 1620.28kb.
- Г. Р. Хасанова общая характеристика работы, 959.74kb.
Инфицированность компрессионных анастомозов с третьих суток после операции была достоверно ниже по сравнению с ручными (р<0,001) и механическими соустьями (р≤0,001) (Табл. 1 ).
Таблица 1.
Инфицированность толстокишечных анастомозов
в различные сроки после операции (Mр±mр)
| Сроки наблюдения (сут.) | Лигатурные анастомозы | Механические анастомозы | Компрессионные анастомозы | |
| 1 (n=48) | 77,08±6,07% | 54,16±7,11% | 52,03±7,21% | |
| 3-5 (n=96) | 87,5±3,37% | 61,45±4,96%. | 33,33±4,81%* # | |
| 7-10(n=96) | 38,54±4,96% | 28,12±4,38% | 11,45±3,24%* # | |
| Примечание: n – количество бак. посевов, выполненных на различные питательные среды; * – достоверно отличающиеся показатели (р<0,001) по сравнению с ручными соустьями; # – достоверно отличающиеся показатели (р≤0,001) по сравнению с механическими анастомозами | ||||
В первые сутки показатели инфицированности толстокишечных анастомозов статистически значимо не отличались друг от друга. Наиболее показательными были результаты исследования на 3-5-е сутки после операции. В лигатурных и механических соустьях в эти сроки отмечалось повышение инфицированности линии шва, обусловленное проникновением кишечной микрофлоры по раневым каналам, образованным шовными лигатурами или металлическими скрепками. В компрессионных соустьях в эти сроки происходило снижение инфицированности шва, что объяснялось минимальной травматизацией кишечной стенки, отсутствием инородных включений в стенке кишки, поддерживающих воспалительную реакцию и способствующих проникновению микрофлоры в брюшную полость.
Микробная обсемененность компрессионных швов во все сроки наблюдения была достоверно ниже (р<0,001) по сравнению с лигатурными и механическими соустьями (Табл. 2). В первые сутки послеоперационного периода более высокие показатели биологической герметичности компрессионного шва были связаны с минимальным инфицированием брюшной полости при выполнении операции.
Таблица 2.
Количество колоний микроорганизмов, высеваемых с линии
толстокишечных анастомозов, в различные сроки после операции (M±m), тыс.
-
Сроки наблюдения
(сут.)
Лигатурные анастомозы
Механические анастомозы
Компрессионные анастомозы
1 (n=6)
642,1±36,3
534,5±21,7
86,3±2,5 *#
3-5 (n=12)
99,2±2,1
92,3±2,4
5,8±0,14 *#
7-10 (n=12)
0,35±0,01
0,26±0,008
0,021±0,001 *#
Примечание: n – количество проб, взятых с линии анастомоза; *– достоверно отличающиеся показатели (р<0,001) по сравнению с ручными соустьями; # – достоверно отличающиеся показатели (р<0,001) по сравнению с механическими анастомозами.
В отличии от открытых способов восстановления непрерывности кишечника, просвет толстой кишки вскрывался лишь на этапе внедрения компрессионного устройства, что значительно снижало инфицирование брюшной полости и повышало асептичность вмешательства. Начиная с 3 - х суток микробная обсемененность анастомозов была связана с проникновением кишечной микрофлоры по раневым каналам, образованным шовными лигатурами или металлическими скрепками. В компрессионных соустьях проникновение кишечной микрофлоры было возможным только через ручную порцию анастомоза, которая составляла 15% от периметра соустья, вследствие чего бактериальная обсемененность «бесшовных» соустий и в последующие сроки наблюдения оставалась достоверно более низкой (р<0,001).
Изучение результатов рентгеновазографии при формировании толстокишечных анастомозов выявило, что при лигатурном способе образуется четко выраженная безсосудистая зона. Ткани инъецированы свинцовым суриком неравномерно, валик анастомоза в пределах 2 – 5 мм совершенно не прокрашивается, сосуды короткие, извитые, прерывистые. В компрессионном анастомозе сосуды прокрашены хорошо, непосредственно примыкают к компрессионному устройству практически по всему периметру анастомоза, краска заполняет даже мелкие сосуды на противобрыжеечном крае.
Сравнительный анализ изученного материала выявил, что независимо от уровня наложения анастомоза в желудочно-кишечном тракте, а также модификации компрессионного устройства, вида лигатурного или механического шва послеоперационный период после наложения анастомоза можно рассматривать как восстановительный период, при котором развиваются стандартные, последовательные изменения, характеризующиеся стадийностью и временной протяженностью. Они проявляются чередованием патологических, регенераторных и компенсаторных процессов. Однотипность развития изменений в восстановительном периоде позволяет уточнить периодизацию восстановительных изменений и выявить особенности морфогенеза каждого из видов анастомозов.
На основании морфологической картины выделено четыре стадии морфогенеза анастомозов. В основу периодизации положено представление о воспалительно-репаративной реакции, подразумевающей единство воспалительного и собственно репаративного компонентов, представляющих собой компенсаторно-приспособительный процесс адаптации тканей к изменившимся условиям (В.В. Серов, А.Б. Шехтер, 1981).
Первая стадия- сдавление и адаптация тканей – характеризуется развитием острой воспалительной реакции в области соустья. При компрессионных анастомозах индуцируется ранняя, короткая по времени воспалительная реакция, приводящая к ускорению процессов репаративной регенерации. В воспалительном инфильтрате происходит смена клеточных популяций, свидетельствующая о переходе пролиферативной фазы воспаления в продуктивную. Восстанавливается баланс между процессами утилизации и синтеза внеклеточного матрикса, формируется базальная мембрана, развивается краевая миграция эпителия с неповрежденных участков, индуцируется ангиогенез, миграция и пролиферация фибробластов, образуется грануляционная ткань. К концу этой стадии острое экссудативное воспаление переходит в подострое, начинается развитие регенераторных процессов.
Особенностью ручных анастомозов является сохранение воспалительной реакции, способствующей дальнейшей деструкции, замедлению реэпителизации и избыточному формированию грануляционной ткани. При лигатурных анастомозах развивается выраженная макрофагальная реакция, свидетельствующая о наличии хронического гранулематозного воспаления. В ранние сроки воспалительного процесса макрофаги встречаются в формирующейся соединительной ткани, а в более поздние сроки они фиксированы на шовных нитях. Наличие и увеличение контактов между макрофагами и лимфоцитами свидетельствует об антигенной стимуляции макрофагов.
Электронномикроскопические исследования выявили, что за счет формирования лигатурных каналов и фитильных свойств нитей в глубине тканей на 14-е сут после операции сохраняется кокковая микрофлора, лимфоциты, макрофаги, свидетельствующие о сохранении воспалительных изменений. Изучение микробной обсемененности толстокишечных анастомозов показало, что при ручных и механических анастомозах она была существенно выше во все исследуемые периоды по сравнению с компрессионными.
Морфологические проявления этой стадии зависят, прежде всего, от способа наложения анастомоза. Независимо от уровня формирования соустья в желудочно-кишечном тракте, во всех ручных анастомозах характерным является развитие большого язвенного дефекта, наличие диастаза анастомозируемых органов, фибринозно-гнойный характер экссудата, выраженные нарушения кровообращения.
Особенностью механических анастомозов толстого кишечника является формирование обширного язвенного дефекта, нечеткие границы раневого канала, выраженные дистрофические изменения в краях.
При тонко - толстокишечных компрессионных анастомозах, выполненных аппаратами УКА, АКШ образуется незначительный язвенный дефект, выраженные нарушения кровообращения, экссудат имеет преимущественно фибринозный характер.
В компрессионных и механических анастомозах эта стадия продолжается до 7-х сут, при лигатурных анастомозах удлиняется до 14 сут.
Вторая стадия - восстановительные изменения - характеризуется реэпителизацией зоны анастомоза и формированием первичного соединительнотканного рубца. Заживление зоны анастомоза развивается за счет сочетания регенерации паренхиматозных клеток и замещения дефекта рубцеванием. Только при компрессионных анастомозах в условиях кратковременно выраженного воспаления процесс регенерации эпителия и соединительной ткани развивается синхронно, отмечается ускоренная эпителизация зоны анастомоза, нормализуется соотношение компонентов внеклеточного матрикса, в короткие сроки формируется первичный соединительнотканный рубец.
При заживлении ручных и механических анастомозов возникают отклонения в ходе развития воспалительно – репаративной реакции, обусловленные переходом острого воспаления в хроническое гранулематозное. Это способствует замедлению реэпителизации, удлинению сроков формирования первичного соединительнотканного рубца, качественным и количественным особенностям формирующейся соединительной ткани.
Переход воспаления в подострое запускает важнейший процесс, характерный для восстановительного периода – репаративную регенерацию. Регенерация – комплексный процесс, охватывающий всю совокупность тканей органа. Пролиферация, дифференцировка эпителия тесно связаны с развитием соединительной ткани.
Рост эпителия происходит с одновременным очищением язвенного дефекта от некротических масс и образованием грануляционной ткани. Специально подготовленной поверхностью для пролиферации и дифференцировки эпителия служит грануляционная или рубцовая ткань, формирующая необходимый каркас и участвующая в кровоснабжении растущей ткани. Очень большая роль принадлежит базальной мембране - специализированной разновидности внеклеточного матрикса, составляющей основу развития предсуществующих структур, способствующей восстановлению полярной ориентации и послойного распределения эпителия. Основным компонентом, в значительной степени интегрирующим остальные биохимические элементы базальной мембраны, является коллаген IY типа.
Пролиферация эпителиоцитов начинается в краях раневого канала, новообразованный эпителий подрастает под фибринозно-гнойный экссудат и стелется по язвенной поверхности. За счет краевой миграции эпителиальных клеток формируются тяжи, которые образуют компоненты базальной мембраны. При этом воспаление достаточно выражено, особенно в глубине тканей. При компрессионном анастомозе создаются благоприятные условия для миграции эпителиоцитов, так как базальная мембрана слизистой оболочки обнажается. При ручных анастомозах этот процесс затруднен из – за большей выраженности деструктивных изменений и нарушения микроциркуляции.
Закрытие язвенного дефекта является очень важным этапом восстановительного периода, препятствуя дальнейшему инфицированию глубоких слоев анастомоза, создавая условия для нормального чередования стадий воспалительного процесса. При компрессионных и механических анастомозах пролиферация эпителия выявлена уже на 5-е сут.
Трансмиссионная электронная микроскопия позволила уточнить особенности регенерации железистого эпителия толстой кишки. Для кишечного эпителия характерна клеточная форма регенерации, проявляющаяся размножением железистого эпителия. Новообразованные эпителиальные клетки характеризуются незрелостью. Первоначально происходит активизация кроющей функции эпителия, играющей важную роль на ранних стадиях заживления дефекта. Иммуногистохимическое исследование, выявило повышение до 70% индекса пролиферации, определяемого по Ki -67, в однорядном эпителии, закрывающем язвенный дефект. Одновременно с этим в проксимальных отделах заживающего дефекта еще до развития полной эпителизации происходит инвагинация эпителия в подлежащую грануляционную ткань с формированием примитивных крипт. Они выглядят как замкнутые мешотчатые структуры, имеющие уплощенные полости. Их стенки образованы эпителиоцитами уменьшенных размеров, сходными с цилиндрическими клетками базальных отделов железистых крипт толстой кишки. Эпителиальные клетки в ацинарных структурах характеризуются многорядностью, как в пролиферирующих криптах. Индекс пролиферации эпителиальных клеток в примитивных криптах составляет 90%. Источником восстановления колоноцитов являются эпителиальные клетки сохраненных железистых крипт в краях анастомоза. Гермитативная зона в толстой кишке занимает нижнюю и среднюю треть крипт. Мелкие цилиндрические клетки базального отдела в восходящей ободочной кишке относятся к коммитированным клеткам, популяция которых постоянно поддерживается в недифференцированном состоянии и имеет неограниченную способность к делению. В наших исследованиях индекс пролиферации эпителиальных клеток в области нижней и средней трети железистых крипт составляет 40%. Часть этих клеток постепенно мигрирует к устью крипты, дифференцируясь в типичные цилиндрические клетки, микроворсинки которых образуют щеточную каемку. Между зонами пролиферирующих и дифференцированных клеток четкой границы нет. Количество бокаловидных клеток в криптах постепенно увеличивается. Повышенное слизеобразование способствует усилению защитной функции новообразованной эпителиальной выстилки, защищая ее от действия химических, механических и бактериальных факторов, так как антибактериальный барьер (лимфо-плазмоцитарный слой) еще не восстановлен. В ворсинках и железистых криптах происходит восстановление основных клеточных популяций, характерных для разных отделов кишечника.
Несмотря на развитие полной эпителизации язвенного дефекта, воспалительные изменения в слизистой оболочке сохраняются. В соединительной ткани собственной пластинки слизистой оболочки между криптами выявляется умеренный отек и скопления макрофагов, лимфоцитов и плазматических клеток, особенно в зоне разрушенной мышечной пластинки
Только при компрессионных анастомозах в условиях кратковременно выраженного воспаления процесс регенерации эпителия и соединительной ткани развивается синхронно. При ручных и механических анастомозах большой объем повреждения, шовный и скрепочный материал поддерживают воспалительный процесс, тормозят реэпителизацию. При компрессионных анастомозах полная эпителизация развивается к 14-м сут послеоперационного периода, при ручных - к 21 сут, при механических анастомозах толстого кишечника – к 30 сут.
Особенностью заживления пищеводно - кишечных анастомозов является избыточная регенерация эпителия пищевода, нарастающего на пролиферирующий кишечный эпителий. При заживлении тонко-толстокишечных анастомозов реэпителизация осуществляется за счет пролиферации эпителия обоих типов.
Вторым компонентом паренхиматозно – стромальной системы является формирование грануляционной ткани, осуществляющей фиксацию между собой резецированных органов за счет формирования соединительнотканного рубца. Динамика формирования и степень выраженности развития соединительнотканного рубца является очень важным показателем надежности, прочности и анатомо - функциональной полноценности сформированного соустья.
Развитие соединительной ткани характеризуется стадийным течением: созреванием, стабилизацией, реорганизацией и инволюцией рубца. В основе этих процессов лежит ангиогенез, миграция, ускоренная пролиферация и дифференцировка фибробластов, синтез и секреция коллагена и других компонентов внеклеточного матрикса, формирование специфической конформации коллагеновых волокон, созревание и реорганизация соединительной ткани.
В этой стадии морфогенеза развивается первичный соединительнотканный рубец, который характеризуется незрелостью соединительной ткани, большими размерами, рыхлой консистенцией. Большое значение имеет синхронное развитие процессов пролиферации эпителия, формирования и созревания грануляционной ткани.
Критериями нормального процесса формирования соединительнотканного рубца являются: срок появления грануляционной ткани и показатель механической прочности анастомоза. Эти критерии находятся в прямой зависимости. В грануляционной ткани выявлены юные фибробласты, которые впоследствии дифференцируются в зрелые формы, они растут в виде клеточных тяжей, сопровождающих капилляры грануляционной ткани. Проведенное морфометрическое исследование выявило, что рубец начинает формироваться с 5-х – 7-х сут послеоперационного периода. В компрессионном анастомозе этот процесс достаточно выражен, при ручном – резко угнетен. С момента формирования грануляционной ткани (5-е – 7-е сут) механическая прочность швов, особенно компрессионного, начинает нарастать.
В компрессионных анастомозах образование соединительнотканного рубца протекает стандартно. В лигатурных и механических анастомозах в условиях хронического гранулематозного воспаления, развивающегося за счет персистенции повреждающего фактора, процесс формирования первичного соединительнотканного рубца нарушается. Гранулемы, формирующиеся вокруг шовных нитей, состоят из макрофагов и лимфоцитов, последние часто окружают центрально расположенный макрофаг, содержащий антиген, и образуют с ним цитоплазматические мостики. Вокруг макрофага может скапливаться до 20 лимфоцитов с образованием гроздьев. Образование тандема макрофаг - лимфоциты предшествует пролиферации лимфоцитов, обеспечивая иммунный ответ (И.Я. Учитель, 1978), отражает наличие специфических антигенных стимулов.
Макрофаги, активированные медиаторами Т-лимфоцитов, выделяют фиброгенные цитокины, способствующие переходу воспаления из пролиферативной фазы в продуктивную, характеризующуюся синтезом коллагена (А.В. Кононов, 1993; О.П. Попова и соавт, 2006; М.А. Пальцев и соавт, 2002). При хроническом воспалении, поддерживаемом антигенными свойствами шовных нитей, этот процесс пролонгируется. Длительное сохранение макрофагальной фазы воспалительного ответа поддерживает пролиферацию фибробластов и синтез внеклеточного матрикса, вызывая избыточное разрастание соединительной ткани.
При компрессионных анастомозах выявлена ранняя и выраженная лимфоцитарная инфильтрация. Она носит кратковременный характер, что свидетельствует о благоприятном течении воспалительно – репаративного процесса.
В составе соединительнотканного рубца выявлена разновидность зрелых фибробластов – коллагенобласты, которые на 7-е сут составляют основную массу клеток созревающей ткани, активность Ki - 67 в них снижена, что свидетельствует об их неспособности к делению. Они имеют звездчатую структуру, которая образуется за счет того, что от веретенообразного тела отходят множественные отростки.
Созревание соединительнотканного рубца характеризуется формированием макрофагально - фибробластических контактов, которые регулируют рост соединительной ткани в условиях патологии (В.В. Серов, В.С. Пауков, 1995). Высокая фагоцитарная активность макрофагов приводит к активной перестройке волокнистого остова формирующегося рубца. Этот процесс характеризуется реорганизацией соединительной ткани, проявляющейся упорядочением расположения коллагеновых фибрилл, перекалибровкой кровеносных сосудов. При сканирующей электронной микроскопии выявлено, что основная масса соединительнотканного рубца образована толстыми зрелыми, спиралевидно скрученными коллагеновыми волокнами с широкими межволоконными пространствами.
Удлинение сроков формирования первичного соединительнотканного рубца при ручных анастомозах происходит по нескольким причинам: а) переход острого воспаления в хроническое гранулематозное с формированием гранулем инородных тел; б) наличие лигатурных каналов, способствующих проникновению микрофлоры в стенку; в) фитильные свойства нитей; г) фрагменты мышечных волокон, «затянутые» в рубец. Имплантация в рубец мышечных волокон характерна также для механических анастомозов и тонко-толстокишечных анастомозов, выполненных АКА. Края мышечной оболочки в зоне резекции неровные, имеют волнообразный вид, при наложении АКА - разволокнены. Мышечные фрагменты подвергаются дистрофическим изменениям и постепенно организуются. Наличие в рубце мышечных фрагментов способствует увеличению размеров соустья, тормозит формирование первичного композита. Наиболее интенсивно этот процесс развивается при лигатурных анастомозах, так как хроническое воспаление задерживает процесс организации мышечных включений.
Первичный рубец при лигатурных, механических анастомозах и анастомозах, выполненных АКА, характеризуется неодинаковой степенью зрелости. Вначале рубец формируется в подслизистой оболочке, в мышечной оболочке он развивается медленнее и характеризуется меньшей степенью зрелости. Наличие патологических включений поддерживает пролиферацию соединительнотканного компонента, препятствуя созреванию соединительной ткани.
При компрессионных анастомозах протяженность стадии до 14 - ти сут, при ручных - до 21 - х сут, при механических анастомозах толстого кишечника – до 30 - х сут.
Третья стадия – завершение формирования соединительнотканного рубца и детерминированная дифференцировка эпителия. В эту стадию сохраняются паренхиматозно – стромальные взаимоотношения, формируется окончательный соединительнотканный рубец. Эпителиальный пласт приобретает обычную структуру, нормальную толщину, а дифференцировка клеток приближается к уровню архитектоники зрелых эпителиоцитов. Образуются основные типы коллагенов, формируется специфическая архитектоника соединительной ткани, развивается её перестройка в рубец. Характеристика рубца на этой стадии многими исследователями считалась окончательной и достаточной для функционирования анастомоза. Удлинение в эксперименте сроков наблюдения за животными в послеоперационный период показало, что эта стадия не является дефинитивной, и морфогенез анастомозов еще не завершен.
Объем восстановительных изменений в эпителиальном пласте проявляется восстановлением исходной толщины слизистой оболочки, нормализацией соотношения стромы и железистого компонента выстилки, увеличением количества бокаловидных клеток в новообразованных криптах. Большое значение для усиления антибактериальной активности реэпителизированного участка имеет восстановление лимфо - плазмоцитарного слоя слизистой оболочки. Лимфоциты и плазматические клетки образуют вторую «линию обороны», направленную против бактерий и других антигенов, проникших в ткани через эпителиальный барьер.
Наиболее полно процесс дифференцировки и созревания эпителиальных клеток развивается при компрессионных анастомозах и заканчивается к 45 сут. В пищеводно - кишечных и пищеводно - желудочных анастомозах секреторные железы слизистой оболочки пищевода хорошо развиты. Это имеет большое значение не только для защиты её от повреждающего действия желудочного сока, но и для нормального течения репаративного процесса.
При заживлении тонко - толстокишечных анастомозов отмечается более ранняя дифференцировка тонкокишечного эпителия. Особенностью ручных и механических толстокишечных анастомозов является повторное развитие некрозов слизистой и подслизистой оболочек вследствие секвестрации шовного и скрепочного материалов, выявляемое до 90-х сут, что поддерживает пролиферацию эпителия и тормозит его созревание. Отсутствие полноценного контакта с мезенхимой затрудняет дифференцировку колоноцитов (Л.И. Аруин, 1987). Это проявляется меньшей степенью дифференцировки новообразованного эпителиального пласта, преобладанием стромы над железистым компонентом.
Паренхиматозно - стромальное взаимодействие имеет важнейшее значение для успешного завершения воспалительно - репаративного процесса. Эпителиальные клетки продуцируют коллагеназу, а стромальные клетки - фибробласты, макрофаги, лимфоциты секретируют факторы ингибирования регенерации эпителиальной и мышечной ткани (В.П. Казначеев, 1978).
Завершение формирования соединительнотканного рубца сопровождается ремоделированием соединительной ткани, рассасыванием избыточного количества коллагеновых волокон и уменьшением ширины сформированного рубца. Ремоделяция и инволюция соединительной ткани характеризуется расщеплением коллагеназами и протеазами избыточных коллагеновых волокон, ингибированием синтеза и секреции коллагена, формированием специализированной архитектоники соединительной ткани в зависимости от ее предназначения (В.В. Серов, 1995). При хроническом воспалении индукция коллагеногенеза преобладает над ингибицией, способствуя прогрессированию склероза, то есть биосинтез коллагена превышает скорость биодеградации.
Коллагеновые волокна в рубце имеют упорядоченное направление, что проявляется их типичным расположением, кислые гликозаминогликаны отсутствуют, свидетельствуя о завершении дифференцировки рубца. В соединительнотканном рубце выявлен волоконно – фибриллярный тип строения, соответствующий выполнению механической функции. что отражает механическую анизотропию. В подслизистой и серозной оболочках коллагеновые волокна лежат продольно, в мышечной – поперечно, что свидетельствует о том, что коллагеновые волокна и пучки волокон правильно ориентированы вдоль линий напряжения, связанных с механическими нагрузками. В компрессионном анастомозе промежутки между волокнами незначительные, что характерно для зрелой плотной соединительной ткани. В ручных и механических анастомозах новообразованная соединительная ткань более рыхлая, что характерно для незрелой соединительной ткани. При формировании анастомозов «конец в конец» рубец приобретает Х-образный вид, при наложении инвагинационных тонко-толстокишечных анастомозов «конец в бок» рубец имеет П-образный вид. Восстановление количественного соотношения, способа взаимодействия коллагеновых и эластических волокон, их пространственной архитектоники способствует усилению упругодеформативных и прочностных свойств соединительнотканного рубца.
Электронномикроскопически выявлено, что новообразованная соединительная ткань в зоне анастомоза характеризуется типичным спиралевидным скручиванием фибрилл в волокне и в пучке, ограничивая скольжение составных элементов фибриллярного каркаса при натяжении, обеспечивая максимальную прочность. Извитые коллагеновые волокна дают возможность растяжения ткани без растяжения коллагеновых волокон, ограничивая напряжение, способствующее деформации рыхлой соединительной ткани. (А. Хэм, Д. Кормак, 1982). Это свойство особенно важно при заживлении лигатурного и механического анастомозов, так как образовавшийся соединительнотканный рубец широкий и должен обеспечить механическую прочность и пластичность зоны анастомоза.
Полученные при сканирующей электронной микроскопии данные уточнили особенности строения соединительной ткани, позволили идентифицировать типы коллагена. Известно, что большинство видов соединительной ткани состоят, в основном, из коллагена I и III типов с различным присутствием коллагенов Y и YI типов. Сравнивая данные литературы с собственными исследованиями, можно считать, что коллагену I типа соответствуют зрелые, толстые коллагеновые волокна, образующие слоистую структуру. Коллагену III типа соответствуют длинные цилиндрические тонкие нити, хаотично вплетающиеся между слоями толстых коллагеновых волокон. Коллагенам Y и YI типов соответствуют очень тонкие нити, которые в виде сети сверху покрывают коллагеновые волокна, образованные I и III типами. Коллаген IY типа выявляется в составе базальных мембран. Формирующаяся специфическая конформация спиральных коллагеновых волокон, поддерживаемая специальной системой тонких связывающих коллагеновых волоконец, оплетающих более толстые коллагеновые волокна, расположенные между ними, обеспечивает архитектонику соединительной ткани.
Проведенные исследования выявили, что соединительнотканный рубец при компрессионном анастомозе образован зрелой соединительной тканью и состоит преимущественно из коллагена I типа с небольшой частью коллагена III типа и незначительным количеством коллагенов Y и YI типов.
Заживление ручного анастомоза развивается в условиях хронического гранулематозного воспаления и характеризуется развитием избыточного фиброза. Соединительнотканный рубец образован недостаточно зрелой соединительной тканью, состоящей из коллагена I, III, Y и YI типов. Соединительнотканная капсула вокруг шовных нитей образована коллагенами I и III типов с примесью коллагенов Y и YI типов. Большое количество коллагена III, Y и YI типов свидетельствует о продолжающемся процессе новообразования соединительной ткани (А.И. Струков и соавт, 1990). Хроническое воспаление способствует нарушению стандартного процесса созревания соединительной ткани, удлиняя фазу созревания грануляционной ткани и фиброза, задерживая развитие стадии реорганизации и инволюции рубца.
При заживлении анастомозов развивается заместительный склероз, в основе которого лежит восстановление нормальных паренхиматозно - стромальных взаимоотношений. При разрешении острого воспаления происходит остановка роста соединительной ткани, ее ремоделяция, а впоследствии - полная или частичная инволюция рубца. При хроническом воспалительном процессе нарушается созревание соединительной ткани, так как нет стимула к прекращению роста.
Считаем целесообразным применить к заживлению зоны анастомоза принцип заживления ран. Р.В. Зиганьшин и соавт. (1990) считают, что компрессионные анастомозы заживают первичным натяжением, а ручные - вторичным. Проведенные исследования убедительно свидетельствуют, что заживление послеоперационных ран при выполнении анастомозов желудочно – кишечного тракта протекает в условиях воспаления. Поэтому понятие «заживление первичным натяжением» или «заживление типа первичного натяжения» здесь использовать нельзя, так как таким образом заживают неинфицированные хирургические разрезы, соединенные с помощью хирургического шва (М.А. Пальцев и соавт., 2002).
При заживлении всех видов анастомозов заживление развивается вторичным натяжением, однако имеются особенности рубца, обусловленные способом формирования анастомоза. Основными признаками, отличающими заживление вторичным натяжением от первичного, являются: заполнение тканевых дефектов фибрином и остатками некротизированных тканей, экссудатом; развитие воспалительной реакции; образование значительного объема грануляционной ткани; развитие феномена сжатия (контракции раны).
Заживление компрессионного анастомоза несомненно развивается вторичным натяжением, так как репарация раны развивается через воспаление. Однако краткосрочность воспалительной реакции, ускоренная репаративная регенерация в зоне раны способствуют образованию небольшого по размерам рубца.
При выполнении ручных и механических анастомозов имеются факторы, способствующие заживлению типичным вторичным натяжением. К ним относятся: широкий раневой канал, фибринозно – гнойный характер экссудата, большой язвенный дефект, переход острого воспаления в хроническое гранулематозное, избыточный объем грануляционной ткани, задержка созревания и ремоделяции соединительной ткани. Все эти факторы способствуют развитию большого по размерам рубца.
А.Б.Шехтером и А.Е. Гуллером (2008) предложена новая клинико - морфологическая классификация рубцов кожи. Ими выделены 4 вида рубцовой ткани, отличающиеся друг от друга особенностями строения и механизмами формирования, происхождения и функции. Мы сочли целесообразным использовать эту классификацию для оценки формирующегося в зоне анастомоза рубца.
Считаем, что при компрессионном анастомозе развивается нормотрофическая рубцовая ткань, которая является продуктом фиброзной трансформации грануляционной ткани, заполняющей раневой дефект. Формирование такой рубцовой ткани служит проявлением нормальной, физиологической субституции, показателем сохранности механизма ауторегуляции роста соединительной ткани, адекватности ее структуры и функционального состояния локальным биомеханическим и гуморальным стимулам (В.В. Струков и соавт, 1981, 1990; А.Б. Шехтер, 2008). В соединительнотканном рубце выявляется упорядоченное расположение плотно упакованных пучков коллагеновых волокон, ориентированных вдоль линий механических напряжений. Процессы биосинтеза и катаболизма коллагена уравновешены.
При лигатурных и механических анастомозах развивается гипертрофическая рубцовая ткань, так же развивающаяся из грануляционной ткани, но характеризующаяся морфофункциональной незрелостью, преобладанием гиперпластических процессов над инволютивными и продукции коллагена над его катаболизмом. По архитектонике она близка к нормотрофической: пучки коллагеновых волокон ориентированы вдоль линий механического напряжения. Состоит из толстых коллагеновых волокон и множества тонких, беспорядочно ориентированных коллагеновых волокон, которые пронизывают всю ткань, в ней много активных фибробластов.
Соединительнотканный рубец имеет общие свойства и особенности в зависимости от способа формирования анастомоза. К общим свойствам относится: ориентация и упорядоченное расположение коллагеновых волокон и пучков волокон вдоль линий напряжения, связанных с механическими нагрузками; неодновременность созревания соединительной ткани в разных оболочках стенки соединяемых органов; структурно – пространственные соотношения внеклеточного матрикса; качественный состав, определяемый наличием фибриллярных коллагенов; заживление вторичным натяжением.
Соединительнотканный рубец при компрессионных анастомозах характеризуется следующими особенностями:
- развивается в ускоренные сроки;
- образован нормотрофической рубцовой тканью;
- состоит преимущественно из коллагена I типа с незначительным количеством коллагенов III, Y и YI типов;
- имеет небольшие размеры;
- обладает хорошими упругодеформативными, прочностными и абактериальными свойствами.
Соединительнотканный рубец при лигатурных и механических анастомозах имеет следующие особенности:
- формируется в условиях хронического гранулематозного воспаления;
- образован гипертрофической рубцовой тканью;
- состоит из коллагена I и III типов со значительным участием коллагенов Y и YI типов;
- имеет большие размеры;
- обладает ригидностью.
При заживлении КА, МА и анастомозов, выполненных АКА, развивается регенерация нервных волокон с их врастанием в рубец. На границе с краем анастомоза нервные окончания гипертрофированы. Восстановление иннервации резецированного участка можно расценить как развитие регенераторного процесса со стороны периферической нервной ткани, способствующего восстановлению непрерывности нервного импульса на всем протяжении кишки, улучшая анатомо-функциональные свойства анастомоза.
Нервные клетки контактируют между собой с помощью многочисленных отростков, нервных окончаний и синапсов. Самые периферические отделы нервных клеток – нервные окончания – обладают высокой способностью к регенерации и гиперплазии, они быстро восстанавливаются после повреждения. В наших исследованиях это явление обнаружено на 21- е сут после операции.
Продолжительность стадии в компрессионных анастомозах с 14-х по 45-е сутки, в ручных анастомозах происходит удлинение стадии до 60-х суток послеоперационного периода.
Четвертая стадия - пролиферация гладкомышечной ткани характеризуется развитием пролиферации гладкомышечных клеток. Этот важный период в морфогенезе анастомозов удалось выявить в полном объеме только за счет удлинения сроков эксперимента. Б.К. Гиберт и соавт. (1990) описали эти изменения и считали, что с 60-х сут рубец полностью стабилизировался и дальнейшим изменениям не подвергается, однако последующие исследования при удлинении сроков эксперимента уточнили степень выраженности этого процесса. Выделение стадии способствует пониманию механизмов заживления раны, контракции, ремоделяции и инволюции соединительной ткани, избыточной фиброплазии.
В компрессионных анастомозах пролиферация гладкомышечных клеток выявляется через 45 сут после операции. В механических и, особенно, лигатурных анастомозах выраженная пролиферация ГМК развивается в более поздние сроки, начиная с 60-х сут.
При резекции кишки развивается неполная репаративная регенерация гладкой мышечной ткани. Она осуществляется за счет врастания гладкомышечных клеток из сохранной зоны в поврежденную. В нашем исследовании выявлено, что репаративная регенерация гладкомышечной ткани развивается, преимущественно, за счет так называемого эпиморфоза, при котором происходит отрастание гладкомышечной ткани в виде «языка» из неповрежденной зоны в поврежденную. Перестройки гладкомышечных клеток в «пенистые», характерные для процесса регенерации гладкомышечной ткани, недифференцированных клеток-предшественников, а также камбиальных элементов не выявлено. Врастание в рубец гладкомышечных клеток можно расценить как адаптивный процесс, способствующий вытеснению коллагеновых волокон и прорастанию его мышечными клетками.
Первоначально пролиферация ГМК выявляется в рубце подслизистой оболочки, а затем в рубце мышечной оболочки. В подслизистой оболочке ГМК хаотично врастают в сформированный рубец. С 60-х сут происходит упорядоченное выстраивание гладкомышечных клеток в ряд с формированием разрушенной мышечной пластинки слизистой оболочки. Выявление выраженной экспрессии α –SMA (гладкомышечного актина) и десмина в клетках новообразованной мышечной пластинки является подтверждением гладкомышечного происхождения этих клеток и наличия в них сократительных свойств, способствующих восстановлению складчатости слизистой оболочки в зоне анастомоза. Процесс восстановления мышечной пластинки слизистой оболочки очень важен для нормального функционирования органа в послеоперационном периоде.
Пролиферация ГМК имеет важное компенсаторное значение, способствующее дальнейшему изменению зоны анастомоза, как со стороны слизистой оболочки, так и в более глубоких слоях. В ранние сроки послеоперационного периода зона анастомоза выглядит как участок линейной формы, который закрыт новообразованной слизистой оболочкой. В результате пролиферации и дифференцировки новообразованного эпителия толщина слизистой в этой зоне постепенно увеличивается, ширина анастомоза уменьшается, но он продолжает выявляться как углубление, расположенное между двумя деформированными складками слизистой оболочки. За счет восстановления мышечной пластинки складчатость слизистой оболочки восстанавливается.
В полном объеме этот процесс развивается только при КА. При РА восстановление мышечной пластинки в эти сроки развивается на небольшом протяжении рубцовой зоны, причем, складчатость в зоне анастомоза не восстанавливается, деформация складок в краях анастомоза сохраняется, зона анастомоза выявляется как углубление слизистой оболочки между двумя складками.
Врастание ГМК в рубец способствует повышению эластичности анастомоза, улучшению его растяжимости. Эластичность анастомоза является важным показателем его анатомо-функциональной характеристики. Основная роль в поддержании механической прочности кишечной стенки принадлежит коллагеновым волокнам подслизистого слоя. Подслизистая оболочка является наиболее прочной из всех слоев кишечной стенки, несет до 60 - 80% прочности стенки органа (В.И. Егоров и соавт, 2001, 2004; М.Ф. Черкасов и соавт, 2001), богато васкуляризирована, является сосудистым коллектором, участвующим в кровоснабжении серозно-мышечного и слизистого слоев. Показатели эластичности толстокишечных компрессионных анастомозов в поздние сроки мало отличаются от эластичности неизмененной стенки кишки, при растяжении механических и лигатурных толстокишечных анастомозов сохраняется остаточная деформация тканей, свидетельствующая о худших анатомо-функциональных характеристиках этих анастомозов.
Не менее значимым является процесс пролиферации ГМК и их врастание в рубец в мышечной оболочке сформированного анастомоза. Гладкая мускулатура мышечной оболочки в зоне анастомоза образует пучки, выходящие из основного массива, которые врастают в соединительнотканный рубец. Гладкие миоциты мышечной оболочки по ультраструктурной организации соответствуют контрактильному фенотипу. Располагаясь в мышечных пучках, они имеют типичную лентовидную структуру. Процесс развивается одновременно в обоих концах анастомозируемых органов, ГМК растут навстречу друг другу, вытесняя при этом соединительнотканные волокна в сформированном рубце, способствуя их деградации и уменьшению размеров соединительнотканного рубца. Наибольшей выраженности пролиферация ГМК достигает при КА, в которых к 90-м сут мышечные тяжи и комплексы занимают большую часть небольшого по размерам рубца. При РА и МА процесс не достигает такой выраженности. Рубец остается широким, только по краям прорастает гладкомышечными клетками, которые образуют изолированные, хаотично расположенные мелкие мышечные пучки.
При проведении иммуногистохимической реакции выявлена выраженная экспрессия белка α - SMA, более интенсивная в краях мышечной оболочки. В литературе имеются сведения о роли миофибробластов в заживлении ран за счет их фиброконтрактильных свойств (А.Б. Шехтер и соавт, 1977; Н.М. Аничков, 2004). Миофибробласты возникают из фибробластов, имеют ультраструктурные характеристики гладкомышечных клеток, экспрессируют гладкомышечный актин, не характерный для типичных фибробластов. За счет приобретения сократительных свойств, они принимают непосредственное участие в стягивании (контракции) ран. В качестве маркера такой фибробласто – миофибробластной модуляции выступает экспрессия α - гладкомышечного актина (α - SMA), которая важна для принудительного генерирования миофибробластов (G. Gabbiani, 2003). Возможно, что такой механизм имеет место при компрессионных анастомозах, способствуя стягиванию зоны небольшого по размерам рубца. Истончение соединительнотканного рубца на стыках кишки способствует восстановлению непрерывности мышечного слоя, повышению растяжимости и эластичности анастомоза, улучшая его анатомо-функциональные характеристики.
Заживление компрессионного анастомоза осуществляется путем вторичного натяжения с формированием узкого линейного рубца. О заживлении лигатурного и механического анастомозов вторичным натяжением свидетельствует избыточная фиброплазия, развивающаяся в условиях хронического воспаления, приводящая к формированию широкого, ригидного рубца.
При компрессионных и механических анастомозах эта стадия развивается с 45 –х по 90-е сут восстановительного периода, в ручных начинается с 60-х сут.
Важным компенсаторным процессом является врастание в рубец нервных волокон из сохранного в краях Ауэрбахова нервного сплетения кишки.
Анализируя полученные данные можно выявить особенности компрессионных, лигатурных и механических способов соединения анастомозируемых органов.
Особенности компрессионного шва:
- небольшой диастаз анастомозируемых органов;
- быстрая эвакуация компрессионного устройства;
- кратковременое развитие острого экссудативного воспаления;
- раннее начало и больший объем репаративной регенерации эпителия;
- восстановление слоя лимфо - плазмоцитарной инфильтрации в СО;
- развитие репаративной регенерации гладкомышечной ткани в подслизистой основе и в мышечной оболочке в достаточно большом объеме, способствующее восстановлению складчатости слизистой оболочки и восстановлению почти полного футлярного строения кишки в области резекции;
- регенерация нервных волокон с их врастанием в рубец;
- формирование узкого соединительнотканного рубца, который впоследствии еще более истончается за счет вытеснения соединительной ткани пролиферирующими гладкомышечными клетками, что приводит почти к полному гистологическому восстановлению целостности мышечной оболочки.
Лигатурный и механический анастомозы имеют общие особенности, отличающие их от компрессионного анастомоза.
Особенности лигатурного и механического швов:
- фибринозно - гнойный характер экссудата в ранние сроки послеоперационного периода;
- длительное сохранение дефекта слизистой оболочки, способствующее поступлению инфекционного начала, поддерживающего воспаление и тормозящего развитие репаративных процессов;
- выраженные нарушения крово – и лимфообращения, дистрофия и некроз мышечных волокон вдали от краев анастомоза;
- нарушение регенераторного процесса в слизистой оболочке с образованием железистых кист;
- нарушение микроциркуляции в зоне соединительнотканного рубца с формированием кистозно расширенных лимфатических протоков;
- хронизация продуктивного воспаления с формированием гранулем инородных тел;
- затягивание в рубец мышечных волокон, волнистые края рубца;
- регенерация нервных волокон с их врастанием в рубец;
- избыточное разрастание соединительной ткани с формированием широкого, грубого соединительнотканного рубца;
- недостаточный объем развития репаративной регенерации гладкой мышечной ткани, проявляющийся отсутствием восстановления складчатости слизистой оболочки в зоне анастомоза и меньшим прорастанием рубца мышечными волокнами, что приводит только к анатомическому восстановлению в зоне сращения.
Сравнительное изучение параметров механической прочности, эластичности, инфицированности, морфометрического исследования гистологических и ультратонких срезов позволило выявить отличия и преимущества компрессионных анастомозов, выполненных на разных уровнях желудочно-кишечного тракта. Об этом свидетельствуют следующие показатели:
- диастаз слизистых оболочек и язвенный дефект при формировании компрессионного пищеводного анастомоза был статистически достоверно меньше, чем при лигатурном анастомозе ( р≤ 0,05);
- ширина рубца, измеренная при растровой электронной микроскопии, в компрессионном пищеводно-кишечном анастомозе к концу эксперимента достоверно уменьшилась в 1, 8 раза;
- уровень нейтрофильных лейкоцитов во все сроки наблюдения при всех видах компрессионных анастомозов был ниже, а уровень фибробластов и фиброцитов - выше, чем при лигатурных ( механических) анастомозах (р≤ 0,05);
- плотность воспалительного инфильтрата в компрессионных толстокишечных анастомозах была достоверно ниже, чем в ручных и механических соустьях (р<0,01);
- толщина слизистой оболочки в зоне толстокишечных компрессионных и механических анастомозов была в 1,5 раза меньше, чем при лигатурных (р≤ 0,05);
- сильная обратная корреляционная связь между физической герметичностью анастомозов и количеством нейтрофильных лейкоцитов, а также прямая сильная корреляционная связь этого показателя с количеством фиброцитов и фибробластов отражает зависимость механической прочности анастомоза в ранние сроки от выраженности воспаления, а начиная с 7-х сут от регенераторных изменений;
- механическая прочность в компрессионных толстокишечных анастомозах выше по сравнению с лигатурными (р<0,05) и механическими соустьями (р<0,05);
- эластичность толстокишечных компрессионных анастомозов выше (р<0,05), в ручных и механических анастомозах толстой кишки эти различия недостоверны (р>0,05);
- инфицированность толстокишечных компрессионных анастомозов, начиная с третьих суток после операции, достоверно ниже по сравнению с лигатурными и механическими (р≤0,001);
- микробная обсемененность толстокишечных компрессионных соустий достоверно ниже, чем лигатурных и механических анастомозов во все сроки наблюдения (р<0,001).
Резекция органов при формировании анастомозов запускает патологический процесс, нарушающий принцип структурного обеспечения гомеостаза. После оперативного вмешательства происходит интенсификация компенсаторно – приспособительных реакций на всех уровнях. В восстановительном периоде только при заживлении компрессионных анастомозов воспалительно – репаративная реакция, характеризующаяся сопряжением воспаления, регенерации и фиброза, развивается без отклонений. Пролиферативная фаза воспаления закономерно переходит в продуктивную и характеризуется образованием рубца. При заживлении ручного и механического анастомозов возникают отклонения в развитии воспалительно – репаративной реакции. Длительное сохранение продуктивного воспаления, обусловленное наличием инородных включений по линии шва и в тканях, задерживает переход пролиферативной фазы воспаления в продуктивную.
Регенерация – комплексный процесс, охватывающий всю совокупность тканей. При заживлении анастомозов регенерация носит характер репаративной и развивается по типу реституции и субституции. Полная репаративная регенерация развивается в слизистой оболочке пищевода, кишечника и парасимпатической нервной системе кишечника. Неполная репаративная регенерация с формированием соединительнотканного рубца формируется в подслизистой, мышечной и серозной оболочках. Регенерация гладкомышечных клеток относится к неполной и носит компенсаторно- адаптивный характер.
Сравнение репаративного процесса в тканях и органах ЖКТ при наложении компрессионных и лигатурных анастомозов по таким показателям, как сроки заживления, прочность послеоперационного рубца на разрыв, а также анализ гистологических препаратов свидетельствуют о том, что «морфологическая зрелость» восстанавливающихся тканей у животных с компрессионными анастомозами достигается раньше, чем с лигатурными.
Склероз, развивающийся в зоне стыка анастомозируемых органов относится к заместительному (вторичному). Только при компрессионных анастомозах паренхиматозно – стромальные взаимоотношения не разобщаются. Новообразованная грануляционная ткань в своем развитии проходит все стадии, заканчивающиеся созреванием соединительной ткани с развитием контракции, ремоделяции и последующей инволюции. Соединительнотканный рубец при компрессионном анастомозе образован зрелой соединительной тканью, для которой характерны: упорядоченное расположение плотно упакованных коллагеновых волокон, ориентированных по линиям механического напряжения, наличие зрелых фибробластов. При лигатурных и механических анастомозах в условиях хронического продуктивного воспаления заместительный склероз приобретает патологические черты. Это проявляется избыточным разрастанием соединительной ткани, морфофункциональной незрелостью, преобладанием продукции коллагена над его катаболизмом.
Проведенные исследования позволяют считать, что морфогенез анастомозов можно изучить в полном объеме только при заживлении компрессионных анастомозов. Общая продолжительность восстановительного периода составляет 3 месяца. За это время успевают развиться все 4 стадии, прослеженные в послеоперационном периоде (Рис. 11). Первая стадия - сдавления и адаптации тканей - развивается в течение первых 7-ми суток послеоперационного периода. Вторая стадия – восстановительных изменений развивается с 7-х по 14-е сут послеоперационного периода. Третья стадия - завершение формирования соединительнотканного рубца и специфическая дифференцировка эпителия – развивается с 14-х по 45-е сут послеоперационного периода. Четвертая стадия - пролиферация гладкомышечной ткани длится с 45-х по 90-е сут после резекции.
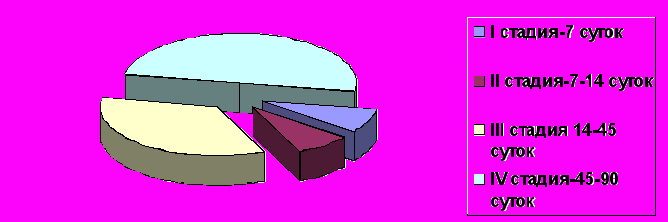
Рис. 11. Продолжительность стадий восстановительного периода при компрессионном анастомозе
При механических анастомозах изменяется продолжительность течения выделенных стадий (Рис. 12). Первая стадия протекает в те же сроки, вторая - удлиняется до 30-х сут за счет торможения регенераторных процессов в условиях хронического воспаления. Третья стадия так четко не выражена, как при компрессионном анастомозе. Процессы созревания и дифференцировки эпителиальных клеток слизистой оболочки, ремоделяция соединительнотканного рубца продолжаются и после 45-ти сут в течение четвертой стадии. Однако значимый для морфогенеза анастомозов процесс пролиферации гладкомышечных клеток отчетливо выявляется начиная с 45-х сут послеоперационного периода.

Рис. 12. Продолжительность восстановительного периода при механическом анастомозе.
При заживлении ручных анастомозов отмечено удлинение продолжительности первой стадии, обусловленное повышенной травматизацией тканей при наложении шовного материала (Рис. 13). Вторая стадия отчетливо не выражена, как при компрессионном анастомозе. Ключевым моментом этой стадии является эпителизация слизистой оболочки. В ручном анастомозе, несмотря на сохранение выраженного хронического воспаления, она развивается на 21-е сут послеоперационного периода. Формирование первичного соединительнотканного рубца в этой стадии только начинается и продолжается на протяжении 3 стадии. Самым важным морфологическим изменением в этой стадии является формирование вторичного соединительнотканного рубца. За счет нарушения созревания соединительной ткани в условиях хронического воспаления развивается избыточный склероз, процесс ремоделяции соединительной ткани затягивается, способствуя удлинениею продолжительности третьей стадии. Четвертая стадия начинается позднее, чем при компрессионном и механическом анастомозах – с 60-х сут послеоперационного периода, и не достигает полного объема, в отведенные экспериментом сроки.

Рис. 13. Продолжительность восстановительного периода при лигатурном анастомозе.
Механизмы восстановления нарушенных структурно – функциональных соотношений в органах при формировании анастомозов на разных уровнях ЖКТ можно рассмотреть с позиций синергетики. Использование теории разнообразия процессов самоорганизации биологических систем позволяет познать и объяснить методологию общих закономерностей процессов восстановления. В результате процесса самоорганизации из беспорядка, то есть хаоса, спонтанно возникают порядок и дефинитивная структура. В «нормальных» условиях сложноорганизованные системы обладают свойством устойчивости, они как бы сами себя стабилизируют. При возникновении патологии, то есть изменении условий (управляющего параметра), сформировавшаяся ранее организация не выдерживает и начинает разрушаться. Для дальнейшего существования организма требуется флуктуация, например, оперативное вмешательство, после которого (начало формирование соустья) наступает состояние хаоса. В этот переломный момент (точка бифуркации) формируется вектор развития системы: останется ли состояние системы хаотичным или она постепенно перейдет на новый уровень упорядоченности, называемый в синергетике диссипативной структурой. Выбор пути, по какому пойдет развитие системы в момент бифуркации – случайное событие. Но для самой системы это не случайность – пути эволюции системы осуществляются в рамках определенного, детерминированного поля возможностей. После преодоления критического значения управляющего параметра (операция) система становится неустойчивой, она отклоняется от стандартного состояния и переходит к новому режиму – в область притяжения нового аттрактора (равновесия).
Проведенные исследования свидетельствуют о том, что при выполнении различными методами любых анастомозов ЖКТ система не теряет внутренней устойчивости, она проходит стандартные стадии развития, достигает нового уровня организации, формируя диссипативную структуру. Восстановительный период можно рассматривать как непрерывную линию развития системы, характеризующую переход от состояния хаоса к формированию диссипативной структуры (соустья). Формирование дефинитивной структуры имеет элемент случайности, определяемый разными факторами: видом хирургического шва, показаниями к выбору способа анастомозирования, наличием тех или иных конструкций, навыками и умениями хирурга и т.д.
Выявлены особенности развития биологической системы в зависимости от способа наложения анастомоза. При заживлении компрессионного анастомоза после удаления устройства исчезает дестабилизирующий фактор (флуктуация), после бифуркации система однозначно развивается в направлении аттрактора. Для этого организмом используется весь комплекс адаптивно - приспособительных реакций, способствующих достижению конечного результата – максимального восстановления нарушенных функций. Д.С. Саркисов (1994) сформулировал пять основных принципов материального обеспечения адаптивных реакций в норме и патологии, обеспечивающих надежность биологической системы в контексте самоорганизации. Эти принципы можно рассматривать как механизмы самоорганизации системы, к ним относятся: мобилизация имеющихся ресурсов путем усиления функции одного или нескольких компонентов системы; расширение «производственных мощностей» путем усиления функций и количества систем; способность к временной синхронизации между началом действия раздражителя и развертыванием адаптивных реакций; рекомбинантные преобразования; дублирование физиологических функций.
При формировании ручных и механических анастомозов система развивается неоднозначно в направлении аттрактора, так как наличие шовного и скрепочного материалов является дестабилизирующим фактором (флуктуациями), способствуя хронизации воспаления и поддержанию постоянного стимула к пролиферации соединительной ткани. За счет этого неустойчивость биологической системы сохраняется длительное время. Развитие системы осуществляется как движение через неустойчивость от одного аттрактора к другому. Это не обозначает скатывание к хаосу, постепенно система самоорганизовывается, но на другом уровне, чем при компрессионном анастомозе.
Таким образом, морфогенез компрессионных анастомозов характеризуется отсутствием дополнительных флуктуаций, ранним достижением положения аттрактора, формированием более устойчивой диссипативной структуры по сравнению с эволюцией ручных и механических анастомозов.
