Желудочно кишечного тракта
| Вид материала | Автореферат |
- Классификация заболеваний желудочно – кишечного тракта, 81.44kb.
- Возможности эндоскопических методов исследования в ранней диагностике онкологических, 42.3kb.
- Исследование микробиоценоза желудочно-кишечного тракта перепелов на фоне применения, 56.33kb.
- Клиническая эффективность препарата лактофильтрум у больных с хроническими заболеваниями, 106.11kb.
- Клиническое значение оценки цитокинового статуса у больных функциональными заболеваниями, 297.09kb.
- - синдромы общего свойства, 558.6kb.
- С. С. Шестопалов, О. Ю. Кушниренко kushn@rambler, 1030.51kb.
- Зубарев Ю. Г. Психология больного, 48.36kb.
- Заболеванием 50% всех заболеваний, 1620.28kb.
- Г. Р. Хасанова общая характеристика работы, 959.74kb.
При компрессионном анастомозе воспалительная инфильтрация в первые сутки после операции выражена меньше, в составе экссудата преобладал фибринозный компонент. Наиболее отчетливо клеточный состав экссудата начинал определяться с 3-х сут.
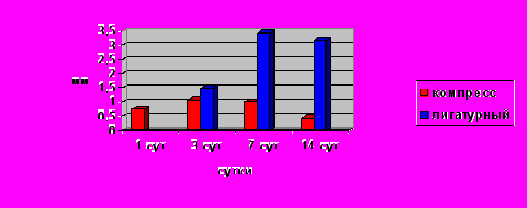
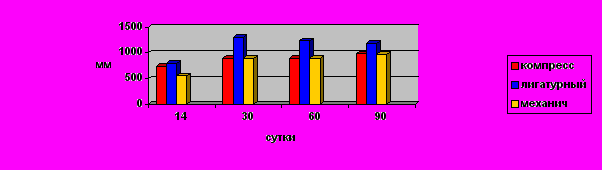
Рис. 1. Диастаз и язвенный дефект слизистых оболочек при лигатурном и компрессионных способах формирования пищеводно-желудочных анастомозов (в мм).
М
орфометрия клеточного состава воспалительного инфильтрата выявила, что он зависел от способа формирования анастомоза. В лигатурном анастомозе в первые 7 сут преобладали нейтрофилы, начиная с 14-х сут их число значительно уменьшалось, усиливался лимфоцитоз, появились фибробласты. В компрессионном анастомозе изменение клеточного состава воспалительного инфильтрата происходило в более ранние сроки. Уровень лейкоцитов в компрессионном анастомозе значительно ниже и уменьшался быстрее, чем при лигатурном (р≤ 0,05) (Рис. 2). Тканевой лимфоцитоз более выражен, образование фибробластов и фиброцитов начиналось раньше.
Рис. 2. Уровень нейтрофильных лейкоцитов при компрессионном и лигатурном пищеводно-желудочных анастомозах (в %)
В компрессионных анастомозах к 7 сут альтерация и экссудация уменьшались, воспаление приобретало характер подострого. Репаративная регенерация эпителия началась уже на 5-е сут послеоперационного периода. Аналогичные изменения при лигатурном шве отмечались с 14-х суток. Полная эпителизация язвенного дефекта происходила в более ранние сроки, чем при ручном шве. Однако процесс дифференцировки и созревания эпителия продолжался до 40-х сут. Сходные изменения при лигатурном шве отмечались на 45-е сут. Особенностью морфогенеза компрессионного шва являлось восстановление лимфо – гистиоцитарного слоя слизистой оболочки. При лигатурном кишечном шве в этот срок изменения не достигали полного развития.
Проведенное морфометрическое исследование рубца позволяет считать, что он начинает формироваться только с 5-х – 7-х сут послеоперационного периода. До 5-х сут раневой канал заполнен фибринозно-клеточным экссудатом. Анализ морфометрических данных выявил, что достоверной является только морфометрия рубца при компрессионном анастомозе (р≤ 0,05). При лигатурном анастомозе выявлено большое колебание ширины рубца, что обусловлено наличием лигатур в составе рубца и невозможностью измерения его в строго фиксированных точках. Ширина рубца при формировании компрессионного анастомоза к 60-м сут послеоперационного периода достоверно уменьшилась в 1, 8 раза (Рис.3).
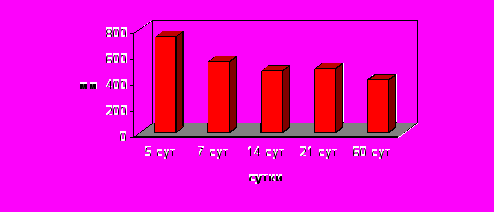
Рис. 3. Динамика ширины рубца в послеоперационном периоде (в мкм) в компрессионных пищеводно-желудочных анастомозах.
Формирование первичного соединительнотканного рубца заканчивалось на 14-е сут , в дальнейшем продолжался процесс его созревания, рубец становился тоньше. При лигатурном шве рубец оставался широким, грубым, с гиалинозом основного вещества соединительной ткани.
На 40-е сут после операции репаративная регенерация в зоне анастомоза полностью завершилась. Сформировавшийся рубец имел типичное Х-образное строение, он уже, чем при ручном шве. Начиная с этого срока, на первое место выходили изменения, развивающиеся в рубце: пролиферация гладкомышечных клеток отмечалась в мышечной пластинке слизистой оболочки, что сопровождалось их врастанием в зону соединительнотканного рубца в подслизистой основе. Этот процесс продолжался до 90-х сут послеоперационного периода и приводил к восстановлению непрерывности мышечной пластинки слизистой оболочки. Следствием этого явилось восстановление складчатости слизистой оболочки кишки над зоной анастомоза. При наложении лигатурного анастомоза к концу эксперимента не происходило восстановление разрушенной мышечной пластинки и складчатости слизистой оболочки в зоне анастомоза.
Пролиферация гладкомышечных клеток в краях мышечной оболочки сопровождалась их врастанием в рубец в мышечной оболочке. К концу эксперимента происходило рассасывание соединительнотканного матрикса и постепенное истончение рубца, рубец уменьшался в объеме, прослеживался в виде узкой полоски не на всем протяжении.
К 90-м сут произошло сращение не только слизистой и серозной оболочек, но и практически полное соединение мышечных слоев. Развитие адаптивных изменений в зоне соустья, проявляющихся восстановлением непрерывности разрушенной мышечной пластинки слизистой оболочки, восстановлением ее складчатости, частичной репарацией мышечного слоя оболочки достигало полного объема только при компрессионном анастомозе.
Анализ гистологических изменений показал, что при заживлении тонко - толстокишечных анастомозов выявлялись следующие особенности. Острые воспалительные изменения резко уменьшались в компрессионных анастомозах к 7 сут эксперимента. При всех видах тонко - толстокишечных анастомозов регенерация эпителия начиналась на 7-е сут послеоперационного периода, в последующем развивалась дифференцировка эпителия.
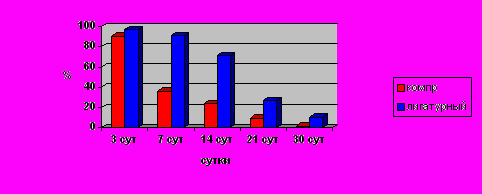
Морфометрия клеточного состава воспалительных инфильтратов выявила, что в ранние сроки преобладающими клетками являлись нейтрофильные лейкоциты. При лигатурном анастомозе уровень нейтрофильных лейкоцитов статистически достоверно выше (р≤ 0,05), чем при компрессионном. Острые воспалительные изменения стихали в компрессионных анастомозах к 7 сут послеоперационного периода. При выполнении лигатурных анастомозов воспалительные изменения были очень выражены: уровень нейтрофильных лейкоцитов существенно уменьшался только на 14-е сут опыта и оставался достаточно высоким вплоть до 21-х сут (Рис. 4).
П
роцесс закрытия язвенного дефекта характеризовался одновременной пролиферацией тонкокишечного и толстокишечного эпителиев. Параллельно с закрытием язвенного дефекта выявлено образование секреторных отделов железистых крипт на границе с подслизистой оболочкой. Новообразованные крипты укорочены, просветы расширены, бокаловидных клетки единичные. Более активно пролиферировал тонкокишечный эпителий, который быстрее дифференцировался и замещал язвенный дефект.
Рис. 4. Динамика изменения количества нейтрофильных лейкоцитов в составе клеточного воспалительного инфильтрата при тонко-толстокишечных анастомозах.
Полная эпителизация слизистой оболочки при компрессионных анастомозах развивалась на 14-е сут послеоперационного периода. При лигатурном анастомозе эпителизация затягивалась до 21-х сут, продолжалось инфицирование глубоких слоев и развивались повторные некрозы новообразованной слизистой оболочки вследствие отхождения шовного материала в просвет кишки.
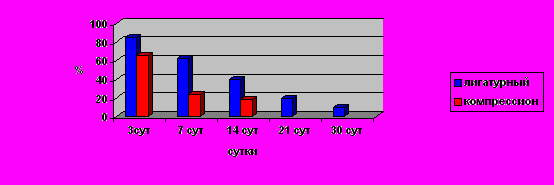
Формирование грануляционной ткани более активно развивалось при заживлении компрессионного анастомоза, фибробласты и новообразованные коллагеновые волокна в большом количестве выявлены на 3-и сут послеоперационного периода. Динамика нарастания числа фибробластов наиболее выражена при компрессионном анастомозе, на 21-е сут уровень фибробластов почти в 4 раза выше (р≤ 0,05), чем при лигатурном анастомозе (Рис. 5 ).
Ф
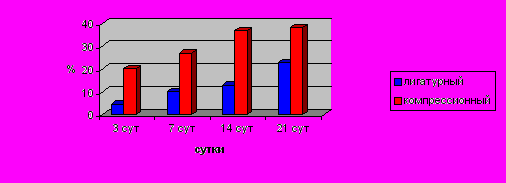
ормирование первичного соединительнотканного рубца при компрессионных анастомозах завершалось на 14-е сут, при лигатурных анастомозах эти процессы затягивались до 21-х сут.
К концу эксперимента в компрессионных анастомозах происходило увеличение толщины выстилки в зоне анастомоза, восстанавливалось соотношение стромы и паренхимы, увеличивалось количество
Рис. 5 . Динамика изменения количества фибробластов в клеточном воспалительном инфильтрате при тонко-толстокишечных анастомозах.
бокаловидных клеток в железистых криптах, восстанавливался лимфо-плазмоцитарный слой слизистой оболочки.
Завершалось формирование соединительнотканного рубца, сопровождающееся рассасыванием избыточного количества коллагеновых волокон и уменьшением ширины сформированного рубца.. При формировании анастомозов «конец в конец», рубец приобретал Х-образный вид, при наложении конце-боковых анастомозов рубец имел П-образный вид, был более узким, особенно в мышечной оболочке. Развивалась регенерация нервных волокон с их врастанием в соединительнотканный рубец.
Пролиферация гладкомышечных элементов выявлялась с 45-х сут. Первоначально этот процесс развивался в подслизистой оболочке, проявляясь в двух формах: хаотичное врастание гладкомышечных клеток в рубец и упорядоченное врастание с формированием мышечной пластинки слизистой оболочки. Наибольшего объема этот процесс достигал при компрессионном анастомозе. Отмечалось практически полное восстановление мышечной пластинки слизистой оболочки. В мышечной оболочке процесс пролиферации гладкомышечных клеток наиболее отчетливо был выражен только при компрессионном анастомозе, сформированном УКА. Заметного уменьшения размеров рубца за счет рассасывания соединительной ткани не выявлено.
Электронномикроскопическое исследование позволило уточнить особенности морфогенеза тонко-толстокишечных анастомозов. В компрессионных анастомозах острые воспалительные изменения сохранялись до 14-х сут послеоперационного периода. В этот срок в составе воспалительного инфильтрата выявлялись малодифференцированные макрофаги, гистиоциты, Т-лимфоциты, плазматические клетки первого типа.
В ранние сроки после операции восстановительные процессы в слизистой оболочке проявлялись двумя типами изменений: закрытием язвенного дефекта новообразованным однорядным эпителием и формированием железистых крипт. Гермитативная зона в толстой кишке занимала нижнюю и среднюю треть крипт. Наряду с пролиферирующими клетками в криптах выявлены клетки в состоянии апоптоза. В исследуемый срок апоптоз выражен незначительно, что свидетельствовало о преобладании пролиферации над гибелью клеток, отражая развитие регенераторных процессов.
Признаки регенерации нервной ткани отмечены на 21-е сут послеоперационного периода. Они выявлены в Мейснеровском и Ауэрбаховом нервных сплетениях. В более поздние сроки нервные волокна определялись в составе соединительнотканного рубца, формирующегося на стыке резецированных петель кишки. В соединительной ткани рубца в большом количестве встречались тучные клетки. Регенерационная гиперплазия нервных волокон выявлялась в отдаленные сроки эксперимента.
При сканирующей электронной микроскопии выявлено несколько функциональных типов фибробластов: юные фибробласты входили в состав грануляционной ткани, зрелые фибробласты выявлялись в составе первичного соединительнотканного рубца, фиброциты - в составе зрелой соединительной ткани. Первичный соединительнотканный рубец на 21-е сут послеоперационного периода состоял из двух типов коллагеновых волокон: толстых, образующих пучки, и тонких, переплетающихся с ними.
Микроскопическое исследование толстокишечных анастомозов выявило, что нарушения кровообращения, дистрофические изменения, воспалительная инфильтрация обусловлены сдавлением тканей компрессионным устройством, которое сохранялось в просвете кишки до 3-х – 5 суток. К 7 сут альтерация и экссудация в компрессионных и механических анастомозах уменьшались, воспаление приобретало характер подострого, в лигатурных анастомозах этот период удлинялся до 14-х сут.
Морфометрическое исследование и статистическая обработка его результатов выявили значительную разницу как количественного, так и качественного составов клеточного инфильтрата в различных толстокишечных анастомозах. Выявлено, что наименьшая плотность воспалительного инфильтрата определялась в первые сутки после наложения анастомозов, на 3-и сут она увеличивалась, что свидетельствовало о прогрессировании острого воспаления.
Начиная с 7-х сут этот показатель неуклонно уменьшался, оставаясь статистически достоверно ниже в компрессионных анастомозах (р<0,01) по сравнению с лигатурными и механическими (Рис. 6). На 14-е сут плотность клеточного инфильтрата в компрессионных анастомозах была более чем в 3 раза ниже, чем в лигатурных и механических соустьях. На 30-е сут плотность клеточного инфильтрата в компрессионных анастомозах была в 3 раза ниже, чем в лигатурных и в 3,2 раза ниже, чем в механических соустьях (р<0,01).
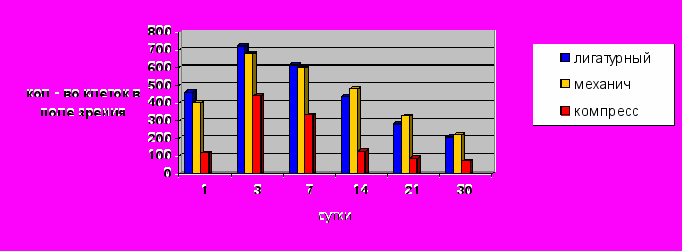 Рис. 6. Динамика изменения плотности клеточного инфильтрата в толстокишечных анастомозах.
Рис. 6. Динамика изменения плотности клеточного инфильтрата в толстокишечных анастомозах.В ранние сроки после операции во всех анастомозах преобладающими клетками являлись нейтрофилы. В компрессионных анастомозах относительное содержание нейтрофильных лейкоцитов во все сроки наблюдения было достоверно более низким (р<0,01) по сравнению с лигатурными и механическими, что свидетельствовало о меньшей степени выраженности воспалительных процессов (Рис. 7).
Начиная с 7-х сут во всех анастомозах, особенно в компрессионных, увеличивалось содержание фибробластов. Во все сроки наблюдения количество фибробластов и фиброцитов в компрессионных анастомозах было статистически достоверно выше. Эти данные свидетельствовали о более ранней активизации пролиферативных процессов в компрессионных соустьях по сравнению с лигатурными и аппаратными (Рис. 8).
Клеточный состав инфильтрата в компрессионных соустьях представлен преимущественно фиброцитами, в то время как в лигатурных и аппаратных соустьях в равной степени определялись как фиброциты, так и фибробласты
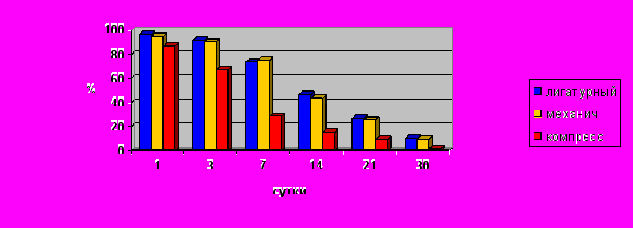
Рис. 7. Динамика изменения относительного количества лейкоцитов в
клеточном инфильтрате в толстокишечных анастомозах.
При компрессионном и механическом анастомозах репаративная регенерация начиналась в более ранние сроки - с 5-х суток. Эпителизация раневой поверхности при компрессионных анастомозах заканчивалась к 14-м сут после операции. При лигатурном анастомозе эпителизация завершалась на 21-е сут, при механическом позднее – на 30-е сутки.
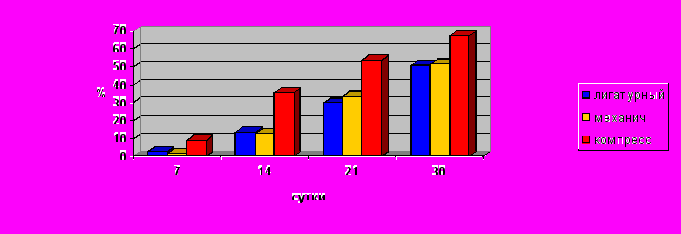
Рис. 8. Динамика изменения относительного количества фибробластов и фиброцитов в клеточном инфильтрате в толстокишечных анастомозах.
Морфометрия новообразованной слизистой оболочки выявила, что толщина реэпителизированного участка слизистой оболочки зависит от сроков развития полной эпителизации. При компрессионных анастомозах толщина слизистой оболочки достоверно выше к концу эксперимента, чем на 14-е сут (р< 0,05), что отражает нормальный процесс дифференцировки эпителиального пласта (Рис. 9). При механическом анастомозе толщина слизистой оболочки в реэпителизированной зоне на 30-е – 90-е сут мало отличается от п
оказателей при компрессионном анастомозе. Самые большие показатели толщины слизистой оболочки при лигатурном анастомозе, особенно на 30-е сут, когда развивалась полная эпителизация язвенного дефекта. В дальнейшем толщина слизистой оболочки уменьшалась, оставаясь почти в 1,5 раза больше, чем при компрессионном и механическом анастомозах.
Рис. 9. Толщина слизистой оболочки (мкм) в толстокишечных анастомозах
Анализ результатов, полученных при растровой электронной микроскопии, позволил выявить следующие закономерности: при создании лигатурных анастомозов отмечалось развитие острой воспалительной реакции, которая связана с травматизацией кишечной стенки шовным материалом, формированием лигатурных каналов, проникновением бактериальной микрофлоры в стенку толстой кишки. Минимальная травматизация тканей в компрессионных соустьях способствовала раннему стиханию воспалительной реакции, более быстрому развитию регенераторных процессов и завершению эпителизации слизистой оболочки на 14-е сутки послеоперационного периода.
Самый широкий рубец формировался при механическом сшивании тканей. Площадь рубца увеличивалась за счет фрагментов мышечных волокон, затянутых в соустье при наложении скрепок. В ручных анастомозах также встречались мышечные фрагменты, попавшие в рубец, при наложении лигатур. Вокруг них формировалась грануляционная ткань, увеличивающая объем соединительнотканного биокомпозита. Формирующийся рубец имел неровные, рваные, края. Во всех анастомозах соединительнотканный рубец приобретал типичный Х-образный вид. Коллагеновые волокна в рубце подслизистой и серозной оболочек ориентированы продольно, в мышечной оболочке – поперечно.
При заживлении компрессионных и механических анастомозов восстанавливался лимфо-плазмоцитарный слой. При механических и компрессионных соустьях за счет секвестрации лигатур и скрепочного материала в просвет кишки развивались повторные изъязвления слизистой оболочки, поддерживающие пролиферацию клеток эпителия и задерживающие их дифференцировку. При ручном и механическом анастомозах выявлена деформация складок и компенсаторная гипертрофия слизистой оболочки вблизи зоны резекции. Выявлено врастание регенерировавших нервных волокон в рубец.
Благодаря удлинению сроков эксперимента в этой серии удалось изучить закономерности регенерации гладкомышечной ткани. Пролиферация гладкомышечных клеток в краях резецированной мышечной пластинки слизистой оболочки и в мышечной оболочке способствовала её гипертрофии на границе с рубцом. Этот процесс продолжался до 90-х сут послеоперационного периода и приводил к восстановлению непрерывности мышечной пластинки слизистой оболочки. Следствием этого явилось восстановление складчатости слизистой оболочки кишки над зоной анастомоза. При наложении лигатурного анастомоза к концу эксперимента не происходило восстановления разрушенной мышечной пластинки и складчатости слизистой оболочки в зоне анастомоза.
Пролиферация гладкомышечных клеток в краях мышечной оболочки сопровождалась врастанием клеток в рубец в мышечной оболочке. К концу эксперимента происходило рассасывание соединительнотканного матрикса и уменьшение рубца. Рубец выглядел истонченным, в виде узкой полоски и прослеживался не на всем протяжении.
К 90-м сут произошла репарация не только слизистой и серозной оболочек, но и полное соединение мышечных слоев. Развитие адаптивных изменений в зоне соустья, проявляющихся восстановлением непрерывности разрушенной мышечной пластинки слизистой оболочки, восстановлением складчатости слизистой оболочки и частичным восстановлением мышечной оболочки достигало полного объема только при компрессионном анастомозе.
При механическом анастомозе регенерация мышечной ткани выражена слабее, чем при компрессионном. Восстановления складчатости слизистой оболочки не развивалось, соединительнотканный рубец оставался широким, отмечалось внедрение в него гладкомышечных клеток. При ручном анастомозе объем репарации гладкомышечной ткани наименьший, что проявлялось только тенденцией к восстановлению мышечной пластинки слизистой оболочки и незначительным прорастанием гладкомышечными клетками соединительно-тканного рубца в мышечной оболочке.
Показатели механической прочности толстокишечных анастомозов зависели от сроков послеоперационного периода. Наиболее низкие показатели физической герметичности соустий определялись на 3 - 5-е сутки после операции. Начиная с 7-х суток, они начинали возрастать, достигая максимума на 45-е сутки послеоперационного периода (Рис. 10).
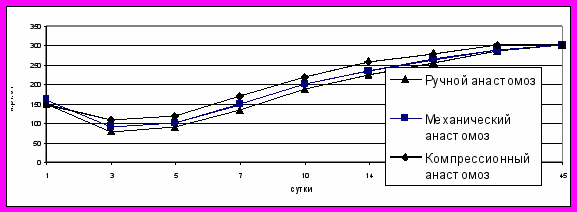
Рис. 10. Механическая прочность толстокишечных анастомозов
в различные сроки наблюдения (мм рт. ст.)
На третьи сутки более герметичными становились компрессионные швы, механическая прочность которых была на 20-25 мм. рт.ст. выше механических, и на 30-35 мм. рт.ст. выше лигатурных швов. На 30-е сутки и в более поздние сроки показатели механической прочности компрессионных, лигатурных и механических швов существенно не отличались друг от друга.
Сравнительное изучение показателей физической герметичности на 1 - 45-е сутки с помощью критерия Уилкоксона (W) показало, что компрессионные анастомозы обладали более высокой механической прочностью, чем лигатурные (W= -28.0, р<0,05) и механические соустья (W= -33,0, р<0,05). Минимальные показатели давления разрыва в компрессионных швах более чем в 2 раза были выше пороговых показателей внутриполостного давления.
Показатели механической прочности кишечных швов зависели от степени выраженности воспалительной реакции в кишечном соустье. Об этом свидетельствовала высокая степень обратной коррелятивной связи между физической герметичностью соустий и относительным количеством нейтрофильных лейкоцитов. Для ручных соустий коэффициент ранговой корреляции Спирмена (rS) составил - -0,82; механических – -0,83; компрессионных – -0,94. Начиная с 7-х суток после операции, физическая герметичность анастомозов зависела от выраженности регенераторных процессов в кишечном шве. Об этом свидетельствовала прямая коррелятивная связь между показателями механической прочности анастомозов и относительным количеством клеток соединительной ткани. Для лигатурных соустий коэффициент ранговой корреляции Спирмена (rS) составил 1, механических – 1, компрессионных – 1, что говорило о высокой степени связи между изучаемыми параметрами. Данные статистической обработки результатов исследования свидетельствовали о том, что более высокая механическая прочность компрессионных анастомозов была связана как с минимальной выраженной воспалительной реакцией, так и с более ранним развитием регенераторных процессов.
Исследование
