Особенности постнатального морфогенеза мышечной оболочки фундального отдела желудка белых крыс при длительном потреблении диспергированной пищи 03. 00. 25 гистология, цитология, клеточная биология
| Вид материала | Автореферат диссертации |
| 4. Особенности морфогенеза мышечной оболочки фундального отдела желудка после смены питания диспергированной пищей на питание не |
- Морфометрические особенности постнатального развития околоушной слюнной железы крыс, 388.58kb.
- Морфофункциональная характеристика слизистой оболочки кишечника потомства самок крыс, 303.36kb.
- Цитологические особенности вторичных миелодисплазий при лимфомах 03. 00. 25 гистология,, 526.98kb.
- Структурно-функциональная характеристика нонапептидергической гипоталамо-гипофизарной, 343.48kb.
- Формирование конечного мозга крыс после нарушения эмбрионального развития, вызванного, 370.65kb.
- Закономерности дегенерации и адаптации сетчатки глаз при экспериментальных ретинопатиях,, 745.16kb.
- Экспериментальное обоснование применения нейропептидов в комплексной терапии острого, 259.86kb.
- Морфофункциональная характеристика пульпы зуба и оценка иммунного статуса при кариесе,, 552.48kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
- Лимфоидные органы и миокард в системе мать-плод при вибрации, воздействии кадмием, 640.36kb.
4. Особенности морфогенеза мышечной оболочки фундального
отдела желудка после смены питания диспергированной пищей на
питание недиспергированной пищей
После перехода, начиная со 120-х суток постнатального онтогенеза, животных II опытной группы от питания диспергированной пищей к
питанию недиспергированной пищей гипертрофическое развитие
(утолщение) МО ФО желудка замедляется (табл. 1): толщина МО
180-суточных животных II опытной группы уступает таковой животных
I опытной группы (р<0,05), продолжающих питаться диспергированной
пищей. Вместе с тем, соответствующий показатель животных II опытной группы оказывается выше, чем у животных контрольной группы (р<0,05). При этом средняя скорость прироста МО у животных II опытной группы в период со 120-х по 180-е сутки снижается (р<0,05) до 0,20 мкм/сутки,
уступая таковой животных контрольной (0,38 мкм/сутки) и I опытной
(0,39 мкм/сутки) групп (табл. 1). В последующие периоды (180-360 сутки) степень развития МО ФО желудка относительно стабилизируется, а
показатели ее толщины обнаруживают сходство с таковыми 270- и
360-суточных животных контрольной группы (р>0,05). Скорость прироста МО в соответствующие периоды онтогенеза обретает отрицательное
значение (-0,02 мкм/сутки и -0,01 мкм/сутки), обуславливая незначительное истончение МО у 270- и 360-суточных животных II опытной группы (р<0,05) по отношению к 180-суточным контрольным животным (табл. 1).
Характер морфологических изменений циркулярного слоя МО в период адаптации к питанию недиспергированной пищей (120-360 сутки) после
длительного питания диспергированной пищей (21-120 сутки) соответствует описанным выше изменениям МО ФО желудка в целом (рис. 15): у
180-суточных животных II опытной группы сохраняется его
гипертрофированное состояние по отношению к контрольным животным (р<0,05), различия в толщине циркулярного слоя МО между животными
II опытной и контрольной групп в последующем (270–360 сутки) полностью исчезают (р>0,05). При этом отрицательная скорость прироста
(-0,02 мкм/сутки; - 0,01 мкм/сутки) обусловливает незначительное
истончение циркулярного слоя МО у 270- и 360-суточных животных
II опытной группы (табл. 2) по отношению к 180-суточным животным этой группы (р<0,05).
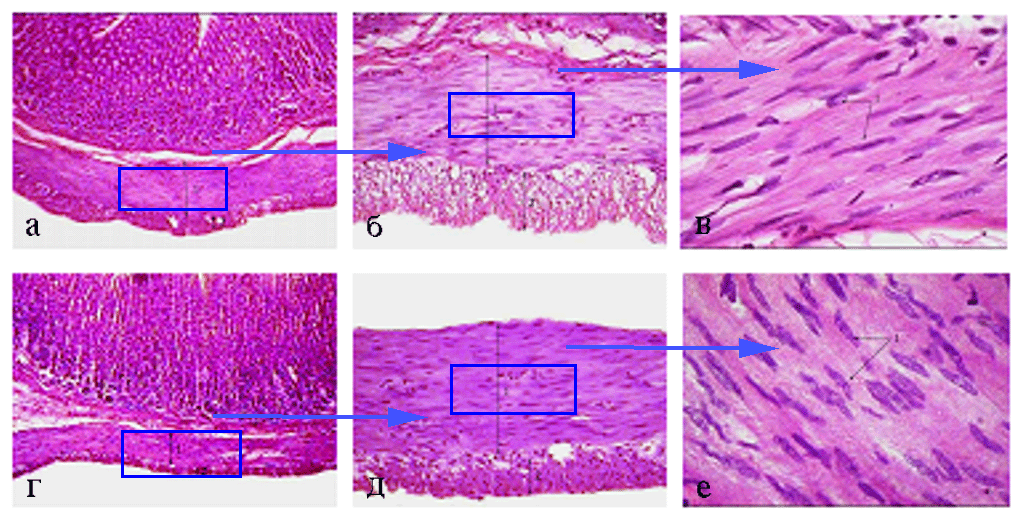
Рис. 15. Мышечная оболочка фундального отдела желудка
(поперечный срез) 180- (а - 100; б - 400; в - 1000) и 360-суточных
(г - 100; д - 400; е - 1000) животных II опытной группы. Окраска
гематоксилином и эозином
Особого внимания заслуживают изменения ядерно-цитоплазматического
отношения гладких миоцитов в циркулярном слое МО 180-суточных
животных II опытной группы, которое резко уменьшается (р<0,05) по
отношению к 180-суточным животным I опытной группы (с 15,82±0,94 % до 8,72±0,51 %) и приближается (р>0,05) к таковому (9,53±0,30 %)
180-суточных контрольных животных (табл. 2). Тем самым степень
дифференцированности гладких миоцитов циркулярного слоя у
180-суточных животных II опытной группы оказывается, подобно таковой 120-суточных контрольных животных (р>0,05), самой высокой (р<0,05) по отношению к животным всех остальных возрастных и опытных групп
(рис. 13). В основе отмеченного снижения ядерно-цитоплазматического
отношения гладких миоцитов циркулярного слоя у животных II опытной группы лежит значительное уменьшение площади сечения (а, следовательно, и объема) ядер гладких миоцитов по отношению к таковому животных
I опытной группы (р<0,05). Более низкие показатели площади сечения ядер отличают также 270- и 360-суточных животных II опытной группы от
животных соответствующего возраста I опытной группы (табл. 2). При этом площадь сечения ядер гладких миоцитов у 270- и 360-суточных животных
II опытной группы превышает таковую контрольных животных
Таблица 1
Морфометрические показатели мышечной оболочки фундального отдела желудка в норме, при потреблении диспергированной пищи и в период
адаптации к питанию недиспергированной пищей
| Возраст (сутки) | Показатель Группа | Толщина МО (мкм) | Средняя скорость прироста МО (мкм/сутки) | Средняя скорость прироста ЦС МО (мкм/сутки) | Средняя скорость прироста ПС МО (мкм/сутки) |
| 21 | Контроль | 32,5±0,45 | - | - | - |
| 45 | контроль | 43,83±1,05* | 0,47 | 0,40 | 0,07 |
| опыт I | 66,6±0,52*+ | 1,42 | 1,18 | 0,24 | |
| 60 | контроль | 67,00±1,59* | 1,54 | 1,30 | 0,24 |
| опыт I | 92,23±1,37*+ | 1,71 | 1,57 | 0,14 | |
| 120 | контроль | 82,13±1,23* | 0,25 | 0,25 | 0,001 |
| опыт I | 100,56±0,84*+ | 0,14 | 0,13 | 0,01 | |
| 180 | контроль | 104,21±1,32* | 0,38 | 0,32 | 0,06 |
| опыт I | 124,51±1,61*+ | 0,39 | 0,32 | 0,05 | |
| опыт II | 112,4±0,89*+ | 0,20 | 0,17 | 0,03 | |
| 270 | контроль | 107,32±1,59 | 0,03 | 0,003 | 0,003 |
| опыт I | 127,4±0,83+ | 0,03 | 0,003 | 0,002 | |
| опыт II | 111,0±0,19 | - 0,02 | - 0,003 | 0,01 | |
| 360 | контроль | 108,5±1,26 | 0,01 | 0,01 | 0,002 |
| опыт I | 129,1±2,28+ | 0,02 | 0,02 | 0,002 | |
| опыт II | 110,29±0,24 | - 0,01 | - 0,01 | - 0,001 |
Примечание: ГМ – гладкие миоциты, ЦС – циркулярный слой,
ПС – продольный слой, МО – мышечная оболочка, ЯЦО – ядерно-цитоплазматическое отношение, *- достоверные отличия от предыдущего значения, + - достоверные отличия от контрольных значений (при р<0,05).
соответствующего возраста (р<0,05), а плотность расположения клеточных ядер (2,87±0,31 ‰ и 2,76±0,26 ‰), наоборот, уступает (р<0,05) таковой
животных контрольной группы (3,42±0,23 ‰ и 3,50±0,34 ‰). Последний показатель позволяет заключить, что гладкие миоциты циркулярного слоя животных II опытной группы отличаются несколько увеличенным объемом цитоплазмы по отношению к гладким миоцитам контрольных животных (р<0,05). Увеличение объема ядер и цитоплазмы гладких миоцитов
циркулярного слоя МО у 270- и 360-суточных животных II опытной группы по отношению к контрольным животным соответствующего возраста
свидетельствуют о том, что у первых в позднем постнатальном онтогенезе (180-360 сутки) сохраняется гипертрофированное состояние гладких
миоцитов в сравнении с контрольными животными (табл. 2). Учитывая сходство степени развития (толщины) циркулярного слоя МО у животных
II опытной и контрольной групп (рис. 4), а также указанные выше
особенности плотности расположения ядер гладких миоцитов у животных этих групп, можно предположить, что циркулярный слой МО животных
II опытной группы отличается от такового контрольных животных
уменьшенным общим количеством гладких миоцитов. Из этого следует, что возникшие при питании диспергированной пищей отклонения морфогенеза гладкой мышечной ткани циркулярного слоя МО, в частности его
гипертрофия, оказали существенное влияние на его последующий
морфогенез, который сопровождается нарушениями процессов
пролиферации и дифференцировки гладких миоцитов, проявляющимися в гипертрофии гладких миоцитов и снижении их общего количества в толще слоя.
Морфологические изменения продольного слоя в период адаптации к питанию недиспергированной пищей (120-360 сутки) после питания
диспергированной пищей (21-120 сутки) отличаются от описанных выше преобразований циркулярного слоя МО (табл. 3). Гипертрофия продольного слоя у животных II опытной группы по отношению к контрольным
животным сохраняется (рис. 5) весь период наблюдения (120-360 сутки). Так, показатели толщины продольного слоя у животных II опытной и
контрольной групп составляют в возрасте 270-и суток 20,30±0,17 мкм и 18,00±0,72 мкм (р<0,05), в возрасте 360-и суток 20,17±0,31 мкм и
18,20±0,80 мкм (р<0,05). При этом по отношению к животным I опытной группы у животных II опытной группы отмечается истончение (р<0,05)
продольного слоя (табл. 3). Эти данные дают основания заключить, что сформировавшаяся в период питания диспергированной пищей (21-120
сутки) гипертрофия продольного слоя МО ФО желудка обладает
относительной устойчивостью, сохраняясь, хотя с меньшей степенью
выраженности, весь последующий период (120-360 сутки) питания
недиспергированной пищей. В основе гипертрофии продольного слоя МО у 270- и 360-суточных животных II опытной группы лежит гипертрофия
формирующих его гладких миоцитов, на которую указывают увеличение как площади сечения (объема) ядер (р<0,05), так и увеличение объема
цитоплазмы гладких миоцитов, подтверждаемое уменьшением (р<0,05)
количества ядер на стандартной площади среза продольного слоя (табл. 3). Показатели плотности расположения ядер гладких миоцитов становятся сходными у 270- и 360-суточных животных I и II опытной групп (р>0,05), указывая на гипертрофированное состояние цитоплазмы гладких миоцитов в продольном слое МО животных этих групп. При этом имеет место значительные различия площади сечения ядер гладких миоцитов между
животными I и II опытной групп в возрасте 270-и и 360-и суток (табл. 3).
20
Таблица 2
Морфометрические показатели циркулярного слоя мышечной оболочки фундального отдела желудка в норме,
при потреблении диспергированной пищи и в период адаптации к питанию недиспергированной пищей
| Возраст (сутки) |  Показатель Показатель Группа | Толщина ЦС МО (мкм) | Площадь сечения ядер ГМ ЦС МО (мкм2) | Количество ядер ГМ ЦС МО на ст. пл. среза | ЯЦО ГМ ЦС МО (%) |
| 21 | контроль | 23,50±0,53 | 6,08±0,44 | 7,23±0,24 | 12,35±0,50 |
| 45 | контроль | 33,17±1,42* | 6,48±0,14 | 7,78±0,40 | 14,42±0,42* |
| опыт I | 51,80±0,38*+ | 10,70±0,18*+ | 4,54±0,26*+ | 13,82±0,31* | |
| 60 | контроль | 52,73±2,14* | 8,98±0,31* | 5,11±0,42* | 13,96±0,53 |
| опыт I | 75,31±1,93*+ | 12,84±0,24*+ | 3,42±0,11*+ | 12,33±0,27*+ | |
| 120 | контроль | 67,81±1,73* | 9,9±0,79 | 3,15±0,81* | 8,46±1,13* |
| опыт I | 83,17±1,17*+ | 12,76±0,93+ | 3,47±0,22 | 12,45±0,95+ | |
| 180 | контроль | 86,52±1,61* | 11,84±0,15* | 2,94±0,27 | 9,53±0,30 |
| опыт I | 102,61±2,23*+ | 16,66±0,94*+ | 3,28±0,22+ | 15,82±0,94*+ | |
| опыт II | 93,37±1,24*+ | 12,58±0,37 | 2,55±0,35* | 8,72±0,51* | |
| 270 | контроль | 89,32±2,13 | 11,72±0,36 | 3,42±0,23 | 11,14±0,43* |
| опыт I | 105,30±1,17+ | 16,20±0,61+ | 2,46±0,22*+ | 11,06±0,65* | |
| опыт II | 90,70±0,23 | 13,80±0,44*+ | 2,87±0,31+ | 11,00±0,53* | |
| 360 | контроль | 90,30±1,60 | 11,58±0,26 | 3,50±0,34 | 11,27±0,43 |
| опыт I | 106,8±3,20+ | 16,55±0,82+ | 2,54±0,12+ | 11,74±0,83 | |
| опыт II | 90,12±0,13 | 13,60±0,37+ | 2,76±0,26+ | 10,36±0,46 |
Примечание: ГМ – гладкие миоциты, ЦС – циркулярный слой, МО – мышечная оболочка,
ЯЦО – ядерно-цитоплазматическое отношение, *- достоверные отличия от предыдущего значения, + - достоверные
отличия от контрольных значений (при р<0,05).
21
Таблица 3
Морфометрические показатели продольного слоя мышечной оболочки фундального отдела желудка в норме,
при потреблении диспергированной пищи и в период адаптации к питанию недиспергированной пищей
| Возраст (сутки) |  Показатель Показатель Группа | Толщина ПС МО (мкм) | Площадь сечения ядер ГМ ПС МО (мкм2) | Количество ядер ГМ ПС МО на ст. пл. среза | ЯЦО ГМ ПС МО (%) |
| 21 | контроль | 9,00±0,35 | 6,84±0,89 | 7,15±0,13 | 13,93±0,90 |
| 45 | контроль | 10,66±0,85* | 6,22±0,41 | 7,45±0,17 | 13,10±0,44 |
| опыт I | 14,80±0,63*+ | 10,88±0,39*+ | 5,24±0,34*+ | 16,62±0,52*+ | |
| 60 | контроль | 14,27±0,67* | 9,08±1,10* | 4,76±0,33* | 12,11±1,06 |
| опыт I | 16,92±0,15*+ | 13,18±0,40*+ | 3,10±0,52*+ | 11,38±0,66* | |
| 120 | контроль | 14,32±0,17 | 10,18±0,83 | 3,20±0,11* | 8,87±0,84* |
| опыт I | 17,39±0,17*+ | 13,20±0,31+ | 3,73±0,24* | 14,04±0,40*+ | |
| 180 | контроль | 17,69±0,93* | 12,28±0,22* | 2,87±0,45 | 9,66±0,50 |
| опыт I | 21,9±0,45*+ | 16,60±0,55*+ | 3,70±0,28+ | 18,14±0,62*+ | |
| опыт II | 19,03±0,24*+ | 12,98±0,71 | 3,01±0,28* | 10,82±0,58* | |
| 270 | контроль | 18,00±0,72 | 12,36±0,52 | 3,52±0,22 | 12,21±0,56* |
| опыт I | 22,10±0,13+ | 16,35±0,95+ | 2,74±0,28*+ | 12,61±0,99* | |
| опыт II | 20,30±0,17*+ | 13,38±0,37+ | 2,88±0,34+ | 10,66±0,51+ | |
| 360 | контроль | 18,20±0,80 | 12,08±0,34 | 3,74±0,15 | 12,73±0,13 |
| опыт I | 22,30±0,40+ | 16,65±0,76+ | 2,65±0,34+ | 12,40±0,70 | |
| опыт II | 20,17±0,31*+ | 12,90±0,84 | 2,68±0,15+ | 9,46±0,85+ |
Примечание: ГМ – гладкие миоциты, ПС – продольный слой, МО – мышечная оболочка,
ЯЦО – ядерно-цитоплазматическое отношение, *- достоверные отличия от предыдущего значения, + - достоверные
отличия от контрольных значений (при р<0,05).
22
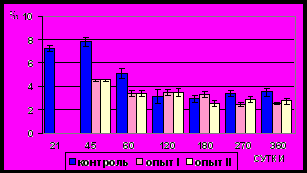
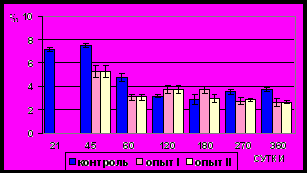
Рис. 16. Количество ядер гладких миоцитов (‰) циркулярного слоя
мышечной оболочки фундального
отдела желудка в норме, при
потреблении диспергированной пищи и в период адаптации к питанию
недиспергированной пищей
Рис. 17. Количество ядер гладких миоцитов (‰) продольного слоя
мышечной оболочки фундального
отдела желудка в норме, при
потреблении диспергированной пищи и в период адаптации к питанию
недиспергированной пищей
Особого внимания заслуживает первый период (120-180 сутки)
адаптации к питанию недиспергированной пищей (табл. 3). Площадь
сечения ядер гладких миоцитов продольного слоя у 180-суточных животных II опытной группы существенно снижается (р<0,05) по отношению к
180-суточным животным I опытной группы, продолжающим питаться
диспергированной пищей (табл. 3). При этом плотность расположения ядер в мышечном слое у 180-суточных животных II опытной группы снижается
незначительно (р>0,05). В результате таких изменений у 180-суточных
животных II опытной группы резко повышается степень
дифференцированности (р<0,05) гладких миоцитов. Следовательно, первый период (120-180 сутки) после перехода от питания диспергированной пищей к питанию недиспергированной пищей характеризуется снижением
интенсивности гипертрофии продольного слоя МО и резким повышением степени дифференцированности его гладких миоцитов. Описанные
изменения показателей площади сечения и плотности расположения ядер в продольном слое МО существенно повлияли на значения ядерно-цитоплазматического отношения, по которым оценивали степень
дифференцированности гладких миоцитов (рис. 14). Последняя существенно возрастает у 180-суточных животных II опытной группы по отношению к животным I опытной группы (р<0,05), а также возрастает у 270- и
360-суточных животных II опытной группы (р<0,05) в сравнении с
животными контрольной и I опытной групп (табл. 3).
Таким образом, смена питания диспергированной пищей на питание недиспергированной пищей обусловливает следующие особенности
морфогенеза продольного слоя МО ФО желудка белых крыс: замедление развития уровня общей гипертрофии мышечного слоя, сохранение
гипертрофированного состояния ядер и цитоплазмы гладких миоцитов,
повышение степени дифференцированности гладких миоцитов.
