Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
Объем и структура диссертации
Диссертация изложена на 110 страницах компьютерного набора и состоит из введения, обзора литературы, двух глав собственных исследований, обсуждения полученных результатов, заключения, выводов, практических рекомендаций, списка литературы. Работа иллюстрирована 22 рисунками и 13 таблицами. Список литературы содержит 195 библиографических источников, из них 42 работы отечественных авторов и 153 зарубежных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Для решения поставленных в работе задач обследовано 110 пациентов, которым проводилось анестезиологическое обеспечение по поводу различного рода хирургических вмешательств на базе отделения анестезиологии и реанимации Клинической больницы №122 им. Л.Г. Соколова ФМБА России.
Распределение обследованных пациентов по полу и видам оперативных вмешательств представлено в табл. 1.
Таблица 1
Распределение больных в зависимости от пола вида и объёма операции
| Вид оперативного вмешательства | Количество пациентов | |||||
| мужчины | женщины | Всего | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Гинекологические операции | ||||||
| Экстирпация матки | - | - | 50 | 45,5 | 50 | 45,5 |
| Консервативная миомэктомия | - | - | 15 | 13,6 | 15 | 13,6 |
| Цистаденома яичника | - | - | 10 | 9,1 | 10 | 9,1 |
| Удаление опухоли яичника | - | - | 5 | 4,5 | 5 | 4,5 |
| Урологические операции | ||||||
| Простатэктомия | 10 | 9,1 | - | - | 10 | 9,1 |
| Пластика уретры | 5 | 4,5 | 5 | 4,5 | 10 | 9,1 |
| Нефрэктомия | 5 | 4,5 | 5 | 4,5 | 10 | 9,1 |
| Всего | 20 | 18,2 | 90 | 81,8 | 110 | 100 |
Большинство исследуемых больных перенесли гинекологические операции – 80 пациентов (72,7%), из которых на долю экстирпация матки приходилось 50 (45,5%). Урологические операции перенесли 30 (27,3%) исследуемых больных, простатэктомия выполнена 10 (9,1%) пациентам.
Возрастно-половая структура пациентов представлена в табл. 2.
Большую часть пациентов составили женщины – 90 (81,8%), и 20 (18,2%) мужчины. Наибольшее количество исследуемых женщин – 39 (35,5%) были в возрасте от 40 до 49 лет. Большинство исследуемых мужчин 8 (7,3%) находились в возрастном диапазоне 50-59 лет.
Таблица 2
Распределение исследуемых больных по возрасту и полу (абс., %)
| Пол | Возраст, годы | ||||
| 20-30 | 30-39 | 40-49 | 50-59 | 60-70 | |
| Женщины абс. | 9 | 16 | 39 | 16 | 10 |
| Женщины % | 8,2 | 14,6 | 35,5 | 14,6 | 9 |
| Мужчины абс. | 2 | 1 | 4 | 8 | 5 |
| Мужчины % | 1,8 | 0,9 | 3,6 | 7,3 | 4,5 |
| Всего абс. | 11 | 17 | 43 | 24 | 15 |
| Всего % | 10 | 15,5 | 39,1 | 21,9 | 13,5 |
Критерии включения в исследование:
- возраст от 20 до 70 лет;
- пациенты с риском анестезии по ASA I-III;
- плановые лапаротомические или лапароскопические вмешательства;
- длительность операции от 1 до 4 часов.
Критериями исключения являлись:
- пациенты, которым интраоперационно проводилась терапия инотропными и вазопрессорными препаратами;
- пациенты с риском анестезии по ASA IV-V;
- наличие в анамнезе заболеваний головного мозга;
- наличие метастазов в легких, головном и спинном мозге;
- хирургическая патология, обнаруженная в ходе оперативного вмешательства и утяжеляющая состояние пациента (острая кишечная непроходимость, перитонит, новообразования ЖКТ);
- сердечная недостаточность III-IV степени по классификации NYHA;
- декомпенсированная дыхательная недостаточность;
- сахарный диабет 1 типа;
- психические заболевания;
- аутоиммунные заболевания;
- туберкулезная инфекция;
- ВИЧ-инфекция;
- исходная анемия Hb < 90 г/л.
Сопутствующая патология исследованных пациентов представлена в табл. 3.
Таблица 3
Характеристика сопутствующей патологии у исследуемых пациентов
| Сопутствующая патология | Мужчины (n=20) | Женщины (n=90) | Всего | |||
| Абс. | % | Абс. | % | Абс. | % | |
| Болезни почек | 10 | 10,2 | 14 | 14,3 | 24 | 24,5 |
| Анемия | 4 | 4,1 | 18 | 18,4 | 22 | 22,5 |
| Пороки сердца | 1 | 1 | 6 | 6,1 | 7 | 7,1 |
| Болезни ЖКТ | 6 | 6,1 | 14 | 14,3 | 20 | 20,4 |
| ГБ и ВСД | 5 | 5,1 | 20 | 20,4 | 25 | 25,5 |
| Всего | 26 | 26,5 | 72 | 73,5 | 98 | 100 |
На 5 этапах интраоперационного периода всем пациентам проводилась регистрация исследуемых показателей в режиме реального времени:
- I этап – фон (исходное состояние до операции);
- II этап – индукция в анестезию;
- III этап – интубация трахеи;
- IV этап – травматический этап операции;
- V этап – пробуждение пациента после операции.
Методика проведения общей анестезии
Накануне оперативного вмешательства назначали премедикацию, включавшую анксиолитик – феназепам 1-2 мг per os на ночь. За 30-40 мин до операции вводили седуксен 0,15 мг/кг внутримышечно, а непосредственно на операционном столе – внутривенно атропин 0,01 мг/кг и сибазон 0,1 мг/кг. Индукцию анестезии осуществляли внутривенным введением пропофола в дозе 2-2,5 мг/кг и фентанила в дозе 3-5 мкг/кг. Интубацию трахеи производили по общепринятым правилам в условиях тотальной миорелаксации недеполяризирующим релаксантом нимбексом в дозе 0,15 мг/кг с последующим переводом на искусственную вентиляцию легких (ИВЛ) аппаратом РО-6. Параметры вентиляции: ЧД – 14 в мин, МВЛ рассчитывали по формуле (масса пациента/10+1), ПДКВ 0 см вод. ст., соотношение вдох : выдох 1 : 2. Интубацию трахеи выполняли эндотрахеальной трубкой с манжетой низкого давления. После перевода на ИВЛ начинали подачу газонаркотической смеси кислорода и закиси азота в соотношении 1 : 2. Поддержание анестезии проводили внутривенным введением фентанила (3-7 мкг/кг/ч) и пропофола (2-6 мг/кг/ч). С целью поддержания миоплегии вводили нимбекс в дозе 0,1-0,2 мг/кг/ч. В конце оперативного вмешательства с целью раннего послеоперационного обезболивания внутривенно вводили 100 мг кетонала.
Инфузионную терапию проводили с использованием кристаллоидных растворов (физиологический раствор натрия хлорида, мафусол, плазмалит) и коллоидных растворов (стабизол, желатиноль). Темп инфузии составлял 8-12 мл/кг/час.
МЕТОДЫ ИССЛЕДОВАНИЯ
Общеклинические методы исследования
Объективное клиническое и лабораторное обследование больных включало оценку общих анализов крови и мочи; биохимический анализ крови (общий белок, альбумины, трансаминазы, билирубин, мочевина, креатинин); исследование коагулограммы, электрокардиограммы, группы крови и резус-фактора. Вышеперечисленные методы клинического и лабораторного обследования позволяли оценить общее состояние больного, выявить наличие сопутствующей патологии и признаки её декомпенсации, предвидеть возможные осложнения анестезии и нивелировать их.
Физиологические методы исследования
Неинвазивное измерение систолического, среднего и диастолического АД, частоту сердечных сокращений (ЧСС), частоту дыхания (ЧД), сатурацию кислорода (SрO2) регистрировали при помощи анестезиологического монитора «КАРДИОЛАН» (Лана-Медика, Россия). Также проводили оценку темпа диуреза, которую рассчитывали в мл/кг/час.
Инструментальные методы исследования
Во время анестезии проводили электроэнцефалографическое исследование и анализировали ряд показателей (нативная ЭЭГ, спектральная мощность). Для регистрации биоэлектрической активности головного мозга использовали электроэнцефалограф «МИЦАР-ЭЭГ-201» (Мицар, Россия). Характеристики снятия ЭЭГ были следующими: скорость развёртки 30 мм/сек, режекторный фильтр включён, ФВЧ 0,3 сек., ФНЧ 30 Гц, усиление амплитуды сигнала 50 мкВ. Запись производили с помощью чашечковых серебряных электродов с биполярного отведения в лобно-затылочной проекции (Fz-Oz).
Расчёт спектральной мощности осуществляли при помощи программного обеспечения «EEG 2000» (Мицар). Спектральный анализ основан на математическом преобразовании Фурье и позволяет представить любой сигнал (в том числе и ЭЭГ) как сумму волн разной частоты. При этом строится особый график, называемый спектр мощности, в котором по горизонтальной оси отложена частота (в герцах, Гц), а по вертикали – выраженность колебаний на этой частоте в микровольтах в квадрате. Для исследования были взяты следующие диапазон частот:
- дельта (Δ) диапазон (0,5-4 Гц);
- тета (θ) диапазон (4-8 Гц);
- альфа (α) диапазон (8-12 Гц);
- бета (β) диапазон (12-25 Гц).
Для регистрации биспектрального индекса ЭЭГ был применён BIS-монитор «A-2000 XP» (Aspect Medical System, США). Использовали одну из разновидностей одноразовых электродов (quarto, standart), которые крепили на лобную область согласно инструкции производителя.
С целью оценки перфузионного индекса были использованы принципы плетизмографии, которые в настоящее время широко применяются в пульсоксиметрии (Калакутский Л.И., Манелис Э.С. 1999). Данная технология позволяет оценивать величину изменения наполнения сосудистого русла при помощи перфузионного индекса (ПИ), представляющего собой отношение сигналов поглощения света: амплитуды пульсирующей составляющей к постоянной составляющей в момент диастолы ПИ= А~ / А_
Анализ ПИ осуществляли при помощи программного обеспечения, написанного на языке C++, на основании данных, получаемых с анестезиологического монитора «КАРДИОЛАН». Значение ПИ было масштабировано в диапазоне от 0 до 4000 для удобства визуального наблюдения за его колебаниями.
Информационную энтропию перфузионного индекса рассчитывали по Шеннону и представляли в виде избыточности энтропии (ИЭ) (Гайдышев И.П., 2001).
Для расчёта концентрации препаратов (фентанил, пропофол) в плазме крови использовали фармакологические математические модели (Shafer S.L., 1992). На основе фармакологических математических моделей нами была создана компьютерная программа, которая позволяет рассчитывать текущие концентрации вводимых препаратов в течение всей операции, а также прогнозировать динамику их изменения.
В зависимости от пола, возраста и веса пациента рассчитывали количество препарата для достижения необходимой концентрации в плазме.
Анализ показателей ИСМ и ПИ выполнен в зависимости от концентраций препаратов используемых для анестезии, в частности, наркотического анальгетика – фентанила и гипнотика – пропофола. Весь интраоперационный период был условно разделен на 3 этапа: нетравматичный (индукция анестезии), травматичный (интубация, травматичный этап операции) и фоновый (до операции, пробуждение). Концентрацию препаратов рассчитывали при помощи математических фармакологических моделей. В зависимости от плазменной концентрации препаратов были взяты 3 диапазона (табл. 4) согласно рекомендациям, предложенным Miller R.D., (2005).
Таблица 4
Диапазоны препаратов в зависимости от плазменной концентрации
| Препарат | Концентрация препарата | ||
| 1 диапазон концентраций | 2 диапазон концентраций | 3 диапазон концентраций | |
| Фентанил | Ф1 0,5-1,2 мкг/л | Ф2 1,2-2,0 мкг/л | Ф3 2,0 мкг/л и выше |
| Пропофол | П1 0,5-1,5 мг/л | П2 1,5-2,5 мг/л | П3 2,5 мг/л и выше |
Статистическая обработка результатов
Статистическую обработку полученных данных проводили с помощью пакета прикладных программ STATISTICA v. 6.0. Основными методами обработки были корреляционный и регрессионный анализы. Значимость различий определяли с помощью непараметрического критерия Вилкоксона. Статистически значимыми считали различия при p<0,05 (Каминский Л.С., 1964). Производили расчёт трёхмерных графических моделей зависимости ИСМ и ПИ от диапазонов концентраций фентанила и пропофола.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
С целью оценки адекватности анестезии был проведён сравнительный анализ параметров, ЭЭГ, ПИ, АДср, ЧСС на 5 этапах интраоперационного периода (табл. 5).
Таблица 5
Значения характеристик ЭЭГ, ПИ, АДср, ЧСС для состояний 1 и 2
на этапах операции
| № № этапа | | Состояние 1, Медиана (интерквартильный размах) | Состояние 2, Медиана (интерквартильный размах) |
| I этап | Δ | 0,45 (0,35-0,55) | 101,00 (100,00-102,00)* |
| θ | 0,95 (0,75-1,05) | 30,00 (29,00-35,00) * | |
| α | 1,95 (1,70-2,05) | 8,00 (8,00-9,00) * | |
| β | 2,70 (2,55-2,95) | 4,00 (3,00-5,00) * | |
| ПИ | 376,0 (304,0-465,5) | 2063,0 (1883,0-2132,0) * | |
| АДср | 96,80 (93,26- 103,64) | 90,74 (89,86- 97,96) * | |
| ЧСС | 94,20 (91,32- 100,50) | 84,00 (76,00- 99,00) | |
| II этап | Δ | 101,00 (100,00-102,00) | 29,00 (27,00-31,00) * |
| θ | 30,00 (29,00-35,00) | 6,00 (5,00-7,00) * | |
| α | 8,00 (8,00-9,00) | 3,00 (2,00-4,00) * | |
| β | 4,00 (3,00-5,00) | 2,70 (2,00-3,00) * | |
| ПИ | 2063,0 (1883,0-2132,0) | 602,5 (443,0-902,0) * | |
| АДср | 90,74 (89,86- 97,96) + | 90,06 (86,84- 98,54) | |
| ЧСС | 84,00 (76,00- 99,00) | 85,00 (78,00- 90,00) | |
| III этап | Δ | 141,00 (138,00-143,00) | 56,00 (52,00-60,00) * |
| θ | 36,00 (34,00-39,00) | 24,00 (22,00-26,00) * | |
| α | 35,00 (32,00-38,00) | 14,50 (12,00-16,00) * | |
| β | 15,00 (12,00-17,00) | 8,00 (7,00-9,00) * | |
| ПИ | 2302,0 (2066,5-2506,5) | 1137,5 (1070,5-1219,5) * | |
| АДср | 88,00 (78,28- 90,74) + | 92,06 (84,86- 98,36) * | |
| ЧСС | 81,00 (75,00- 91,00) | 79,00 (76,00- 86,00) | |
| IV этап | Δ | 3,00 (2,80-3,80) | 205,00 (198,00-210,00) * |
| θ | 6,00 (5,00-7,00) | 38,50 (36,00-41,00) * | |
| α | 22,50 (21,00-28,00) | 37,50 (36,00-42,00) * | |
| β | 7,00 (5,00-8,00) | 14,00 (12,00-17,00) * | |
| ПИ | 2243,0 (1546,5-2767,0) | 3193,0 (2646,5-3567,0) * | |
| АДср | 102,97(95,46- 110,64) | 88,66 (85,16- 96,28) * | |
| ЧСС | 77,50 (69,00- 84,00) | 77,00 (73,00- 81,00) | |
| V этап | Δ | 1,05 (0,90-1,20) | 3,80 (3,60-4,00) * |
| θ | 0,45 (0,40-0,60) | 2,20 (2,10-2,40) * | |
| α | 0,80 (0,70-0,90) | 0,50 (0,40-0,60) * | |
| β | 1,20 (1,10-1,30) | 1,05 (0,90-1,20) * | |
| ПИ | 4938,5 (4205,0-5320,0) | 5523,0 (5510,0-6100,0) * | |
| АДср | 95,96 (79,96- 100,48) | 79,22 (74,16- 85,64) *+ | |
| ЧСС | 79,00 (72,00- 84,00) | 73,00 (69,00- 77,00) |
*- p<0,05 по сравнению с состоянием 1
+ – p<0,05 по сравнению с исходным АДср
Δ, θ, α, β (мкВ2) – диапазоны спектральной мощности ЭЭГ.
Выявлено, что показатели ЧСС и АДср на исследуемых этапах операции недостоверно отражали описанные изменения в состоянии пациентов. Так ЧСС значимо не отличалась в исследуемых парах состояний всех пяти этапов. Несмотря на то, что среднее артериальное давление значимо отличалось в парах 1, 3, 4 и 5 этапов, по сравнению с исходным АДср. достоверные отличия выявлялись в сторону с меньшими значениями. Кроме того, возможности измерения неинвазивного артериального давления несопоставимы с оценкой динамики ПИ и ЭЭГ. Параметры ЭЭГ и ПИ по сравнению с изменениями гемодинамических показателей более своевременно и наглядно отражают состояние пациента в интраоперационном периоде.
Проведена сравнительная характеристика спектральной мощности ЭЭГ и биспектрального индекса на различных этапах интраоперационного периода (табл. 6).
Таблица 6
Динамика диапазонов спектральной мощности ЭЭГ и BIS на 5 этапах интраоперационного периода
| | Фон | Индукция | Интубация | Травматичный этап операции | Пробуждение |
| Δ | 6,1 (4,6-10,0) | 108,1 (50,35-194,5) * | 83,2 (55,8-174,2) | 10,6 (6,1-16,9) * | 6,4 (4,75-9,4) * |
| θ | 3,5 (2,1-6,0) | 27,4 (13,6-42,5) * | 24,5 (15,1-34,6) | 5,9 (3,1-11,5) * | 4,95 (2,75-8,0) * |
| α | 7,8 (5,0-14,0) | 19,4 (10,1-34,2) * | 18,8 (10,4-38,4) | 5,7 (2,8-12,2) * | 7,2 (4,2-14,5) |
| β | 5,0 (3,3-9,1) | 9,3 (5,75-16,8) * | 12,1 (6,3-20,8) | 10,6 (6,8-18,2) | 10,5 (7,3-16,9) |
| BIS | 95 (92-97) | 30 (29-60) * | 45 (43-58) | 76 (75-80) * | 88 (85-92) * |
*- p<0,01 по сравнению с предыдущим этапом
Δ, θ, α, β (мкВ2) - диапазоны спектральной мощности ЭЭГ.
Показатель BIS удобен для оценки глубины анестезии благодаря наличию числовой шкалы, представленной в диапазоне от 0 до 100. Относительно спектральной мощности ЭЭГ, Δ-область является основной характеристикой NREM фазы сна (Gross R.E., 1992; Tasali E. et al., 2008). Поэтому изменение этого диапазона ЭЭГ стало основой для характеристики динамики ЭЭГ в интраоперационном периоде. Выявлено, что Δ-область спектральной мощности ЭЭГ и кривая BIS меняются разнонаправлено на исследуемых этапах интраоперационного периода. Был предложен интегральный параметр спектральной мощности ЭЭГ, который мы назвали «индекс спектральный мощности» (ИСМ). Для того что бы получить цифровой показатель, величина мощности Δ-диапазона было отнесена к сумме значений Δ-, α- и β-диапазонов. Такая процедура позволила использовать цифровую оценку ИСМ в диапазоне от 0 до 1. Отметим, что θ-область в расчёт не входила, несмотря на то, что на всех этапах интраоперационного периода наблюдались ее изменения в абсолютных числах. Но при этом, как видно из табл. 7, значения спектра в θ-диапазоне выраженные в процентах, в отличие от других составляющих спектральной мощности, ни на одном из этапов статистически значимо не изменялись. Таким образом, включать данный диапазон в расчёт ИСМ мы сочли нецелесообразным.
Таблица 7
Динамика диапазонов спектральной мощности ЭЭГ выраженная
в процентах от общей мощности
| | Фон | Индукция | Интубация | Травматичный этап операции | Пробуждение |
| Δ | 27,2% | 65,8%* | 60% | 32,4%* | 21,6%* |
| θ | 15,6% | 16,7% | 17,7% | 18% | 16,9% |
| α | 34,8% | 11,8%* | 13,6% | 17,5%* | 24,7%* |
| β | 22,4% | 5,7%* | 8,7% | 32,1%* | 36,8% |
*- p<0,01 по сравнению с предыдущим этапом
Для оценки динамики изменений ИСМ и BIS мы провели их сравнительный анализ на всех исследуемых этапах интраоперационного периода, что представлено в табл. 8.
Таблица 8
Динамика ИСМ и BIS на 5 этапах интраоперационного периода
| | Фон | Индукция | Интубация | Травматичный этап операции | Пробуждение |
| ИСМ | 0,30 (0,24-0,38) | 0,69 (0,56-0,83) * | 0,55 (0,44-0,8) | 0,39 (0,31-0,46) * | 0,29 (0,23-0,33) * |
| BIS | 95 (92-97) | 30 (29-60) * | 45 (43-58) | 76 (75-80) * | 88 (85-92) * |
*- p<0,01 по сравнению с предыдущим этапом
Как показано в табл. 8, показатели ИСМ и BIS имеют схожие изменения на всех этапах интраоперационного периода.
С помощью регрессионного анализа нами была исследована зависимость между BIS и ИСМ (рис.1).
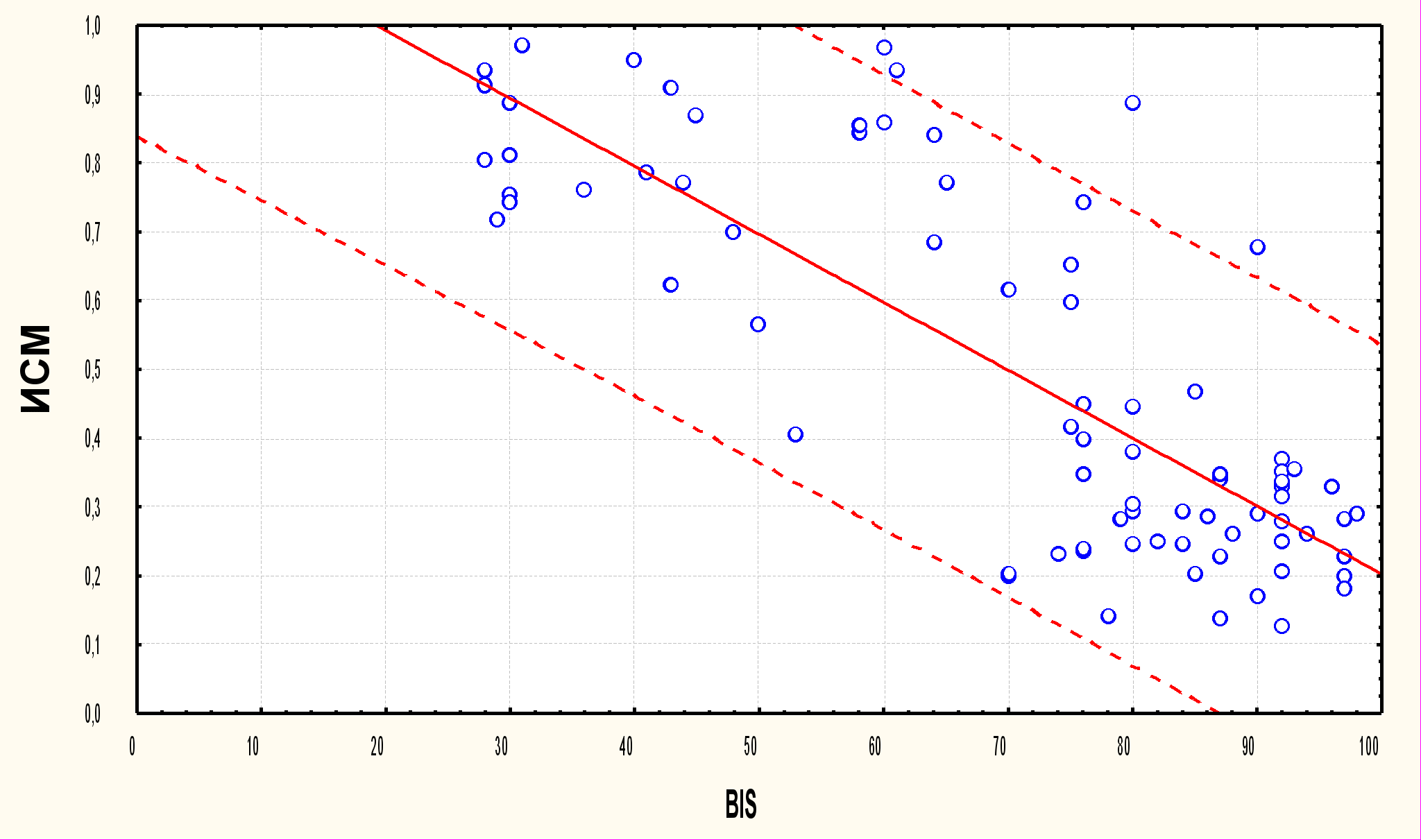
ИСМ = 1,1903-0,0099*x
BIS:ИСМ: r = – 0,7952, p = 0,0000; y = 1,19025904 – 0,00987522879*x
Рис.1. Взаимосвязь между показателями BIS и ИСМ на исследуемых этапах интраоперационного периода (r = – 0,79, p<0,01).
Из приведённых данных видна динамика показателей BIS и ИСМ на различных этапах операции и анестезии. Выявлена обратная корреляционная связь (r = – 0,79), которая является статистически значимой (p<0,01).
Таким образом, наличие статистически значимой корреляционной связи между показателями ИСМ и BIS позволяет использовать индекс спектральной мощности как характеристику гипнотического компонента анестезии.
В дальнейшем мы провели сравнительный анализ индекса спектральной мощности электроэнцефалографии и перфузионного индекса на всех исследуемых этапах интраоперационного периода (табл. 9; рис. 2).
Таблица 9
Динамика ИСМ и ПИ на 5 этапах интраоперационного периода
| | Фон | Индукция | Интубация | Травматичный этап операции | Пробуждение |
| ИСМ | 0,32 (0,25-0,36) | 0,79 (0,67-0,86) * | 0,77 (0,61-0,83) | 0,36 (0,30-0,48) * | 0,26 (0,20-0,31) * |
| ПИ | 1031 (672-1251) | 5693 (3923-6673) * | 1717 (954-2755) * | 1543 (1029-2100) | 928 (483-1140) * |
*- p<0,01 по сравнению с предыдущим этапом
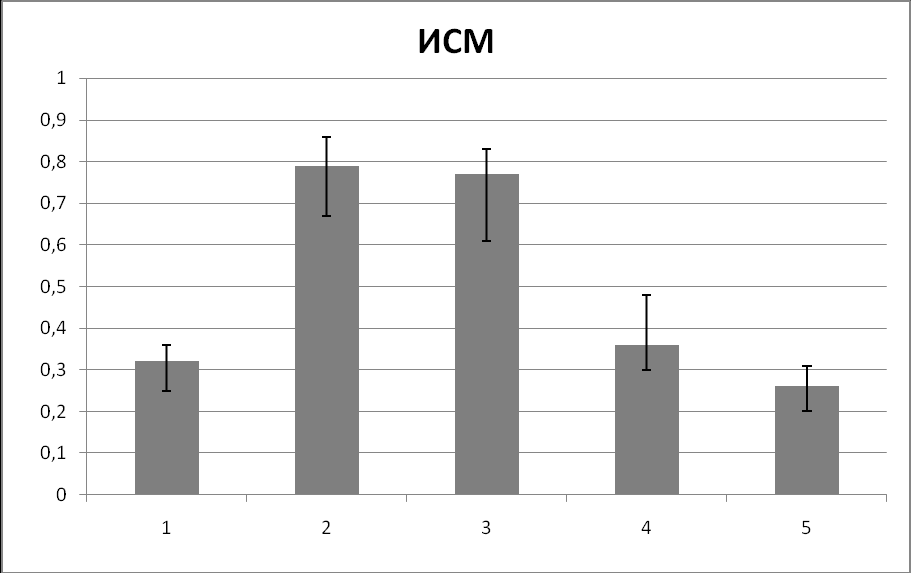
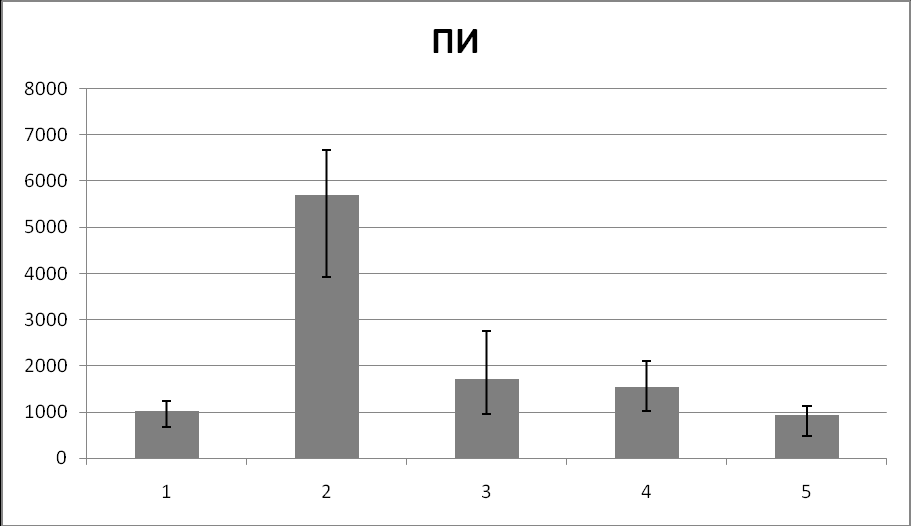
Рис. 2. Динамика значений медиан ИСМ и ПИ на исследуемых этапах периоперационного периода.
Из приведённых данных видно, что показатели ИСМ и ПИ меняются однонаправленно на всех исследуемых этапах интраоперационного периода за исключением 3 этапа (интубация).
С помощью регрессионного анализа нами была исследована зависимость между ИСМ и ПИ.
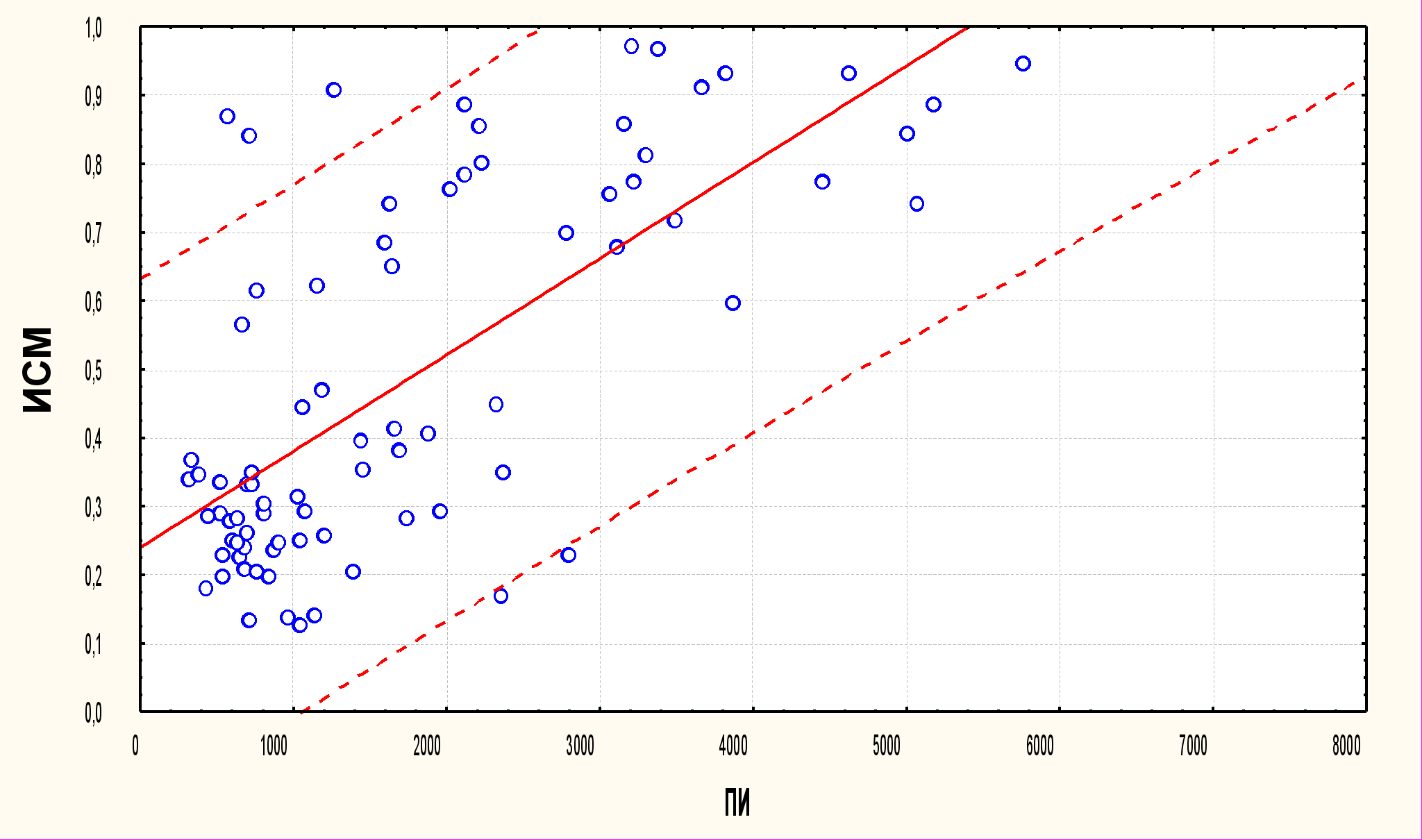
ПИ:ИСМ: r = 0,7012, p = 0,0000; y = 0,240139274 + 0,000140623756*x
ИСМ = 0,2401+0,0001*x
Рис. 3. Взаимосвязь между показателями ИСМ и ПИ на исследуемых этапах интраоперационного периода (r = 0,70, p<0,01).
Отчётливо прослеживается прямая корреляционная связь между показателями ИСМ и ПИ (r = 0,70), которая является статистически значимой (p<0,01).
Таким образом, показатели ИСМ и ПИ меняются однонаправлено с высокой корреляцией во время операции и анестезии и являются взаимодополняющими критериями оценки проводимого анестезиологического обеспечения. При этом показатель ПИ более чувствительный маркер недостаточной анальгезии по сравнению с ИСМ. Анализ этих параметров позволяет оценивать анестезию по составляющим компонентам: гипнотическому (ИСМ), а также анальгетическому и вегетативному (ПИ).
На следующем этапе исследования была проведена оценка динамики показателей ИСМ и ПИ в зависимости от концентраций препаратов (фентанил, пропофол) на различных этапах интраоперационного периода.
Динамика показателей ИСМ и ПИ продемонстрирована нами в трехмерной системе координат. Различной интенсивностью серого цвета показана зависимость исследуемых величин от уровней концентрации пропофола и фентанила (рис. 4-7). На оси Z представлена динамика управляемых переменных, которыми являются показатели ИСМ и ПИ. В качестве управляющих переменных выступают концентрации пропофола (ось Y) и фентанила (ось X).
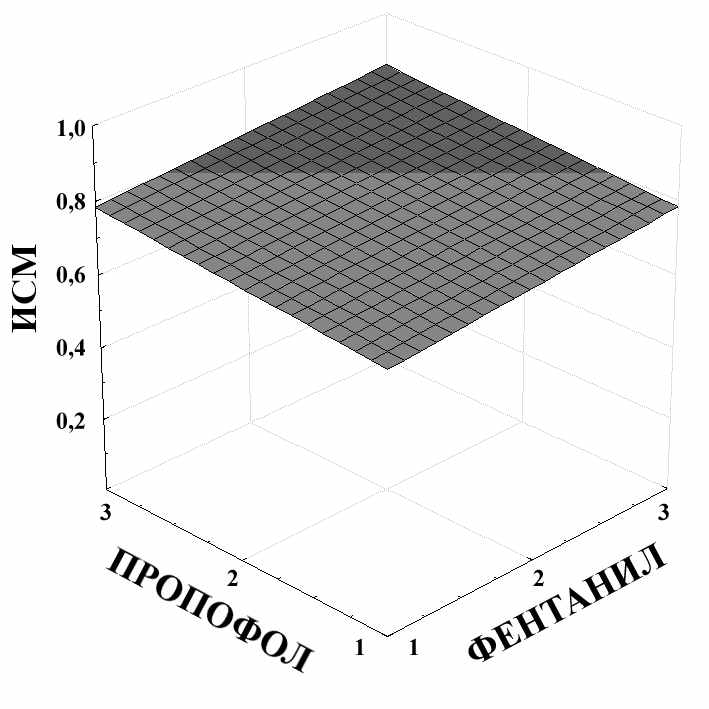
ИСМ = 0,6367+0,0367*x+0,0367*y
Рис. 4. Связь показателя ИСМ с концентрацией пропофола и концентрацией фентанила для нетравматичного этапа операции.
По данным, представленным на рис. 4, видно, что уровень ИСМ равный 0,6 и выше можно достичь при значениях концентраций пропофола 1,5-2,5 мг/л и фентанила 1,2-2,0 мкг/л. При дальнейшем увеличении концентрации препаратов показатель ИСМ повышается незначительно.
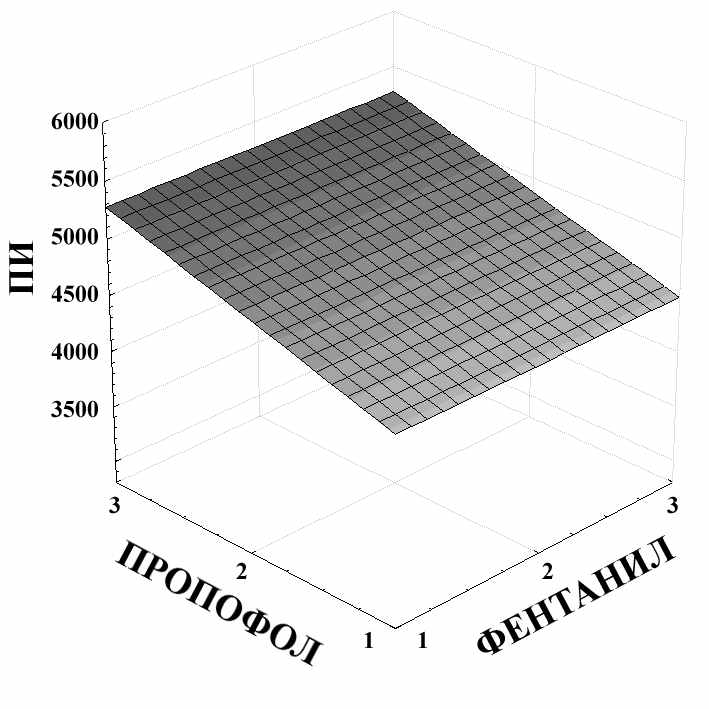
ПИ = 4085,7778-1,1667*x+398*y
Рис. 5. Связь показателя ПИ с концентрацией пропофола и концентрацией фентанила для нетравматичного этапа операции.
Согласно рис. 5, увеличение концентрации пропофола до 3,0 мг/л вызывает интенсивный рост ПИ до 5250. В то же время, повышение концентрации фентанила не вызывает столь значимого роста показателя ПИ. В частности, повышение концентрации фентанила до 3,0 мкг/л приводит к увеличению ПИ только до 4500. Таким образом, показатель ПИ является более чувствительным к повышению концентрации пропофола по сравнению с фентанилом.
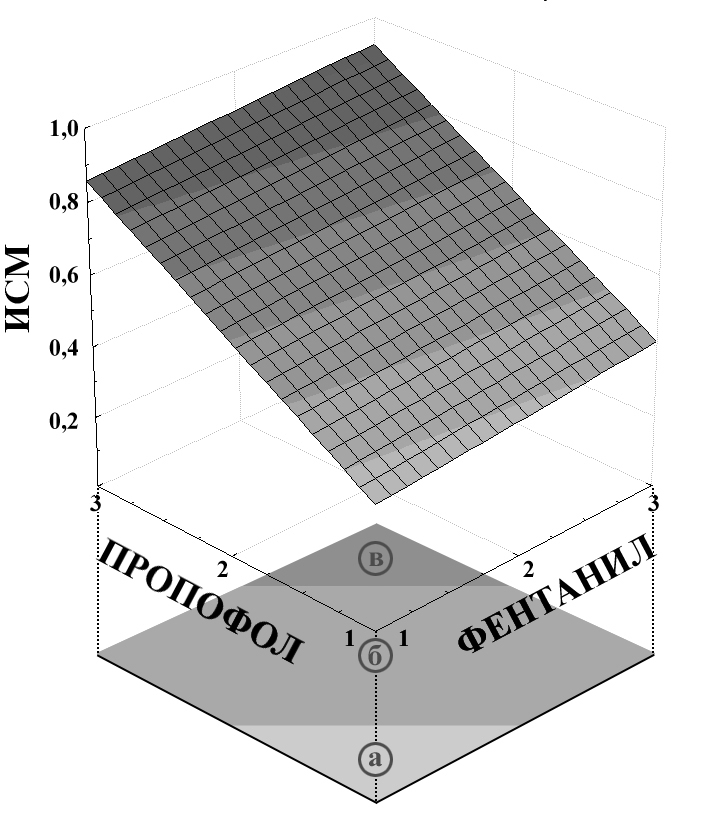
ИСМ = 0,0589+0,0333*x+0,255*y
Рис. 6. Связь показателя ИСМ с концентрацией пропофола и концентрацией фентанила для травматичного этапа операции.
* В горизонтальной плоскости как было указано выше, дополнительно нанесены уровни травматичного этапа: а – при зашивании раны, б – интубация трахеи, в – активные воздействие на внутренние органы, в частности тракция матки.
Рис. 6 демонстрирует высокие потребности в пропофоле (выше 2,0 мг/л) и фентаниле (выше 2,0 мкг/л) на травматичном этапе операции, которые требуются для достижения необходимой стадии анестезии, что подтверждается значениями показателя ИСМ 0,6 и выше.
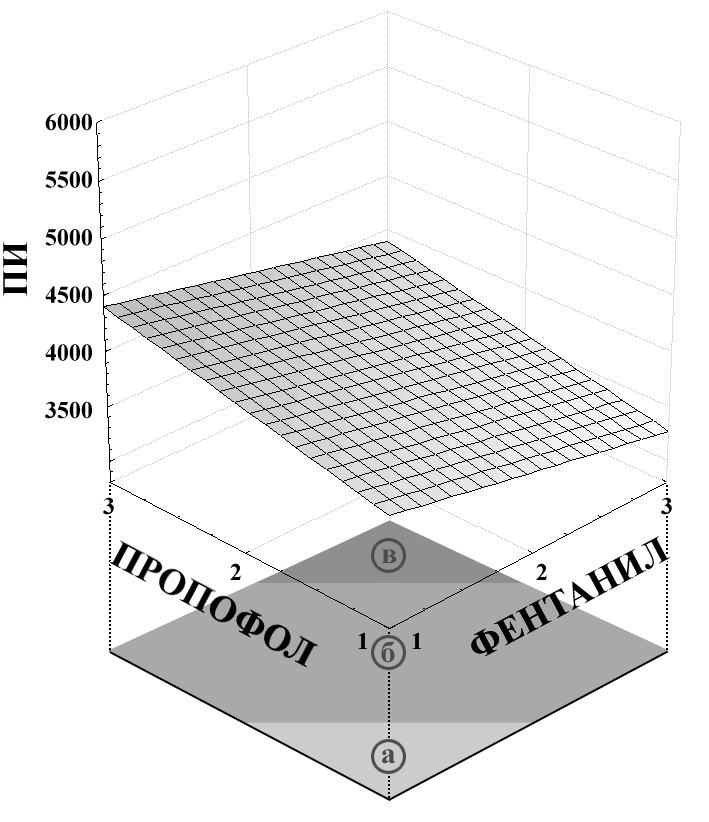
ПИ = 3744,2222-260,5*x+307*y
Рис. 7. Связь показателя ПИ с концентрацией пропофола и концентрацией фентанила для травматичного этапа операции.
На рис. 7 показательным является невыраженный рост ПИ при увеличении концентрации фентанила и пропофола. Это свидетельствует о том, что рост агрессивности воздействия отражается на динамике этого показателя. Иными словами, значения ПИ являются более чувствительным к хирургической агрессии, чем значения ИСМ.
Таким образом, показатели ИСМ и ПИ динамично изменяются не только в зависимости от этапа интраоперационного периода (травматичный, нетравматичный), но и от концентраций фентанила и пропофола.
Полученные данные динамики показателей ИСМ и ПИ на различных этапах анестезии позволяют оценить эффективность качества анестезии и управлять концентрацией препаратов в необходимых пределах.
