Химия атмосферы
| Вид материала | Лекция |
СодержаниеГеохимический цикл азота Распределение солнечной энергии, падающей на землю Состав и химическая зональность атмосферы |
- Программа дисциплины «Химия атмосферы», 98.37kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- C. Исследование атмосферы и океана оптическими методами, 39.28kb.
- C. Исследование атмосферы и океана оптическими методами, 41.93kb.
- C. Исследование атмосферы и океана оптическими методами, 41.81kb.
- Утверждаю, 65.11kb.
- Программа «аналитическая химия» по направлению подготовки 020100 «Химия», 31.74kb.
- Первое информационное сообщение, 25.56kb.
Тема Химия атмосферы.
Лекция 2.
Геохимия главных компонентов. Вертикальная химическая зональность
Геохимия азота
Азот от греческого азоос означает безжизненный. На самом деле азот не ядовит, но просто по своим свойствам для не может заменить кислород и в чисто азотной атмосфере живое погибает из –за отсутствия последнего. Тем не менее, в земной атмосфере молекулярный азот является главным компонентом и уже только поэтому не может не оказывать экологического влияния.
Порядковый номер азота семь, пятая группа, второй период. В таблице Менделеева располагается между углеродом и кислородом и химические свойства этого элемента как бы промежуточные между ними. Во внешней оболочке 5 электронов, при этом на р-подуровне три неспаренных электрона, поэтому в молекуле азота атомы связаны прочно тройной связью, что объясняет их устойчивость и малую химическую активность. Энергия диссоциации очень велика (945 кдж/моль), поэтому даже при нагревании до 3000 град диссоциирует лишь 0,1% молекул и только при этой температуре начинает реагировать с кислородом и металлами, а с водородом также при нагревании и в присутствии катализаторов. Неметаллические свойства азота выражены слабее, чем у кислорода, меньше электроотрицательность, поэтому связь с водородом менее полярная, и водородные соединения азота не отщепляют в водном растворе водород и не имеют кислотных свойств. Плотность азота немного меньше чем у воздуха, температура плавления -210, кипения - -195,6 оС. В природе по большей части находится в свободном молекулярном состоянии в виде газа.
Азот – главный компонент земной атмосферы, где его объемная доля 78,2 %, однако общее содержание азота во внешних оболочках, включая земную кору всего 0,04%. Из неорганических соединений в природе известны оксиды, гидриды, соли азотной кислоты - селитра Природных минеральных скоплений, где азот минералообразующий элемент немного. Известно лишь одно месторождение в Чили натровой селитры. Зато велика роль азота для биоты, где он входит в состав белков, аминокислот. Из соединений азота в природе заметную роль играют водородные соединения (аммиак, ион аммония) и кислородные соединения солей азотистой и азотной кислоты (нитраты, нитриды). Высшая валентность +5 в азотной кислоте, сильнейшем окислителе, который окисляет до кислот многие неметаллы (серная, фосфорная), а низшая минус 3 в аммиаке, поэтому последний является восстановителем. Металлы окисляются азотной кислотой легко за исключением золота, платины, тантала, родия, иридия. Сама азотная кислота при этом восстанавливается до оксидов с уменьшением положительной валентности, до нулевой у молекулярного азота. Смесь одной части азотной и 3-4 частей соляной кислот – царская водка окисляет и золото. Усиление окисляющих свойств обусловлено, тем, что азотная кислота окисляет соляную, с выделением в качестве промежуточного продукта хлора – еще более сильного окислителя.
Геохимический цикл азота
Азот постоянно поступает в атмосферу из глубин Земли с вулканическими эманациями, которые содержат от первых единиц до нескольких десятков процентов молекулярного азота (в газах лав гавайских вулканов содержится до 5,7 вес.% N2). Еще более высокое содержание азота отмечается в газах горячих источников, получивших в связи с этим наименование азотных терм. В азотных фумаролах Везувия содержание азота достигает 98 вес. %.
Лишь небольшая часть азота играют активную роль в биосфере, однако роль эта весьма важна. По данным А. Н. Штралер и А. Г. Штралер из нее 7% азота заключено в живых организмах, 5% захоронено в осадках , а остальное в почве и разлагающейся органике.
За небольшим исключением животные и растения не могут получать азот непосредственно из атмосферы, растения получают его из почвенных солей, а животные даже из солей не могут его усваивать, а лишь питаясь растениями.
При гниении органических остатков, азот из белков, где его доля достигает 18%, переходит в аммиак, в почве он окисляется нитрифицирующими бактериями до азотной кислоты и хорошо растворимых нитратов. Последние легко поглощаются растениями а часть азота под воздействием денитрифицирующих бактерий выделяется в молекулярной форме и поступает в атмосферу, что создает дефицит азота в почве, который необходимо пополнять удобрениями.. Однако имеются и природные процессы восстанавливающие этот дефицит. Это деятельность азотных (клубеньковых) бактерий. Усваивая азот непосредственно из атмосферы, они питают им растения, а те превращают его в белки. В этом же направлении работают и электрические разряды в атмосфере с образованием оксидов азота и азотной кислоты, которые с осадками попадают в почву.
В отличие от биосферы, где миграция азота сопровождается образованием и распадом его соединений, для атмосферы образование окислов азота представляет собой хотя и закономерное, но редкое явление. Поскольку соединение азота с кислородом воздуха требует затраты значительной энергии, в атмосфере такого рода реакции происходят только при вспышке молнии. Таким образом, содержание N02 в тропосфере (NO в воздухе быстро окисляется до N02) прямо зависит от числа и интенсивности гроз. Об этом можно судить по вариациям содержания нитратов в дождевых водах районов с различным климатом. Максимальное содержание нитрат-иона (первые единицы миллиграмма на литр) отмечается в дождевых водах, богатых грозами тропических регионов, минимальное (десятые доли миллиграмма на литр и менее) - в осадках влажных районов умеренного климата.
Из 16.1020 моль азота, присутствующих в земной коре, по расчетам К. Делвича 2,7.1020 моль (17%) находятся в виде N2 в атмосфере, 0,014.1020 моль (0,08% ) растворено в океанических водах и 10,3.1020 моль (65%) в той или иной форме заключены в горных породах литосферы
Экологическое значение атмосферы.
Экологическая роль атмосферы огромна. Атмосфера снабжает нас необходимым для дыхания кислородом. Защищает нас от перегрева летом и днем и защищает от холода зимой и ночью. Защищает нас от коротковолнового ультрафиолетового и ионизирующего излучения. Она обеспечивает необходимый для жизни круговорот вещества и энергии.
| РАСПРЕДЕЛЕНИЕ СОЛНЕЧНОЙ ЭНЕРГИИ, ПАДАЮЩЕЙ НА ЗЕМЛЮ | ||||
| Отражается в космическое пространство | Поглощается и переходит в тепловую энергию | Расходуется на круговорот воды | Расходуется на движение воздуха (ветер) | Расходуется на фотосинтез |
| 30% | 47% | 23% | 0,2% | 0,02% |
Почти вся достигшая Земли солнечная энергия, в конечном счете, возвращается обратно в космическое пространство в виде тепловой энергии, но это происходит не сразу. Атмосфера прозрачна для основной части солнечного излучения – видимого света. Однако тепловое (инфракрасное) излучение Земли поглощается молекулами диоксида углерода СО2, воды Н2О, метана СН4, органическими молекулами. Облака также хорошо поглощают тепловое излучение, исходящее от земной поверхности. Поэтому в облачную погоду суточные температуры нес толь контрастны как в ясную. Это излучение вновь возвращается на поверхность Земли. Таким образом, земная атмосфера – это одеяло планеты - ловушка для энергии, которая помогает сохранить тепло на Земле. Наличие атмосферы приводит к повышению средней температуры на нашей планете и смягчает различия между дневными и ночными температурами. Это явление называют парниковым эффектом. Если бы парникового эффекта не было, средняя температура на нашей планете составляла бы не плюс 150 С, как сейчас, а минус 25 -270 С.
Атмосфера – самый маленький по своей массе из геологических резервуаров Земли, она составляет менее 10–5 % ее массы. Именно ограниченные размеры делают атмосферу такой чувствительной к загрязнению. Кроме того, за счет вращения Земли и перепада температуры с высотой атмосфера очень быстро перемешивается и загрязнение ее постепенно приобретает глобальный характер, Однако атмосфера, как и все прочие компоненты сложной планетной системы, обладает способностью к самоочищению. Но об этом мы будем говорить позже. Все происходящие на Земле так называемые гипергенные или экзогенные процессы определяются свойствами атмосферы или прямо связаны с ней, Это климат, это рельеф, это процессы внешней геодинамики, выветривание, эрозия, эоловый перенос и осадконакопление.
Большая часть биологических видов приспособилась жить в условиях суши, которые определяются динамикой и химическим составом наземной атмосферы. Все живое на суше давно приспособилось к определенному составу и давлению атмосферного столба. Вследствие падения общего давления атмосферы по мере подъёма на высоту соответственно снижается и парциальное давление кислорода. В лёгких человека постоянно содержится около 3 л альвеолярного воздуха. Парциальное давление кислорода в альвеолярном воздухе при нормальном атмосферном давлении составляет 110 мм рт. ст., давление углекислого газа — 40 мм рт. ст., а паров воды −47 мм рт. ст. С увеличением высоты давление кислорода падает, а суммарное давление паров воды и углекислоты в лёгких остаётся почти постоянным — около 87 мм рт. ст. Поступление кислорода в лёгкие полностью прекратится, когда давление окружающего воздуха станет равным этой величине.
На высоте около 19—20 км давление атмосферы снижается до 47 мм рт. ст. Поэтому на данной высоте начинается кипение воды и межтканевой жидкости в организме человека. Вне герметической кабины на этих высотах смерть наступает почти мгновенно. Таким образом, с точки зрения физиологии человека «космос» начинается уже на высоте 15—19 км.
По мере подъёма на все большую высоту над поверхностью Земли постепенно ослабляются, а затем и полностью исчезают такие привычные для нас явления, наблюдаемые в нижних слоях атмосферы, как распространение звука, возникновение аэродинамической подъёмной силы и сопротивления. На высотах выше 100 км атмосфера лишена и другого замечательного свойства — способности поглощать, проводить и передавать тепловую энергию путём конвекции (т. е. с помощью перемешивания воздуха). Это значит, что различные элементы оборудования, аппаратуры орбитальной космической станции не смогут охлаждаться снаружи так, как это делается обычно на самолёте, — с помощью воздушных струй и воздушных радиаторов. На такой высоте, как и вообще в космосе, единственным способом передачи тепла является радиационное излучение.
В чем причина падения плотности атмосферы с высотой? На этот вопрос вы мне должны ответить сами.
Состав и химическая зональность атмосферы
Атмосфера имеет достаточно сложный и разнообразный состав, мы знаем, что воздух земной атмосферы это смесь газов, в которой имеются постоянные и переменные составляющие. В чем особенность атмосферного воздуха? Обладая плотностью, почти в сто раз меньшей, чем у воды, он очень подвижен и легко перемешивается, поэтому химический состав его хорошо выдержан, но в пределах определенных зон по вертикали, Нижняя, прилегающая к земной поверхности часть атмосферы до высоты 80 км носит название гомосферы. Плотность гомосферы быстро уменьшается с высотой так, что 99 % ее массы заключено между уровнем поверхности океана и высотой 29 км, однако ее химический состав (имеются в виду количественные отношения между газами) в пределах гомосферы достаточно постоянен до высоты 90- 100км
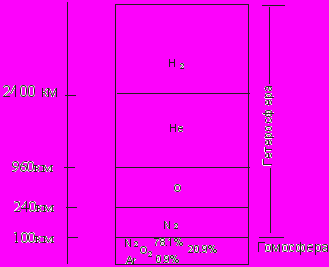
Выше атмосфера отчетливо стратифицирована, в том числе и по химическому составу. Оболочка атмосферы, располагающаяся над гомосферой, получила название гетеросферы. Здесь состав атмосферного воздуха значительно меняется с высотой вследствие фотодиссоциации газовых молекул и вследствие приближения к условиям диффузного равновесия. Гетеросфера состоит из четырех газовых слоев различного химического состава и плотности составляющих компонентов. На высотах 100-240 км расположен первый слой -молекулярного азота лишь с небольшой примесью молекулярного кислорода. Второй слой до 960 км состоит атомарного кислорода. Далее, до 2400 км, прослеживается гелиевый слой. Выше он сменяется водородным слоем, в котором преимущественную роль играют атомы водорода. Условной верхней границей водородного слоя считают высоту 10000 км, Основное внимание нами будет уделено наиболее важной для биосферы зоне атмосферы гомосфере и особенно ее нижнему слою - тропосфере.
Химический состав гомосферы определяется присутствием четырех главных компонентов, составляющих более 99,9!)% ее массы - азота, кислорода, аргона и углекислого газа. Кроме того, постоянными газовыми составляющими атмосферы является также ряд микрокомпонентов, представленных главным образом редкими инертными газами и водородом.
Кроме постоянных составных частей в атмосфере обычно присутствуют в переменных количествах ксенокомпоненты, являющиеся временными примесями, поступление которых обязано вулканической деятельности, жизнедеятельности биосферы, а также производственной и бытовой деятельности человека. Большая часть ксенокомпонентов атмосферы в повышенных концентрациях оказывает отрицательное влияние на развитие растительности и живых организмов и, таким образом, должна рассматриваться как загрязнитель окружающей среды. К числу ксенокомпонентов атмосферы относятся также поступающие в нее в результате различных процессов пылевые частицы, которые часто мигрируют в воздушной среде на большие расстояния. По источнику образования атмосферные пылевые частицы можно разделить на пять категорий
1) пылевые частицы, выдуваемые с континентов (по всей вероятности, их средний химический состав близок к составу лёсса);
2) пылевые частицы растворимых солей, выдуваемые с поверхности океанов и морей;
3) пыль вулканических извержений;
4) пылевые частицы внеземного происхождения;
5) пылевые частицы антропогенного (техногенного) происхождения.
По имеющимся данным можно составить количественное представление об общей массе пылевых частиц, присутствующих в атмосфере. Р. Гаррелс и Ф. Маккензи оценивают среднее количество пыли в 1 м3 значением 10-12 см3. На всю массу тропосферы это составляет 1.05.1013 г пыли. Общее количество пыли, попадающей в Мировой океан из стратосферы и тропосферы, оценивается этими авторами значением 0,6.1014 за счет пыльных бурь). Пылевые частицы внеземного происхождения, представляющие собой частицы космической пыли железо-никелевого и оливин-пироксенового состава, по расчетам ДЖ. Т. Уоссона и др. [340], ежегодно выпадают на земную поверхность в количестве 10-7 г/см2. О составе атмосферной пыли, имеющих морское происхождение, можно судить по разнице в составе дождевых вод, выпадающих вблизи и вдали от морей или океанов. Так, при удалении от океана на несколько сотен километров содержание хлоридов натрия и калия в дождевых осадках уменьшается в десять и более раз. Столь же резко уменьшается в дождевой воде концентрация такого типичного элемента моря, как йод. Сводные данные о количестве пылевых частиц, ежегодно поступающих в атмосферу в результате сжигания твердого и жидкого топлива, из дымовых труб различных металлургических и химических предприятий, цементных заводов и других производств, отсутствуют. По различным подсчетам оно составляет от 5 до 45% общего количества пыли, привносимой в атмосферу
