Особенности эволюции морфологических и молекулярных признаков на примере близкородственных видов дрозофил 03. 02. 07 генетика
| Вид материала | Автореферат |
| Adh имеет наименьший показатель индекса дисперсии. Консервативная митохондриальная последовательность 12S-16S mt rRNA Рис.13 Изменения R(T) Список публикаций по теме диссертации |
- Молекулярные механизмы формирования множественной лекарственной резистентности у Burkholderia, 787.44kb.
- Рабочая программа генетика Код дисциплины по учебному плану опд ф. 6 для студентов, 274.5kb.
- Наследственность и ее роль в патологии медицинская генетика и ее задачи Наследственность, 327kb.
- Эволюция и Генетика, 167.01kb.
- Рабочая программа генетика и селекция Код дисциплины по учебному плану опд ф 1 для, 292.62kb.
- Практическая работа «Генетика», 116.83kb.
- Л. П. Татаринов необратимость эволюции и ее направленность, 194.79kb.
- Генетика Генетика, 18.18kb.
- Л. И. Параллелизмы в молекулярной организации генома и проблемы эволюции. В кн.: Молекулярные, 251.18kb.
- Рабочая программа дисциплины «молекулярная генетика» Код дисциплины по учебному плану, 112.43kb.
Выделены максимальные значения R(t), полученные с учетом индекса инфляции.
Объяснить это можно следующим образом. Индекс инфляции Балмера включает поправку на дисперсии и ковариации дистанций между ними (Equation 19a, Bulmer, 1989): p(Sa) = n(v+(s-4)c)/ā(s-2). Нетрудно показать, что при v+(s-4)c<(s-2)ā/n фактор инфляции будет принимать значения меньше единицы, что при применении поправки приведет к эффекту, противоположному ожидаемому – росту индекса дисперсии. Отмеченный феномен может существовать в ограниченных рамках – границы изменчивости показателя ковариации (c) должны иметь значения от ā/n, при условии соблюдения пуассоновского распределения, когда R(T)=1, до (ā(s-2)-vn)/n(s-4). Если показатель ковариации находится в указанных пределах, индекс дисперсии оказывается занижен, и применение поправки Балмера ведет к его увеличению. Дальнейший рост ковариации приведет к раздуванию индекса дисперсии, и применение поправки дает обратный эффект.
Рост ковариации дистанций может быть вызван независимым (конвергентным) накоплением одинаковых замен у рассматриваемых видов. Действительно, в использованных последовательностях присутствует 31 сайт, обладающий статусом, на основании которого все виды субфилады kanekoi (или два вида из трех) можно отнести к кластеру lummei, и 40 сайтов, свидетельствующих в пользу их локализации совместно с кластером montana. Важно отметить, что во всех последовательностях эти сайты расположены стохастически, не образуя общих кластеров.
Высоко полиморфный локус Adh имеет наименьший показатель индекса дисперсии. Консервативная митохондриальная последовательность 12S-16S mt rRNA имеет наибольший индекс дисперсии. Среди ядерных генов наибольшее значение (с учетом индекса инфляции Балмера) получено для высококонсервативного гена Ras1.
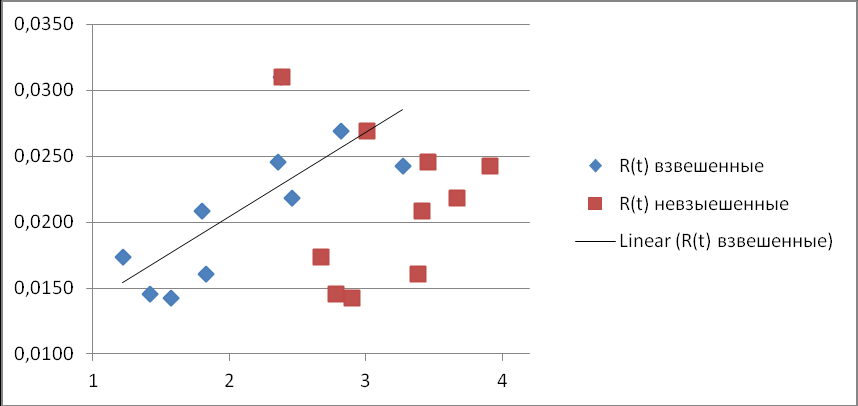
Регрессия средних значений R(T) на средние значения дистанций, определенных по объединенной редуцированной последовательности всех 5-и генов, показала хорошую линейную зависимость только для взвешенных значений R(T) (рис. 12).
Результаты анализа дистанций в парах индивидуальных родословных представлены на графиках 13a, б и в, отдельно для каждой из 3-х субфилад.
Можно отметить несколько общих закономерностей характера изменений R(T).
Ось Х - Среднее количество замен на нуклеотид
Ось Y – значения R(T)
Рис. 12. Соотношение среднего количества замен на один нуклеотид в данной родословной и полученного для этой родословной среднего индекса дисперсии.
а
б
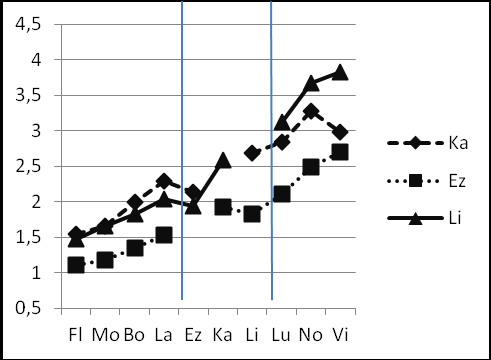
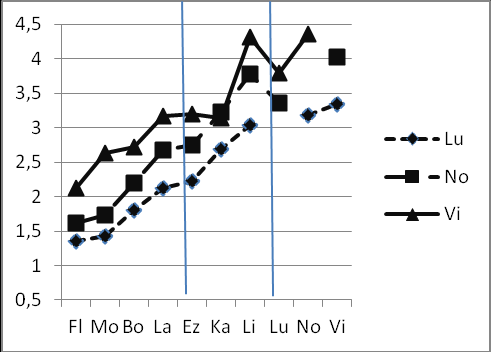
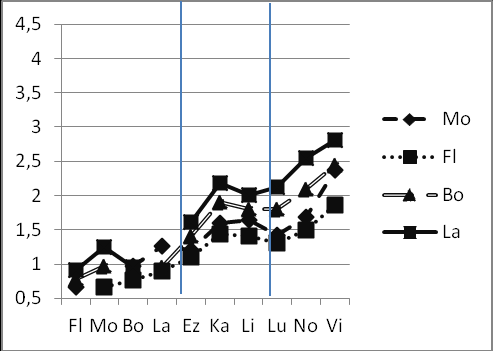
Рис.13 Изменения R(T)i j inflat.,weight (ось Y) в рядах видов, относящихся к одной субфиладе. a – субфилада virilis (D. virilis, D. lummei, D. novamexicana); б –субфилада montana (D. montana, D. flavomontana, D. lacicola, D. borealis); в –субфилада kanekoi (D. kanekoi, D. ezoana, D. littoralis).
в
1. Виды субфилады montana (рис. 13б) имеют наиболее низкие и наиболее сходные между собой показатели R(T). Это свидетельствует о сходной равномерной скорости молекулярной эволюции в соответствующих родословных. При этом D. flavomontana, имеет самые низкие значения R(T).
2. Значения R(T) в парах, включающих вид D. virilis (рис. 13а), являются максимальными, что предполагает наиболее существенные нарушения равномерности хода молекулярных часов в эволюционной линии D. virilis. Остальные виды данной субфилады (D. lummei, D. novamexicana) также имеют более высокие индексы дисперсии по сравнению с представителями других субфилад. Возможно, что на всех этапах расхождения видов данной субфилады были периоды значительных изменений скорости молекулярной эволюции.
3. При сравнении представителей филады virilis и субфилады montana получены минимальные значения R(T). Это означает, что на ранних этапах дивергенции от общего предка молекулярные часы шли более равномерно, чем на поздних этапах у видов – представителей филады virilis.
4. Виды – представители субфилады kanekoi (рис. 13в) (D. kanekoi, D. ezoana, D. littoralis) имеют более сложную картину распределения показателей R(T). Минимальные значения показателя наблюдаются у вида D. ezoana, а виды D. kanekoi и D. littoralis при сравнении между собой показывают промежуточные значения R(T)≈2.5, а при сравнении с представителями других субфилад – противоположные значения.
Как было показано выше, наиболее вероятная топология филогенетического древа включает филаду virilis с видом D. virilis в качестве внешнего по отношению к остальным видам филады, и филаду montana, состоящую из субфилад montana и kanekoi. Это не исключает возможности сохранения видом D. virilis наибольшей близости к предковому виду. Тогда наиболее ранним актом дивергенции явилось отделение общего предка для видов филады montana, далее разделившихся на две субфилады, тогда как выделение субфилады lummei происходило позже. Следует ожидать, что значения R(T) для пар видов, включающих D. virilis и представителя субфилады montana, будут выше, чем для пар, включающих D. virilis и представителя субфилады lummei, предполагая показанную Катлером прямую зависимость R(T) от времени дивергенции. Это ожидание не подтверждается полученными результатами. Тем не менее, топология приведенного дерева может соблюдаться при условии равномерного хода молекулярных часов в эволюционной линии D. virilis на отрезке, включающем дивергенцию с предковыми видами филады montana, и существования более позднего периода ускорения хода молекулярной эволюции в родословной D. virilis.
При формировании предкового вида субфилады lummei происходило изменение скорости молекулярных часов, так как значение R(T) для пары видов D. virilis-D. lummei значительно выше 3. Внутри субфилады lummei также наблюдается значительное нарушение равномерности хода молекулярных часов. Низкие индексы дисперсии, характеризующие виды субфилады montana, свидетельствуют в пользу того, что при происхождении общего предка этих видов, соблюдалось правило равномерного хода молекулярных часов. Тем не менее, оценка среднего индекса дисперсии для каждого из этих видов позволяет предположить существование возможных периодов нарушения хода молекулярных часов на поздних этапах дивергенции, при расхождении вида D. montana и видов D. borealis и D. lacicola.
В субфиладе kanekoi основные события, приводящие к формированию больших значений индекса дисперсии, должны были случиться независимо в ходе формирования видов D. kanekoi и D. littoralis, тогда как дивергенция D. ezoana от предкового вида субфилады в наибольшей степени соответствовала равномерному ходу молекулярных часов.
ОБСУЖДЕНИЕ
Нами было установлено, что неравномерная скорость дивергенции близкородственных видов характерна как для морфологических, так и для молекулярных признаков. Однако причины изменений скорости эволюции морфологических и молекулярных признаков оказываются различными.
Адаптивно значимые признаки в ходе эволюции подвергаются давлению направленного отбора. Но собственно направление отбора и его интенсивность могут существенно меняться даже для представителей одного вида, одновременно обитающих в разных географических изолятах и в разных климатических условиях. Как мы убедились на примере анализа формы крыловой пластины, в этом случае признак может обладать значительной внутривидовой изменчивостью, превышающей межвидовую для близкородственных видов. Важным результатом, полученным при исследовании формы крыловой пластины, является отсутствие направленных изменений по данному признаку в родословных видов данной группы. Даже те отличия, которые были показаны для нескольких видов по латеральной, наиболее консервативной области крыла, связаны с адаптивной дивергенцией видов по характеристикам двигательной активности и формировались, очевидно, независимо в разных родословных.
Признаки формы копулятивного аппарата имеют иной характер изменчивости. Находясь под давлением полового отбора, данные признаки эволюционируют быстро и направленно. Значительная доля изменчивости видоспецифических признаков у эволюционно молодых видов принадлежит рецессивным признакам. В соответствии с концепцией «сита Холдейна», в аутбредных популяциях вероятность фиксации вновь возникающих рецессивных мутаций крайне мала (Haldane, 1927), и основной вклад в эволюционно-значимую изменчивость должен принадлежать доминантным мутациям. Вклад рецессивной изменчивости в формирование новых адаптаций за счет отбора по сохраняющейся в популяциях генетической изменчивости, был объяснен в теоретической работе Орра и Бетанкура (Orr, Betancourt, 2001). Наши результаты, свидетельствующие о сохранении значительной популяционной изменчивости по эволюционно-значимым признакам и преимущественном вкладе рецессивной изменчивости в эволюцию этих признаков, поддерживают концепцию Орра и Бетанкура.
Мы показали, что скорость накопления генетической изменчивости не является постоянной величиной в каждой независимой эволюционной линии и различается между ними. Тем не менее, общая скорость накопления межвидовых различий по форме копулятивного аппарата является наиболее высокой среди прочих морфологических признаков, что соответствует концепции Сингха эволюции генов, ограниченных полом, по «быстрому пути», т.е. со скоростью, многократно превышающей среднюю скорость эволюции генов данного генома (Civetta, Singh, 1998, Singh, Kulathinal, 2000, Haerty et. al., 2007). Вместе с тем, наличие значимого внутривидового полиморфизма по признакам формы копулятивного аппарата, являющихся статусными видовыми признаками, и данные регрессионного анализа показателей изменчивости данных признаков на генетические дистанции между видами предполагают, что эффективность полового отбора по этим признакам существенно снизилась после выделения вида как независимо эволюционирующей совокупности популяций. Следовательно, концепция Сингха приобретает звучание как «эволюция генов, ограниченных полом, по быстрому и прерывистому пути».
Как известно, интенсивное формирование презиготических изоляционных барьеров опосредовано отбором при реализации симпатрических сценариев видообразования. Дрозофилы группы virilis проявляют межвидовые различия по частотным характеристикам брачной песни, за исключением видов субфилады lummei, для которых эти различия носят количественный характер и паттерны сигналов в значительной степени перекрываются (Hoikkala et al., 1982; Hoikkala, Lumme, 1987; Hoikkala, 1988; Routtu et al, 2007). Эти данные согласуются с нашим наблюдениям за эволюцией формы копулятивного аппарата, согласно которым наименьшими различиями обладают виды D. americana и D. novamexicana. Учитывая время дивергенции и направления миграции вновь возникающих видов, можно предположить, что формирование видов D. americana и D. novamexicana осуществлялось по аллопатрическому сценарию. Эволюция всех остальных видов происходила на сопредельной или общей территории и могла осуществляться по симпатрическому сценарию, что и привело к быстрому накоплению видоспецифической изменчивости по признакам, связанным с брачным поведением и оплодотворением.
Интересно, что наибольшую нагрузку по накоплению видоспецифической изменчивости взяли на себя 5-я аутосома и микрохромосома, несущие видоспецифические инверсии у D. lummei. Этот результат подтверждает концепцию Добжанского об эволюционной роли хромосомных перестроек (Dobzhansky, 1971) и соответствует модели «подавления рекомбинации» при накоплении в перестройках видоспецифической изменчивости (Ayala, Coluzzi, 2008). Важно, что здесь впервые получено подтверждение концепции Добжанского на эволюционно-значимых признаках. Ранее такие подтверждения были сделаны на основании анализа замен в коллинеарных последовательностях, попадающих в районы перестроек или свободные от них области хромосом (Ranz et al., 2001, 2007).
При анализе доминирования новых видоспецифических признаков удалось показать, что степень доминирования новых статусных признаков находится в прямой зависимости от времени существования вида с момента его дивергенции от предкового, и связана с эпистатической изменчивостью. Этот результат подтвердил концепцию Фишера об эволюции доминантности (Fisher 1928а,б, 1930), неразрывно связанную с эпистатическими, или модификационными межгенными отношениями. Концепция Фишера представлялась спорной, исходя из упрощенных представлений о регуляции активности экспрессии генов, и была подвергнута жесткой критике со стороны Райта и последователей (Wright, 1934; Crosby, 1963; Kacser and Burns, 1981). Интерес к этой концепции возродился в связи с формированием принципиально новых парадигм молекулярной биологии, и основанных на них математических моделях эволюции генетической архитектуры (Bűrger 2005, 2008; Bagheri 2006; Kopp, Hermisson 2006; Johnson, Barton, 2007). Экспериментальные подтверждения этой концепции в последнее время были найдены в области экологической генетики, что ограничивало реализацию механизмов эволюции доминирования только для адаптивно-ценных признаков и на очень коротких эволюционных промежутках. Полученные нами подтверждения распространяются на отрезки времени, сопоставимые с продолжительностью существования вида. Они могут также объяснить показанный выше феномен направленной изменчивости в родословных данных видов. Отбор по признаку в популяции, дивергирующей от предкового вида, будет приводить к фиксации уклоняющейся формы, на основе сохраняющейся рецессивной изменчивости. На ранних этапах дивергенции этот отбор приведет к формированию асимметричного распределения селектируемого признака. Равная вероятность направления отбора в обоих направлениях на очередных этапах дивергенции будет восстановлена только после накопления новой изменчивости и восстановления симметричной формы распределения количественного признака, по которому идет отбор. Однако такое восстановление изменчивости будет затруднено на ранних этапах дивергенции, так как статус новых признаков является рецессивным, и стабилизирующий отбор по видоспецифическим признакам будет выметать из популяции уклоняющиеся формы, и, соответственно, новые аллели. Только по прошествии определенного времени, необходимого для формирования доминантного статуса нового признака, в популяции начнет накапливаться рецессивная изменчивость. Соответственно, чем короче эволюционные промежутки между последовательными актами дивергенции монофилетических видов, тем выше вероятность однонаправленной эволюции количественных признаков, подверженных действию отбора.
Обращаясь к эффекту нарушения равномерного хода “молекулярных часов”, отметим прежде всего, что этот эффект показан нами для нейтральных или близких к нейтральности замен. Следовательно, влияние отбора на полученные оценки можно исключить, и сопутствующий отбору эффект hitch-hicking также, учитывая применение поправки Гилеспи при определении средней оценки R(T) на данную эволюционную линию по всем используемым последовательностям. Тем не менее, влияние эффекта hitch-hicking возможно для независимых оценок R(T) по каждой последовательности. Катлер предпринял анализ численных моделей, учитывающих различные эволюционные факторы, которые могут влиять на темп накопления замен (Cutler, 2000). В соответствии с результатами этого анализа, интенсивный отбор, действующий на локус, должен способствовать снижению R(T), т.е., более равномерным темпам молекулярной эволюции. Полученные нами результаты хорошо согласуются с выводами Катлера. Высоко полиморфный локус Adh, связанный с пищевыми адаптациями к бродящим субстратам и находящийся под действием положительного отбора (Merçot et al., 1994; Vieira, Charlesworth 2000; Sheeley, McAllister, 2008), имеет наименьший показатель индекса дисперсии. Консервативная митохондриальная последовательность 12S-16S mt rRNA имеет наибольший индекс дисперсии. Среди ядерных генов наибольшее значение (с учетом индекса инфляции Балмера) получено для гена Ras1, также высококонсервативного и обладающего исключительно низким популяционным полиморфизмом (Gasperini, Gibson, 1999). Эти факты подтверждают идею о том, что позитивный отбор (в отличие от очищающего отбора) способствует более равномерным темпам молекулярной эволюции.
В 2008 г. Хартл и Бедфорд на примере видов дрозофил с проаннотированными геномами показали, что зависимость R(T) от количества накопленных замен носит положительный линейный характер. Тем не менее, методологически авторы сравнивали именно последовательности, скорость эволюции которых в геноме существенно варьирует, и использовали виды, время дивергенции которых различается от нескольких миллионов до нескольких десятков миллионов лет. Большие выборки последовательностей и качественные различия между эволюционными скоростями отдельных генов позволяют в этом случае игнорировать поправку Балмера. Однако оценка средних для генома показателей чувствительна к этой поправке. На графике, построенном для средних показателей изученных нами видов, хорошую линейную зависимость удается получить только с учетом поправки Балмера.
Высокие значения R(T), полученные нами как для большинства парных сравнений родословных близкородственных видов дрозофил, так и средних значений для эволюционных линий видов филады virilis и субфилады kanekoi, свидетельствуют о влиянии популяционных механизмов на скорость накопления замен. Араки и Тачида, используя модель карточного домика (НОС) для описания замен, показали, что при условии как стохастического, так и периодического формирования бутылочных горлышек, уже после небольшого числа таких колебаний наблюдается значительный рост R(T). Авторы предположили, что возможным механизмом для генерации требуемой моделью периодичности «бутылочных горлышек» могут быть 100-тысячелетние ледниково-межледниковые циклы. При сходном влиянии такого фактора на группу родственных видов, рост R(T) будет пропорционален времени дивергенции между видами, а следовательно, и генетическим дистанциям между ними. Мы не получили такого результата. Скорее, наоборот, наиболее поздно дивергировавшая субфилада lummei имеет максимальные значения R(T). Можно предполагать, что различные виды испытывали разное давление окружающей среды и в разной степени подвергались эффекту прохождения через «бутылочные горлышки».
В целом полученные результаты соответствуют концепции мозаичности генома, в разных последовательностях которого процессы накопления изменчивости идут с разной скоростью. Предположение о неравномерном темпе эволюционного процесса, в отношении времени дивергенции и времени независимого существования видов, прозвучало еще у Дарвина. Эта идея представлена и в теории Гулда и Элдриджа «прерывистого равновесия» (Eldredge, Gould, 1972). Хотя в виде правила, исполняемого в равной степени всеми последовательностями эволюционирующего генома, данная теория вряд ли найдет подтверждение, тем не менее, она справедлива для большого числа индивидуальных последовательностей в пределах одного генома. Изменение темпов эволюционного процесса является, очевидно, широко распространенным явлением, реализация которого на разных уровнях организации обеспечена действием различных эволюционных факторов.
Выводы
- Показано, что на протяжении всего времени дивергенции видов группы virilis форма копулятивного органа самцов находилась под действием направленного полового отбора. Максимальному давлению отбора подвержены признаки вентральной поверхности эдеагуса, шипа на его конце и формы парамеров.
- Скорость накопления видоспецифической изменчивости по признакам формы копулятивного аппарата различается как между разными эволюционными линиями дрозофил группы virilis, так и в пределах каждой родословной.
- Связь эволюционно-значимых частей копулятивного аппарата дрозофилы с половым поведением опосредована сенсорными микрохетами на вентральной поверхности эдеагуса.
- Эволюция формы крыла у близнецовых видов virilis не имеет направленного характера, связана преимущественно с аллометрическими эффектами и указывает на участие данного признака в формировании частных адаптаций. Дивергенция по форме крыловой пластины осуществляется значительно медленнее, чем по признакам формы полового аппарата.
- Оценки дивергенции видов группы virilis методом RAPD-фингерпринтинга и по последовательности гена Ras1 указывают на неравномерность хода молекулярной эволюции различных участков генома.
- Точные оценки равномерности хода молекулярных часов по последовательностям митохондриальных и ядерных генов у видов дрозофил группы virilis свидетельствуют о нарушениях хода молекулярных часов в большинстве эволюционных линий данной группы видов. Нарушение хода молекулярных часов характерно для поздних стадий дивергенции исследуемых видов.
- Показано, что неравномерная скорость накопления эволюционно-значимой и нейтральной изменчивости опосредована действием различных эволюционных факторов. Нарушения скорости накопления изменчивости по статусным видовым признакам связаны с действием полового отбора, выступающего в роли дизруптивного в момент расхождения видов. Нарушения скорости накопления нейтральной изменчивости вызваны действием генетико-автоматических процессов.
- Эволюция статусных признаков формы копулятивного аппарата у дрозофил осуществляется на основе сохраняющейся генетической изменчивости, в соответствии с концепцией Орра «Сито Холдейна и адаптации на основе поддерживающейся в популяции генетической изменчивости».
- Степень доминирования нового фенотипа усиливается с течением времени, определяя темп и направленность накопления изменчивости; эволюция доминантности осуществляется за счет эпистатической изменчивости, в соответствии с концепцией Фишера «эволюции доминантности».
- В накоплении видоспецифической изменчивости статусных признаков формы копулятивного аппарата принимают участие все хромосомы, но мажорная роль принадлежит 5-й и 6-й аутосомам, несущим видоспецифические инверсии, что соответствует модели «подавления рекомбинации».
Список публикаций по теме диссертации
- Горностаев Н.Г., Куликов А.М., Митрофанов В.Г. Морфологическая диагностика самцов видовой группы Drosophila virilis s.l. (Diptera, Drosophilidae) // Энтомологическое обозрение. 1998. Т. 77. Вып. 3. С. 700-703.
- Куликов А.М., Мельников А.И., Горностаев Н.Г., Митрофанов В.Г. Дивергенция видов дрозофил группы virilis по форме фаллуса // Докл. Акад. Наук. 2001. Т. 376. N 6. С. 841-843.
- Куликов А.М., Мельников А.И., Горностаев Н.Г., Лазебный О.Е., Митрофанов В.Г. Морфометрический анализ половых органов самцов видов-двойников Drosophila virilis Sturt.// Генетика, 2004, Т.40. №2. С. 180-194.
- Kulikov A.M., Melnikov A.I., Gornostaev N.G., Lazebny O. E. and Mitrofanov V. G. Morphological analysis of male mating organ in the Drosophila virilis species group: a multivariate approach // J. Zool. Syst. Evol. Research. 2004. V. 42. № 2. P. 135-144.
- Темкина Л.М., Куликов А.М., Лазебный О.Е., Митрофанов В.Г. Некоторые проблемы исследования генетических основ видообразования на примере дрозофил группы virilis // Онтогенез. 2005. Т. 36. № 5. C. 1-7.
- Кузнецов А., Куликов А.М. Рекуррентная модель зависимости динамики вытеснения рецессивной мутации от компонент приспособленности и способ ее решения // Генетика. 2005. Т. 41. № 3. C. 411-421.
- Куликов А.М., Кузнецов А., Марец Ф., Митрофанов В.Г. Определение компонент приспособленности особей, несущих рецессивную летальную мутацию l(2)М167DTS с теплочувcтвительным доминантным эффектом, в популяционных экспериментах на D. melanogaster // Генетика. 2005. Т. 41. № 6. C. 767-777.
- Марков А.В., Куликов А.М. Системы различения «своего» и «чужого» и формирование репродуктивной изоляции (гипотеза иммунологического тестирования брачных партнеров) // Успехи современной биологии. 2006. Т. 126, № 1. C. 10-26.
- Марков А.В., Куликов А.М. Историческое развитие систем распознавания «своего» и «чужого» и их роль в эволюции биоразнообразия // Успехи современной биологии. 2006. Т. 126. № 2. C. 132-148.
- Марков А.В., Куликов А.М. Гипотеза «иммунологического тестирования» партнеров – согласованность адаптаций и смены половых предпочтений // Известия РАН. Сер. биол. 2006. Т. 33. № 3. C. 205-216.
- Марков А.В., Куликов А.М. Гипотеза «иммунологического тестирования» партнеров – системы распознания «свой-чужой» в исторической перспективе // Известия РАН. Сер. биол. 2006. Т. 33. № 4. C. 311-322.
- Михайловский С.С., Куликов А.М., Потапов С.Г., Лазебный О.Е., Митрофанов В.Г. RAPD-фингерпринтинг видов-двойников дрозофил группы virilis // Генетика. 2007. Т. 43. № 1. C. 105-109.
- Bubliy O.A., Tcheslavskaya K.S., Kulikov A.M., Lazebny O.E., Mitrofanov V.G. Variation of wing shape in the Drosophila virilis species group (Diptera: Drosophilidae) // J. Zool. Syst. Evol. Research. 2008. V. 46. № 1. P. 38-47.
- Куликов А.М., Лазебный О.Е., Горностаев Н.Г., Чекунова А.И., Митрофанов В.Г. Неравномерность скорости эволюции у дрозофил группы virilis. I. Применение филогенетически опосредованных тестов Такезаки // Известия РАН. Сер. биол. 2010. № 1. C. 1-9.
- Куликов А.М., Лазебный О.Е., Горностаев Н.Г., Чекунова А.И., Митрофанов В.Г. . Неравномерность скорости эволюции у дрозофил группы virilis. II. Применение теста Таджимы // Известия РАН. Сер. биол. 2010. № 2. C. 1-6.
- Куликов А.М., Лазебный О.Е., Рыбакова Е.Ю. Оценка равномерности хода молекулярных часов в родословных видов дрозофил группы virilis // Вестник Московского Университета. Серия 16. 2010. Биология. Т. 65. № 4. С. 100-103.
