Особенности эволюции морфологических и молекулярных признаков на примере близкородственных видов дрозофил 03. 02. 07 генетика
| Вид материала | Автореферат |
- Молекулярные механизмы формирования множественной лекарственной резистентности у Burkholderia, 787.44kb.
- Рабочая программа генетика Код дисциплины по учебному плану опд ф. 6 для студентов, 274.5kb.
- Наследственность и ее роль в патологии медицинская генетика и ее задачи Наследственность, 327kb.
- Эволюция и Генетика, 167.01kb.
- Рабочая программа генетика и селекция Код дисциплины по учебному плану опд ф 1 для, 292.62kb.
- Практическая работа «Генетика», 116.83kb.
- Л. П. Татаринов необратимость эволюции и ее направленность, 194.79kb.
- Генетика Генетика, 18.18kb.
- Л. И. Параллелизмы в молекулярной организации генома и проблемы эволюции. В кн.: Молекулярные, 251.18kb.
- Рабочая программа дисциплины «молекулярная генетика» Код дисциплины по учебному плану, 112.43kb.
Выделены нагрузки на хромосомы, вклад в видоспецифическую изменчивость которых выше ожидаемого. SRR* - ожидаемая по нагрузкам на хромосомы SRR-генов; M-S** - ожидаемая по нагрузкам специфичных для самцов генов.
Очевидно, что нагрузки на 5-ю аутосому и микрохромосому выше ожидаемых. При этом известно, что обе хромосомы несут характерные для D. lummei видоспецифические инверсии, отсутствующие у D. virilis, причем инверсия на 5-й аутосоме перекрывает незначительную часть хромосомы, тогда как микрохромосома перекрыта инверсией полностью. Этим может объясняться сравнительно слабое превышение наблюдаемого вклада 5-й хромосомы в общую изменчивость по форме копулятивного аппарата, по сравнению с ожидаемым.
Таким образом, скорость накопления эволюционно-значимой изменчивости по признакам формы копулятивного аппарата самцов дрозофил выше в хромосомах, несущих видоспецифические инверсии, что соответствует модели «подавления рекомбинации» и концепции Добжанского об эволюционной роли хромосомных перестроек.
1.6. Видовая специфичность и роль микрохет на эдеагусе дрозофил
Присутствие микрохет на половых органах самцов и значительное разнообразие по этому признаку у разных видов дрозофил может быть следствием сохранения функциональной значимости микрохет и их участия в формировании прекопуляционных изолирующих барьеров. Наши эксперименты по сравнению эффективности брачных ухаживаний в кон- и гетероспецифических скрещиваниях показали, что эффективность перехода от стадии “садки” к стадии “копуляции” в межвидовых скрещиваниях снижается в 1,5-2 раза. Кроме того, продолжительность времени копуляции в случае перехода на эту стадию сокращается в 2-4 раза, что сказывается на полноценности осеменения самки. Следовательно, в момент попытки оплодотворения осуществляется рецепция, определяющая эффективность как перехода на стадию копуляции, так и процесса осеменения самки.
Роль сенсорных механизмов при копуляции могут играть микрохеты, обнаруженные на дорсальной поверхности копулятивного аппарата. На увеличении до 5000 видна внутренняя полость, характерная для сенсорных органов дрозофилы (рис. 6). Эволюционное происхождение внутренних половых органов насекомых связано с 8-м и 9-м тергитами брюшка, из которых у самцов образовались копулятивный аппарат и гипандрий, соответственно. Тергиты густо покрыты микро- и макрохетами, играющими механосенсорную функцию, и гомологичные структуры на внутренних половых органах могут обладать той же функцией.
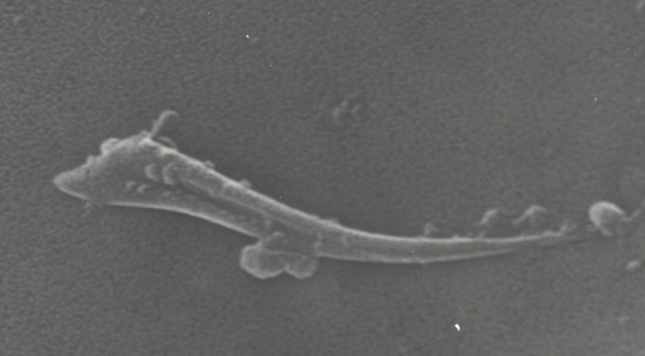
Рис. 6 Микрохета с вентральной поверхности эдеагуса D. montana x5000.
Наличие микрохет на поверхности эдеагуса у дрозофил группы virilis наблюдается в верхней, наиболее приподнятой над основанием части сагиттальной проекции органа (рис. 7). Максимальное количество микрохет характерно для всех видов филады montana (рис. 7а) – щетинки занимают до ¼ площади дорсальной части фаллоса по направлению к шипу на его конце. У видов D. americana, D. novamexicana (оба вида являются аллопатрическими) микрохеты отсутствуют полностью и у вида D. virilis появляются редко и только в случае развития личинок при пониженной температуре (рис. 7б).
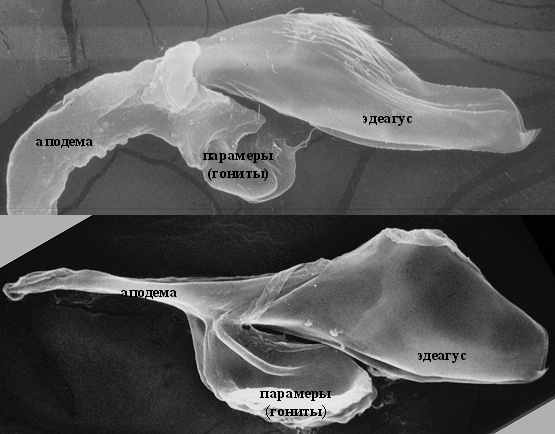

Рис. 7 Наличие микрохет у D. montana (а) и D. virilis (б). х 200
Генетический анализ данного признака был проведен с использованием гибридных самцов F1 и самцов от возвратных скрещиваний самок D. virilis с самцами F1 от скрещиваний D. virilis на D. lummei в обоих направлениях. Было показано доминирование фенотипа D. virilis при развитии потомства в нормальных условиях (25оС) и фенотипа D. lummei при содержании личинок при 17оС. В ходе анализа влияния отдельных хромосом на экспрессию признака было показано достоверное влияние 2-й (G2=2.834, d.f.=5, p<<0.001) и 6-й (G2=32.538, d.f.=5, p<<0.001) хромосом. Показано также влияние взаимодействия аутосом 3, 4 и 5 с аутосомами 2 и 6 на экспрессию признака, и взаимодействия Y-хромосомы с аутосомой 2.
4-я микрохромосома D. melanogaster имеет в своем составе всего 95 структурных генов и полностью гомологична 6-й микрохромосоме D. virilis. Поиск генов-кандидатов на формирование видовой специфичности количества микрохет на поверхности эдеагуса, расположенных на микрохромосоме, был проведен с использованием биоинформационных подходов по последовательности SOP-(sensory organ precursor) энхансера. Искомая последовательность была найдена в районе локализации генов-кандидатов shaven, CG1909 и Ephrin, экспрессирующихся в клетках нервной системы мух.
Таким образом, действие отбора на быстро эволюционирующие части копулятивного аппарата самца дрозофилы может осуществляться через сенсорные структуры на поверхности эдеагуса.
2. Оценка дивергенции видов дрозофил группы virilis по форме крыла
Крыло дрозофилы играет существенную роль в брачном ритуале – это и реализация характерных поз самца, и сенсорика контактных феромонов, размещенных на поверхности тела самки, с помощью разнообразных рецепторов, в том числе и расположенных на крыловой пластине, и генерация своеобразной брачной песни самца и ответа на нее самки. Поскольку и сам рисунок брачного танца, и амплитуда и частота звуков брачной песни являются строго видоспецифическими характеристиками, представляется интересным оценить дивергенцию близкородственных видов дрозофил по форме крыловой пластины.
Характеристики формы крыловой пластины, полученные для 17 линий 11 видов дрозофил группы virilis, были использованы для сравнения самцов и самок, представителей разных видов и разных линий дрозофил. Используя двухфакторный MANOVA, прокрустову метрику как показатель формы крыловой пластины, и принадлежность к полу и линии как факторы, нам удалось показать, что эффект линии на форму крыла высоко значим (Wilk’s λ =1.20х10-7, F(384,9670.05) =57.88, p < 0.001). Вместе с тем, прокрустовы дистанции между линиями, определенные независимо для самцов и самок, были высоко коррелированны (r = 0.927, n = 136, p <0.001) и эффект принадлежности полу был примерно в 4 раза ниже, чем эффект принадлежности линии, показанный для самок и самцов независимо. Эти результаты указали на высокую степень подобия для формы крыла самцов и самок, и в дальнейших исследованиях мы использовали только объединенные выборки двух полов.
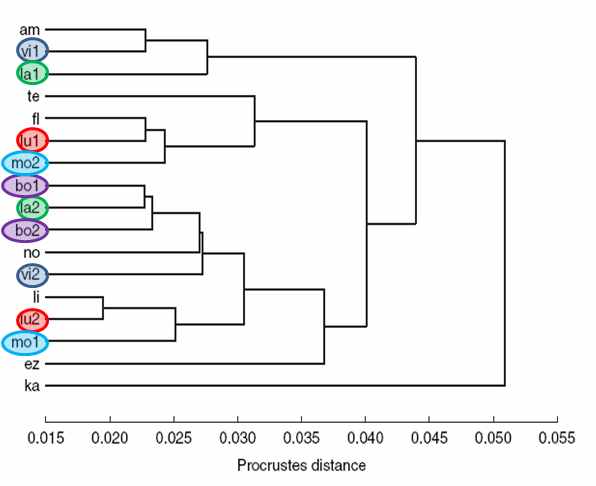
Рис. 8 Дендрограмма распределения линий дрозофил группы D. virilis по форме крыла.
Дендрограмма, построенная методом UPGMA по средним прокрустовым дистанциям для линий, демонстрирует отсутствие эффекта видовой принадлежности на форму крыла (рис. 8). Мы видим случайную картину распределения линий по кластерам, и отсутствие сходства полученной дендрограммы с известными филогенетическими построениями для дрозофил группы virilis. t-тест также показывает, что различия по средним прокрустовым дистанциям между линиями одного вида (31.16×10-3 ± 4.39×10-3) и линиями разных видов (39.22×10-3 ± 0.93×10-3) являются величинами одного порядка.Разбиение крыловой пластины на дистальную и проксимальную области, ограниченные лэндмарками 9-14 и 1-8 соответственно, позволяет определить различия этих компартментов по изменчивости. Средние значения MS (средняя сумма квадратов) для лэндмарок каждого компартмента составляют 4.43×10-3 ± 0.90×10-3 против 1.33×10-3 ± 0.19×10-3 для этих областей соответственно, t12 = 3.89, p < 0.01. Напротив, антериорная и постериорная зоны, различающиеся степенью костализации и граничащие между радиальной и медиальной жилками, не показывают значимых различий по изменчивости. Средние MS для лэндмарок этих зон составили 2.39×10-3 ± 0.93×10-3 против 2.92×10-3 ± 0.71×10-3.
Аллометрические эффекты оказывают значимое влияние на эволюцию формы крыловой пластины. Получена достоверная регрессия средних прокрустовых дистанций между данной линией и остальными (различия по форме крыла) на соответствующую разницу по значениям центроидов (различия по величине): F(1,15) = 9.00, p < 0.01 (рис. 9), т.е. отличия по форме усиливаются с увеличением размера крыла. Эти результаты дают основание предполагать, что накопление видоспецифической изменчивости может осуществляться по-разному в различных компартментах крыла, и нарастать по мере увеличения размера крыла.
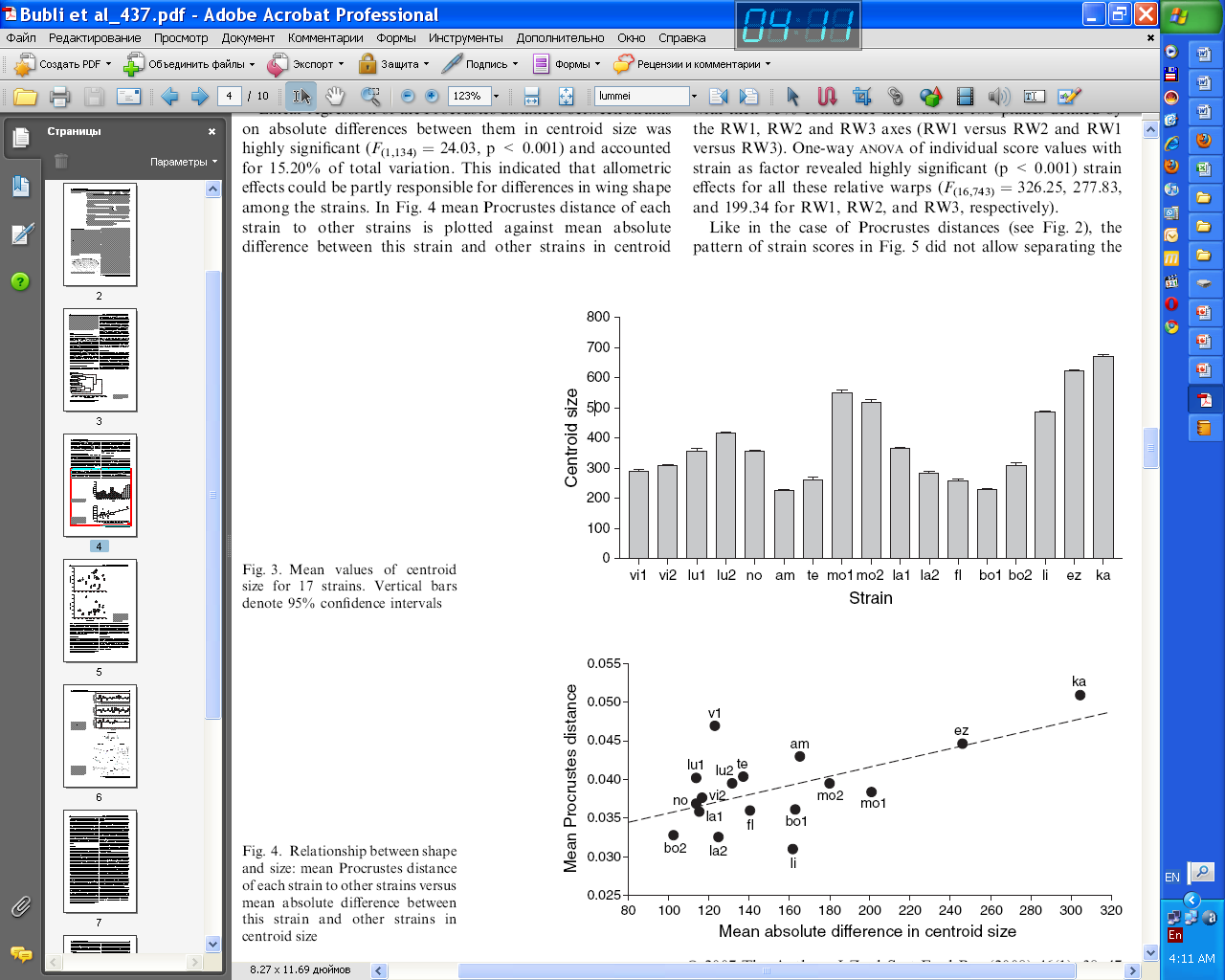
По оси абсцисс – средняя абсолютная разница размеров центроидов, по оси ординат – средние прокрустовы дистанции
Рис. 9. Регрессия средних прокрустовых дистанций между данной линией и остальными на соответствующую среднюю разницу по значениям центроидов.
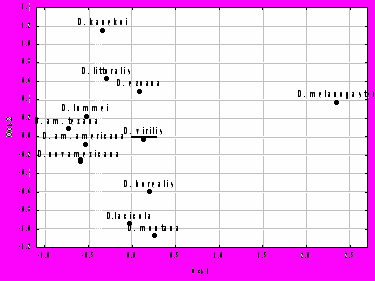
Для выявления и визуального представления наиболее характерных изменений в разных частях крыла мы использовали многомерный метод анализа относительных деформаций (relative warp analysis; Bookstein 1991). Были рассмотрены факторные нагрузки для трех наиболее значимых осей относительных деформаций (relative warps RW1, RW2 и RW3), объясняющих 64,5% всей наблюдаемой изменчивости. Проекции индивидуальных значений особей с учетом нагрузок (relative warp scores) на ось RW3 (в отличие от RW1 и RW2) четко разделяли крупные виды D. kanekoi, D. ezoana и D. montana между собой и отделяли их от остальных видов группы. Для RW3, определяющей 13% изменчивости формы крыла, лэндмарки проксимального компартмента (1, 2, 3, 5, 6, 7 и 8) имели наиболее высокие нагрузки. Анализ деформаций показал, что с ростом значений вдоль оси RW3 наблюдается уменьшение проксимальной части крыла относительно дистальной части, несущей основную функциональную нагрузку при полете.
Т
Score – 0.05
Score +0.05
аким образом, процесс видообразования в группе virilis не связан с изменением формы крыловой пластины. Скорость накопления видоспецифической изменчивости по данному признаку значительно ниже, чем по копулятивному аппарату дрозофил. Межвидовую дивергенцию по форме крыла можно отметить только для некоторых филогенетически удаленных видов, у которых она затрагивает консервативную проксимальную область крыловой пластины, причем эта дивергенция не носит направленного характера. Межвидовые различия по форме крыловой пластины могут быть связаны с адаптациями к активному полету.
3. Оценки степени родства видов по молекулярным последовательностям
3.1. RAPD-фингерпринтинг видов-двойников дрозофил группы virilis.
Score –0.05
Score +0.05
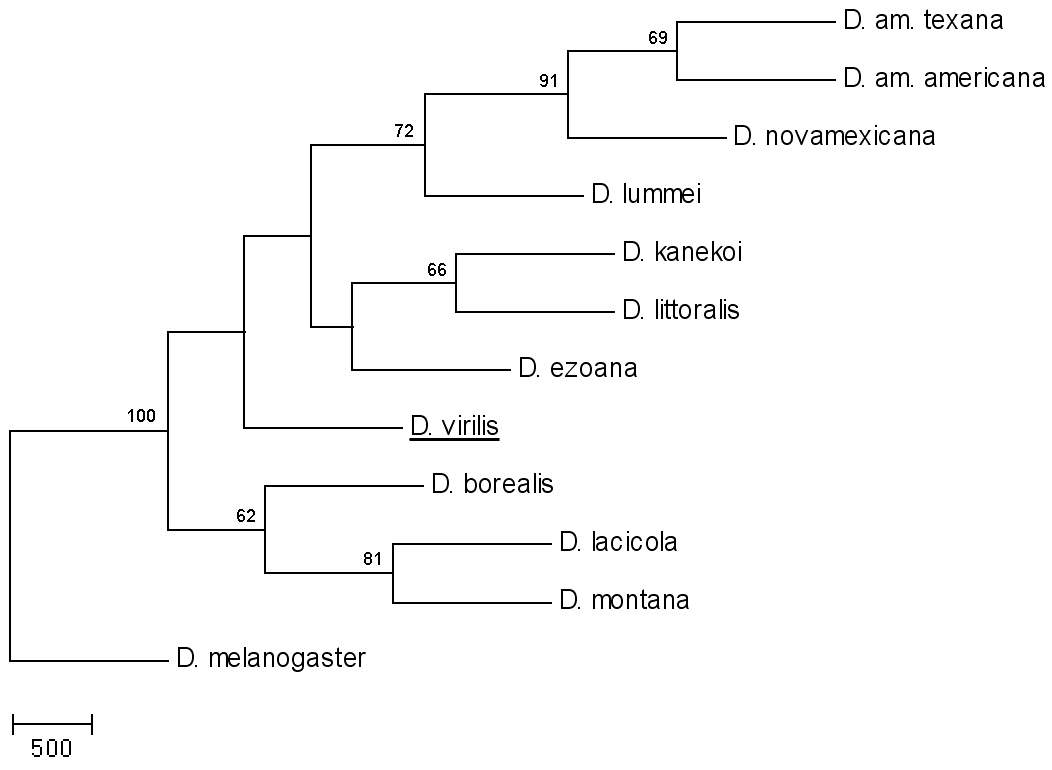
Используя 14 RAPD-праймеров, мы получили 440 парсимониально значимых RAPD-маркеров для 10 видов дрозофил группы virilis. По бинарной суммарной матрице были рассчитаны оценки генетических расстояний по Нею и Ли, и методами кластерного анализа и многомерного шкалирования показана степень родства сравниваемых видов (рис. 10а и б, соответственно).
а
б
Рис. 10. Дендрограмма отношений родства видов группы virilis (а) и распределение видов дрозофил в плоскости осей 1 и 2 многомерного шкалирования по результатам анализа RAPD-маркеров (б).
Обращает на себя внимание характер первого ветвления NJ дерева, изображенного на рис. 10а и имеющего максимальную поддержку бутстрепа. Один из двух кластеров объединяет всего лишь три вида филады montana (D. montana, D. lacicola и D. borealis), при этом значения индекса бутстрепа являются достаточно высокими (0.62 и 0.81), тогда как другой, больший кластер объединяет все остальные виды. При этом, если большинство видов филады virilis и образуют четко выделяющуюся группу, то положение самого вида D. virilis является крайне неустойчивым. Положение видов D. ezoana, D. kanekoi и D. littoralis в общем кластере, так же как и положение в нем D. virilis, является неопределенным, хотя выделение D. kanekoi и D. littoralis в парный кластер поддержано относительно высоким значением бутстрепа.
Использование метода многомерного шкалирования (рис. 10б) позволяет сделать сходные выводы. В пространстве двух первых осей можно видеть разделение классической филады montana на независимые группы montana и kanekoi и промежуточное положение вида D. virilis между кластерами lummei, montana и kanekoi. Эти результаты в наибольшей степени сходны с филогенетическими оценками, полученными на основании анализа инверсионного полиморфизма и изменчивости по признакам формы копулятивного аппарата.
3.2. Родственные отношения дрозофил группы virilis, реконструиро-ванные на основе последовательностей гена Dras1.
Использование исключительно нейтральных замен для оценки филогенетических отношений между видами позволяет исключить эффект отбора, эффективность которого в разных родословных и в разные временные периоды могла существенно различаться. Вмешательства эффектов направленного отбора можно избежать, используя нейтральную изменчивость высококонсервативных последовательностей, подверженных действию очищающего отбора. Ген Dras1 хорошо соответствует этому требованию, имея исключительный консерватизм аминокислотных последовательностей активных центров. Для дрозофил показан крайне низкий популяционный полиморфизм по любым типам замен для данного гена.
Используя точный тест Фишера, мы подтвердили действие очищающего отбора на кодирующие последовательности гена Dras1. Формальный критерий на действие очищающего отбора – dS/Lsyn ≥ dN/Lnonsyn (соотношение оцененного и ожидаемого числа соответствующих замен), был справедлив для всех пар сравниваемых видов. Тест Таджимы на нейтральность подтвердил действие отбора по первым позициям кодонов в последовательности экзона 2 гена Dras1 и нейтральную эволюцию нуклеотидной последовательности по третьим позициям кодонов данного экзона и некодирующей последовательности 2-го интрона.
Филогенетический анализ общих последовательностей фрагмента гена Dras1 12 линий 11 видов дрозофил группы virilis был проведен методом Neighbor-Joining, используя в качестве модели подстановки трехпараметрическую модель Тамуры.
Оценка устойчивости полученной дендрограммы проведена бутстрепом (500 повторностей). В одном случае мы применяли попарное удаление сайтов с пропусками (данные не приведены), полученными в ходе выравнивания последовательностей, в другом – полное удаление таких сайтов. Имеющихся замен в проанализированном участке недостаточно, чтобы получить устойчивую оценку степени родства видов филады montana, с чем связана низкая поддержка бутстрепом полученных ветвей. При этом 3 вида филады lummei и 4 вида филады montana формируют устойчивые группы, имеющие хорошую поддержку бутстрепом при полном удалении сайтов с пропусками. В зависимости от метода учета парсимониально информативных сайтов, положение видов D. virilis и D. kanekoi на дендрограмме меняется местами.
Метод минимально разветвленной сети ( Minimum Spanning Network) используется для оценки минимально необходимого числа точечных мутаций при происхождении данных гаплотипов. Его применение вновь демонстрирует предковую роль вида D. virilis и неустойчивое положение видов субфилады kanekoi (рис. 11). В частности, при изменении лимита образования связей между гаплотипами, состав и связи внутри субфилад lummei, montana и центральное положение D. virilis остаются неизменными, тогда как положение и связи D. ezoana, D. kanekoi и D. littoralis существенно меняются, что соответствует сделанным выше выводам об их неустойчивом положении.
Таким образом, анализ выявленных нами и представленных в литературе противоречий по степени родства видов группы virilis с использованием разных последовательностей и методов их оценок указывает на неравномерность хода молекулярной эволюции в данной группе видов.
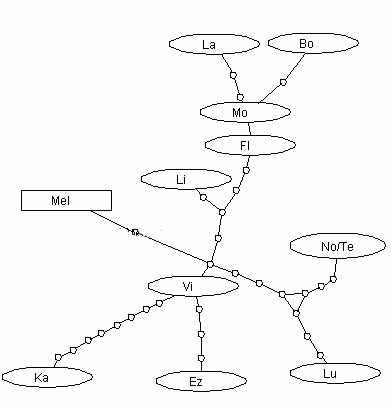
Рис. 11. Минимальная сеть происхождения наблюдаемых замен. Узлами обозначены замены, отличающие последовательности родственных видов.
3.3. Оценка степени родства видов группы virilis по пяти молекулярным последовательностям, сопоставление темпов эволюции морфологических и молекулярных признаков
Филогенетически-опосредованные методы имеют высокую чувствительность к правильности топологии оцениваемого дерева. При проведении филогенетической оценки необходимо подобрать модель учета замен, максимально соответствующую характеру последовательности и распределению наблюдаемых замен. Для выявления наиболее вероятной топологии дерева мы использовали последовательности Adh, NonA, Fu, Ras1 ядерных генов и 16S–12S рРНК митохондриальных генов и два алгоритма оценки дистанций: Neighbor-Joining (NJ) и Maximum Parsimony (MP). В качестве внешнего вида использовали D. melanogaster. Для общей последовательности, включающей все пять используемых фрагментов, были использованы модели GTR+I+G (общая реверсионная модель (General Time Reversible) с учетом неравенства консервативных сайтов и гамма-распределением скорости замен) с параметрами I=0.7195 и G=0.3955, и TrN+I+G (модель Тамуры и Нея с учетом неравенства консервативных сайтов и гамма-распределением скорости замен) с параметрами I=0.6916 и G=0.3991, при условии полного удаления пропусков. При филогенетических построениях с использованием парсимониального метода применяли алгоритм метода ветвей и границ (branch and bound) для оценки связи ветвей с условием как полного удаления пропусков, так и учета их в качестве пятого основания.
MP дерево, построенное с использованием пропусков в качестве пятого основания, хорошо соответствует классическому представлению о степени родства видов группы virilis: вид D. kanekoi оказывается связанным в один кластер с видами D. ezoana и D. littoralis, и сам кластер kanekoi входит в состав филады montana, вид D. virilis является внешним в своем кластере. Топология MP дерева, построенного с использованием пропусков в качестве пятого основания, была подтверждена анализом распределения делеций/инсерций в последовательностях.
Оценка генетических дистанций между видами группы virilis по нейтральной изменчивости четырежды вырожденных сайтов кодирующих последовательностей и сайтам некодирующих последовательностей дает возможность сопоставить темп накопления нейтральной молекулярной изменчивости и видоспецифической изменчивости морфологических признаков. Регрессионный анализ был проведен по показателям генетических дистанций между парами видов, с одной стороны, и разнице по средним значениям признаков формы копулятивного аппарата, а так же по обобщенным характеристикам – Евклидовым дистанциям, полученным по значениям 35-и ИМП и по значениям 11-и канонических дискриминантных функций (dkm) , с другой. Достоверная положительная связь между генетической дистанцией для конкретной пары видов, и разницей по средним значениям признака между данной парой видов, для большинства признаков получена только для моделей нелинейной регрессии. Это подтверждает неравномерное изменение скорости накопления эволюционно-значимой изменчивости, относительно скорости накопления нейтральной молекулярной изменчивости, в родословных изучаемых видов. Обе обобщенных характеристики изменчивости количественных признаков показывают значимую положительную регрессию на генетические дистанции (для дистанций по 35 ИМП R=0.296, p=0.048; для дистанций по 11 dkm R=0.447, p=0.002). Оценки эвклидовых дистанций в парах «D.virilis – все остальные виды» всегда выше оценок в парах видов, принадлежащих к разным субфиладам, в том числе – субфиладам montana и lummei. При пропорциональном вкладе изменчивости по исследованным признакам на ранних и поздних этапах дивергенции видов значения эвклидовых дистанций в парах «D.virilis – все остальные виды» должны быть ниже значений дистанций в парах видов, принадлежащих разным филадам.
Можно заключить, что скорость накопления морфологических различий значительно снижалась на более поздних этапах дивергенции видов.
3.4. Применение общепринятых тестов для оценки хода молекулярных часов
Результат применения двухкластерного теста Такезаки для общей последовательности изученных генов показал неравномерное накопление замен в кластере D. kanekoi, как в родословных видов D. ezoana и D. littoralis, так и D. kanekoi с субкластером видов D. ezoana и D. littoralis. Анализ независимых последовательностей подтвердил выявленные различия видов субфилады kanekoi для генов 16S–12S mtRNA, Fu, Ras1, в двух последних случаях на уровне тенденции (90<Р<95). Он также выявил дополнительные кластеры видов, имеющих значимые различия по скорости накопления замен в родословных. Подтверждения найдены для видов субфилады montana по последовательностям генов 16S–12S mtRNA, Adh, Fu, и для видов филады virilis по последовательностям генов 16S–12S mtRNA, Ras1 и NonA.
Существенные различия длин ветвей в пределах одного кластера значительно увеличивают дисперсию средней длины ветви для данного кластера и не позволяют выявить достоверные различия между отдельными ветвями родословных, расположенных в различных кластерах. Эту проблему частично решает тест длин ветвей, сравнивающий суммарную длину ветви каждой родословной, от общего для всех родословных узла до конца ветви, со средней длиной ветви в дереве данной топологии. Применение теста длин ветвей подтвердило достоверное увеличение скорости замен в родословных D. ezoana и D. littoralis. Вместе с тем выявляются значимые отклонения родословных D. montana, D. lummei, D. texana и D. novamexicana от средней длины ветви, не отмеченные ранее двухкластерным тестом для суммарной последовательности. Учитывая внешнее в своем кластере положение вида D. virilis, имеющего низкие индексы поддержки бутстрепом, можно ожидать высокий показатель дисперсии для значения разницы средних длин ветвей родословных субкластеров D. virilis и D. lummei-D. texana-D. novamexicana и низкие показатели двухкластерного теста.
Использованные нами тесты Такезаки (Takezaki et al., 1995) опосредованы филогенетическими оценками дистанций между видами и группами видов и имеют два существенных недостатка – чувствительность к показателям групповой дисперсии и к точности филогенетических оценок, берущихся a priori. Чтобы избежать влияния показателей групповой дисперсии, можно обратиться к филогенетически независимому тесту Таджимы, оценивающему относительные скорости молекулярной эволюции только для трех последовательностей – двух тестируемых видов и одного внешнего вида.
Сопоставление суммарной последовательности Adh, NonA, Fu, Ras1 ядерных генов и 16S–12S рРНК мтДНК у видов субфилад virilis и montana при использовании D. melanogaster в качестве внешнего вида подтвердило справедливость предположения о нарушении равномерности хода молекулярных часов для некоторых родословных. Для субфилады montana не показано достоверного отличия в скорости накопления замен по сравнению с D. virilis, и значимые различия по этому признаку отмечены для видов D. montana и D. flavomontana с видами субфилады lummei. Скорость накопления нуклеотидных замен в исследуемых последовательностях у всех видов-близнецов в субфиладе lummei существенно отличается от вида D. virilis. Для видов субфилады montana показано нарушение хода молекулярных часов для видов D. montana и D. lacicola. Между внутренними видами субфилады kanekoi достоверных различий тест не выявил. Использование в качестве внешнего вида представителей собственной группы видов, являющихся внешними по отношению к сравниваемой паре, позволяет дополнительно подтвердить неравномерность скорости молекулярной эволюции у видов субфилады kanekoi. Тем не менее, этот тест также не лишен недостатков. Он не учитывает характера сравниваемых последовательностей, внешний вид должен быть удален от сравниваемых.
Представленные результаты свидетельствуют о неравномерной скорости накопления замен в разных родословных изученной группы видов и о неодинаковом характере накопления замен в пределах каждого генотипа по разным последовательностям. Тем не менее, получить четкую взаимоподтверждаемую разными тестами картину не удается, в силу различных недостатков каждого из тестов.
3.4. Использование методов прямой оценки равномерности хода молекулярных часов, с поправками на различия между родословными и последовательностями
Модель нейтральной эволюции предполагает, что число мутаций (нуклеотидных или аминокислотных замен), фиксирующихся в популяции за T поколений, должно соответствовать Пуассоновскому распределению со средним значением uT, где u – число мутаций, фиксирующихся за одно поколение. Следовательно, в рамках этой модели дисперсия числа замен должна быть равна их среднему числу uT (поскольку в Пуассоновском распределении дисперсия равна среднему). Тогда и индекс дисперсии R(T), соответствующий частному дисперсии числа замен на их среднее число, как мера нарушения хода молекулярных часов, не отличается достоверно от единицы.
Существуют формальные факторы, приводящие к смещению оценок R(T). Это число узлов филогенетического древа (или степень отличия конкретной филогении от филогении «звезды»), скорость смены поколений в разных родословных, недоучет параллельных и множественных замен в сравниваемых последовательностях и др. Методы оценки величины взвешенного индекса дисперсии были разработаны Гилеспи и Балмером. Эти методы приложимы к разным исходным данным и учитывают разные факторы.
Суть метода Гилеспи заключается в использовании весовых коэффициентов (w) при оценке параметров M (среднее число замен) и S2 (дисперсия числа замен) для замен в выборке последовательностей трех сравниваемых видов. Гилеспи определил весовые коэффициенты как "эффекты происхождения", общие для разных последовательностей (локусов) одного генома. Эффекты происхождения нормируют дистанции между последовательностями с учетом следующих «формальных» причин нарушения нуль-гипотезы нейтральной эволюции: 1) отклонения филогении сравниваемых видов от филогении «звезды», 2) неравная продолжительность поколений в разных родословных и 3) различия по общим молекулярным, биохимическим и физиологическим параметрам, определяющим скорость эволюции, в отдельных родословных.
Балмер предложил метод для сравнения скорости накопления замен у любого числа видов по одной последовательности и ввел поправку (коэффициент инфляции) на неоправданное увеличение R(T), возникающее при использовании сложных моделей, учитывающих множественные замены. Коэффициент инфляции оценивает возможные множественные, параллельные и обратные мутации в независимых родословных по ковариациям скоростей замен. Коэффициент инфляции имеет удобное χ2-распределение, позволяющее оценивать полученные отклонения в скорости накопления замен от пуассоновского распределения.
Нами был разработан и применен новый метод учета скорости накопления замен, принимающий во внимание обе поправки.
Невзвешенный R(T), с поправкой на коэффициент инфляции. Оценивается отдельно для каждого из k локусов и каждой пары видов i-j,
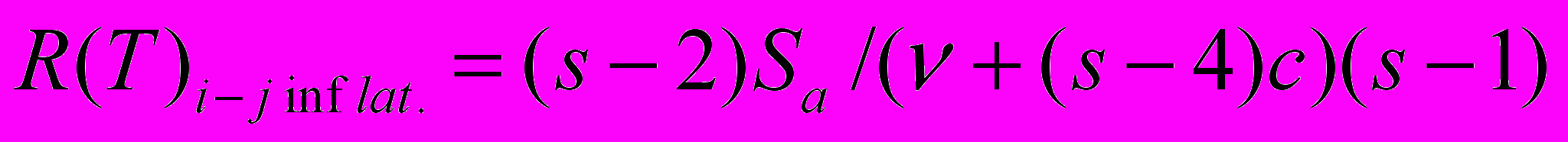 ,
,где v и c – значения обобщенных оценочных показателей для каждой i-ой родословной (по Балмеру) Var (dij) и Cov (dij, dik) соответственно, d – дистанции между соответствующими родословными, s – число сравниваемых видов,
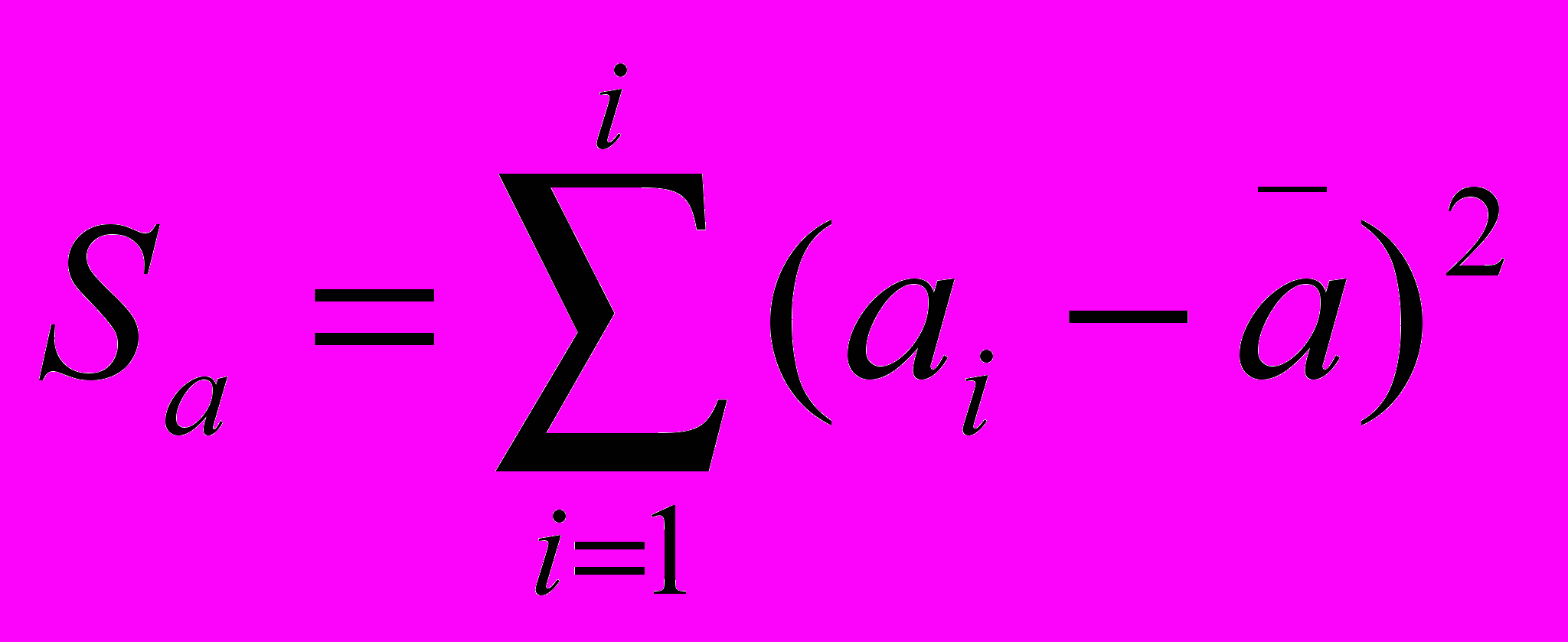 , где ai – число замен на один нуклеотид в данной родословной, ā–среднее число замен на один нуклеотид во всех рассматриваемых эволюционных линиях. Вариационно-ковариационную матрицу этих показателей, как показал Балмер, можно определить с высокой точностью по стандартным формулам сложения дисперсий и ковариаций независимых линейных функций:
, где ai – число замен на один нуклеотид в данной родословной, ā–среднее число замен на один нуклеотид во всех рассматриваемых эволюционных линиях. Вариационно-ковариационную матрицу этих показателей, как показал Балмер, можно определить с высокой точностью по стандартным формулам сложения дисперсий и ковариаций независимых линейных функций: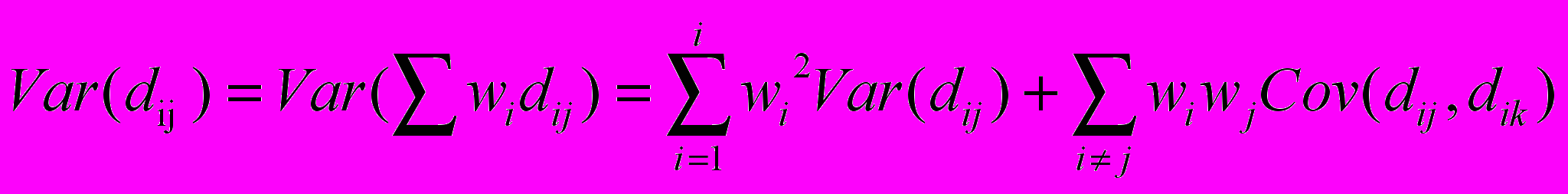
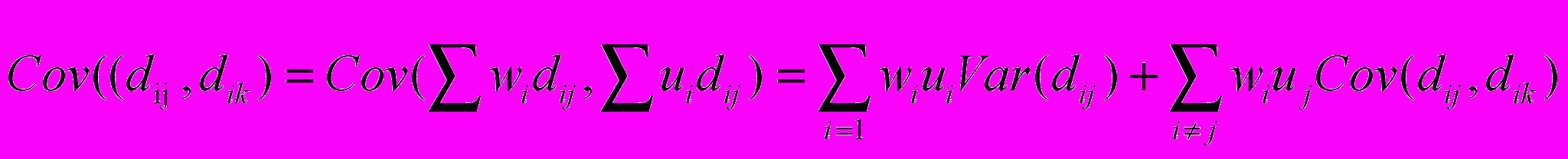
где wi, wj и ui, uj – веса вхождения дистанций dij, dik в родословную i.
Стандартные значения весов (wi, wj и ui, uj) входят в формулы дисперсии и ковариации дистанций для данной эволюционной линии «i» с положительным знаком и значением +wi=1/(s-1), для всех дистанций между видом «i» и остальными видами, и с отрицательным знаком и значением -wi=1/(s-1)(s-2), для всех остальных дистанций.
Статистика χ2 = (s - 2)Sa/(v + (s - 4)c) определяется для искомого показателя R(T)i j inflat по индивидуальным значениям дисперсии и ковариации каждой родословной каждого анализируемого локуса. Пользуясь свойством аддитивности независимых распределений χ2, мы можем получить оценку для средних по всем локусам значений R(T)i-j inflat., для всех пар данного вида и внешних по отношению к нему, используя суммы соответствующих статистик χ2 и суммы их степеней свободы, вместо аргумента функции x используется аргумент nx.
Показатель индекса дисперсии для данной эволюционной линии R(T)i inflat определяется как среднее по всем парам, образуемым данным видом. Данный метод оценки был использован Балмером для одного локуса. Однако на основе этой методики мы можем также получить среднее значение для каждой пары и для каждой родословной по всем локусам.
Оценка среднего показателя R(T)i inflat по всем парным дистанциям в пределах одной родословной (между данным видом и каждым из оставшихся) и средних показателей по всем родословным затруднена, так как соответствующие распределения не являются независимыми.
Взвешенный R(T), с поправкой на коэффициент инфляции. Оценивается отдельно для каждого из k локусов и каждой пары видов i-j. Веса ωi определяются по средним ai для всех k локусов:
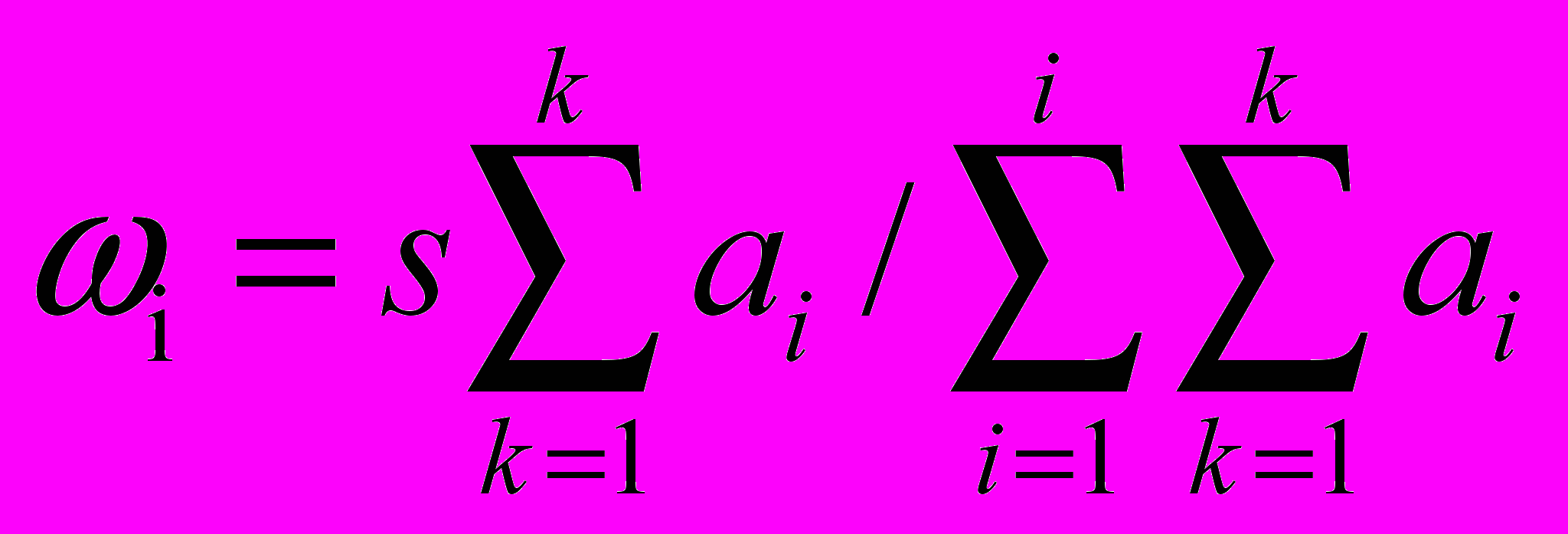 , так, что Σ ωi = s.
, так, что Σ ωi = s.В соответствии со свойствами дисперсии и ковариации, для произвольных случайных величин ξ1, ξ2 верны равенства:
Var (ωi2 ξ) = ωi2 Var (ξ) и Cov (ωi ξ1, ωj ξ2) = ωi ωj Cov (ξ1, ξ2).
Учитывая уже определенную вариационно-ковариационную матрицу, полученную для невзвешенных значений среднего числа замен на один нуклеотид ai, воспользуемся свойствами дисперсии и ковариации и разделим значения матрицы на соответствующие им весовые коэффициенты.
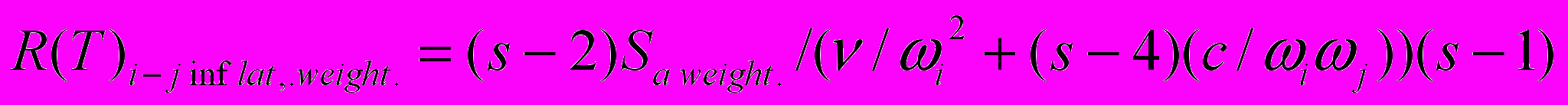
χ2 = (s - 2) Sa weight./((v/ ωi2) + (s - 4)(c/ ωi ωj)).
Индекс дисперсии для родословной i R(T)i inflat., weight также определяется как среднее по всем парам, образуемым данным видом.
Итог применения всех 4-х алгоритмов для оценки индекса дисперсии по 5 последовательностям в родословных видов группы virilis получился неожиданным. Применение индекса инфляции как для наивных значений, так и для значений, взвешенных по эффектам происхождения, приводит к увеличению индекса дисперсии (табл. 4).
Табл. 4. Средние значения индекса дисперсии для изученных последовательностей видов дрозофил группы virilis.
| Гены | Наивные формулы | С учетом индекса инфляции | ||
| R(T) | R(T)Гилеспи | R(T)unw | R(T)Гилеспи | |
| Ras1 | 1.42 | 0.80 | 3.53 | 1.93 |
| NonA | 1.55 | 0.83 | 2.97 | 1.53 |
| 12S-16S | 3.65 | 3.22 | 5.14 | 4.58 |
| Adh | 1.46 | 0.60 | 1.66 | 0.68 |
| Fus | 1.12 | 0.80 | 2.52 | 1.85 |
| среднее | 1.84 | 1.25 | 3.16 | 2.12 |
