Особенности рака и гиперпластических процессов эндометрия в сочетании с миомой матки 14. 00. 14 онкология
| Вид материала | Автореферат |
| Результаты исследования |
- Значение аблации эндометрия в терапии гиперпластических процессов эндометрия пациенток, 411.8kb.
- Последняя надежда или чудо своими руками, 3060.3kb.
- Диагностика больных с миомой матки и аденомиозом, 178.92kb.
- Home, 120.82kb.
- Совершенствование методов диагностики и лечения рака тела матки 14. 00. 14 онкология, 520.93kb.
- Only for you!!! Убедительная просьба не использовать документ полностью, без изменений., 493.4kb.
- Стратегия и тактика лучевой терапии в многокомпонентном лечении местно-распространенного, 1026.52kb.
- На правах рукописи, 387.05kb.
- Комплексное эндохирургическое лечение больных с субмукозной миомой матки 14. 00., 300.79kb.
- Эпидемиология рака молочной железы в иркутской области 14. 00. 14 онкология, 371.42kb.
Результаты исследования
Изучение особенностей клинического течения гиперпластических процессов и рака эндометрия в сочетании с миомой и без миомы матки показало, что менометроррагия у больных раком эндометрия с миомой матки встречалась чаще в пери- и постменопаузальном периодах (в 83,3% и 86,8% соответственно), чем в репродуктивном периоде (33,3%, р=0,009) (рис.2,3).
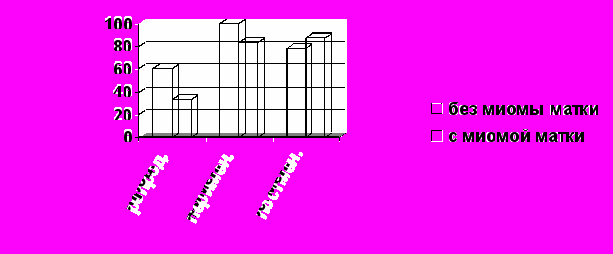 |
| Рис. 2. Частота менометроррагий у больных раком эндометрия с миомой и без миомы матки в различные возрастные периоды. |
-
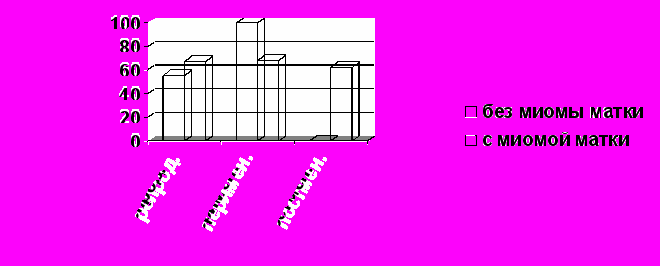
Рис. 3. Частота менометроррагий у больных железистой гиперплазией эндометрия с миомой и без миомы матки в различные возрастные периоды.
Бессимптомное течение рака эндометрия на фоне миомы матки было чаще в репродуктивном периоде (50%), а гиперпластических процессов - в постменопаузе (22%, р<0,05).
Выявлено, что у больных раком эндометрия миома матки была диагностирована впервые в возрастной период после 40 лет в 87,5% случаев, а у больных железистой гиперплазией и у пациенток без патологических изменений в эндометрии – в 61% (р=0,006) и 52,5% случаев (р<0,001) соответственно. При этом у больных железистой гиперплазией репродуктивного возрастного периода миома матки была выявлена в течение текущего года, либо отмечался её рост в 67,6%, перименопаузального – в 26%, постменопаузального – в 55,6% случаев, а при раке эндометрия – в 67% , 83,3% и 67% случаев соответственно (р=0,048 при межгрупповом сравнении пациенток перименопаузального возрастного периода). Выявлено, что миома матки в 100% случаев сопутствовала гиперплазии эндометрия в постменопаузе.
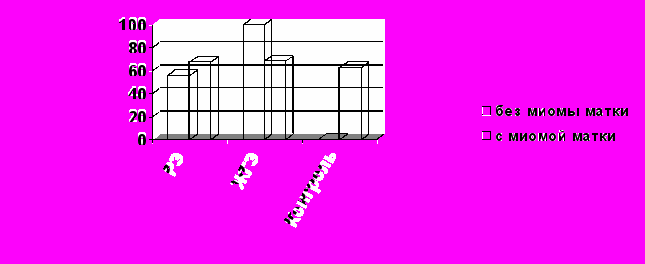
Частота встречаемости ожирения у больных раком и атипической гиперплазией эндометрия с миомой матки выше, по сравнению с больными без миомы матки (рис.4,5), что может свидетельствовать о существовании единых этиопатогенетических моментов в возникновении гиперпластических процессов, рака эндометрия и миомы матки, а также большей глубине эндокринно-метаболических нарушений у пациенток с сочетанной патологией эндо- и миометрия, что подтверждается данными литературы [Савельева Г.М., 1981г., Бохиан Я.В., 1985г.,Мезинова Н.Н., Вихляева Е.М., 2000г., Бахидзе Е.В., 2002г., 1985г., Kistner R.W., 1976, Studzinski Z., Branika D., 1999].
Анализ частоты артериальной гипертензии показал, что её встречаемость была статистически выше у больных раком эндометрия по сравнению с контрольной группой и у больных с атипической гиперплазией эндометрия, кроме того, удельный вес артериальной гипертензии был выше у больных раком эндометрия с миомой матки по сравнению с больными без миомы. Тенденция к большей частоте встречаемости артериальной гипертензии при наличии миомы матки наблюдалась во всех изучаемых группах, а у больных железистой гиперплазией эндометрия различия были статистически значимыми (38,5% и 46,3%, р<0,05), что свидетельствует, о том, что сосудистый фактор является одним из компонентов гормонально-метаболического синдрома в развития рака эндометрия и формировании миомы матки [Берштейн Л.М., Гамаюнова В.Б., 2000г.].
 |
| Рис. 4. Частота ожирения у больных раком железистой гиперплазией эндометрия и группы контроля с миомой и без миомы матки. |
 |
| Рис. 5. Частота ожирения III-IV степени у больных раком железистой гиперплазией эндометрия и группы контроля с миомой и без миомы матки. |
Удельный вес больных с нарушениями углеводного обмена у больных раком и атипической гиперплазией эндометрия был выше в подгруппе с миомой матки (30% и 9%) по сравнению с больными без миомы (18% и 0% соответственно). Заболевания вен нижних конечностей были отмечены статистически значимо чаще у больных раком эндометрия, по сравнению с группой больных с железистой гиперплазией эндометрия, особенно, при сочетании с миомой матки (р<0,05). Как известно, явления гиперэстрогении, характерные для рака эндометрия, сопровождаются изменением биохимических, реологических свойств крови, желчи, реализующихся в повышении частоты встречаемости патологии гепатобилиарной системы и гиперкоагуляционном синдроме. Кроме того, нарушения функции гепатобилиарной системы могут сопровождаться снижением синтеза глобулина, связывающего половые стероиды, что также может способствовать усилению явлений гиперэстрогении. В связи с этим, можно предполагать большую степень выраженности гиперкоагуляционного синдрома как следствие большей эстрогенизации у больных раком эндометрия в сочетании с миомой матки (БерштейнЛ.М.,2000, Potischman N., 1996, Sherman M.E., 1997).
Анализ липидного спектра сыворотки крови больных исследуемых групп показал, что дислипидемия была выражена в большей степени при сочетанной патологии эндо- и миометрия, однако статистически значимые различия в зависимости от наличия миомы матки получены лишь при оценке уровня триглицеридов в группе пациенток с железистой гиперплазией эндометрия. Уровень триглицеридов был связан положительной корреляционной связью со степенью ожирения и отрицательной - степенью дифференцировки опухоли (р<0,01) у больных раком эндометрия, что cоответствует данным литературы (Л.А. Коломиец, А.Л. Чернышова, Н.Г., 2003г., Артымук Н.В., Магарилл Ю.А., 2004). Возможно, что при более выраженных изменениях в липидном спектре развитие рака эндометрия протекает по I патогенетическому варианту – гормонозависимому (Берштейн Л.М., 2005г.). Таким образом, дислипидемия, как и клинические проявления обменно-эндокринных нарушений, является патогенетически значимым компонентом в развитии как пролиферативных процессов в эндо- метрии, так и в развитии миомы матки (Бохман Я.В., 1989г, Берштейн Л.М., 2003г.).
Анализ состояния репродуктивного здоровья больных изучаемых групп показал, что при железистой гиперплазии эндометрия отмечается наибольшее количество беременностей в анамнезе по сравнению с пациентками без патологических изменений в эндометрии (р<0,05). Хотя, во всех исследуемых группах число беременностей, родов и абортов было выше при наличии миомы матки, статистически значимых различий выявлено не было.
Одними из факторов риска рака эндометрия являются возраст менархе и возраст менопаузы (Мезинова Н.Н., 1985г., Бохман Я.В., 1989г, Сидорова И.С., 2002, Максимов С.Я., 2003г., Берштейн Л.М., 2003г., Маликова Л.В., 2004г.). В анамнезе у больных раком эндометрия с миомой матки тенденция к более позднему становлению менструальной функции была более выражена, при сравнении с больными без миомы матки и с больными других исследуемых групп. Анализ возраста наступления менопаузы у больных изучаемых групп показал, что практически у половины больных раком эндометрия отмечается позднее наступление менопаузы: как у больных с миомой (58,5%), так и у больных без миомы матки (45%).
При изучении частоты встречаемости опухолевидных процессов яичников (гистологическая классификация опухолей яичников ВОЗ, 1996г.) у больных исследуемых групп была выявлена тенденция к более высокой частоте встречаемости функциональных кист у больных с сочетанной патологией эндо- и миометрия, особенно в группе больных раком эндометрия - в 43,5% случаев с миомой и в 32% случаев без миомы матки. Удельный вес бесплодия у больных раком эндометрия составил 13,8%, при этом, частота первичного бесплодия не зависела от наличия или отсутствия миомы матки, что сопоставимо с данными литературы (Мезинова Н.Н., 1985г., Сидорова И.С., 2002). Следовательно, ановуляция, бесплодие и формирование функциональных кист довольно тесно сопряжены с патогенезом как пролиферативных процессов эндометрия, так и миомы матки (Вишневская Е.Е., 2002г., Кулавский В.А., 2002г., Сидорова И.С., 2002г., Берштейн Л.М., 2004г., Новикова Е.Г., 2005г.).
Выявлено, что возраст первичной диагностики миомы матки у больных раком эндометрия статистически не значимо, но отличался (практически на 10 лет) по сравнению с группой больных железистой гиперплазией эндометрия (52,1 лет и 40,1 лет, соответственно) и на 4 года – с группой больных атипической гиперплазией эндометрия (48,3 года, р=0,058). При этом у 87,5% больных раком эндометрия и у 82% больных атипической гиперплазией эндометрия миома матки была диагностирована в возрасте после 40 лет (р<0,05 при сравнении с больными железистой гиперплазией и контролем). У 65,3% больных раком эндометрия возраст выявления миомы матки соответствовал постменопаузальному, а у 82% пациенток с железистой гиперплазией эндометрия миома матки была выявлена в репродуктивном возрастном периоде (р<0,001).
В соответствии с возрастом выявления, длительность анамнеза миомы матки у больных железистой гиперплазией эндометрия была наиболее продолжительной (6,2±5,3 лет), а в группах с атипической гиперплазией и раком эндометрия - наименее продолжительной (3,0±2,8 лет и 4,3±4,1 лет соответственно), что, однако, не отличалось от группы контроля.
Анализ данных, полученных при ультрасонографии органов малого таза и при расчёте показателя объём матки (Ландеховский Ю.Д., 1988г.) статистически значимых различий не выявил (табл. 3), однако, наименьшие его значения выявлены в группе больных раком эндометрия (99,4 ±67,3 мм3), наибольшие – при железистой и атипической гиперплазии эндометрия (174,5 ±105,6мм3 и 151,1 ±106,1мм3 соответственно).
Таблица 3.
Ширина и объём матки у больных исследуемых групп
-
Группа
Ширина (мм)
Объём матки (см3)
РЭ+ММ
56,2±19,1
99,4 ±67,3
ЖГЭ+ММ
77,5 ±18,7
174,5 ±105,6
АГ+ММ
72,4 ±19,6
151,1 ±106,1
Контроль+ММ
72,1 ±22,1
167,1 ±123,2
Примечание: РЭ – рак эндометрия; ЖГЭ – железистая гиперплазия эндометрия; АГ– атипическая гиперплазия эндометрия; АЭ – атрофия эндометрия, ММ – миома матки.
В группе пациенток с миомой матки без патологических изменений в эндометрии объём матки составил 167,1 ±123,2 мм3.
Т.о., для больных раком эндометрия характерны менее длительный анамнез миомы матки, более частое её выявление в пери- и постменопаузальном периодах, наименьшие размеры матки.
У больных раком эндометрия с миомой матки отмечена тенденция к более частому выявлению высокодифференцированного варианта аденокарциномы (52,5%) и удельного веса рака «in situ» и Iа стадий, по сравнению с больными без миомы матки, а II-III стадий – наоборот, ниже, что не противоречит концепции о патогенетической неоднородности рака эндометрия и может свидетельствовать в пользу того, что при миоме матки преимущественным является I патогенетический вариант развития рака эндометрия.
Оценка концентрации половых стероидов в системном и локальном кровотоках показала, что уровень эстрадиола в сыворотке крови у больных раком эндометрия без миомы матки был в 2 раза выше, чем у больных с миомой (р=0,013). У пациенток с железистой гиперплазией эндометрия и в группе контроля выявлены аналогичные тенденции. Оценка частоты гиперэстрадиолемии у больных изучаемых групп показала, что она была наиболее высокой у больных раком эндометрия, находившихся в перименопаузальном (54,5%) и постменопаузальном периодах (72%), а также у пациенток с железистой гиперплазией эндометрия в постменопаузе (60%), что согласуется с данными литературы о роли гиперэстрогенизации в развитии пролиферативных процессов в эндометрии, особенно в пери- и постменопаузальном периодах (Берштейн Л.М., 2000г., Савицкий Г.А., 2000г., Сидорова И.С., 2002г., Вихляева Е.М., 2002г., 2001, Bulun S.E., 1993, 2000, Zeleniuch-Jacquotte A.).
-
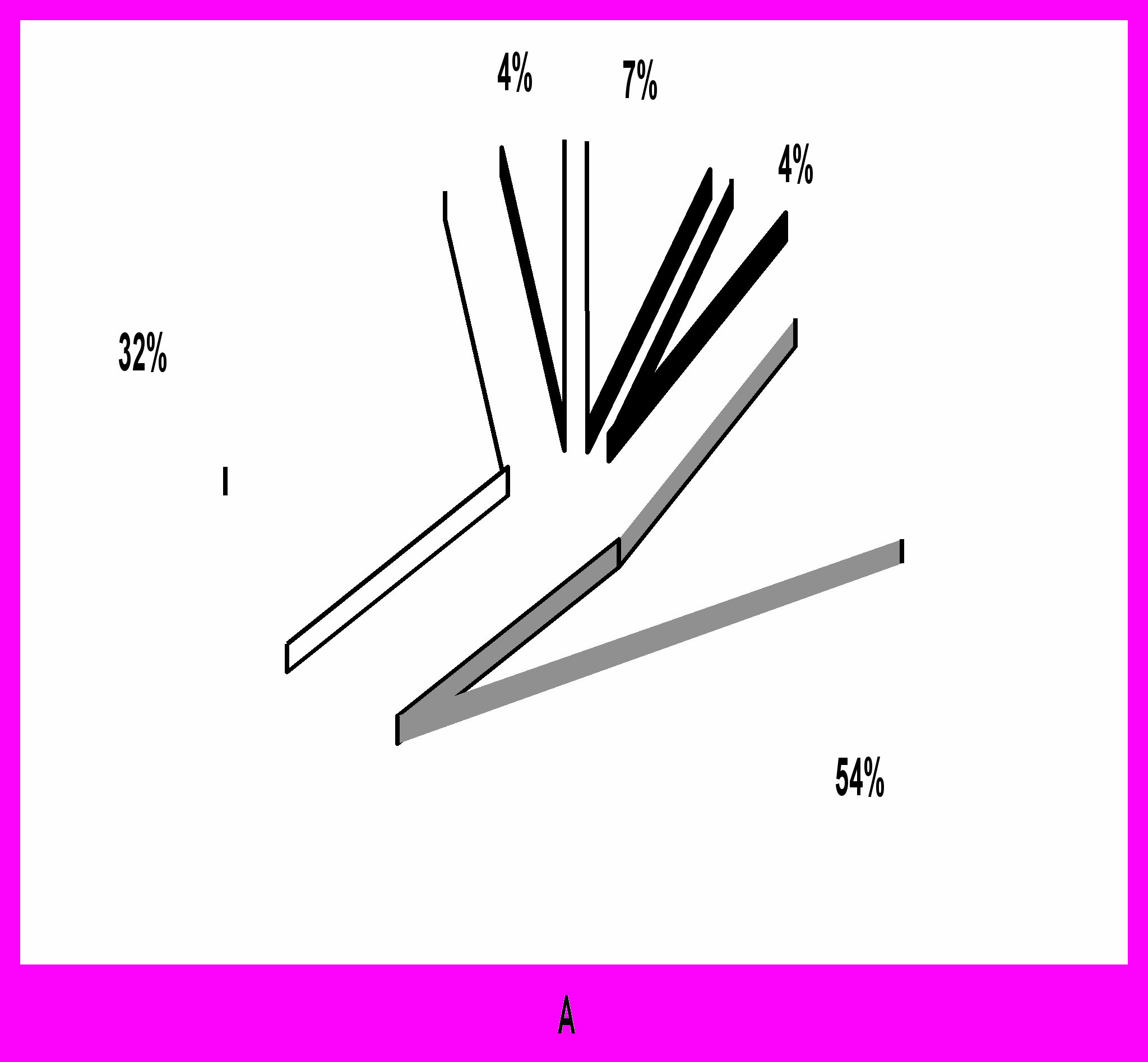
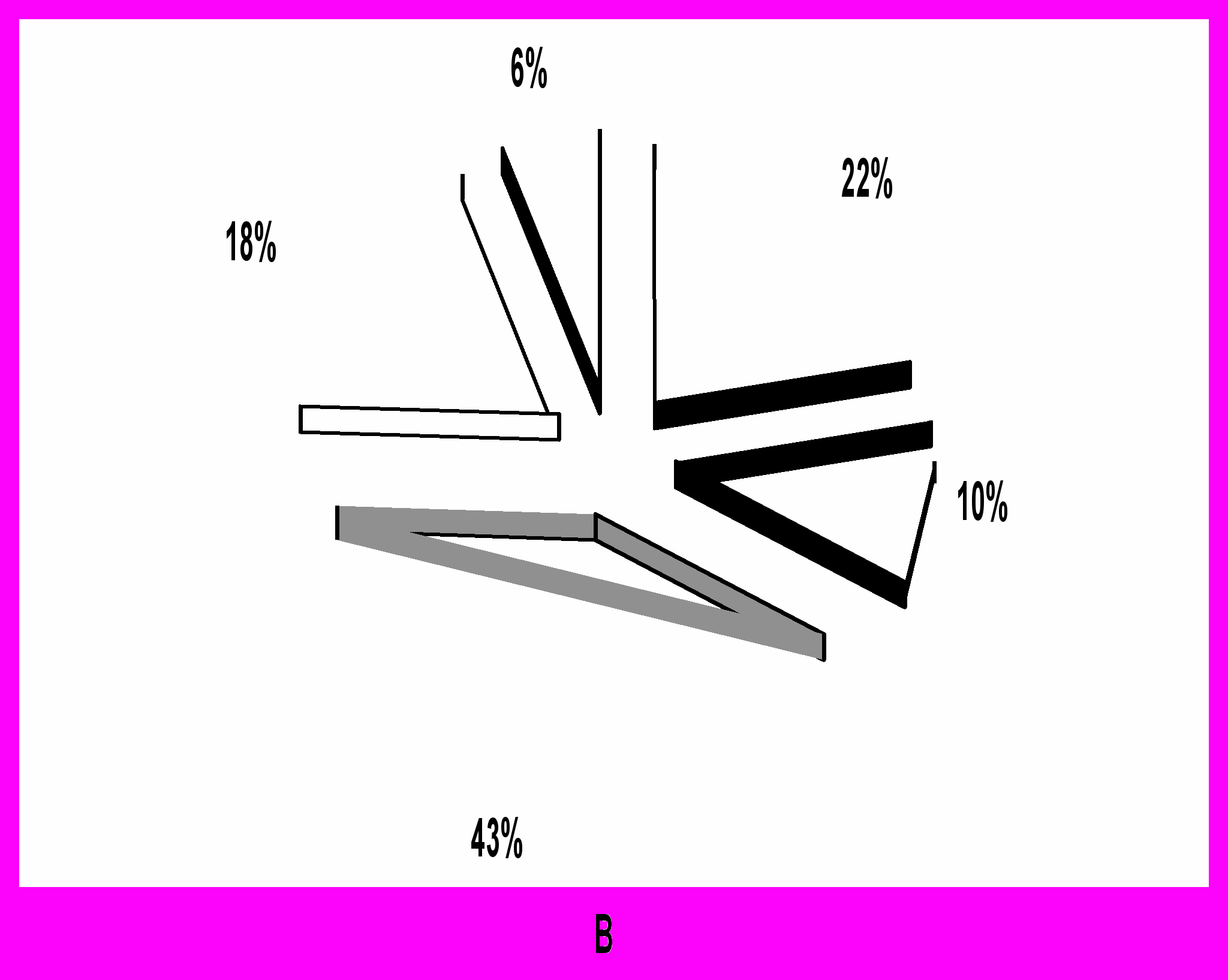
Рис. 6. Удельный вес различных стадий у больных раком эндометрия без миомы (А) и с миомой матки (В).
П римечание: рак in situ,
римечание: рак in situ,
 I a стадия,
I a стадия,
 I в стадия,
I в стадия,
 II стадия,
II стадия,
 III стадия.
III стадия.
Уровень эстрона сыворотки крови больных раком эндометрия выше при наличии миомы матки, чем у больных без миомы (р=0,040), что, возможно, обусловлено как преобладанием больных перименопаузального и постменопаузального периодов, так и большей тяжестью эндокринно-обменных изменений у больных раком эндометрия с миомой матки. По данным литературы эстрон обладает более низкой гормональной активностью, по сравнению с эстрадиолом, но способен на молекулярном уровне усиливать экспрессию онкогенов и факторов роста (Сидорова И.С., 2002, Сметник В.П., 1995г, Вихляева Е.М., 2000г., Bulun S.E., 1994.). Следовательно, можно предполагать, что у больных с миомой матки с высоким уровнем эстрона вероятность реализации событий по II патогенетическому варианту выше.
Индекс свободных эстрогенов оказался наиболее высоким при раке и железистой гиперплазии эндометрия, причём, у больных раком эндометрия он был выше в подгруппе без миомы матки (р=0,018). Полученные данные не противоречат представлениям о ведущей роли локальных источников синтеза эстрогенов у больных с миомой матки, к числу которых относится и ткань миомы (Вихляева Е.М., 2000г., Берштейн Л.М., 2004г., Новикова Е.Г., 2004г., Kistner R.W., 1976, Bulun S.E., Simpson E.R., 1994,). У больных раком эндометрия с миомой матки частота гипопрогестеронемии была наиболее высокой в постменопаузе (68% случаев), что в 1,6 раз выше, чем в подгруппе без миомы матки (41,7%). У больных железистой гиперплазией эндометрия наибольшая частота гипопрогестеронемии была выявлена в перименопаузе, при этом у пациенток с железистой гиперплазией эндометрия без миомы матки постменопаузального периода, случаев гипопрогестеронемии выявлено не было, а при наличии миомы матки она отмечалась в 33,3% случаев, что подтверждаются литературными данными о существовании нарушений в соотношении эстрогены/прогестерон у больных с пролиферативными процессами эндо- и миометрия и демонстрируют особую роль гипопрогестеронемии в развитии гиперпластических процессов и рака эндометрия в перименопаузальном периоде (Берштейн Л.М., 2002, 2005гг., Hale G, 2002, Тарасова М.А., 2004, Капушева Л.М., 2005).
Г.А. Савицким и В.В. Морозовым в 1991 г. было установлено, что у больных с различными гиперпластическими процессами эндометрия в активном и позднем репродуктивном периодах, сочетающимися с множественной миомой матки, содержание эстрадиола и прогестерона в сосудах матки выше, чем в других отделах сосудистой системы и этот феномен был назван локальной гипергормонемией.
При исследовании особенностей локальной гормонемии у больных раком эндометрия в сравнении с системным кровотоком были выявлены статистически значимые различия в уровнях эстрона и белка, связывающего половые стероиды. Уровень эстрона в регионарном кровотоке у больных раком эндометрия с миомой матки был выше, чем в системном (59,0±25,0 нмоль/л и 45,1±25,9 нмоль/л, р=0,015), а уровень белка, связывающего половые стероиды был наоборот выше в системном кровотоке, чем в регионарном (28,8±9,5нмоль/л и 22,9±8,1 нмоль/л, р=0,031). Причём, у больных раком эндометрия без миомы матки уровень эстрона в локальном кровотоке был ниже (32,1±16,9 нмоль/л, р=0,015) чем у больных с миомой матки. Выявленные различия в системной и локальной эстронемии у больных раком эндометрия с миомой матки могут быть объяснены только наличием внутритканевого синтеза эстрогенов в опухолевой ткани при участии ферментов: ароматазы и стероид сульфатазы. Отмечена также тенденция к более высоким значениям индекса свободных эстрогенов в локальном кровотоке у больных раком эндометрия с миомой матки (1,47±0,34 и 1,27±0,45, р=0,831).
У больных раком эндометрия с миомой матки выявлена тенденция к более высокому уровню прогестерона в локальном кровотоке, по сравнению с больными без миомы матки, что может объяснять более высокую частоту развития высокодифференцированных форм рака эндометрия у больных с миомой матки (Тихомиров А.Л., 1998).
Таким образом, полученные данные свидетельствуют о высокой концентрации стероидных гормонов в локальном кровотоке при раке эндометрия и миоме матки. По всей видимости, это обусловлено помимо общепринятых внегонадных источников гиперэстрогении (жировая ткань) существованием локальных источников стероидогенеза (эндометрия, миометрия и миоматозных узлов), в связи с чем была проведена оценка активности фермента ароматазы, катализирующей переход андрогенов в эстрогены, в вышеперечисленных тканях. Патогенетические аспекты участия фермента метаболизма эстрогенов в малигнизированном эндометрии у больных раком эндометрия в сочетании с миомой матки остаются практически неизученными. (Ларионов А.А., 1997г., Bulun S., Noble L., 1997, 1999, Sasaki H., 1993, Tarcovski R., 2000, Urabe M., 1990, Takamori K., 1984, Yamamoto T., 1993, Watanabe K., 1995, Cavalieri E.L., 2002).
Наиболее высокий уровень ароматазной активности в эндометрии наблюдался в группах больных раком эндометрия и атипической гиперплазией эндометрия (р<0,05 с группой контроля), наименьший – в группах с атрофией эндометрия и в группе контроля. Активность ароматазы в группе больных с железистой гиперплазией практически не отличалась от уровня при раке и при атипической гиперплазии эндометрия.
При оценке активности фермента в эндометрии больных в зависимости от наличия миомы матки (табл. 4) было выявлено, что во всех исследуемых группах наблюдалась тенденция к более высокому уровню активности фермента при наличии миомы матки, однако уровень различий был статистически значимым лишь в группе больных раком эндометрия репродуктивного возрастного периода (р=0,041, рис. 3).
Таблица 4.
Уровень ароматазной активности в эндометрии больных исследуемых групп (фмоль андростендиона/мг белка в час).
-
Группа
n
Ароматаза (M±m)
Р **
РЭ
без ММ
24
17,7±12,1
0,056
с ММ
42
22,3±10,2
ЖГЭ
без ММ
6
16,0±12,2
0,646
с ММ
49
22,1±14,1
АГ
без ММ
5
19,8±10,8
0,495
с ММ
10
18,8±14,2
АЭ
без ММ
1
0,0
0,146
с ММ
11
17,6±11,8
Контроль
без ММ
6
4,7±3,5
0,760
с ММ
20
7,8±4,4
Примечание: РЭ – рак эндометрия; ЖГЭ – железистая гиперплазия эндометрия; АГ– атипическая гиперплазия эндометрия; АЭ – атрофия эндометрия, ММ – миома матки.
Р – достигнутый уровень значимости различий с использованием критерия Манна-Уитни между подгруппами без миомы и с миомой матки.
-
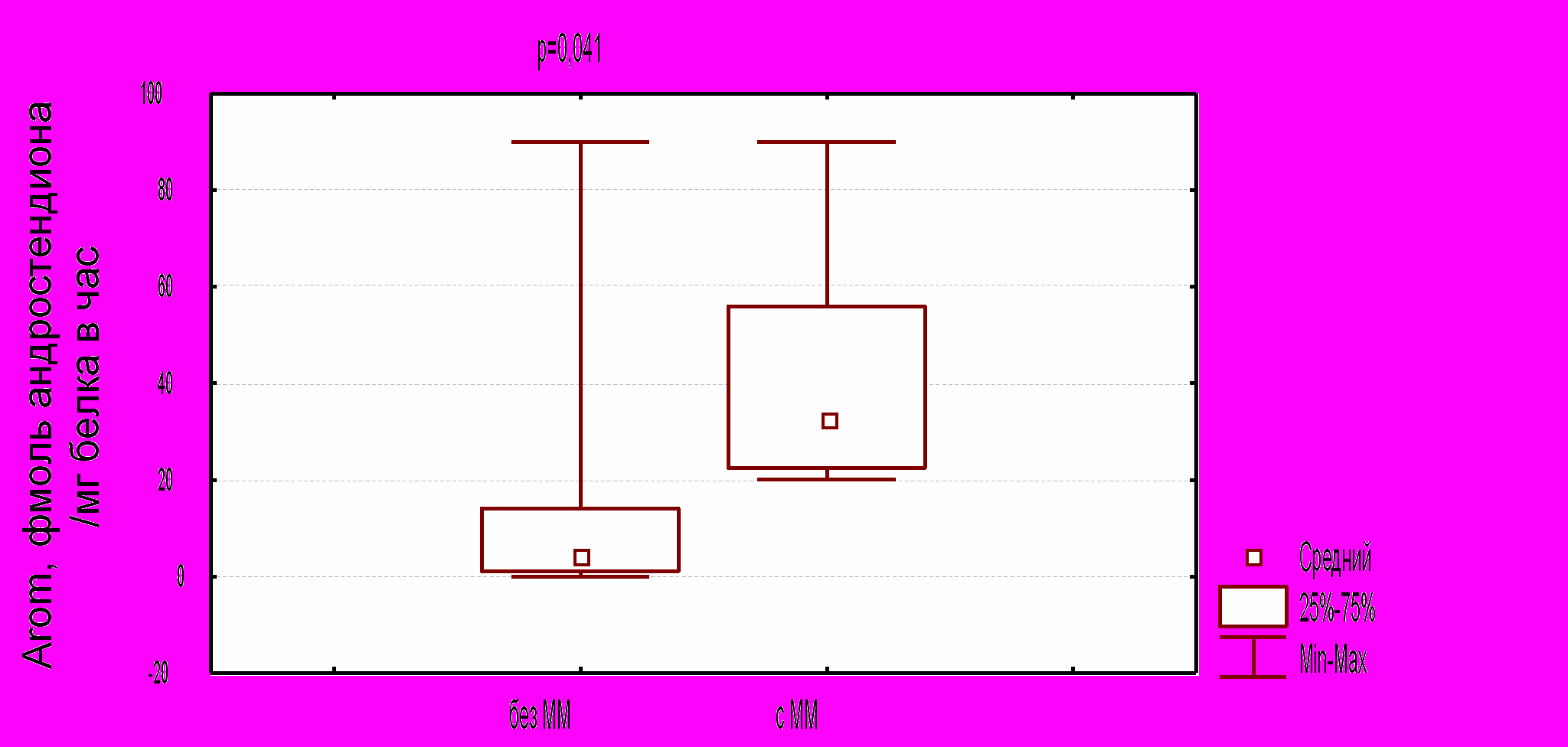
Рис. 3. Средние значения уровня активности ароматазы в эндометрии больных раком эндометрия репродуктивного периода с миомой и без миомы матки.
Примечание: ММ – миома матки.
Полученные результаты могут свидетельствовать о значимости локального синтеза эстрогенов в эндометрии при участии ароматазы у больных раком эндометрия с миомой матки репродуктивного возрастного периода, что не было встречено в данных литературы, хотя ранее было показано, что высокая активность ароматазы в эндо- и миометрии способна поддерживать локальный уровень эстрогенов независимо от эстрогенов гонадного происхождения, и тем самым обеспечивать своего рода автономность и самостоятельное существование не только патологически изменённого эндометрия, но и миоматозных узлов в миометрии (Берштейн Л.М., 1998, 2000гг., Тихомиров А.Л., 1998г., Urabe M., 1990, Sasaki H., 1993, Bulun S., 1997,1999, Madigan M., 1998, Nelson L.R., 2001, Jongen V.H., 2002).
Активность ароматазы в опухоли была связана положительной корреляционной связью с уровнем глобулина, связывающего половые стероиды, в системном кровотоке у постменопаузальных больных раком эндометрия с миомой матки, что, возможно, косвенно свидетельствует о зависимости активности фермента от уровня свободных эстрогенов сыворотки, либо о существовании обратной связи между ними.
Активность ароматазы в эндометрии коррелировала с размерами матки при раке (r=0,40, р=0,003) и железистой гиперплазии эндометрия (r=0,32, р=0,046). В обеих подгруппах больных раком эндометрия прослеживалась связь активности фермента в опухоли с размерами матки: r=0,60 (р=0,023) - в подгруппе больных без миомы матки r=0,32 (р=0,049) - в подгруппе больных с миомой матки. В группе больных с железистой гиперплазией эндометрия – только в подгруппе с миомой матки (r=0,33, р=0,046).
Наиболее высоким уровень активности фермента в эндометрии был у больных раком эндометрия с миомой матки, диагностированной в период от 30 до 40 лет (37,5±16,8 фмоль андростендиона/мг белка в час), и наиболее низкий - при выявлении миомы матки после 40 лет (17,7±18,5 фмоль андростендиона/мг белка в час р=0,044), что, по-видимому, связано не только с фактором времени воздействия эстрогенов на эндометрий. Выявлена положительная корреляция ароматазной активности в опухоли у больных без миомы матки со стадией заболевания и степенью дифференцировки опухоли, что не противоречит данным литературы (Берштейн Л.М., 2003г., Watanabe K, Sasano H., 1995).
При изучении активности ароматазы в миометрии у больных с миомой матки оказалось, что она была практически одинаково высокой как при раке или железистой гиперплазии эндометрия, так и у пациенток без патологических изменений в эндометрии. Активность фермента в тканях миомы также не зависела ни от характера изменений в эндометрии, ни от размеров миомы, что согласуется с данными литературы (Bulun S.E., 1994).
Оценка результатов изучения ароматазной активности в эндометрии, миометрии и ткани миомы, позволяет предполагать существование тесной взаимосвязи между патологически изменённым эндометриемем, миометрием и тканью миомы матки, особенно при раке эндометрия, реализующейся в усилении локального синтез эстрогенов в прямо пропорциональной заисимомти от продолжительности существования источника локальной гиперэстрогенемии и объёма эстрогенпродуцирующих тканей (миомы матки). Следовательно, у больных с миомой матки можно предполагать усиление не только пролиферативного воздействия эстрогенов на эндометрий, но и усиление генотоксического воздействия эстрогенов на эндометрий – за счёт увеличения уровня эстрадиола, эстрона и их производных – катехолэстроген-ортохинонов – за счёт интенсификации процессов ароматизации в миометрии, ткани миомы, эндометрии, жировой ткани и эстрогенов гонадного происхождения. В связи с этим, возможно, существует не меньшая вероятность развития событий с эндометрии по второму (генотоксическому) патогенетическому пути у больных с длительным анамнезом миомы матки и выраженными эндокринно-обменными нарушениями, по сравнению с больными с непродолжительным анамнезом миомы матки, больными без миомы и с невыраженными эндокринно-обменными нарушениями. Вероятно, это лежит в основе отсутствия статистически значимых различий в частоте встречаемости аденокарцином высокой и низкой степени дифференцировки у больных с миомой и без миомы матки.
Наряду с гормональными факторами в патогенезе гиперпластических процессов и рака эндометрия не меньшее значение имеет состояние рецепторного аппарата эндометрия. В литературе недостаточно хорошо освящены особенности рецепторного статуса у больных с сочетанной патологией эндо- и миометрия.
При анализе рецепторного статуса у пациенток с различной патологией эндометрия была выявлена тенденция к более высокому уровню рецепторов эстрогенов и более низкому уровню рецепторов прогестерона у больных с аденокарциномой эндометрия. При раке эндометрия с миомой матки доля больных с рецептор-позитивными вариантами фенотипов была выше, чем у больных без миомы матки, а процент рецептор-негативных фенотипов не изменялся. У больных раком эндометрия без миомы отмечено увеличение доли опухолей с рецепторным фенотипом ER+PR- (40%), по сравнению с больными раком эндометрия без миомы матки, где частота ER+PR- составила 19% (р=0,050), что, согласно данным литературы, обусловлено нарушением передачи эстрогенного сигнала на прогестероновые рецепторы (Берштейн Л.М., Максимов С.Я., 200г.).
-
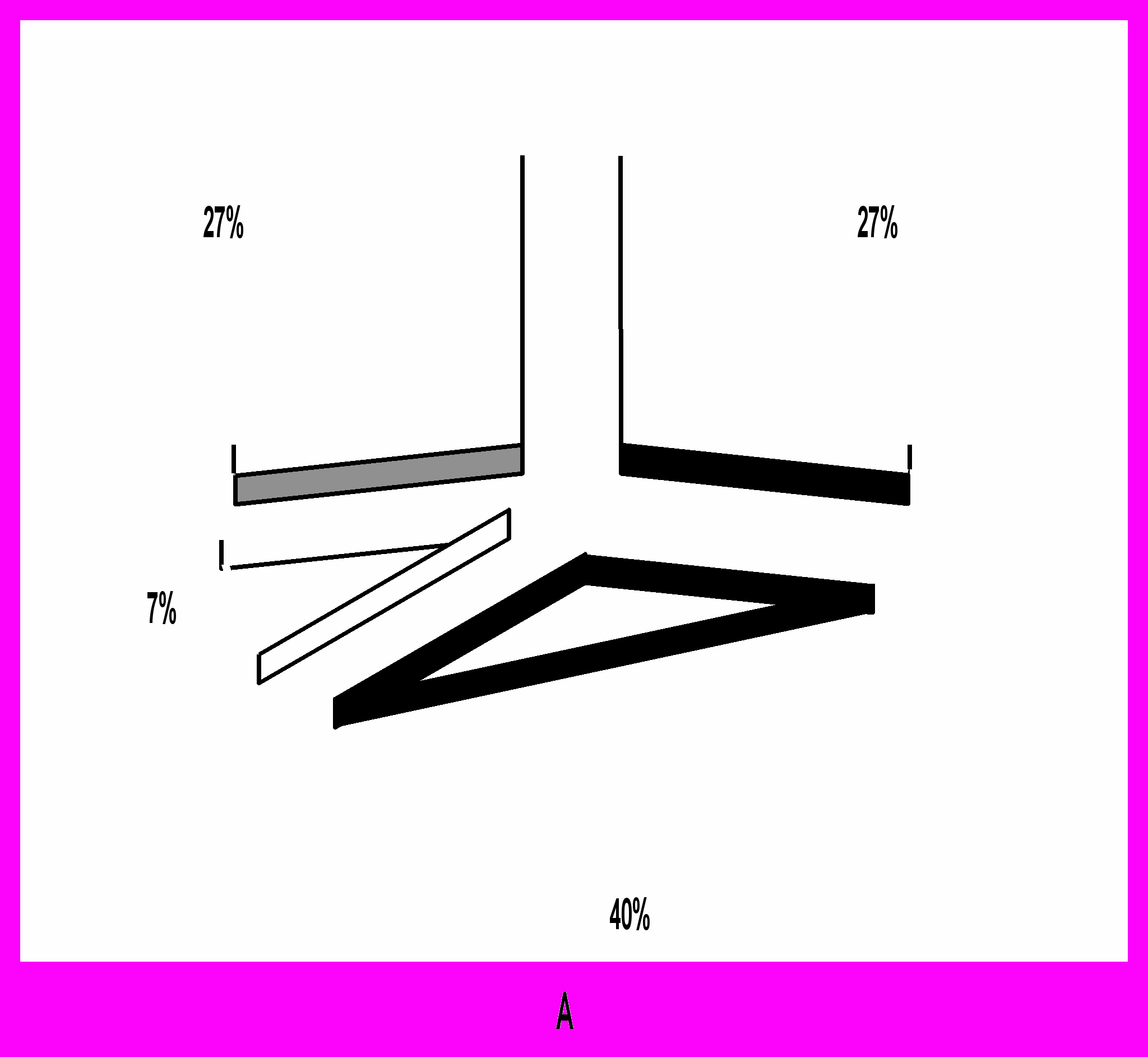
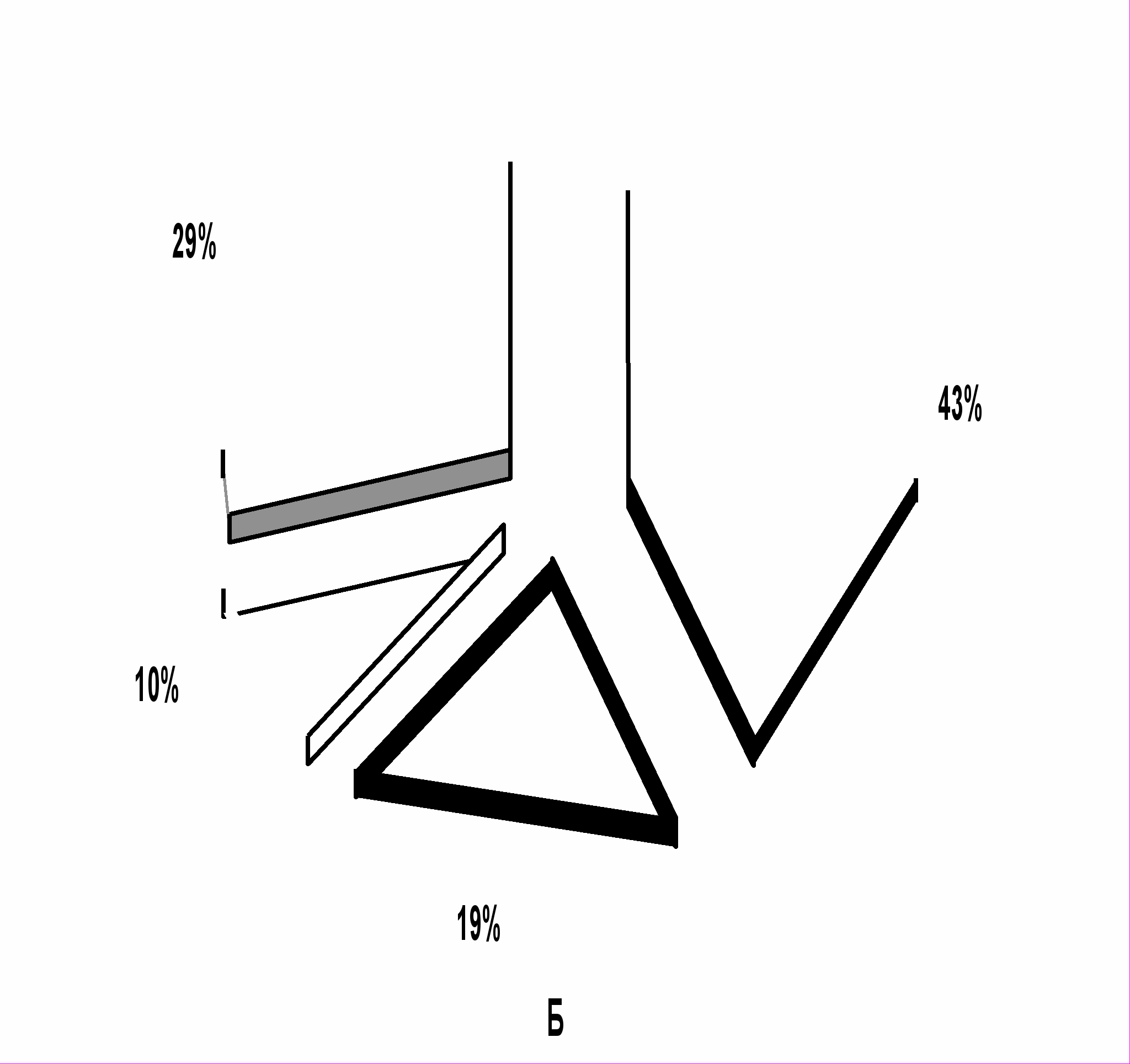
Рис.4. Удельный вес рецепторных фенотипов в группе больных раком эндометрия с миомой и без миомы матки.
Примечания: А – в подгруппе без миомы матки, Б – в подгруппе с миомой матки. ER – рецепторы эстрогенов, PR – рецепторы прогестерона.

 ER+PR+;
ER+PR+;
ER+PR-;
 ER-PR+;
ER-PR+;
 ER-PR-.
ER-PR-.
В свете теории гормонального канцерогенеза, доминирование рецепторпозитивных фенотипов у больных раком эндометрия с миомой матки возможно обусловлено более высоким уровнем эстрогенов при сочетании патологий эндометрия и миометрия, поскольку эстрогены являются стимуляторами синтеза собственных рецепторов и рецепторов прогестерона (Сергеев П.В., 1994г., H.J.M.M. Mertens, 2001).
С целью оценки взаимосвязи рецепторного статуса с клиническими параметрами, был проведен корреляционный анализ, который показал, что у больных железистой гиперплазией эндометрия и пациенток без патологических изменений в эндометрии и миомой матки уровень рецепторов эстрогенов в эндометрии коррелировал с размерами матки (r=-0,42, р=0,045 и r=-0,87, р=0,001 соответственно). Уровень рецепторов эстрогенов в ткани узлов миомы матки не зависел от размеров матки ни в одной из групп, а уровень рецепторов прогестерона в ткани узлов при раке эндометрия был взаимосвязан с размерами матки (r=-0,64, р=0,023).
При корреляционном анализе выявлено, что активность ароматазы в гиперплазированном эндометрии при наличии миомы матки связана отрицательной корреляционной связью - с уровнем рецепторов прогестерона. Возможно, высокая ароматазная активность в гиперплазированном эндометрии связана с низкой чувствительностью к прогестерону при наличии миомы матки.
Полученные закономерности позволяют разработать новые подходы к оценке онкологического риска у больных с гиперпластическими процессами эндометрия и миомой матки.
В связи с этим, была разработана математическая модель прогноза риска развития рака эндометрия у больных с гиперплазией эндометрия и миомой матки проводилась на основании комплексной оценки анамнестических, клинических, ультрасонографических, гистологических данных 92 обследованных больных (всего 47 признаков). В результате проведённой пошаговой логистической регрессии была определенна регрессионная функция, в которую вошли информативные показатели с уровнем значимости р<0,05: возраст, значение индекса массы тела, ширина матки, объём матки, уровень глобулина, связывающего половые стероиды сыворотки крови.
На следующем этапе было определено значение регрессионной функции (F) по формуле:
F= 27,209+0,307*х1+0,478*х2+(-1,027)*х3+0,194)*х4+(-0,194)*х5;
где: х1= возраст; х2 = индекс массы тела; х3 = ширина матки (мм); x4 = объём матки (см3); x5 = уровень глобулина, связывающего половые стероиды сыворотки крови (нмоль/л);
Затем, используя значение регрессионной функции и основание натурального логарифма (е) была разработана математическая модель в виде формулы для оценки риска развития рака эндометрия у больных с сочетанной патологией эндо- и миометрия.
Общий вид математической модели представлен в виде формулы:
е F
Р = ----------- х 100%
1+e F
где Р – вероятность развития рака эндометрия у больных с гиперпластическими процессами и миомой матки;
е (основание натурального логарифма) = 2,718
F – регрессионная функция.
При значении Р ≥ 50% констатировали наличие онкологического риска в плане развития рака эндометрия, а при значении Р< 50% отсутствие такового риска.
Проверка модели проводилась на группе больных гиперпластическими процессами эндометрия с миомой матки, которые не включались в построение модели (n = 30). Точка разделения Р = 0,5. Средний возраст пациенток, вошедших в проверочную группу, составил 47,8±5,8 лет.

Рис. 9. Диагностическая эффективность применения модели.
Чувствительность модели составила 87%, специфичность – 85%.
Таким образом, выявленные особенности позволяют охарактеризовать особенности клинического течения, обменно-эндокринных проявлений, системной, локальной гормонемии, синтеза эстрогенов in situ, рецепторного статуса у больных с сочетанием рака и гиперпластических процессов и миомы матки с учётом возрастного периода.
