Семян и зародышей редких видов растений
| Вид материала | Автореферат диссертации |
- Красная книга, 61.32kb.
- Молекулярно-генетический анализ генофондов редких и исчезающих видов растений пермского, 701.05kb.
- Венции должны содействовать восстановлению исчезающих видов, в частности, путем разработки, 98.37kb.
- «Красной книге», 31.74kb.
- Школьные экскурсии, 230.88kb.
- Программа для поступающих в нввкус по специальности «Психология», 284.28kb.
- Международного Союза Охраны Природы Питеру Скотту. По его инициативе в мсоп в 1949, 1423.12kb.
- «Путешествие по регионам Большого Алтая, 177.44kb.
- Перечень видов продукции, на которые оформляются сертификаты качества муки, хлебобулочных, 13.78kb.
- Лекция Многообразие растение. Водоросли Систематика растений, 162.25kb.
На правах рукописи
ВЕТЧИНКИНА
Екатерина Михайловна
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КУЛЬТИВИРОВАНИЯ IN VITRO
СЕМЯН И ЗАРОДЫШЕЙ РЕДКИХ ВИДОВ РАСТЕНИЙ
Специальность 03.02.01 – Ботаника
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2010
Работа выполнена в Учреждении Российской академии наук
Главный ботанический сад им. Н. В. Цицина РАН
Научный руководитель: кандидат с.-х. наук
Молканова Ольга Ивановна
Официальные оппоненты: доктор биологических наук
Карписонова Римма Анатольевна
доктор биологических наук
Калашникова Елена Анатольевна
Ведущая организация: Учреждение Российской академии наук
Центральный сибирский ботанический сад СО РАН.
Защита диссертации состоится 20 мая 2010 г. в 13 часов на заседании Диссертационного совета Д.002.028.01 в Главном ботаническом саду им. Н. В. Цицина Российской академии наук в конференц-зале лабораторного корпуса.
Адрес: 127276, г. Москва, ул. Ботаническая, д. 4, ГБС РАН
Факс: 8 (495) 977-91-72
С диссертацией можно ознакомиться в Научной библиотеке ГБС РАН по адресу:
127276, г. Москва, ул. Ботаническая, д. 4
Автореферат разослан « 20 » апреля 2010 г.
Ученый секретарь
диссертационного совета
доктор биологических наук Ю. К. Виноградова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В настоящее время одной из наиболее острых экологических проблем является стремительное сокращение ареалов распространения и полное исчезновение многих видов растений. В связи с этим все большую актуальность приобретает необходимость разработки методов сохранения и поддержания биологического разнообразия как in situ, так и ex situ (Андреев, Горбунов, 1999). Эффективность сохранения растений ex situ может быть существенно повышена путем создания генетических банков in vitro. Использование системы in vitro по сравнению с традиционными методами поддержания коллекций растений имеет целый ряд преимуществ, в том числе и возможность успешной репродукции видов, естественное возобновление которых в природе ослаблено или затруднено (Молканова и др., 2008; Новикова и др., 2008). При создании генетических банков редких и исчезающих растений в качестве исходного предпочтителен семенной материал, поскольку, таким образом, при использовании небольшого количества ценного материала и без нарушения естественных популяций сохранность генетического разнообразия вида обеспечивается на максимальном уровне. В экспериментальной работе с семенами многих редких видов возникает такая проблема, как покой семян и его преодоление. Культура in vitro позволяет значительно сократить срок выведения семян из покоя (Батыгина, Васильева, 2002; Ишмуратова, Ткаченко, 2009). Важнейшей задачей генетического банка, особенно актуальной для редких и исчезающих видов, является поддержание генетической чистоты сохраняемых in vitro таксонов, а также их всестороннее изучение. Использование современных молекулярно-генетических методов исследования генетической вариабельности не только позволяет контролировать стабильность хранящихся in vitro растений (Артюкова и др., 2004), но также дает возможность для быстрой и точной идентификации видовой подлинности вновь поступающих образцов и молекулярного маркирования растений на популяционном уровне, в том числе и редких видов сохраняемых в коллекциях in vitro (Журавлев и др., 1999, Боронникова, 2009).
Цель и задачи исследований – выявление специфики культивирования семян и зародышей представителей родов Iris L., Belamcanda Adans., Paeonia L. и Fritillaria L. в культуре in vitro и оптимизация методов сохранения исследуемых таксонов.
Для достижения этой цели были поставлены следующие задачи:
- исследовать особенности покоя семян представителей Iris, Belamcanda, Paeonia и Fritillaria и способов его преодоление в условиях in vitro;
- оценить возможность использования эмбриокультуры как метода преодоления покоя вышеназванных таксонов;
- изучить влияние условий стратификации, степени развития зародыша и состава питательной среды на начальные этапы онтогенеза растений in vitro;
- разработать методику культивирования in vitro зародышей исследуемых таксонов;
- изучить возможности применения ISSR-анализа для идентификации и паспортизации коллекций in vitro.
Научная новизна исследований. Выявлены общие закономерности и специфические особенности культивирования in vitro зародышей Iris, Belamcanda, Paeonia и Fritillaria,определены оптимальные сроки их изоляции.
Впервые для некоторых представителей рода Iris, Belamcanda, Paeonia и Fritillaria экспериментально установлены границы наступления стадии относительной автономности зародыша. Отработаны методы культивирования семян и зародышей исследуемых таксонов, показано преимущество эмбриокультуры по сравнению с традиционными способами преодоления покоя семян.
Впервые показана возможность использования ISSR-анализа для идентификации видовой подлинности и паспортизации коллекций in vitro.
Практическая ценность работы. Подобраны оптимальные условия для культивирования in vitro семян и зародышей исследуемых таксонов.
Создан генетический банк in vitro представителей Iris, Belamcanda, Paeonia и Fritillaria, включающий в том числе 37 образцов редких и исчезающих видов.
Предложен подход ISSR-анализа для уточнения видовой подлинности образцов семян некоторых редких видов рода Iris и детектирования на популяционном уровне Belamcanda chinensis в коллекциях in vitro.
Апробация работы. Основные положения и результаты диссертационной работы доложены и обсуждены на III Международной научной конференции «Биологическое разнообразие. Интродукция растений» (Санкт-Петербург, 2003); VIII Молодежной конференции ботаников в Санкт-Петербурге (Санкт-Петербург, 2004); Молодежном научном семинаре «Биоразнообразие природных и антропогенных экосистем» (Екатеринбург, 2004); Международной научной конференции молодых ученых и специалистов, посвященной 140-летию РГАУ-МСХА им. К. А. Тимирязева (Москва, 2005); Международной научной конференции «Плодо- и семеноведение. Состояние и перспективы исследований» (Киев, 2005); Международном симпозиуме ирисоводов «Задачи международного сотрудничества ирисоводов» (Москва, 2005); I Международной Школе для молодых ученых «Эмбриология и Биотехнология» (Санкт-Петербург, 2005); IV Международной научной конференции «Биологическое разнообразие. Интродукция растений» (Санкт-Петербург, 2007). II Всероссийской научно-практической конференции «Биотехнология как инструмент сохранения биоразнообразия растительного мира» (Волгоград, 2008).
Публикации результатов исследований. По материалам диссертации опубликовано 23 работы, в том числе 2 статьи в реферируемом журнале.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, описания объектов и методов исследований, результатов и их обсуждения, заключения и выводов. Работа изложена на _____ страницах компьютерного текста, содержит ____ таблиц, ____ рисунков и ____ приложений, объемом _____ страниц. Список использованной литературы включает _____ наименований, из них ____ на иностранных языках.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Работа выполнена в лаборатории биотехнологии растений ГБС им. Н.В. Цицина РАН в 2003 – 2009 гг.
В качестве исходного материала использовали экспедиционный и коллекционный семенной материал из фондов ГБС им. Н.В. Цицина РАН, а также семена, полученные в системе межботанического обмена.
Для семян исследуемых видов Iris и Belamcanda, характерен комбинированный и физиологический покой различной глубины (Аф-В1-3; В1-3); для семян видов Paeonia – простой глубокий морфофизиологический покой (Б-В3); для видов Fritillaria – сложный глубокий морфофизиологический покой (БВ-В3) (Николаева, 1985,1999).
Модельными объектами в эксперименте служили 31 вид Iris, в том числе 6 занесенных в Красную книгу РФ (I. acutiloba C.A. Mey., I. aphylla L., I. ensata Tunb., I. nota Bieb., I. pumila L. s. l., I.scariosa Willd. ex Lik); 16 видов Paeonia, в том числе 6 занесенных в Красную книгу РФ (P. caucasica (Schipcz) Schipcz., P. lactiflora Pall, P. obovata Maxim, P. oreogeton S. Moore, P. tenuifollia L., P.wittmanniana Hartwiss ex Lindl.), 26 видов Fritillaria, в том числе 3 занесенных в Красную книгу РФ (F.caucasica Adams., F. meleagris L., F. ruthenica Wikstr.) и Belamcanda chinensis (L.) CD (Красная книга РФ).
Методика биотехнологических исследований основывалась на общепринятых классических приемах работы с культурами изолированных тканей и органов растений (Бутенко, 1999). Во всех вариантах эксперимента использовали питательную среду Murashige, Skoog (1962). В связи со спецификой покоя исследуемых таксонов, для каждого из них были использованы индивидуальные схемы культивирования.
Семена видов рода Iris и Belamcanda chinensis культивировали на среде с добавлением 1 мг/л ГК3, также использовали несколько способов предобработки семян: замачивание в растворе ГК3 в концентрации 1 и 10 мг/л в течение суток, холодная стратификация в течение 1 и 3 месяцев. Обработанные семена и изолированные из них зародыши помещали на среду безгормонального состава. Контролем являлись необработанные семена и изолированные из них зародыши, культивируемые на безгормональной среде.
Незрелые зародыши извлекали из семян 13 модельных видов рода Iris и Belamcanda chinensis в разные периоды созревания: 20-30 дней после опыления (ДПО), 35-45 ДПО, 50-60 ДПО, 65-75 ДПО и культивировали на питательных средах МС: с добавлением 0,1 мг/л БАП, питательная среда с увеличенными в два раза концентрациями минеральных и органических компонентов, питательная среда, не содержащая гормональных добавок.
Семена видов рода Paeonia культивировали на безгормональной питательной среде. Изолированные из зрелых семян зародыши на этапе теплой стратификации культивировали на питательных средах с добавлением 0,1 и 0,3 мг/л БАП, а также на питательной среде с увеличенными в два раза концентрациями минеральных и органических компонентов и безгормональной питательной среде (контроль); на этапе холодной стратификации на питательных средах (8 вариантов) с добавлением БАП (0,1; 0,5 и 1 мг/л) и ГК3 (0,1 и 1 мг/л) и безгормональной питательной среде (контроль).
Незрелые зародыши извлекали из семян 3 модельных видов рода Paeonia в разные периоды созревания: 20-30 ДПО, 30-40 ДПО, 40-50 ДПО и культивировали на питательных средах с добавлением 0,1 мг/л БАП, питательной среде с увеличенными в два раза концентрациями минеральных и органических компонентов и безгормональной питательной среде (контроль).
Семена видов рода Fritillaria культивировали на безгормональной питательной среде (контроль) и питательных средах с добавлением 1 мг/л БАП и 1 мг/л ГК3 в течение 2-х этапной стратификации: 5-7 недель при температуре 20-220С, 2 – 9-12 недель при температуре 3-50С. Для эмбриокультуры зародыши изолировали из семян на разных этапах стратификации (5, 9, 12 и 18 недель) и культивировали на питательных средах (10 вариантов) с добавлением ГК3 (0,1 – 1 мг/л) и БАП (0,1 – 1 мг/л), а также на питательной среде с увеличенными в 2 раза концентрациями минеральных и органических компонентов. Контроль – питательная среда, не содержащая гормональных добавок.
Математическую обработку данных проводили стандартными методами (Доспехов, 1985, Зайцев, 1984) с использованием пакета программ Microsoft Office.
В молекулярных исследованиях использованы образцы семян I. pumila (3 популяции), I. aphylla (4 популяции), I. scariosa (3 популяции), I. notha (2 популяции) и I. variegatа (2 популяции), а так же образцы 3-х популяций Belamcanda chinensis.
ДНК исходных образцов выделяли с использованием набора NucleoSpin® Plant II (Macherey-Nagel, Germany) из 100 мг свежего растительного материала, полученного из листьев 2-3 недельных проростков. ДНК контрольных образцов выделяли тем же способом из молодых вегетирующих листьев.
Полимеразную цепную реакцию проводили в амплификаторе DNA Engine DiadTM (Bio-Rad, USA) с ISSR-праймерами: М1, М2, М3, М4, М5, М9, М11, М12, М13, М14, UBC881, UBC855, 844B, НВ15, синтезированными ЗАО «СИНТОЛ» («Биоком», Россия). Для полимеразной цепной реакции были использованы наборы реактивов производства “Диалат-ЛТД” (Москва). Все реакции были проведены в двукратной повторности.
ISSR-профили анализировались с помощью программы Cross Checker (Version 2.91) (Buntjer,1999). Учитывали только хорошо различимые фрагменты. За полиморфные принимали ДНК-фрагменты, присутствующие в спектре не всех образцов. Уровень геномной вариабельности оценивали по значениям генетических расстояний. Межвидовые и внутривидовые генетические расстояния определялись с использованием коэффициента Жаккарда. Расчеты выполняли с помощью программы PAST (Version 1.89) (Hammer et al., 2001), используя кластерный анализ методом невзвешенного парно-группового арифметического усреднения (UPGMA). Анализ образцов на гибридное происхождение проводили с помощью программы NewHybrids (Version 1.1 beta) (Anderson, Thomson, 2002)
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
1.Культура in vitro семян и зародышей представителей Iris и Belamcanda.
1.1.Влияние гиббереллиновой кислоты на преодоление покоя семян и развитие зародышей в культуре in vitro.
Для семян исследуемых видов Iris и Belamcanda, характерен комбинированный и физиологический покой различной глубины (Аф-В1-3; В1-3), обработка семян гиббереллинами (ГК) способствует преодолению покоя такого типа (Николаева, 1985,1999; Небыков и др., 2005).
На динамику прорастания значительное влияние оказали тип покоя, используемый способ аппликации ГК3 и продолжительность периода хранения исходных семян.
Из всех высаженных семян, проростки были получены только у 16 видов, процент прорастания при этом варьировал. Было показано, что во всех вариантах эксперимента показатель прорастания культивируемых in vitro семян, прошедших 2-х летний период хранения был значительно ниже по сравнению с показателем прорастания семян, хранившихся 1 год. Для семян, покой которых относится к комбинированному типу было отмечено совместное стимулирующее действие ГК3 и скарификации (Табл.1).
Таблица 1
Влияние скарификации и гиббереллиновой кислоты на прорастания семян in vitro.
| Вид | Семена без скарификации | Скарифицированные семена | ||||
| MS0 | MS + 1 мг/л ГК3 | 10 мг/л ГК3; MS | MS0 | MS + 1 мг/л ГК3 | 10 мг/л ГК3; MS | |
| Belamcanda chinensis | 53,62 ± 1,2 | 54,79 ± 1,0 | 54,94 ± 1,0 | 70,79 ± 2,1 | 80,86 ± 2,3 | 82,86 ± 1,7 |
| I. ensata | 55,64 ± 2,1 | 53,12 ± 1,6 | 52,33 ± 1,1 | 69,64 ± 3,1 | 75,12 ± 1,6 | 77,22 ± 2,2 |
| I. laevigata | 8,01 ± 0,2 | 7,95 ± 0,5 | 7,63 ± 0,3 | 21,37 ± 1,1 | 28,62 ± 1,1 | 26,15 ± 1,0 |
| I. pseudacorus | 15,58 ± 1,1 | 13,12 ± 0,9 | 14,45 ± 0,8 | 35,32 ± 2,1 | 42,18 ± 1,4 | 43,43 ± 1,3 |
| I. setosa | 17,32 ± 0,8 | 17,00 ± 0,8 | 17,67 ± 0,2 | 27,83 ± 1,4 | 35,63 ± 1,7 | 36,0 ± 2,7 |
| I. sibirica | 62,37 ± 1,0 | 60,20 ± 1,2 | 63,05 ± 1,0 | 71,45 ± 2, | 78,12 ± 2,2 | 81,34 ± 2,5 |
| I. spuria | 8,52 ± 0,7 | 9,11 ± 0,6 | 8,79 ± 0,3 | 13,75 ± 0,9 | 15,62 ± 1,1 | 13,01 ± 1,1 |
Установлено, что между способами аппликации ГК3 ни в одном из вариантов эксперимента ни для одного из исследуемых видов значимых различий выявлено не было.
Положительное влияние ГК3 на процент прорастания было показано только для видов с промежуточным физиологическим типом покоя семян (I.ensata, I.sibirica, I.pseudacorus, Belamcanda chinensis и др.), хранившихся 1 год (Рис.1).
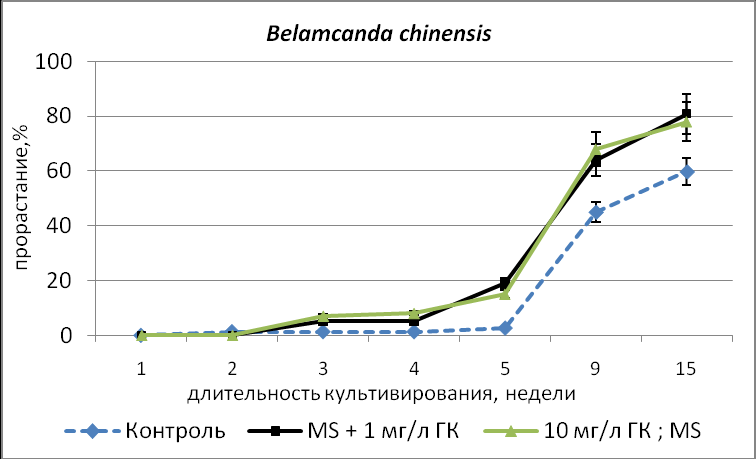
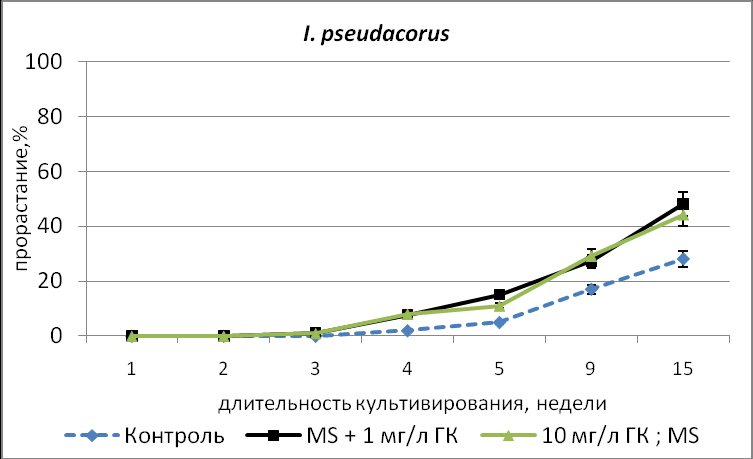
Рис.1. Влияние гиббереллиновой кислоты на динамику прорастания in vitro семян с промежуточным типом физиологического покоя.
Значимого влияния на прорастание семян с неглубоким типом физиологического покоя, не зависимо от года хранения ( I.pumila, I. scariosa) показано не было. Для видов, семена которых имеют глубокий физиологический покой (I.graminea, I.klatti и др.), использование двух предложенных вариантов аппликации ГК3 оказалось не результативным – семена не прорастали.
Показано, что развитие зародышей, выделенных из семян, прошедших предобработку зависело от длительности периода хранения, типа покоя исходных семян и концентрации используемой ГК3.
В данном варианте эксперимента проростки были получены из культивируемых зародышей всех 32 исследуемых видов. Наибольший процент прорастания изолированных зародышей наблюдался у видов с неглубоким типом физиологического покоя семян, в этом варианте эксперимента максимальный результат (I.pumila – 92,15%) был получен у контрольных образцов, обработка семян ГК3 приводила к снижению процента прорастания (I.pumila – 79,85%). Установлено, что для зародышей, выделенных из семян с промежуточным и глубоким типом покоя семян процент прорастания в контрольном варианте был значительно ниже. Также показано, что предобработка семян ГК3 существенно увеличивала прорастание изолированных зародышей по сравнению с контролем, однако показатель прорастания, в среднем не превышал 50% (I.graminea – 49,23%) для видов с глубоким типом физиологического покоя семян и 73% (I.versicolor – 72,47%) для видов с промежуточным типом физиологического покоя семян.
Развитие проростков, полученных из изолированных зародышей, зависело от продолжительности периода хранения, типа покоя исходных семян и используемой концентрации ГК3. Максимальные показатели развития для проростков, полученных из зародышей изолированных, из семян с неглубоким типом физиологического покоя и хранившихся 1 год отмечены в контрольном варианте (без обработки ГК3) (Рис.2); из хранившихся 2 года – в варианте с предобработкой семян ГК3 в концентрации 10 мг/л.

Рис.2. Изменение длины наиболее развитого листа у проростков, полученных из зародышей, изолированных из семян c неглубоким (I.pumila) и промежуточным (I.pseudacorus) типом физиологического покоя семян, обработанных ГК3
Для развития проростков, полученных из зародышей, изолированных из семян с промежуточным и глубоким типом физиологического покоя, показано стимулирующее влияние предобработки исходных семян ГК3, не зависимо от продолжительности периода хранения (Рис.2).
